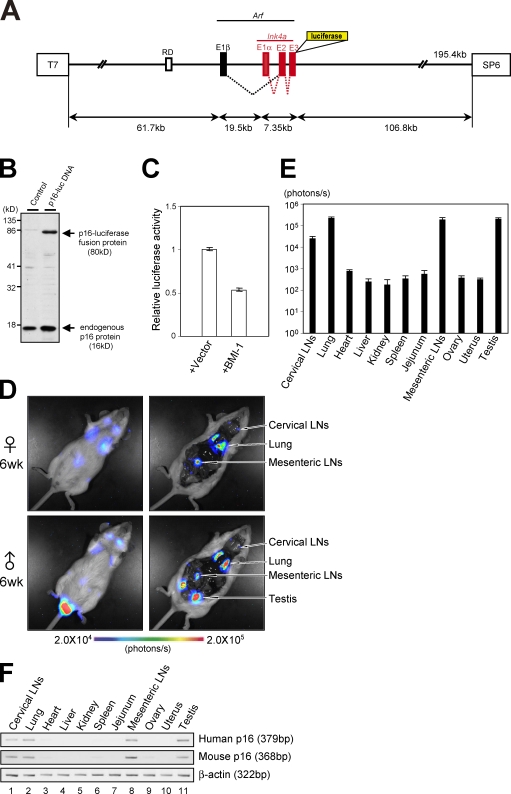
结果 人的可视化 第16页 墨水4a 活体动物的基因表达 监测人类 第16页 墨水4a 基因表达尽可能准确,我们使用了人类染色体的一个大基因组DNA片段,其中包含整个 墨水4a/Arf 基因位点( 图1 A ). 此外,该染色体片段被设计用于表达人类p16的融合蛋白 墨水4a 和萤火虫荧光素酶(p16-luc),而不删除任何基因组DNA序列 墨水4a/Arf 基因位点( 图1、A和B ). 这一点非常重要,因为BMI-1是 第16页 墨水4a 基因表达( Jacobs等人,1999年 ),已知不仅与启动子区域结合,还与 第16页 墨水4a 轨迹( Bracken等人,2007年 ; Kotake等人,2007年 ). 此外,p16-luc融合蛋白的表达使我们能够确定 第16页 墨水4a 基因表达但不表达 阿尔夫 这个重叠基因位点的基因表达。 值得注意的是,p16-luc的过度表达对视网膜母细胞瘤抑癌蛋白(pRb)的磷酸化没有任何显著影响,尽管p16的水平相似 墨水4a 这种表达有效地阻断了U2OS细胞中pRb的磷酸化,表明p16-luc不起Cdk抑制剂的作用( 图S1 A ). 然而,重要的是,当重组人染色体片段(p16-luc DNA)与BMI-1表达载体共导入组织培养细胞时,观察到荧光素酶活性显著降低( 图1 C ). 总之,这些结果表明p16-luc-DNA将是监测人类的理想工具 第16页 墨水4a 体内基因表达 , 尤其是在活体动物的环境中。
图1。
人类的一代 第16页 墨水4a 报告鼠。 (A) 人类染色体的一个大基因组DNA片段(195.4 kb),包含整个 INK4a/ARF公司 基因位点和周围序列,包括已知可调节的假定DNA复制起源(RD) 第16页 墨水4a 基因表达( Gonzalez等人,2006年 ),被设计用于表达荧光素酶标记的p16 墨水4a (B)将含有p16-luc DNA的BAC载体或空BAC载体转染293T细胞。 p16的表达 墨水4a -荧光素酶融合蛋白经抗生素筛选后用Western blotting分析。 (C) 将含有p16-luc DNA的BAC载体与0.2 mg的MMLV(Moloney murine leukaemia virus)-lacZ质粒一起导入293T细胞,该细胞带有或不带有BMI-1表达质粒。 荧光素酶活性通过lacZ活性标准化。 误差条指示SD。(D)6周龄 p16-luc页 小鼠接受非侵入性BLI。显示了五个不同实验的典型图像(左)。 同样的小鼠在麻醉下通过口腔和肛门被切开。 给出了五个不同实验的典型BLI数据。 颜色栏指示具有最小和最大阈值的光子。 (E) 绘制器官发出的生物发光强度图(log10比例)。 显示了五个独立实验的平均值±SD。 (F) 外源(人类)水平 第16页 墨水4a 基因表达与内源性(小鼠) 第16页 墨水4a 基因表达 p16-luc页 采用半定量RT-PCR对小鼠进行分析。 β-肌动蛋白作为负荷对照。 给出了五个不同实验的代表性数据。
因此,携带p16-luc DNA的转基因小鼠系( p16-luc页 根据FISH、Southern blotting和PCR分析判断,已将整个p16-luc DNA片段并入其基因组(图S1 B,未描绘)。 为了检测转基因的拷贝数,从来源于 p16-luc页 老鼠。 通过实时PCR分析扩增和量化人类染色体片段特有的DNA序列( Ballester等人,2004年 ; Chandler等人,2007年 )使用从相同数量的早期传代人二倍体成纤维细胞(HDF)制备的基因组DNA作为对照。 从 p16-luc页 MEF几乎是HDF的一半,HDF有两个人体拷贝 墨水4a/Arf 基因(图S1 C)。 这些结果以及FISH分析数据(图S1 B)表明 p16-luc页 小鼠株含有p16-luc DNA片段的单个拷贝。 如前所述,p16-luc小鼠在麻醉下接受无创生物发光成像(BLI)( Ohtani等人,2007年 ). 尽管先前的研究报告p16 墨水4a 在年轻人和啮齿动物的正常组织中几乎检测不到蛋白质表达( Zindy等人,1997年 ; 尼尔森等人,1999年 )BLI对检测6周龄小鼠子宫颈、胸部、中央腹部和睾丸中p16-luc的表达十分敏感( 图1D ,左)。 为了确定表达高水平生物发光信号的器官,相同的小鼠在麻醉下经口和肛门切开后再次接受BLI( 图1D ,右侧)。 正如非侵入性BLI数据所预期的那样( 图1D 左),在颈部淋巴结(LN)、肺、肠系膜LN和睾丸中观察到显著水平的生物发光信号( 图1,D[右]和E ). 值得注意的是,这些水平不仅与外源性(人类)密切相关,也与内源性(小鼠)密切相关 第16页 墨水4a mRNA表达( 图1、E和F ; 和图S1 D),表明人类组织特异性基因表达 第16页 墨水4a 该基因与小鼠的基因非常相似 第16页 墨水4a 基因。
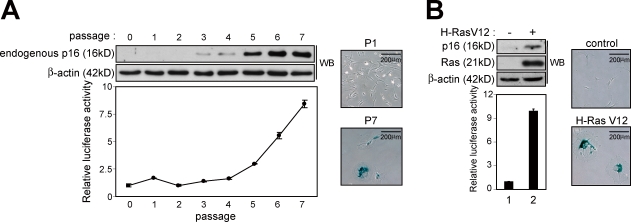
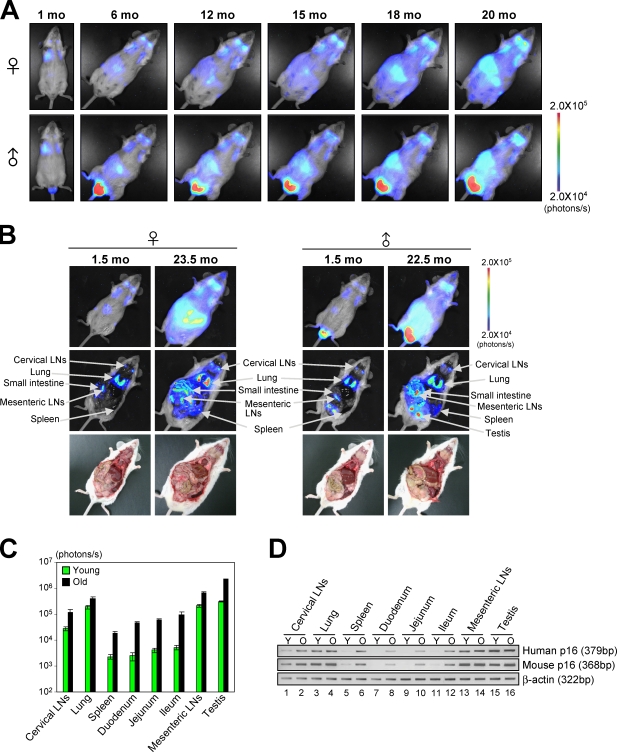
诱导 第16页 墨水4a 细胞衰老和器官衰老中的表达 因为归纳 第16页 墨水4a 表达是细胞衰老的标志( Hara等人,1996年 ; Serrano等人,1997年 ),我们接下来问 第16页 墨水4a 该基因对小鼠细胞的衰老刺激作出反应。 为此,MEF由 p16-luc页 通过连续传代或在培养基中异位表达致癌Ras使小鼠衰老。 与内源性p16水平同步 墨水4a 表达,萤光素酶活性在两种环境中诱导细胞衰老后显著增加( 图2 ),表明人类 第16页 墨水4a 该基因对小鼠细胞的衰老刺激也有反应。 此外,由于老鼠的水平 第16页 墨水4a 随着年龄的增长,许多不同组织中的基因表达增加( Zindy等人,1997年 ; Krishnamurthy等人,2004年 ),生物发光信号的水平 p16-luc页 在整个身体的衰老过程中,小鼠数量急剧增加( 图3,A和B ). 然而,在中央腹部观察到最显著的增加,并发现其局限于小肠和脾脏( 图3,A和B ; 和 图S2 ). 这些水平与外源性(人类)和内源性(小鼠)密切相关 第16页 墨水4a mRNA表达( 图3、C和D ). 总的来说,这些结果表明人类的整体调节 第16页 墨水4a 基因表达与小鼠非常相似 第16页 墨水4a 基因表达,至少在小鼠细胞中,说明了 p16-luc页 分析用小鼠 第16页 墨水4a 体内抗致癌刺激的基因表达 .
图2。
人类的诱导 第16页 墨水4a 培养MEF细胞衰老开始期间的基因表达。 (A和B)主要MEF来源于 p16-luc页 通过连续传代(A)或致癌Ras表达(逆转录病毒感染;B)使小鼠衰老。 内源性水平 第16页 墨水4a 检测其表达和荧光素酶活性。 给出了三个独立实验的代表性数据。 为了证实衰老,显示了SAβ-gal活性染色的细胞的代表性照片。 β-肌动蛋白作为负荷对照。 显示了三个独立实验的平均值±SD。 WB、Western blot。
图3。
The dynamics of第16页 墨水4a 体内衰老过程中的基因表达 . (A) 相同的p16-luc小鼠在其整个生命周期中每2周接受一次非侵入性BLI。 显示了10只独立小鼠的代表性图像。 (B) p16-luc页 对小鼠(年轻和老年)进行非侵入性BLI。然后在麻醉下从口腔和肛门切开相同的小鼠。 (A和B)颜色栏指示具有最小和最大阈值的光子。 (C) 绘制年轻(1.5个月)和老年(22.5个月)小鼠器官发出的生物发光强度(log10标度)。 显示了五个独立实验的平均值±SD。 (D) 外源(人类)水平 第16页 墨水4a 基因表达与内源性(小鼠) 第16页 墨水4a 用半定量RT-PCR分析年轻(Y;1.5个月)和老年(O;22.5个月)小鼠的基因表达。 β-肌动蛋白作为负荷对照。 给出了五个独立实验的代表性数据。
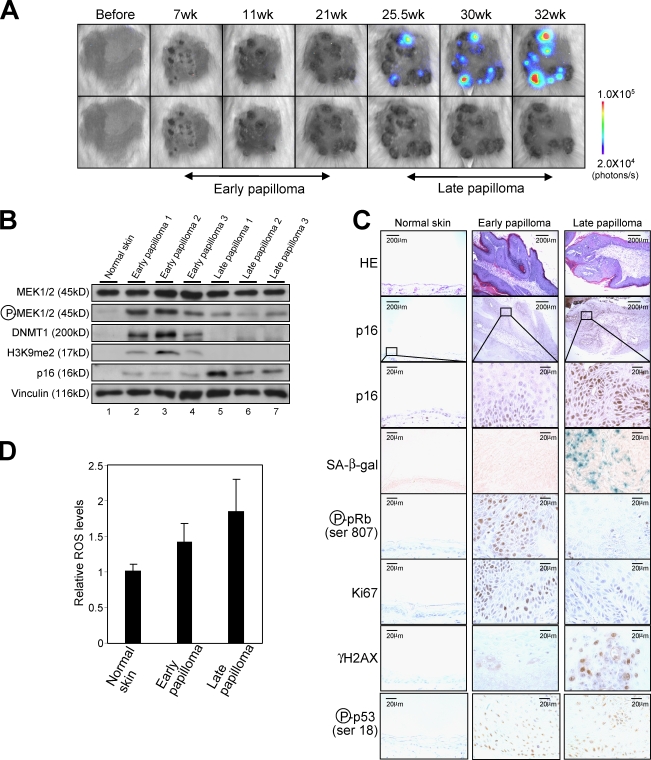
延迟响应 第16页 墨水4a 体内抗肿瘤Ras信号的表达 尽管在培养的正常HDF中广泛观察到致癌Ras诱导的衰老( Serrano等人,1997年 ; 塞拉诺和布拉斯科,2001年 ; 坎皮西,2005年 ; 吉尔和彼得斯,2006年 ; Kim和Sharpless,2006年 ),新分离的HDF对致癌Ras诱导的衰老具有抵抗力,因为其水平较低 第16页 墨水4a 基因表达( Benanti和Galloway,2004年 ). 为了在更生理的环境中探索这一概念,而不是在培养细胞中使用致癌Ras的异位表达 p16-luc页 小鼠接受传统的化学诱导皮肤乳头状瘤方案,单剂量DMBA,然后用TPA进行多次治疗。 因为该方案导致 H(H) - ras(拉斯维加斯) 基因( Quintanilla等人,1986年 ),它似乎是研究 第16页 墨水4a 活体动物中抗癌Ras信号的基因表达。 与之前的研究一致( Quintanilla等人,1986年 ; 坎普,2005年 ),良性皮肤乳头状瘤在治疗7周后开始出现,并在接下来的18周内继续增大( 图4 A ,底部,早期乳头状瘤)。 尽管在此期间几乎无法检测到生物发光信号,但随着乳头状瘤停止生长,生物发光信号显著增强( 图4 A ,顶部,晚期乳头状瘤)。 生物发光信号的水平与内源性p16的水平密切相关 墨水4a 表达以及其他衰老标志物,如衰老相关(SA)β-半乳糖苷酶(β-gal)活性( Dimri等人,1995年 )pRb的去磷酸化( 图4,A–C ; 坎皮西,2005年 )表明致癌Ras信号源于内源性 H-ras公司 基因确实能引发p16 墨水4a 伴随衰老细胞周期阻滞的体内表达 .
图4。
The dynamics of第16页 墨水4a 皮肤乳头状瘤形成过程中的基因表达。 (A) p16-luc页 用DMBA/TPA治疗的小鼠在开始TPA治疗后的指定时间点接受无创BLI。 图中显示了10个独立实验的代表性图像(顶部)。 这些乳头状瘤是在暗光下拍摄的(下图)。 颜色栏指示具有最小和最大阈值的光子。 (B) 皮肤乳头状瘤或对照正常皮肤活检样本的典型Western印迹使用左侧所示的抗体显示。 使用文丘林作为负荷控制。 (C) 苏木精和伊红(HE)染色、SAβ-半乳糖染色和免疫组织化学检测内源性 第16页 墨水4a 使用皮肤乳头状瘤或对照正常皮肤的活检样本,检测Ser807处pRb的表达、Ki67的表达、组蛋白H2AX(γ-H2AX)的磷酸化和Ser18处p53的磷酸化。 方框表示以下放大倍数较高的区域(p16染色)。 (D) ROS水平通过皮肤乳头状瘤或对照正常皮肤的活检样本进行测量。 显示了三个独立实验的平均值±SD。
注意,p16的水平 墨水4a 早期乳头状瘤的表达略高于正常皮肤( 图4、B和C ). 然而,由于在早期乳头状瘤中观察到显著水平的pRb磷酸化和Ki67表达,这是细胞增殖的标志物( 图4 C ),此水平的p16 墨水4a 表达似乎不足以诱导衰老细胞周期阻滞。 因此,很容易推测 第16页 墨水4a 可能在晚期乳头状瘤中发挥更重要的作用,可能阻止良性肿瘤的恶性转化。 事实上,DMBA/TPA治疗后30周,33%的患者 第16页 墨水4a 敲除小鼠(C57BL/6背景)至少有一种癌症,而野生型小鼠只有5%(未发表数据),这表明 第16页 墨水4a 在预防良性肿瘤恶性转化中起着重要作用。 这些结果与之前的一项研究相一致,该研究表明,DMBA处理小鼠的无瘤生存率在 第16页 墨水4a 基因敲除小鼠( 夏普莱斯等人,2004年 ).
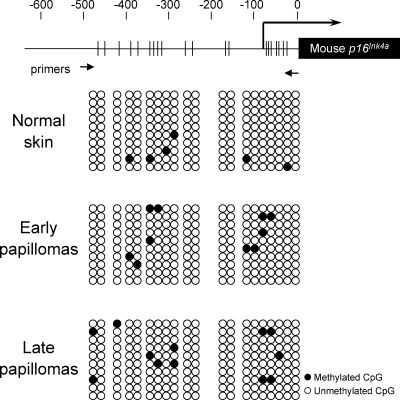
晚期乳头状瘤中组蛋白3赖氨酸9(H3K9)二甲基化(H3K9me2)的整体水平降低 考虑到 H-ras公司 已知该基因在DMBA治疗后立即出现( Quintanilla等人,1986年 )确实在早期乳头状瘤中观察到( 图S3 ),令人困惑 第16页 墨水4a 晚期乳头状瘤的基因表达被完全诱导,但早期乳头状瘤没有( 图4,A–C ). 我们首先推断 第16页 墨水4a 基因表达可能是由Ras信号强度的自发上调引起的,因为高水平而非低水平的致癌Ras表达已被证明可诱导 第16页 墨水4a 携带四环素诱导物转基因小鼠的基因表达 ras(拉斯维加斯) 致癌基因( Sarkisian等人,2007年 ). 然而,出乎意料的是,早期乳头状瘤中磷酸化MEK(MAPK/ERK激酶)的水平甚至高于晚期乳头状瘤( 图4 B )这意味着致癌Ras信号对 第16页 墨水4a 发起人( Serrano等人,1997年 ; Ohtani等人,2001年 )可能在早期乳头状瘤中被抵消。
为了证实这一观点,我们接下来寻求了 第16页 墨水4a 其活性在早期乳头状瘤中增加的表达。 在我们的研究过程中,我们发现DNMT1的水平,这是已知的抑制 第16页 墨水4a 表达式( Robert等人,2003年 ),在早期乳头状瘤中显著增加,在晚期乳头状瘤则减少( 图4 B ). 这些结果使我们推测,DNMT1水平的增加可能抵消致癌Ras信号传导对 第16页 墨水4a 早期乳头状瘤中的启动子,随后DNMT1水平降低,从而使 第16页 墨水4a 基因启动子,可能通过改变DNA甲基化状态 第16页 墨水4a 晚期乳头状瘤的基因启动子。 然而,出乎意料的是 第16页 墨水4a 早期和晚期乳头状瘤的启动子没有实质性差异( 图5 ),表明DNMT1可能会调节 第16页 墨水4a 在这种情况下,基因表达可以是间接的,也可以是通过DNMT1的不同活性进行的。
图5。
小鼠亚硫酸氢盐序列分析 第16页 墨水4a 基因启动子。 鼠标示意图 第16页 墨水4a 基因启动子显示在顶部,序列从启动Met密码子的前面向后编号(数字的位置由垂直破折号表示)。 转录起始点由粗垂直线表示,转录方向由相关箭头表示。 鼠标的编码区域 第16页 墨水4a 基因被注释并用一个封闭的方框表示。 CpG二核苷酸的聚类显示为穿过启动子区域的细垂直线。 甲基特异性PCR引物的位置用两个小箭头表示如下。 亚硫酸氢处理的DNA是从正常皮肤或早期或晚期乳头状瘤中制备的( 图4 ). 将甲基化特异性PCR产物亚克隆到pGEM-T载体中,并对每个样本的10个克隆进行测序。 给出了三个不同实验的典型结果。
最近研究表明,DNMT1还具有通过与G9a(一种主要的H3K9单甲基和二甲基转移酶)相互作用来增强H3K8甲基化的活性( Estève等人,2006年 ). 因此,我们接下来检测了皮肤乳头状瘤发展过程中H3K9甲基化的水平。 有趣的是,H3K9me2的整体水平在早期乳头状瘤中显著升高,在晚期乳头状瘤中降低,这与皮肤乳头状瘤发展过程中DNMT1的水平一致( 图4 B ). 这些结果,再加上先前的研究表明 第16页 墨水4a 基因表达与几个人类肿瘤细胞系中H3K9甲基化相关( Nguyen等人,2002年 ; 巴赫曼等人,2003年 ),导致我们假设DNMT1的水平可能调节 第16页 墨水4a 通过改变H3K9me2在 第16页 墨水4a DMBA/TPA诱导皮肤乳头状瘤发生过程中的基因启动子区。
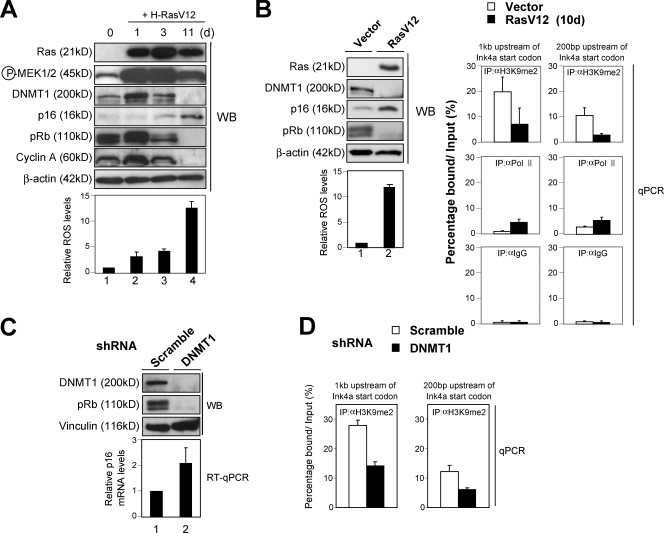
Ras信号强度和DNMT1表达水平之间的平衡调节p16 墨水4a 表达 为了验证这一假设并阐明相关的分子机制,我们接下来使用了初级HDF,因为小鼠缺乏 DNMT1(DNMT1) 基因对胚胎致命( Li等人,1992年 )和 第16页 墨水4a 基因对小鼠原代细胞的组织培养应激非常敏感( Zindy等人,1997年 ; Parrinello等人,2003年 ). 值得注意的是,在培养的HDF中,DNMT1的水平最初通过致癌Ras的表达而增加,随后随着细胞达到衰老阶段而降低( 图6 A ). 这让人想起我们对DMBA/TPA诱导的皮肤乳头状瘤的研究结果( 图4 B ). 请注意,DNMT1的级别绑定到 第16页 墨水4a 培养HDF中致癌Ras诱导衰老的基因启动子显著减少( 图S4 A ). 此外,H3K9me2在 第16页 墨水4a 基因启动子在相同的环境下也显著减少( 图6 B ),表明类似的机制可能参与 第16页 墨水4a 体外(培养的HDF)和体内(小鼠皮肤)致癌Ras信号转导的基因表达。
图6。
DNMT1水平与H3K9me2水平的相关性 第16页 墨水4a 基因启动子。 (A) 早期传代TIG-3细胞感染编码致癌Ras的逆转录病毒(+H-RasV12)。 然后在指定的时间用左侧显示的抗体对细胞进行Western blot(WB)分析,并对细胞内ROS水平进行分析。 (B) 早期传代TIG-3细胞被编码致癌Ras(RasV12)的逆转录病毒或对照空载体感染10 d,并用所示抗体进行Western blotting,分析细胞内ROS水平,并使用所示抗体(IP)进行ChIP分析。 沉淀的DNA通过实时定量PCR(qPCR)扩增,使用针对 第16页 墨水4a 上述基因启动子( Bracken等人,2007年 ). (C和D)早期传代TIG-3细胞感染编码shRNA的逆转录病毒 DNMT1(DNMT1) 用嘌呤霉素筛选后第7天从细胞中制备细胞提取物,并进行Western blotting和定量实时RT-PCR(RT-qPCR)分析 第16页 墨水4a 基因表达(C),并使用H3K9me2(D)抗体进行ChIP分析。 (D) 沉淀的DNA通过实时定量PCR扩增,使用针对 第16页 墨水4a 上述基因启动子( Bracken等人,2007年 ). (A–D)显示了三个独立实验的平均值±SD。
值得注意的是,在增殖的早期传代HDFs中观察到磷酸化MEK(Ras信号传导的指标(阳性因子))和DNMT1(阴性因子)的显著水平( 图6 A )RNAi导致DNMT1水平的耗竭导致 第16页 墨水4a 早期传代HDF中伴随衰老样细胞周期阻滞的基因表达( 图6C 以及图S4、B和C)。 此外,DNMT1水平与 第16页 墨水4a 基因启动子和H3K9me2 第16页 墨水4a DNMT1敲除细胞中的基因启动子也显著减少( 图6 D 和图S4 D)。 因此,很可能 第16页 墨水4a 通过Ras信号强度(正因子)和DNMT1表达水平(负因子)之间的平衡,基因至少部分受到调控。 注意正常皮肤中Ras信号的强度很低( 图4 B ). 这可以解释为什么 第16页 墨水4a 尽管正常皮肤中DNMT1的表达水平很低( 图4 B ). 总之,这些结果表明DNMT1水平的增加可能会抵消致癌Ras信号传导对 第16页 墨水4a 基因启动子,可能通过促进H3K9me2围绕 第16页 墨水4a 早期乳头状瘤的基因启动子。 值得注意的是,致癌Ras信号被显示为激活 DNMT1(DNMT1) 基因启动子( MacLeod等人,1995年 ). 因此,DNMT1表达的诱导似乎是由致癌Ras表达的直接作用引起的。 然而,尚不清楚为什么在晚期乳头状瘤和培养的HDF中致癌Ras诱导的衰老中DNMT1水平随后降低( 图4 B 和 6安 ).
DDR引发 第16页 墨水4a 通过降低DNMT1水平表达 因为一些证据表明,由高细胞增殖触发的DDR在肿瘤诱导衰老的发病中起着关键作用( Bartkova等人,2006年 ; Di Micco等人,2006年 ; Mallette等人,2007年 )接下来,我们询问由高细胞增殖引发的DDR是否与晚期乳头状瘤中DNMT1水平的降低有关。 事实上,在检测到γ-H2AX病灶和含有ATM(共济失调毛细血管扩张突变)/ATR(ATM和Rad3相关)底物基序的蛋白质磷酸化之前,在皮肤乳头状瘤中观察到pRb磷酸化和Ki67表达的显著增加,这是超细胞增殖的标志,这是DDR的标志( 图4 C 和图S4 E)。 此外,使用DNA损伤剂阿霉素(DXR)治疗后,DNMT1和H3K9me2修饰显著减少 第16页 墨水4a 基因启动子,伴随着 第16页 墨水4a 培养HDF中的基因表达( 图S5、A和B ). 总之,这些结果表明,过度细胞增殖引发的DNA损伤积累可能导致晚期乳头状瘤中DNMT1水平的降低。
为了了解DNA损伤如何导致DNMT1水平降低,我们接下来关注细胞内活性氧(ROS)的水平,因为已知ROS水平会因致癌Ras表达和DNA损伤而增加(图S5 a; 芬克尔和霍尔布鲁克,2000年 ; 麦克劳德,2008年 )ROS水平的增加对培养的HDF中致癌Ras诱导的衰老的发生至关重要( Lee等人,1999年 ). 在培养的HDF中,晚期乳头状瘤和致癌Ras诱导的衰老中ROS水平显著增加( 图4 D 和 6安 ). 此外,当在培养的HDF中添加过氧化氢酶减弱ROS生成时,致癌Ras表达导致的DNMT1水平降低有所减少(图S5 C)。 相反,H治疗 2 O(运行) 2 增加细胞内ROS水平可显著降低 DNMT1(DNMT1) HDF中的基因表达(图S5 D),可能是通过阻断E2F转录因子的活性,因为已知E2F活性激活 DNMT1(DNMT1) 基因表达( McCabe等人,2005年 )并通过H治疗减少 2 O(运行) 2 (未描述)。 总之,这些结果提供了令人信服的证据,证明DNA损伤会引发 第16页 墨水4a 通过阻断 DNMT1(DNMT1) ROS水平升高的基因表达。
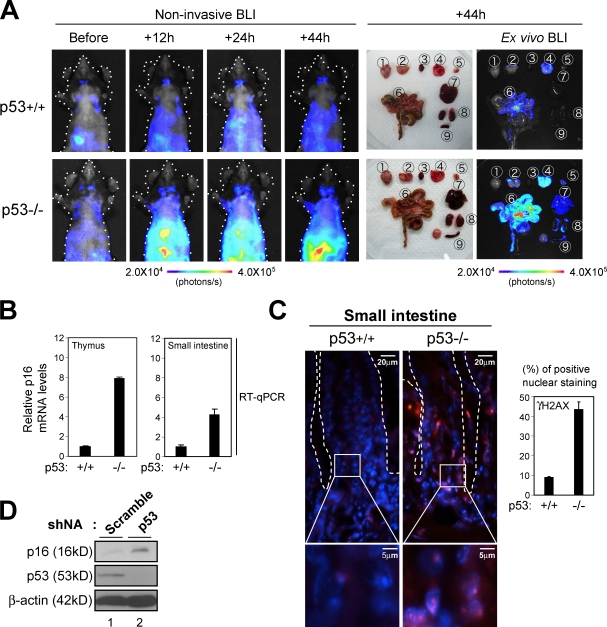
p53失活加速DDR途径激活 第16页 墨水4a 基因表达 因为已知p53抑癌基因在检测到DNA损伤后立即被激活,从而阻止受损细胞的增殖( 沃斯登和莱恩,2007年 ; 莱利等人,2008年 ),我们想知道p53是否对DDR通路的激活有一些影响 第16页 墨水4a 体内基因表达 . 事实上,早期乳头状瘤中观察到Ser18处的p53磷酸化,这是p53激活的标志( 图4 C )这意味着p53可能阻止DDR的积累,从而抵消 第16页 墨水4a 体内基因表达 . 为了探索这个想法,我们再次利用 p16-luc页 老鼠。 这个 p16-luc页 老鼠被杂交成 第53页 纯合无效遗传背景,以及 p16-luc页 缺少 第53页 在使用DXR治疗后的指定时间,对基因进行无创BLI。 有趣的是,尽管DXR治疗后生物发光信号仅轻微诱导 p16-luc页 小鼠,这种作用通过 第53页 缺失,尤其是在胸腺或小肠等高度增殖组织中( 图7 A ). 注意,生物发光信号的水平与内源性信号的水平密切相关 第16页 墨水4a 基因表达和DNA损伤灶数量 p16-luc页 老鼠( 图7、B和C ). 此外,RNAi介导的p53缺失也增加了p16的水平 墨水4a 培养HDF中的表达( 图7 D ),排除了 第16页 墨水4a 中的基因 第53页 敲除小鼠是BLI和/或 第53页 击倒老鼠。 因此,这些结果表明p53功能的丧失确实加速了DDR通路的激活 第16页 墨水4a 基因表达,揭示p53和p16之间的调节电路 墨水4a 肿瘤抑制剂。
图7。
加速诱导 第16页 墨水4a 缺乏DNA损伤小鼠的基因表达 第53页 . (A) 8周龄 p16-luc页 缺少 第53页 基因(p53 −/− )或野生型对照(p53 +/+ )静脉注射20µg/g DXR,并在指定时间点进行无创BLI。 然后处死相同的小鼠,快速取出组织并置于培养皿中,进行体外组织BLI。 检查的组织如下:1、脑; 2、宫颈淋巴结; 3、心脏; 4、肺; 胸腺; 6、小肠; 7、肝脏; 8、肾脏; 9、脾脏。 颜色条指示具有最小和最大阈值的光子。 显示了五个不同实验的代表性图像。 图示为鼠标体示意图(虚线)。 (B和C)分离组织进行定量实时RT-PCR(RT-qPCR)分析 第16页 墨水4a 基因表达(B)或使用γ-H2AX抗体进行免疫荧光分析(红色;C)。 DNA用DAPI(蓝色)染色。 直方图显示了γ-H2AX染色阳性细胞核的百分比。 显示了三个独立实验的平均值±SD。 (C) 方框区域的放大图像如下所示。 小肠隐窝用虚线标记。 (D) 早期传代TIG-3细胞感染编码shRNA的逆转录病毒 第53页 或控制干扰shRNA。用嘌呤霉素筛选后制备细胞提取物,并用左图所示抗体进行免疫印迹。 β-肌动蛋白作为负荷对照。
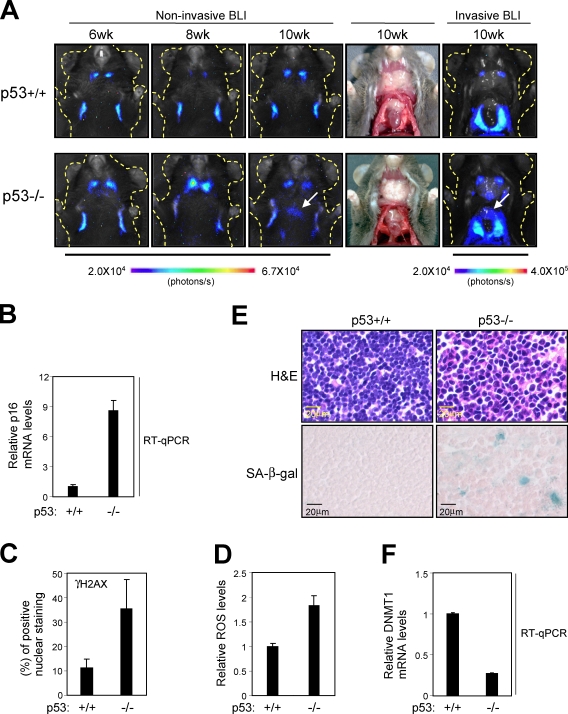
进一步验证p53和p16之间调节电路的生物学意义 墨水4a ,我们接下来问 第16页 墨水4a 基因表达是在 第53页 删除。 有趣的是,在几乎所有缺乏生物发光信号的小鼠的胸腺中,确实观察到生物发光信号比对照组显著增加 第53页 出生后10-20周左右( 图8 A ). 注意,p53基因敲除小鼠对胸腺淋巴瘤高度敏感( Donehower等人,1992年 ). 因此,删除 第53页 基因引起强烈的致癌刺激 第16页 墨水4a 在胸腺中表达。 事实上,生物发光信号的水平与内源性 第16页 墨水4a 胸腺组织中γ-H2AX灶、ROS和SAβ-gal活性的表达 第53页 基因敲除小鼠( 图8,B–E ). 此外 DNMT1(DNMT1) 在胸腺组织中也观察到基因表达 第53页 基因敲除小鼠( 图8 F ). 总之,尽管其他机制可能在这里发挥作用,但这些数据强烈表明p53失活增强了DDR途径的激活 第16页 墨水4a 基因表达,从而导致胸腺等高增殖组织中的衰老细胞周期停滞。 然而,由于p53基因敲除小鼠对胸腺淋巴瘤高度敏感( Donehower等人,1992年 ),p16的诱导 墨水4a p53是基因组的守护者,在缺乏p53的情况下,似乎不足以长期稳定衰老细胞周期。
图8。
诱导 第16页 墨水4a p53基因敲除小鼠的基因表达。 (A) p16-luc页 缺少 第53页 基因(p53 −/− )或野生型对照(p53 +/+ )在指定年龄接受非侵入性BLI检查。 然后在麻醉下对同一组小鼠进行切割(在常规光线下拍摄),并再次进行BLI(侵入性BLI)。 显示了五个不同实验的代表性图像。 颜色条指示具有最小和最大阈值的光子。 图示为鼠标体示意图(虚线)。 箭头显示来自胸腺的生物发光信号。 从10周龄小鼠(A)的两种基因型中分离出(B–F)胸腺组织,并对其进行实时定量RT-PCR(RT-qPCR)分析 第16页 墨水4a 基因表达(B)或 DNMT1(DNMT1) 基因表达(F)或组织化学(苏木精和伊红[H&E]染色和SAβ-gal染色;E)、γ-H2AX病灶(C)或细胞内ROS水平(D)。 显示了三个独立实验的平均值±SD。
讨论 人类的调节 第16页 墨水4a 基因表达仍然没有完全定义,至少部分是因为 第16页 墨水4a 组织培养应激在非转化细胞中快速诱导基因表达( Shay和Wright,2007年 ). 为了避免这个问题,我们开发了一种携带整个人类的新型转基因小鼠模型 第16页 墨水4a 荧光素酶标记的基因位点。 在这个小鼠模型中,荧光素酶活性允许人类表达 第16页 墨水4a 在活体小鼠的各种生理条件下监测基因。 我们没有观察到 p16-luc页 小鼠和对照非转基因小鼠(未公布数据),尽管 Matheu等人(2009年) 报告说还有一两只老鼠 墨水4a/Arf 没有报告基因的基因座会损害男性生殖细胞的生产,降低与衰老相关的癌症的发病率,延长寿命。 然而,由于p16-luc融合蛋白不起Cdk抑制剂的作用(图S1 a),这些看似矛盾的数据很可能至少部分是由p16的差异引起的 墨水4a 我们的小鼠和 Matheu等人(2009年) 有趣的是,人类 第16页 墨水4a 基因与小鼠 第16页 墨水4a 根据几种公认的标准判断,基因在小鼠细胞中的调控类似( 图1 – 4 ). 总的来说,这些结果表明 p16-luc页 转基因小鼠是研究小鼠生理反应的理想工具 第16页 墨水4a 体内抗癌应激的基因表达。
通过监测和量化 第16页 墨水4a 在DMBA/TPA诱导皮肤乳头状瘤发展的整个过程中,基因在同一小鼠中反复表达,我们揭示了 第16页 墨水4a 体内抗肿瘤Ras信号转导的基因表达( 图4 A ). 奇怪的是,尽管早期乳头状瘤的Ras信号强度高于晚期乳头状瘤( 图4 B ),p16的显著诱导 墨水4a 晚期乳头状瘤有表达,但早期乳头状瘤无表达( 图4,A–C ),表明致癌Ras信号传导对 第16页 墨水4a 基因启动子( Serrano等人,1997年 ; Ohtani等人,2001年 )可能会被以下负面监管机构抵消 第16页 墨水4a 早期乳头状瘤的基因表达。 有趣的是,DNMT1的水平是 第16页 墨水4a 基因表达( Robert等人,2003年 ),在早期乳头状瘤中显著增加,在晚期乳头状瘤则减少( 图4 B ). 此外,在培养的HDF中致癌Ras诱导的衰老过程中,也观察到DNMT1表达的类似动力学( 图6 A )RNAi对DNMT1的消耗导致 第16页 墨水4a 增殖HDF中的基因表达( 图6C ). 因此,DNMT1表达水平的增加很可能会抵消 第16页 墨水4a 早期乳头状瘤中的基因表达,随后DNMT1水平降低,导致 第16页 墨水4a 晚期乳头状瘤表达。
因为已知Ras信号可以激活 DNMT1(DNMT1) 基因启动子( MacLeod等人,1995年 ),早期乳头状瘤中DNMT1的诱导很可能是致癌Ras信号的直接作用( 图4 B ). 然而,尚不清楚晚期乳头状瘤中DNMT1是如何减少的( 图4 B ). 我们的研究结果强烈表明,由过度细胞增殖引发的DDR在阻止细胞凋亡水平方面起着关键作用 DNMT1(DNMT1) 通过ROS水平的升高,至少部分地表达基因( 图4 D 和 6安 和图S5)。 请注意 DNMT1(DNMT1) E2F调节基因表达( McCabe等人,2005年 )E2F活性降低了H 2 O(运行) 2 治疗(未公布的数据)。 因此,ROS可能调节 DNMT1(DNMT1) 通过E2F表达,至少部分表达。 这些结果,再加上DNMT1的耗竭导致 第16页 墨水4a 培养HDF中的基因表达( 图6C ),表明DDR在诱导 第16页 墨水4a 通过阻断 DNMT1(DNMT1) Ras在体内外诱导衰老环境中的表达。
尽管DNMT1表达水平存在显著差异,但我们无法看到CpG甲基化状态在 第16页 墨水4a 早期和晚期乳头状瘤的基因启动子( 图5 ). 然而,有趣的是,H3K9me2的整体水平在早期乳头状瘤中显著升高,在晚期乳头状瘤中降低,这与DNMT1在这些情况下的水平变化一致( 图4 B ). 此外,H3K9me2在 第16页 墨水4a 在致癌Ras诱导的衰老和培养HDF中DNMT1缺失中,启动子也减少( 图6、B和D ). 这些结果,以及最近的一项观察,即DNMT1通过与G9a相互作用而具有增强H3K9me2的活性( Estève等人,2006年 ),建议DNMT1调节 第16页 墨水4a 通过改变周围的H3K9me2状态来表达基因 第16页 墨水4a 致癌Ras诱导衰老过程中的基因启动子。 值得注意的是 成田等人(2003) 据报道,衰老HDF中E2F靶启动子H3K9甲基化增加。 通过我们在 第16页 墨水4a 基因启动子,H3K9甲基化的广泛再分配可能在衰老开始时发生。
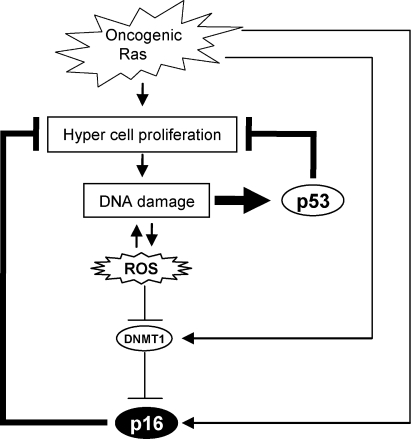
因此,我们提出了一种模型,在该模型中,尽管致癌Ras信号具有激活的潜力 第16页 墨水4a 基因表达( Serrano等人,1997年 ; 塞拉诺和布拉斯科,2001年 ; Ohtani等人,2001年 ),这种作用最初被DNMT1水平的升高所抵消,从而导致细胞过度增殖。 然而,由于细胞过度增殖往往导致DNA损伤和活性氧升高, DNMT1(DNMT1) 这种活性氧最终会降低基因表达,导致表观遗传去表达 第16页 墨水4a 基因表达与衰老细胞周期阻滞( 图9 ). 此外,重要的是,由于p53倾向于阻止受损细胞的增殖,从而导致DNA损伤的进一步累积,因此这种途径在p53缺失的情况下更为增强( 图9 ; 沃斯登和莱恩,2007年 ; 莱利等人,2008年 ). 事实上,DDR途径激活 第16页 墨水4a 几乎所有缺乏基因表达的小鼠的胸腺中都有基因表达 第53页 出生后10-20周左右( 图8 ). 因此,p16可能 墨水4a 在p53意外失活的情况下,尤其是在胸腺等高增殖组织中,可能起到备用肿瘤抑制作用。 事实上,先前已经表明Aurora A的过度表达导致p16的显著诱导 墨水4a p53基因敲除小鼠乳腺的表达( Zhang等人,2008年 ). 总之,我们的发现可能有助于解释为什么小鼠对p53和p16双重缺乏 墨水4a 肿瘤形成率增加( Sharpless等人,2002年 ; Terzian等人,2008年 )为什么p53和p16的结合 墨水4a 人类癌细胞经常发生丢失( Malumbres和Barbacid,2001年 ).
图9。
通过DDR的p53和p16通路之间的串扰。 尽管致癌Ras信号可能激活 第16页 墨水4a 基因表达,这种效应最初被DNMT1水平的升高所抵消,从而导致强烈的增殖爆发,导致DNA损伤的累积。 DNA损伤的积累激活了活性氧的产生,而活性氧又反过来阻碍 DNMT1(DNMT1) 基因表达,从而导致表观遗传去表达 第16页 墨水4a 基因表达,从而延缓衰老细胞周期。 这种途径被p53途径抵消,因为DNA损伤会立即激活p53,并阻止受损细胞的增殖,从而导致DNA损伤的进一步累积。 因此,DDR途径激活 第16页 墨水4a p53失活时表达加快。
然而,很明显 第16页 墨水4a 调节不能用本研究中描述的因素来解释 第16页 墨水4a 基因受到多重控制( Jacobs等人,1999年 ; Passegué和Wagner,2000年 ; Ohtani等人,2001年 , 2003 ; Gonzalez等人,2006年 ; Bracken等人,2007年 ; Kotake等人,2007年 ; 贝克等人,2008年 ; Kia等人,2008年 ; Agger等人,2009年 ; Barradas等人,2009年 ; Tzatsos等人,2009年 ; Witcher和Emerson,2009年 ). 然而,我们的结果揭示了p53和 第16页 墨水4a 基因表达,扩大我们对如何 第16页 墨水4a 基因表达是由体内致癌刺激诱导的,为其控制开辟了新的可能性。
材料和方法 p16-luc小鼠的产生 包含人类基因组DNA的大片段(195.4 kb) 第16页 墨水4a 该基因来自BACPAC资源中心。 用与细菌人工染色体(BAC)载体(pBACe3.6)插入侧翼元件互补的引物测定末端序列。 将编码萤火虫荧光素酶的cDNA片段插入p16的3′端 墨水4a 使用计数器选择BAC修改试剂盒(基因桥)编码序列。 DNA用NotI消化,然后用于微量注射。 转基因小鼠株是通过将报告转基因原核微注射到受精的ICR卵母细胞中而产生的。 一个转基因系, p16-luc页 (行号CDB0416T-53),因转基因完整性完整而被选择。 对于化合物小鼠的产生, p16-luc页 小鼠与C57BL/6小鼠杂交8代,然后与 第53页 敲除小鼠(C57BL/6; Ohtani等人,2007年 ). 第16页 墨水4a 敲除小鼠(C57BL/6)由N.E.Sharpless(北卡罗来纳大学Lineberger综合癌症中心,北卡罗来那州教堂山; 夏普莱斯等人,2004年 ). 所有动物均采用日本癌症研究基金会和/或德岛大学实验动物使用和护理委员会批准的方案进行护理。
BLI和图像采集 为了检测荧光素酶的表达,将小鼠麻醉并腹腔注射75 mg/kg d日 -荧光素钠盐开始光子记录前5分钟。 如前所述,从活体小鼠或分离器官中获得光子( Ohtani等人,2007年 ). 简言之,将小鼠置于光密封室中,首先用暗淡的光记录小鼠的灰度图像,然后使用冷却的电荷耦合器件(CCD)相机(PIXIS 1024B;普林斯顿仪器公司)采集发光图像。 通过2×2装箱和15分钟暴露,信噪比增加。 为了在动物身上实现发光光子发射的共定位,使用Image-Pro Plus(媒体控制论)合并灰度图像和伪彩色图像。
肿瘤诱导实验 10只老鼠 p16-luc页 将处于毛发周期静止期的线(8周龄)剃光,并用100µl丙酮中的100µg DMBA(7,12-二甲基苯并[a]蒽)处理。 DMBA治疗1周后,用12.5µg TPA(12-o-十四烷基佛波醇13-醋酸盐)和100µl丙酮每周两次治疗小鼠15周。 对照组小鼠用丙酮代替DMBA/TPA治疗。
H-ras测序 使用TRIZOL试剂(Invitrogen)从皮肤乳头状瘤和对照正常组织中分离出总RNA。 RNA通过寡核苷酸(dT)引物转化为cDNA,330-bp PCR片段包含 H-ras公司 用5′-TGGGGCAGGAGCTCCTGGAT-3′和5′-CTGTACTGATGGTCCTC-3′引物扩增该基因。 使用pGEM-T Easy矢量系统(Promega)亚克隆PCR片段,并使用染料终止器和Big-Dye循环测序系统(Applied Biosystems)进行测序。
半定量RT-PCR 使用TRIZOL试剂分离总RNA,并使用2µg总RNA进行反转录反应。 PCR使用混合Taq聚合酶(丰田)和小鼠特异性引物进行 第16页 墨水4a 基因,人类 第16页 墨水4a 基因与小鼠 β-肌动蛋白 基因如下所示。 人类 第16页 墨水4a ,5′-ACCAGAGGCAGTAACCATGC-3′(正向)和5′-TGTTCGTGCGGGCGCAACTG-3′(反向); 鼠标 第16页 墨水4a ,5′-GAACTCTTTCGGTCGTACCC-3′(正向)和5′-TGGGCGTTGTGAGCTGA-3′(反向); 和 β-肌动蛋白 ,5′-GTATGGAATCCTGGCATC-3′(正向)和5′-AAGCACTTGGTGCACGAT-3′(反向)。
实时RT-PCR 使用SYBER Premix EX Taq系统(TAKARA)和Prism 7900HT(ABI)进行定量实时RT-PCR。 扩增信号经凝胶电泳证实为单带,并归一化为3-磷酸甘油醛脱氢酶(GAPDH)水平。 使用SDS2.1软件(ABI)分析数据。 使用的PCR引物序列如下: GAPDH公司 ,5′-CAACTACATGTGTACATGTTC-3′(正向)和5′-GCCAGTGGACTCCACGAC-3′(反向); 人类 第16页 墨水4a ,5′-CCCAACGCACCGAATA-3′(正向)和5′-ACCAGCGTGCCAGGAAG-3′(反向); 鼠标 第16页 墨水4a 5′-GAACTTTCGGTCGTACCC-3′(正向)和5′-CGAATCTTGCACCGTTAGTTGA-3′(反向); 人类 DNMT1(DNMT1) ,5′-TACCTGGACGACCCTGACCTC-3′(正向)和5′-CGTTGGCATCAAAGATGACA-3′(反向); 鼠标 DNMT1(DNMT1) ,5′-GAGGAGGCTACCTGCTAA-3′(正向)和5′-AGTGAAGGTGTTCCGT-3′(反向); 转基因5′末端,5′-GCAGAAAGCCAGGAGGTG-3′(正向)和5′-GCCGCAGACAGGTGAC-3′(反向); 转基因3′端,5′-TCCTTATCCTTACCCACT-3′(正向)和5′-TGATGATCCTATGGT-3′(反向); 和 GAPDH公司 (人类/小鼠通用序列),5′-AGACCACAGTCCATGCCATC-3′(正向)和5′-TTGCCACACGTGGCAG-3′(反向)。
组织学和免疫组织化学 如前所述进行免疫组织化学( Ohtani等人,2007年 ). 所用的主要抗体为小鼠p16(Santa Cruz Biotechnology,Inc.)、γ-H2AX(Millipore)、磷酸化pRb(Ser807/811;细胞信号技术)、Ki67(RTU-Ki67-MM1;Novocastra)和磷酸化(Ser/Thr)-ATM/ATR底物(细胞信号技术)。 使用的荧光色素为DAPI(Dojindo)和Alexa Fluor 546(Invitrogen)。 使用荧光显微镜(AxioImager.A1;Carl Zeiss,Inc.),通过使用AxioVision软件(Carl Zeiss,Inc.)的EC Plan-Neofluar 10×NA 0.3 Ph1、40×NA 0.75 Ph2或63×NA 1.25 oil Ph3物镜,与CCD相机(Axio CamMRc5;Carl蔡司,Inc.)连接,在RT下获得显微图像。
细胞和细胞培养实验 早期传代(45个PDL)HDFs(TIG-3细胞)、MEFs、293T细胞和U20S细胞在37°C添加10%FBS的DME中培养。 如前所述进行逆转录病毒感染( Takahashi等人,2006年 ). 在RNAi实验中,HDF感染了编码短发夹RNA(shRNA)的逆转录病毒,如前所述( 前原诚司等人,2005年 ). 使用的RNAi序列如下:scramb,5′-CATTGCTATAGAGGCAGAT-3′; 人类 DNMT1(DNMT1) ,5′-TGGTCCGCATGGGCTATCAGT-3′; 和人类 第53页 ,5′-GACTCAGTGGTTAATCTAC-3′。
如前所述进行SAβ-gal染色( Dimri等人,1995年 ). 使用倒置显微镜(AxioVert 135;Carl Zeiss,Inc.),通过AxioVision软件的Achrostigmat 10×NA 0.25 Ph1物镜连接AxioCamMRc5 CCD相机,在RT下获得显微图像。 如前所述,使用DAPI进行SA异色病灶分析( 成田等人,2003年 ). 显微图像是在RT时使用AxioImager获得的。 A1荧光显微镜通过使用AxioVision软件的EC Plan-Neofluar 63×NA 1.25油Ph3物镜与AxioCamMRc5 CCD相机相连。
蛋白质印迹分析 如前所述进行免疫印迹( Takahashi等人,2006年 ). 使用的主要抗体包括人类p16(EMD)、Ras(EMD,pRb(BD)、vinculin(hVIN-1;Sigma-Aldrich)、小鼠p16(Santa Cruz Biotechnology,Inc.)、DNMT1(Santa Cruz Bintechnologies,Inc.),H3K9me2(Abcam)、磷酸化-MEK1/2(Ser217/221;细胞信号技术)、MEK1/2(细胞信号技术, 和磷酸化p53(细胞信号技术)。
染色质免疫沉淀(ChIP)分析 使用EZ-ChIP(Millipore)进行ChIP分析。 使用的抗体为抗H3K9me2(Abcam)、抗RNA聚合酶II(Millipore)和抗IgG(Millipore)作为阴性对照。 如实时RT-PCR所述,通过实时定量PCR对免疫沉淀DNA进行定量。 PCR引物的序列如前所述( Bracken等人,2007年 ).
致谢 我们感谢N.E.Sharpless博士提供的第16页 墨水4a 敲除小鼠,R.Agami和R.Bernards(荷兰阿姆斯特丹荷兰癌症研究所)用于RNAi载体,M.Serrano(西班牙马德里西班牙国家癌症研究中心)用于编码H-RasV12的逆转录病毒载体。 我们还感谢Y.Shinkai博士(日本京都京都大学)为H3K9me2的分析提供了宝贵的建议,并感谢C.Sugita女士(日本东京都小东区日本癌症研究基金会)和S.Chiba女士(日本德岛黑本町德岛大学)在小鼠实验中提供的帮助。
这项工作得到了日本教育、文化、体育、科学和技术部、细胞科学研究基金会、三菱基金会、奈藤基金会、高松公主癌症研究基金、武田科学基金会和赛车纪念基金会的资助。
脚注 本文中使用的缩写:BAC,细菌人工染色体; β-半乳糖苷酶; 生物发光成像; 电荷耦合器件; ChIP,染色质免疫沉淀; DDR,DNA损伤反应; DXR,阿霉素; GAPDH,3-磷酸甘油醛脱氢酶; H3K9,组蛋白3 Lys9; H3K9me2,H3K9二甲基化; HDF,人二倍体成纤维细胞; 淋巴结; MEF,小鼠胚胎成纤维细胞; 视网膜母细胞瘤抑癌蛋白; 活性氧; SA,衰老相关; 短发夹RNA。
参考文献
Agger K.、Cloos P.A.、Rudkjaer L.、Williams K.、Andersen G.、Christensen J.、Helin K。 2009 H3K27me3去甲基酶JMJD3有助于INK4A-ARF基因座的激活,以响应致癌基因和应激诱导的衰老。 基因发育。 23:1171–1176 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
巴赫曼K.E.、帕克B.H.、莱伊I.、拉贾戈帕兰H.、赫尔曼J.G.、拜林S.B.、金兹勒K.W.、沃格尔斯坦B。 2003 抑癌基因DNA甲基化前的组蛋白修饰和沉默。 癌细胞。 3:89–95 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Baker D.J.、Perez-Terzic C.、Jin F.、Pitel K.、Niederländer N.J.、Jeganatan K.、Yamada S.、Reyes S.、Rowe L.、Hiddinga H.J.等人。 2008 p16Ink4a和p19Arf在BubR1功能不全引起的衰老和衰老中的相反作用。 自然细胞生物学。 10:825–836 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Ballester M.、CastellóA.、Ibáñez E.、Sánchez A.、Folch J.M。 2004 基于实时定量PCR的转基因动物转基因拷贝数测定系统。 生物技术。 37:610–613 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Barradas M.、Anderton E.、Acosta J.C.、Li S.、Banito A.、Rodriguez-Niedenführ M.、Maertens G.、Banck M.、Zhou M.M.、Walsh M.J.等人。 2009 组蛋白脱甲基酶JMJD3通过致癌RAS参与INK4a/ARF的表观遗传控制。 23:1177–1182 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Bartkova J.、Rezaei N.、Liontos M.、Karakaidos P.、Kletsas D.、Issaeva N.、Vassiliou L.V.、Kolettas E.、Niforou K.、Zoumpourlis V.C.等人。 2006 癌基因诱导的衰老是DNA损伤检查点施加的肿瘤发生屏障的一部分。 自然。 444:633–637 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Benanti J.A.、Galloway D.A。 2004 正常人成纤维细胞对RAS诱导的衰老具有抵抗力。 分子细胞。 生物。 24:2842–2852 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Bracken A.P.、Kleine Kohlbrecher D.、Dietrich N.、Pasini D.、Gargiulo G.、Beekman C.、Theilgard-Mönch K.、Minucci S.、Porse B.T.、Marine J.C.等人。 2007 Polycomb组蛋白在整个INK4A-ARF位点结合,在衰老细胞中分离。 基因发育。 21:525–530 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
坎皮西J。 2005 衰老细胞、肿瘤抑制和器官老化:好公民,坏邻居。 单元格。 120:513–522 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Chandler K.J.、Chandler R.L.、Broeckelmann E.M.、Hou Y.、Southard-Smith E.M.和Mortlock D.P。 2007 小鼠BAC转基因拷贝数的相关性:跨多个转基因系的转基因拷贝数变化以及与转基因完整性和表达的相关性。 妈妈。 基因组。 18:693–708 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Di Micco R.、Fumagalli M.、Cicalese A.、Piccinin S.、Gasparini P.、Luise C.、Schurra C.、Garre’M.、Nuciforo P.G.、Bensimon A.等人。 2006 癌基因诱导衰老是一种由DNA超复制触发的DNA损伤反应。 自然。 444:638–642 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Dimri G.P.、Lee X.、Basile G.、Acosta M.、Scott G.、Roskelley C.、Medrano E.E.、Linskens M.、Rubelj I.、Pereira-Smith O.等人。 1995 一种生物标志物,用于识别培养物和体内老化皮肤中的衰老人类细胞。 程序。 国家。 阿卡德。 科学。 美国。 92:9363–9367 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Donehower L.A.、Harvey M.、Slagle B.L.、McArthur M.J.、Montgomery C.A.、Jr.、Butel J.S.、Bradley A。 1992 缺乏p53的小鼠发育正常,但易患自发性肿瘤。 自然。 356:215–221 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Estève P.O.、Chin H.G.、Smallwood A.、Feehery G.R.、Gangisetty O.、Karpf A.R.、Carey M.F.、Pradhan S。 2006 DNMT1和G9a之间的直接相互作用在复制过程中协调DNA和组蛋白甲基化。 基因发育。 20:3089–3103 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
新泽西州霍尔布鲁克Finkel T。 2000 氧化剂、氧化应激和衰老生物学。 自然。 408:239–247分 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Gil J.、Peters G。 2006 INK4b-ARF-INK4a抑癌基因座的调控:一对一或一对所有。 自然修订版分子细胞生物学。 7:667–677 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Gonzalez S.、Klatt P.、Delgado S.、Conde E.、Lopez-Rios F.、Sanchez-Cespedes M.、Mendez J.、Antequera F.、Serrano M。 2006 通过抑制INK4/ARF基因座Cdc6的致癌活性。 自然。 440:702–706 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Hara E.、Smith R.、Parry D.、Tahara H.、Stone S.、Peters G。 1996 p16CDKN2表达的调节及其对细胞永生化和衰老的影响。 分子细胞。 生物。 16:859–867 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Ince T.A.、Richardson A.L.、Bell G.W.、Saitoh M.、Godar S.、Karnoub A.E.、Iglehart J.D.、Weinberg R.A。 2007 不同人类乳腺上皮细胞类型的转化导致不同的肿瘤表型。 癌细胞。 12:160–170 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Jacobs J.J.、Kieboom K.、Marino S.、DePinho R.A.、van Lohuizen M。 1999 癌基因和多梳组基因bmi-1通过ink4a位点调节细胞增殖和衰老。 自然。 397:164–168 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
肯普·C.J。 2005 以小鼠多步骤皮肤癌为模型研究癌细胞的进化。 塞明。 癌症生物学。 15:460–473 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Kia S.K.、Gorski M.M.、Giannakopoulos S.、Verrijzer C.P。 2008 SWI/SNF介导INK4b-ARF-INK4a位点的多梳驱逐和表观遗传重编程。 分子细胞。 生物。 28:3457–3464 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Kim W.Y.,新东方夏普莱斯。 2006 INK4/ARF在癌症和衰老中的调节。 单元格。 127:265–275 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Kotake Y.、Cao R.、Viatour P.、Sage J.、Zhang Y.、Xiong Y。 2007 pRB家族蛋白是H3K27三甲基化和Polycomb阻遏复合物与p16INK4alpha抑癌基因结合并沉默所必需的。 基因发育。 21:49–54 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Krempfort P.、Ijpenberg A.、Song J.Y.、van der Valk M.、Nawijn M.、Zevenhoven J.、Berns A。 2007 p15Ink4b是缺乏p16Ink4a的关键肿瘤抑制因子。 自然。 448:943–946 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Krishnamurthy J.、Torrice C.、Ramsey M.R.、Kovalev G.I.、Al-Regaiey K.、Su L.、Sharpless N.E。 2004 Ink4a/Arf表达是衰老的生物标志物。 临床杂志。 投资。 114:1299–1307 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Lee A.C.、Fenster B.E.、Ito H.、Takeda K.、Bae N.S.、Hirai T.、Yu Z.X.、Ferrans V.J.、Howard B.H.、Finkel T。 1999 Ras蛋白通过改变细胞内活性氧的水平来诱导衰老。 生物学杂志。 化学。 274:7936–7940 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Li E.、Bestor T.H.、Jaenisch R。 1992 DNA甲基转移酶基因的靶向突变导致胚胎死亡。 单元格。 69:915–926 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Lin A.W.、Barradas M.、Stone J.C.、van Aelst L.、Serrano M.、Lowe S.W。 1998 涉及p53和p16的早衰被激活以响应MEK/MAPK有丝分裂信号。 基因发育。 12:3008–3019 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Lowe S.W.、Cepero E.、Evan G。 2004 内在肿瘤抑制。 自然。 432:307–315 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
MacLeod A.R.、Rouleau J.、Szyf M。 1995 Ras信号通路对DNA甲基化的调节。 生物学杂志。 化学。 270:11327–11337 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
麦克劳德K.F。 2008 RB肿瘤抑制途径在造血系统氧化应激反应中的作用。 Nat.Rev.癌症。 8:769–781 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
前原诚司(Maehara K.)、山口诚司(Yamakoshi K.),大塔尼(Ohtani N.)、库博(Kubo Y.)、高桥(Takahashi A.)、阿拉斯(Arase S.)、琼斯(Jones N.)和原(Hara E.)。 2005 在缺乏功能性pRB和p53的癌细胞中,总E2F/DP活性的降低导致衰老样细胞周期阻滞。《细胞生物学杂志》。 168:553–560 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Mallette F.A.、Gaumont-Leclerc M.F.、Ferbeyre G。 2007 DNA损伤信号通路是肿瘤诱导衰老的关键介质。 基因发育。 21:43–48 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Malumbres M.、Barbacid M。 2001 骑自行车还是不骑自行车:癌症的关键决定。 Nat.Rev.癌症。 1:222–231 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
马修A.、马拉弗A.、科拉多M.、加西亚-Cao I.、卡纳梅罗M.、博拉斯C.、弗洛雷斯J.M.、克拉特P.、维尼亚J.、塞拉诺M。 2009 Ink4/Arf位点的抗衰老活性。 老化细胞。 8:152–161 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
McCabe M.T.、Davis J.N.、Day M.L。 2005 pRb/E2F1途径对DNA甲基转移酶1的调节。 癌症研究。 65:3624–3632 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Michalloglou C.、Vredeveld L.C.、Soengas M.S.、Denoyelle C.、Kuilman T.、van der Horst C.M.、Majoor D.M.、Shay J.W.、Mooi W.J.、Peeper D.S。 2005 BRAFE600相关的人类痣衰老样细胞周期阻滞。 自然。 436:720–724 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
成田M.,Nũnez S.,Heard E.,成田M..,Lin A.W.,Hearn S.A.,Spector D.L.,Hannon G.J.,Lowe S.W。 2003 Rb介导的异染色质形成和E2F靶基因在细胞衰老过程中的沉默。 单元格。 113:703–716 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Nguyen C.T.、Weisenberger D.J.、Velicescu M.、Gonzales F.A.、Lin J.C.、Liang G.、Jones P.A。 2002 组蛋白H3-赖氨酸9甲基化与癌细胞中异常的基因沉默有关,并可被5-氮杂-2′-脱氧胞苷快速逆转。 癌症研究。 62:6456–6461 [ 公共医学 ] [ 谷歌学者 ]
尼尔森G.P.、Stemmer-Rachamimov A.O.、Shaw J.、Roy J.E.、Koh J.、Louis D.N。 1999 正常成人和婴儿组织中p16INK4A表达的免疫组织化学研究。 实验室投资。 79:1137–1143 [ 公共医学 ] [ 谷歌学者 ]
Ohtani N.、Zebedee Z.、Huot T.J.、Stinson J.A.、Sugimoto M.、Ohashi Y.、Sharrocks A.D.、Peters G.、Hara E。 2001 Ets和Id蛋白对细胞衰老过程中p16INK4a表达的相反作用。 自然。 409:1067–1070 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Ohtani N.、Brennan P.、Gaubatz S.、Sanij E.、Hertzog P.、Wolvetang E.、Ghysdael J.、Rowe M.、Hara E。 2003 EB病毒LMP1阻断p16 墨水4a –通过促进E2F4/5.细胞生物学杂志的核出口实现RB途径。 162:173–183 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Ohtani N.、Imamura Y.、Yamakoshi K.、Hirota F.、Nakayama R.、Kubo Y.,Ishimaru N.、Takahashi A.、Hirao A.、Shimizu T.等人。 2007 可视化活体动物中p21(Waf1/Cip1)细胞周期蛋白依赖性激酶抑制剂表达的动力学。 程序。 国家。 阿卡德。 科学。 美国。 104:15034–15039 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Parrinello S.、Samper E.、Krtolica A.、Goldstein J.、Melov S.、Campisi J。 2003 氧敏感性严重限制了小鼠成纤维细胞的复制寿命。 自然细胞生物学。 5:741–747 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
PasseguéE.、Wagner E.F。 2000 JunB通过转录激活p16(INK4a)表达抑制细胞增殖。 EMBO J。 19:2969–2979 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
昆塔尼拉M.、布朗K.、拉姆斯登M.、巴尔曼A。 1986 小鼠皮肤癌变过程中致癌物特异性突变和Ha-ras扩增。 自然。 322:78–80 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Ramirez R.D.、Morales C.P.、Herbert B.S.、Rohde J.M.、Passons C.、Shay J.W.、Wright W.E。 2001 复制性衰老的假定端粒独立机制反映了生长条件不足。 基因发育。 15:398–403 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Ramsey M.R.、Krishnamurthy J.、Pei X.H.、Torrice C.、Lin W.、Carrasco D.R.、Ligon K.L.、Xiong Y.、Sharpless N.E。 2007 p16Ink4a的表达可补偿细胞周期素依赖性激酶4/6依赖性肿瘤和组织中p18Ink4c的缺失。 癌症研究。 67:4732–4741 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
莱利·T、桑塔格·E、陈·P、莱文·A。 2008 人类p53调节基因的转录控制。 自然修订版分子细胞生物学。 9:402–412 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Robert M.F.、Morin S.、Beaulieu N.、Gauthier F.、Chute I.C.、Barsalou A.、MacLeod A.R。 2003 DNMT1是维持人类癌细胞中CpG甲基化和异常基因沉默所必需的。 自然遗传学。 33:61–65 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Sarkisian C.J.、Keister B.A.、Stairs D.B.、Boxer R.B.、Moody S.E.、Chodosh L.A。 2007 剂量依赖性致癌物诱导的体内衰老及其在乳腺肿瘤发生过程中的规避。 自然细胞生物学。 9:493–505 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Serrano M.、Blasco M.A。 2001 强调衰老。 货币。 操作。 细胞生物学。 13:748–753 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Serrano M.、Lin A.W.、McCurrach M.E.、Beach D.、Lowe S.W。 1997 癌基因ras引起与p53和p16INK4a积累相关的细胞过早衰老。 单元格。 88:593–602 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
夏普莱斯N.E.,DePinho R.A。 2005 癌症:犯罪与惩罚。 自然。 436:636–637 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Sharpless N.E.、Alson S.、Chan S.、Silver D.P.、Castrillon D.H.、DePinho R.A。 2002 p16(INK4a)和p53缺陷在肿瘤发生中起协同作用。 癌症研究。 62:2761–2765 [ 公共医学 ] [ 谷歌学者 ]
Sharpless N.E.、Ramsey M.R.、Balasubramanian P.、Castrillon D.H.、DePinho R.A。 2004 p16(INK4a)或p19(ARF)缺陷对细胞生长和肿瘤发生的不同影响。 致癌物。 23:379–385 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Shay J.W.、Wright W.E。 2007 组织培养作为一种不利环境:乳腺癌进展研究的条件确定。 癌细胞。 12:100–101 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
铃木M.、山田T.、基原-内基F.、樱井T.、原E.、特南D.G.、和美N.、小川T。 2006 PU.1和Dnmt3a/b癌基因复合物引起的位点特异性DNA甲基化。 25:2477–2488 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Takahashi A.、Ohtani N.、Yamakoshi K.、Iida S.、Tahara H.、Nakayama K.、Nakayana K.I.、Ide T.、Saya H.、Hara E。 2006 有丝分裂信号和p16INK4a-Rb通路共同促进不可逆细胞衰老。 自然细胞生物学。 8:1291–1297 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Terzian T.、Suh Y.A.、Iwakuma T.、Post S.M.、Neumann M.、Lang G.A.、Van Pelt C.S.、Lozano G。 2008 Mdm2或p16INK4a缺失可缓解突变型p53的固有不稳定性。 基因发育。 22:1337–1344 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Tzatsos A.、Pfau R.、Kampranis S.C.、Tsichlis P.N。 2009 Ndy1/KDM2B通过抑制Ink4a/Arf基因座使小鼠胚胎成纤维细胞永生化。 程序。 国家。 阿卡德。 科学。 美国。 106:2641–2646 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
沃斯登K.H.,Lane D.P。 2007 p53与健康和疾病。 自然修订版分子细胞生物学。 8:275–283 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Wiedemeyer R.、Brennan C.、Heffernan T.P.、Xiao Y.、Mahoney J.、Protopopov A.、Zheng H.、Bignell G.、Furnari F.、Cavenee W.K.等人。 2008 INK4抑癌基因之间的反馈电路限制人类胶质母细胞瘤的发展。 癌细胞。 13:355–364 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Witcher M.、Emerson B.M。 2009 p16(INK4a)抑癌基因的表观遗传沉默与CTCF结合和染色质边界的丢失有关。 分子细胞。 34:271–284 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Zhang D.、Shimizu T.、Araki N.、Hirota T.、Yoshie M.、Ogawa K.、Nakagata N.、Takeya M.、Saya H。 2008 极光A过表达诱导p53缺陷小鼠乳腺增生性肿瘤细胞衰老。 致癌物。 27:4305–4314 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
朱J.、伍兹D.、麦克马洪M.、主教J.M。 1998 致癌Raf诱导人成纤维细胞衰老。 基因发育。 12:2997–3007 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Zindy F.、Quelle D.E.、Roussel M.F.、Sherr C.J。 1997 小鼠发育和衰老过程中p16INK4a抑癌基因相对于其他INK4家族成员的表达。 致癌物。 15:203–211 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]