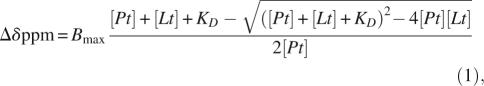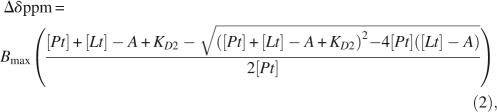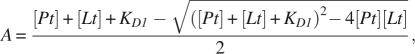Raphilin-3A是一种参与神经递质释放循环的细胞溶质神经蛋白。 尽管尚未完全阐明,但其功能与受调节的囊泡循环过程的特定阶段有关,如囊泡与肌动蛋白细胞骨架的相互作用( Baldini等人,2005年 )这些小泡与质膜的对接( 筑波和福田2005 )广泛诱发神经递质释放后囊泡的再摄取( Deak等人,2006年 )以及迄今为止尚未确定的内吞作用步骤( Ohya等人,1998年 ). Raphilin-3A由一个N端Rab小GTPase结合域、一个功能未知的连接区和一个参与Ca的C2结构域(C2A和C2B)的C端串联组成 2+ -蛋白质的依赖性膜靶向( 图1 ). 这些C2结构域对兔亲素3A在突触囊泡运输过程中的功能至关重要。 它们被描述为与SNARE蛋白SNAP25相互作用( 筑波和福田2005 ),β-内收蛋白( 宫崎骏等人,1994年 ),现金( Zhang等人,2001年 )和annexin A4( Willshaw等人,2004年 ). 然而,这些C2结构域的主要靶点是膜磷脂磷脂酰丝氨酸(PS)和磷脂酰肌醇-4,5-二磷酸(PIP2)。 后者代表质膜中<1%的脂质,并形成微域来调节几个信号事件( Golub和Caroni 2005 ; Osborne等人,2006年 ). 更具体地说,PIP2参与神经递质释放过程的不同阶段。 它是氯氰菊酯介导的内吞作用所必需的( Haucke 2005年 )针对特定阶段的胞吐和突触囊泡运输( Osborne等人,2006年 ). PIP2将蛋白质招募到质膜的特定位置,以调节与膜交通有关的空间定位事件( 克雷莫纳和德·卡米利2001 ). 虽然不知道是一个经典的磷脂酰肌醇结合模块,但一些C2结构域被描述为与磷脂酰肌苷特别是与PIP2相互作用( Cho和Stahelin 2006 ). 到目前为止,PKCα的C2结构域是功能和结构特征最好的PIP2相互作用C2结构域。 这种相互作用对于PKCα的正确亚细胞定位至关重要( Rodríguez-Alfaro等人,2004年 ; Evans等人,2006年 ). 位于其C2结构域凹侧的一组基本残基对于结合PIP2至关重要( Corbalán-García等人,2003年 ; Marín-Vicente等人,2005年 ). 参与突触囊泡融合的蛋白质的几个C2结构域已被描述为结合PIP2,例如突触素的C2结构域( Tucker等人,2003年 ),第1章( Grishanin等人,2004年 ),和Raphilin-3A( Chung等人,1998年 ). 突触结合蛋白1的C2B结构域与PIP2的结合使蛋白质预先定位在富含PIP2膜上( Schiavo等人,1996年 )在SNARE复合介导的脂质体融合中增加突触球蛋白1的速度反应( Bai等人,2004年 ). 最近,CAPS-1与PIP2的相互作用在致密核囊泡融合的预融合步骤中发挥了作用( Grishanin等人,2004年 ). 与synaptotagmin 1和11相反,前者仅通过其C2B结构域结合PIP2,后者仅通过C2A结构域结合PIP2( Tucker等人,2003年 ),兔亲素3A的两个C2结构域均与PIP2相互作用。 尽管拉菲菌素3A参与了PIP2调节的过程,但到目前为止,这种相互作用还没有被认为具有功能性作用( Chung等人,1998年 ).
图1。
兔亲素3A的结构组织。 柱状图描述了rabphilin-3A的结构域,其三维结构已得到解决:Rab结合域、C2A域和C2B域。
在神经递质释放过程中,PIP2是细胞骨架-膜连接、小泡对接和内吞之间的共同参与者。 由于兔亲素3A参与了这些过程,其通过C2结构域的PIP2结合特性可能对阐明其功能很重要。 在此背景下,我们利用核磁共振波谱表征了这两个C2结构域的PIP2头部基团结合特性。 除了结构特征外,溶液中的相对亲和力和Ca 2+ 讨论了这些交互的依赖性。 结合核磁共振数据和C2A/IP3复合对接模型,可以预测囊泡运输中两个C2域的特定功能。
结果 甘油磷酸丝氨酸与兔亲素3A的C2A和C2B结构域的相互作用 在通过兔亲素3A的C2结构域解决PIP2头部组识别之前,我们研究了这两个结构域是否以特定方式与甘油磷酸丝氨酸(GPS)相互作用,后者是其主要磷脂靶点PS的头部组( Yamaguchi等人,1993年 ). 15 N个- 1 基于H HSQC的GPS在饱和钙存在下对C2A和C2B域的滴定 2+ 高达20 mM的浓度(5 mM,见下文)GPS不会引起Ca中的化学位移扰动 2+ -两个域的结合区域。 因此,这些域的CBR中无法描述特定的PS头组识别站点,尽管PS是其主要目标。
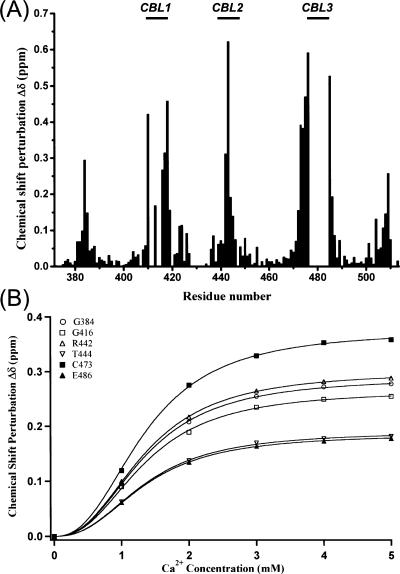
钙 2+ -C2A域的IP3-绑定模式 兔亲素3A的C2A结构域的晶体结构不含任何有序钙 2+ 离子( Biadene等人,2006年 ). 因此,我们探测了Ca 2+ -该C2结构域的结合性质。 A类 15 N个- 1 基于H HSQC的钙 2+ 从0到20 mM的滴定主要引起Ca中残留物的化学位移变化 2+ -结合区(CBR)( 图2A )与之前关于该结构域结合Ca的能力的观察结果一致 2+ ( Montaville等人,2007年 ). N端和C端末端也受到中度影响,这是因为它们在空间上接近CBR。C2A结构域在5 mM Ca时达到饱和 2+ .没有额外的低亲和力钙 2+ -在较高浓度下发现了结合位点。 根据Ca拟合CBR附近残留物的化学位移扰动 2+ 浓缩是可能的 方程式3 (见材料和方法),表示合作绑定。 获得了1.1±0.01 mM的总离解常数,希尔系数为2.24±0.03( 图2B ). 这表明两个Ca 2+ 离子以合作的方式结合到兔子蛋白3A的C2A结构域。
图2。
钙 2+ -兔亲素3A C2A结构域的结合特性。 ( A类 ) 1 H(H)- 15 添加5 mM Ca后,根据C2A结构域片段(371–510)序列绘制的N化学位移扰动δΔ(见材料和方法) 2+ 缺失的化学位移偏差与pH 7.0下无钙时中间化学交换率的交叉峰有关 2+ 和脯氨酸残基。 三个Ca的位置 2+ -绑定循环(CBL1、CBL2和CBL3)突出显示在 顶部 . ( B类 )根据Ca对六个残基主链HN交叉峰的化学位移扰动进行同步拟合 2+ 使用希尔方程的浓度( 方程式3 ; 参见材料和方法)。
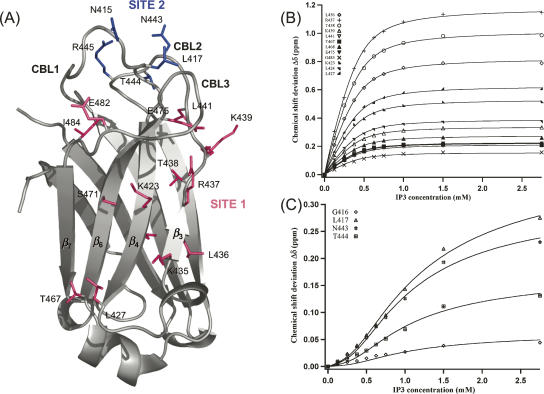
饱和钙浓度下C2A结构域的D-肌醇-1,4,5-三磷酸(IP3,即PIP2头组)滴定 2+ (5mM)对于位于核心结构域凹侧的一组有限的残基显示出大的化学位移扰动(位点1)( 图3A ). 结合发生在快速交换时间尺度上,表明溶液中配体的亲和力相当低,尽管对IP3的识别涉及明确的结合位点。 此外,属于CBL3残基和β3和β4链之间的环的HN共振在pH 7.0时变宽,但在高IP3浓度的光谱中出现(数据未显示)。 这表明围绕C2A结构域β-槽的这两个环的整体动力学在结合时发生变化,并且这些环可能积极参与结合。 当配体过量五倍时达到饱和。 同时配合 方程式1 (见材料和方法)使用来自12 HN交叉峰的化学位移扰动给出了 K(K) D类 55±4μM的值( 图3B ).
图3。
兔亲素3A C2A结构域的IP3-结合模式。 ( A类 )残留物 1 小时- 15 在2.75 mM IP3和5 mM Ca的存在下,N个交叉峰经历了显著的化学位移扰动 2+ 映射在C2A域晶体结构上(PDB访问号2chd)。 确定位置1的残留物用洋红色表示; 确定位点2的残基用蓝色表示。 ( B类 )在5 mM Ca存在下进行IP3滴定时,对来自IP3结合位点1的12个残基主链HN交叉峰的化学位移扰动进行同步拟合 2+ 使用 方程式1 (见材料和方法)。 ( C类 )在5 mM Ca存在下IP3滴定时,对四个残基主链HN交叉峰的化学位移扰动进行同步拟合 2+ 使用 方程式2 (见材料和方法)。 这些残基对应于第二个IP3结合位点(位点2)。
主要位于CBL2和CBL1(位置2)残基的HN交叉峰的第二个子集( 图3A )与位于核心结构域(位置1)凹侧的残基相比,IP3结合的影响不同。 实际上,CBL2上残基N443和T444以及CBL1上G416和L417的IP3-结合( 图3C )由S形曲线描述。 与站点1残留物的结合曲线相比,50%结合对应的IP3浓度更高。 残基G416、L417(CBL1)、N443和T444(CBL2)的交叉峰的化学位移扰动的同时拟合使用 方程式2 (见材料和方法),考虑到第一个位点结合耗尽的自由配体浓度,给出了一个 K(K) D类 540±45μM( 图3C ). 这些观察结果表明,第二个低亲和力IP3结合位点(定义为位点2)涉及位于CBL2和CBL1上的残基( 图3A ). 由于这两个站点在拓扑上彼此接近,IP3绑定中可能会发生协作。 为了探索这一点,对与位点1残基对应的结合曲线进行了拟合 方程式3 。拟合数据与使用 方程式1 Hill系数为0.95±0.02,表明两个站点之间没有合作性。
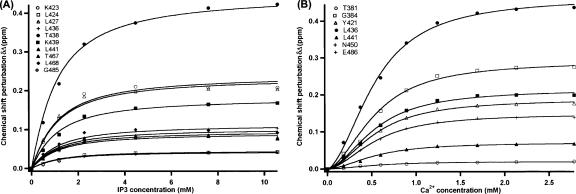
钙 2+ IP3绑定对C2A域的依赖性 研究钙之间可能的协同作用 2+ 在不添加Ca的情况下,我们对C2A结构域进行了IP3滴定 2+ 到缓冲区。 在约10mM IP3时达到饱和( 图4A ). 受影响残留物与 方程式1 适用于除K423、L427和L468之外的所有残留物,这些残留物在IP3浓度很高的情况下可能会产生副作用( 图3A ). 安装其他受影响的残留物导致 K(K) D类 800±50μM,表明在没有Ca的情况下 2+ C2A结构域的亲和力大约是饱和钙浓度下的16倍 2+ 这表明Ca 2+ 促进IP3绑定。 接下来,我们执行了一个Ca 2+ 饱和(10mM)IP3存在下的滴定( 图4B ). 受影响残留物的同时拟合使用 方程式3 (参见材料和方法)导致 K(K) D类 320±9μM,Hill系数为1.49±0.04,表明Ca的协同性有限下降 2+ -在IP3饱和的情况下结合。 加利福尼亚州 2+ 在这些条件下亲和力增加了三倍。 这些数据表明,尽管IP3的内在亲和力较低,但它能够促进钙的补充 2+ 揭示了钙之间的协同作用 2+ 和IP3结合到兔亲素3A的C2A结构域。
图4。
钙 2+ IP3绑定到C2A域的依赖性。 ( A类 )在不添加Ca的情况下,对IP3滴定时IP3结合位点1的10个残基主链HN交叉峰的化学位移扰动进行同步拟合 2+ 缓冲区使用 方程式1 (见材料和方法)。 ( B类 )根据Ca对七个残基主链HN交叉峰的化学位移扰动进行同步拟合 2+ 使用希尔方程的浓度( 方程式3 ; 见材料和方法)。
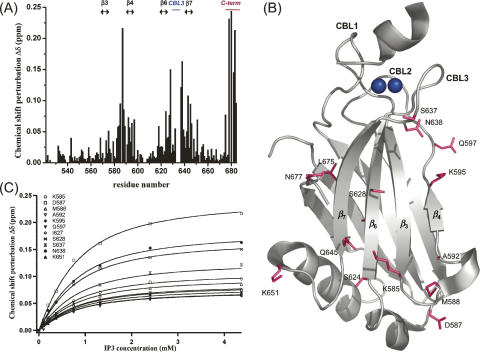
IP3-绑定到C2B域 接下来,使用IP3来探索兔亲素3A的C2B结构域如何与PIP2头组结合。 存在1 mM Ca时 2+ ,a 15 N个- 1 基于H HSQC的IP3滴定显示C2B域光谱中有限数量的交叉峰发生了化学位移扰动( 图5A ),与PS相反( Montaville等人,2007年 ). 与C2A结构域类似,所有受影响的残基都位于C2B结构域的凹面基槽中。 然而,IP3结合不仅影响β链3和4的残基,也影响β链6和7的残基( 图5B ). 出乎意料的是,位于兔非蛋白3A C末端尾部的极性残基,即His 680、Ser 682和Ser 683,出现了最强的位移。 这个C末端尾部(Q674–D684)被认为是柔性的,因为它的大部分不包括在C2B结构域的核磁共振结构中( Ubach等人,1999年 )这些残留物在晶体结构中也不是有序的( Montaville等人,2007年 )此域的。 值得注意的是,E678位于β链7附近的两个结构中,使最后的柔性残基朝向C2B结构域的凹侧(补充图1)。 因此,对位于β链7上的残基观察到的化学位移扰动可能是受到强烈影响的C末端残基对IP3结合的间接影响。 IP3与核心结构域残基的相互作用发生在快速交换速率的时间尺度上,表明亲和力相当低,这在没有膜界面的情况下是可以预期的。 对于这些残留物,根据IP3总浓度绘制的化学位移偏差可以用单一结合位点模型进行拟合( 方程式1 ; 图5C ). 通过同时拟合11个残基的化学位移扰动(参见 图5C )直接或间接参与IP3结合。
图5。
Rabbilin-3A的C2B结构域的IP3结合模式。 ( A类 ) 1 H(H)- 15 N在1 mM Ca存在下添加4.3 mM IP3后,根据C2B结构域片段(519–684)序列绘制的化学位移扰动δΔ(见材料和方法) 2+ .参与结合的二级结构元素,β-链3、4、6和7,Ca 2+ -绑定回路3和C端子尾部突出显示在 顶部 . ( B类 )残留物 1 H(H)- 15 IP3滴定时大于0.07 ppm的N化学位移扰动映射在C2B晶体结构上(PDB登录号2cm6,链B)。 ( C类 )根据IP3浓度对11个残基主链HN交叉峰的化学位移扰动进行同步拟合,使用 方程式1 (见材料和方法)。
钙存在和不存在时IP3-结合C2B结构域光谱的叠加 2+ 表明,即使在没有钙的情况下,参与IP3结合的残基的交叉峰也能保持IP3结合 2+ ( 图6 ),表示IP3-结合不依赖于Ca 2+ -绑定。 为了验证IP3在C2B结构域上探测PIP2结合位点的应用,我们使用亚微米浓度的1,2-二辛醇-PIP2(DOPIP2)。 单体DOPIP2诱导的HN峰间位移对应于中等IP3浓度促进的同一组残基的化学位移扰动(数据未显示)。
图6。
钙 2+ -独立IP3绑定到C2B域。 区域的覆盖 1 H(H)- 15 N HSQC C2B域谱。 红色共振对应于Ca 2+ -结合C2B结构域(1 mM Ca 2+ ),Ca的蓝色共振 2+ 游离C2B结构域(10 mM EGTA),与Ca的品红色共振 2+ -和IP3结合的C2B结构域(1 mM Ca 2+ ,4 mM IP3)和Ca的青色共振 2+ 自由,IP3绑定C2B域(10 mM EGTA,4 mM IP3)。 黑色箭头表示交叉峰(Ca)的化学位移偏差 2+ 游离和结合)。
将PIP2停靠在C2A域的绑定位点1上 对接过程是使用C2A域的晶体结构驱动的( Biadene等人,2006年 )作为起始坐标。 将PIP2(1,2-二乙酰基-sn-3-[磷酸肌醇-3,4,5-三磷酸])对接,以便从质膜中嵌入的脂质模拟极性头部。 为了匹配实验条件,在蛋白质和PIP2的IP3部分之间定义了模糊的分子间约束。 补充表2总结了最终总体的统计数据。 能量标准令人满意,高模糊驱动蛋白-蛋白质DOCKing(HADDOCK)得分为-1724±4 kCal.mol −1 对于C2A/PIP2复合物。 在50个最终结构的集合中,获得了单个簇。 因此,配体位置和方向在整体上很好地保持不变,如在蛋白质/配体界面测得的相对较低的RMSD值所示:1.90±0.62º。
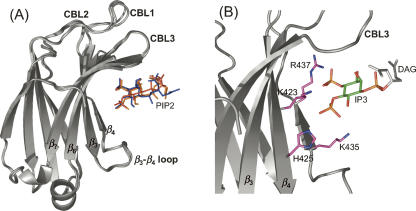
审查三个最具代表性的结构( 图7A )对于C2A/PIP2杂岩(场地1),PIP2的位置和方向相对明确。 如所示 图7B ,PIP2分子通过PIP2头部基团的磷酸部分4和5与β-链3和4(Lys 423 ,他的 425 ,赖氨酸 435 、和Arg 437 ). 这种相互作用模式使磷脂头部组的主轴垂直于β-片定义的平面。 该对接模型类似于PKCαC2域的PIP2结合模型( Sanchez-Bautista等人,2006年 ).
图7。
C2A/PIP2复合体的对接模型。 ( A类 )C2A/PIP2复合体最终模型集合的带状表示。 PIP2以彩色棒表示形式显示。 ( B类 )C2A/PIP2复合体最具代表性模型的带状表示。 积极参与结合模型的残基侧链用棒子表示,并用洋红色和蓝色表示; PIP2分子的IP3碳环呈绿色; DAG链为浅灰色。
讨论 C2A域作为PIP2目标模块 Raphilin-3A是迄今为止唯一已知的C2结构域串联蛋白,其中两个C2结构域都与PIP2结合( Chung等人,1998年 ). 众所周知,这种磷脂在富含神经递质的小泡的运输中起着重要作用。 C2B结构域的功能作用已被假定用于该过程,而C2A结构域的作用仍不明确。 在这里,我们已经表明,兔亲素3A的两个C2结构域与PIP2头部基团的结合模式在亲和力上以及在Ca上都不同 2+ 附属国。
用PIP2头基团对C2A结构域进行滴定,发现特定分子相互作用预期的HN交叉峰的限制组出现了化学位移偏差。 IP3与兔亲素3A的C2A结构域的结合方式涉及两个结合位点。 第一个具有最高亲和力(即。, K(K) D类 =55μM),涉及域的凹面,包括位于β-链3和4上的基本贴片( 图3A ). 第二个结合位点涉及CBR的残留物( 图3A ). 亲和力约为站点1的10倍( K(K) D类 >500微米)。 尽管亲和力很低,但这种相互作用不能归因于钙的亲和力 2+ -负电荷磷脂酰基团的负载CBR,因为在PS极性头部基团的情况下未检测到相互作用。因此,第二个结合位点对IP3相当特异。 PKCαC2结构域还描述了两个IP3结合位点( Corbalán-García等人,2003年 ).
绑定到C2A域的IP3具有Ca 2+ -独立出资( 图4 ),但当Ca 2+ 存在。 另一方面,加州 2+ IP3的存在大大增强了C2A域的加载。 突触结合蛋白1的C2B结构域与含有PIP2的脂质体的相互作用也有类似的行为( Bai等人,2004年 ; Li等人,2006年 ). 这最近被定义为目标激活信使亲和(TAMA)机制( Corbin等人,2007年 ). 在这种机制中,信使和靶点必须同时存在,才能使蛋白质以生理浓度与它们相互作用。 PKCαC2结构域的这种特性负责将整个蛋白质正确靶向Ca上富含PIP2的亚结构域 2+ 信号( Sanchez-Bautista等人,2006年 ; Corbin等人,2007年 ). 根据TAMA机制,类比PKCα–PIP2相互作用,C2A结构域可能参与将兔亲素3A靶向富含PIP2的膜亚结构域。 值得注意的是,在生理钙水平下,突触结合蛋白1的C2B结构域与t-SNARE的PIP2介导的相互作用也有类似的机制 2+ 浓度( Tucker等人,2003年 ).
C2A域-PIP2对接模型 到目前为止,还没有获得PIP2头基配合物中C2结构域的核磁共振或晶体结构。 此外,常规方法的核磁共振结构研究,如RDC或分子间NOE的测量,由于C2结构域和IP3之间的低亲和力而受到阻碍。 此外,由于IP3分子的质子密度低(只有五个质子位于糖环中),使用特定的核磁共振方法来研究低亲和力络合物,如STD或Tr-NOESY实验,受到影响。 在这些情况下,化学位移图是唯一可用的直接结构信息。 它不允许区分活性(直接配体相互作用)和被动(无直接配体交互作用)残基。 因此,使用特定的对接协议可能有助于识别积极参与结合过程的残基,即使它不能完全解决化学位移映射数据的固有模糊性。 HADDOCK是一种强大的对接方法,它利用模糊的实验数据来驱动对接计算( Dominguez等人,2003年 ). 由于在IP3结合时对兔亲素3A C2A结构域进行了化学位移映射,因此很容易使用这些数据生成C2A结构区与PIP2复合物的模型。 该模型提供了一个相当明确的相对蛋白质-配体定位和定向。 在C2A/PIP2复合体中( 图7A、B )PIP2垂直指向β片的凹面,类似于其与PKCαC2结构域的相互作用( Guerrero-Valero等人,2007年 ). 对接模型( 图7B )表明位于β链3和4上的碱基残基直接参与配体结合。 类似地,这些基本残基在PKCαC2结构域中保守,并且对于该C2结构域与PIP2的相互作用至关重要( Rodríguez-Alfaro等人,2004年 ; Evans等人,2006年 ).
C2B域-PIP2结合 尽管是C2B域的主要目标( Chung等人,1998年 )在溶液中无法证明该结构域对磷脂酰丝氨酸头部基团的特异识别。 与PS结合的C2B域为Ca 2+ 依赖并需要膜界面( Montaville等人,2007年 ). 这些观察结果与钙的静电开关函数一致 2+ C2结构域的CBR与带负电荷的膜表面之间,而不是特定的磷脂识别( 莱蒙2008 ). 另一方面,IP3与C2B结构域的基本凹面结合,类似于PKCαC2结构域的相互作用模式( Corbalán-García等人,2003年 )兔亲素3A的C2A结构域(如图所示)和突触球蛋白的C2B结构域( Schiavo等人,1996年 ). 然而,如IP3滴定所示,PIP2头部组结合仅轻微涉及β-链4中的保守多基基序( 图5A ). 根据最近的一项研究,该研究描述了C2B结构域β-链4上的多基基序在SNAP25结合中的作用( Tsuboi等人,2007年 )值得注意的是,只有来自多元拉伸的K595和K593参与了IP3相互作用( 图5A ). 该区域的其他基本残基(K590、K591、H594、K599、K600和K601)仍可用于SNAP25相互作用。 因此,PIP2和SNAP25可以同时绑定到C2B域。 值得注意的是,已有研究表明,在PIP2存在下,t-SNARE在重组磷脂双层中的横向扩散降低( Wagner和Tamm 2001 )最近研究表明,PIP2和SNAP25共同定位于PC12细胞质膜的特定亚结构域内( Aikawa等人,2006年 ).
兔亲素3A的C2B结构域与C2A结构域表现出完全不同的IP3结合特性。 它在Ca中结合IP3 2+ -独立时尚,在解决方案中亲和力相对较低( K(K) D类 =0.5毫米)( 图5C ). 其他C2域也观察到了这一点。 例如,突触结合蛋白9的C2B结构域也在Ca 2+ -独立方式( Tucker等人,2003年 ). 加利福尼亚州 2+ -溶液中兔红素3A的C2B结构域对PIP2头组的独立识别模式与其Ca并不矛盾 2+ -依赖性结合含PIP2脂质体( Chung等人,1998年 ). 在该研究中,作者表明,与未掺入PIP2的脂质体相比,C2B结构域与含19%PS和0.36%PIP2脂质体的相互作用能力大大增强。 相互作用的强烈增加不能完全用PIP2掺入脂质体后负表面电荷的增加来解释。 相反,假设C2B结构域与PIP2有特定的相互作用。 此外,在同一研究中,C2B结构域与含有PI(4,5)P2的脂质体的结合被证明比与含有PI(3,4)P2的脂质体的结合更有效( Chung等人,1998年 ). 因此,Ca 2+ -这种特殊相互作用的独立性及其在溶液中的低亲和力表明,这种相互作用应该发生在C2B结构域与Ca中的PS结合之后 2+ -膜界面的依赖方式。 因此,PIP2似乎是C2B域的效应器,而不是C2A域的靶点。
通过目前的工作,我们根据亲和力Ca表征了兔亲素3A C2结构域对PIP2头基的结合特性 2+ 依赖关系和绑定站点。 此外,我们能够提出C2A域与PIP2复合体的有价值模型,支持实验数据。 综上所述,这些结果表明兔亲素3A的两个C2结构域在PIP2头部组相互作用方面具有强烈的不对称性。 在囊泡贩运的背景下,PIP2显然应该是C2A结构域的靶点,而磷脂可能是C2B结构域的效应器。 未来对C2结构域与PIP2相互作用的体内研究应能更好地了解兔亲素3A在囊泡运输中的功能意义。
材料和方法 样品制备 如前所述制备大鼠兔亲素3A的C2A(片段371-510)和C2B(片段519-684)结构域( Biadene等人,2006年 ; Montaville等人,2007年 ). 这个 15 通过在含有 15 N标记的氯化铵是唯一的氮源。 所有样品在50 mM HEPES、pH 7.0、150 mM NaCl和1 mM DTT中浓缩至0.5 mM,并添加10%D 2 O。
装配程序 用钙评价标记C2结构域的滴定实验 2+ 和IP3,根据配体浓度绘制了受显著影响的残基的化学位移偏差。 使用Igor Pro(Wavemetrics,Inc.)和以下等式进行同步拟合。 单绑定站点模型( Auguin等人,2004年 ):
其中[ 铂 ], [ 书信电报 ], K(K) D类 、和 B类 最大值 分别是总蛋白浓度、配体浓度、离解常数和饱和时的化学位移偏差。
为了在第二结合位点的残基的IP3滴定中拟合HN化学位移扰动,该残基的亲和力低于第一结合位点,必须调整总配体浓度,以考虑高亲和力结合位点中配体的结合:
哪里
和[ 铂 ], [ 书信电报 ], K(K) D类 1 , K(K) D类 2 、和 B类 最大值 分别是总蛋白浓度、配体浓度、第一位点的离解常数(高亲和力)、第二位点的离合常数(低亲和力)和饱和时的化学位移偏差。 A类 表示结合到高亲和力结合位点的配体浓度,根据 方程式1 。因此[ 书信电报 ]- A类 是亲和力较低的结合位点所经历的总配体浓度。
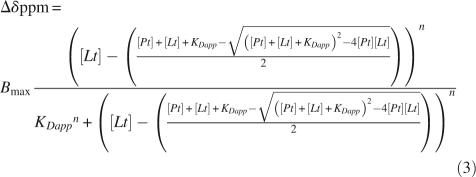
对于合作结合模型,在Hill方程中使用总配体浓度来计算自由配体浓度:
其中[ 铂 ], [ 书信电报 ], K(K) 达普 , n个 、和 B类 最大值 分别是总蛋白质浓度、配体浓度、总离解常数、希尔系数和饱和时的化学位移偏差。
C2A域的停靠模型–PIP2复合体 使用对接程序HADDOCK计算C2A/PIP2复合体的模型( Dominguez等人,2003年 )与CNS结合( Brunger等人,1998年 ). 兔亲素3A C2A结构域的坐标取自蛋白质数据库(条目2CHD)( Biadene等人,2006年 ). 从与IP3复合物中肌醇1,4,5-三磷酸受体结合核心的晶体结构中提取IP3配体的配位(条目1N4K)( Bosanac等人,2002年 )然后,通过使用InsightII中的构建器模块将1,2-二乙酰基-sn-甘油基团(二乙酰基甘油,DAG)添加到IP3(位置1)中来设计PIP2配体,然后使用Discover将其最小化( Hill and Sauer 1994年 ; Hwang等人,1994年 ; Maple等人,1994年 ). 拓扑和参数文件是使用PRODGR2服务器生成的( Schuttelkopf和van Aalten 2004年 ).
对接过程仅使用模棱两可的分子间约束来驱动,这些约束是根据配体结合时观察到的C2A酰胺基团的化学位移扰动(Δδ)来定义的。 只有经历显著化学位移扰动(Δδ大于0.1 ppm)的溶剂可及残基才被定义为活性残基。 由于使用IP3进行滴定实验,PIP2分子被视为两个残基(DAG基团和IP3核心)。 只有IP3核心被定义为活性残留物。 IP3保持刚性,以保持肌醇环的舟状构象。DAG组被设置为完全柔性。 对接计算使用HADDOCK 2.0进行,使用液体模拟优化参数和parallhdg5.3.pro力场中的键合参数。 补充表1总结了对接协议的更多细节,包括活性残基列表和对接连续阶段的完整描述。 对水精制后获得的50个结构进行分析,并根据它们的HADDOCK评分进行排名(补充表2)。 三个最佳模型被选为复杂结构的最终代表性集合。
电子补充材料 补充表1显示了对接协议和输入参数。 补充表2给出了蛋白质/配体模型50个结构的最终集合的结构统计数据。 在补充图1中,涉及E678和C2B核心结构域残基的氢键网络如C2B结构域晶体结构的带状表示所示。
致谢 我们感谢卡米拉·萨巴赫的技术帮助,感谢克里斯蒂安·格里辛格的有益讨论和慷慨支持。 M.Z.获得了DFG海森堡拨款(ZW 71/2-1和3-1)的支持。 这项工作也得到了马克斯·普朗克学会的支持。
脚注
转载请求:Stefan Becker,NMR-based Structural Biology系,Max-Planck-Institute for Biophysical Chemistry,Am Fassberg 11,37077 Göttingen,Germany; 电子邮件: sabe@nmr.mpibpc.mpg.de ; 传真:49-551-201-2202。
缩写 :PIP2,磷脂酰肌醇-4,5-二磷酸; DOPIP2,1,2-二辛酰基PIP2; PS,磷脂酰丝氨酸; GPS,甘油磷酸丝氨酸; 加州承载比。 钙 2+ -结合区; CBL,加利福尼亚州 2+ -束缚环; NOE,核过热效应; 模拟退火; MD,分子动力学; 二酰甘油; Tr-NOESY,转移核滞流效应谱; STD,饱和传输差。
工具书类
Aikawa,Y.,Xia,X.,Martin,T.F.SNAP25,但不是联合体1A,在神经内分泌细胞中通过ARF6调节途径进行再循环。 分子生物学。 单元格。 2006年; 17:711–722. doi:10.1091/mbc。 E05-05-0382。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Auguin,D.,Barthe,P.,Royer,C.,Stern,M.H.,Noguchi,M.,Arold,S.T.,Roumestand,C.T细胞白血病-1(TCL1)家族原核蛋白共同激活蛋白激酶B的结构基础。 生物学杂志。 化学。 2004; 279:35890–35902. doi:10.1074/jbc。 M400364200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Bai,J.,Tucker,W.C.,Chapman,E.R.PIP2提高突触球蛋白的反应速度,并将其膜渗透活性导向质膜。 自然结构。 分子生物学。 2004; 11点36分至44分。 doi:10.1038/nsmb709。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Baldini,G.,Martelli,A.M.,Tabellini-G.,Horn,C.,Machaca,K.,Narducci,P.,Baldini-G.Rabphilin定位于细胞肌动蛋白细胞骨架,并刺激颗粒与α-肌动蛋白交联的F-actin的结合。 生物学杂志。 化学。 2005; 280:34974–34984. doi:10.1074/jbc。 M502695200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Biadene,M.,Montaville,P.,Sheldrick,G.M.,Becker,S.拉菲林-3A C2A结构域的结构。 《水晶学报》。 D生物结晶仪。 2006年; 62:793–799. doi:10.1107/S0907444906017537。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Bosanac,I.、Alattia,J.R.、Mal,T.K.、Chan,J.、Talarico,S.、Tong,F.K.、Tong、K.I.、Yoshikawa,F.、Furuichi,T.、Iwai,M.等。复合物中肌醇1,4,5-三磷酸受体结合核心与其配体的结构。 自然。 2002; 420:696–700. doi:10.1038/nature01268。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Brunger,A.T.,Adams,P.D.,Clore,G.M.,DeLano,W.L.,Gros,P.,Grosse-Kunstleve,R.W.,Jiang,J.S.,Kuszewski,J.,Nilges,M.,Pannu,N.S.等人,《晶体学与核磁共振系统:一种用于大分子结构测定的新软件套件》。 《水晶学报》。 D生物结晶仪。 1998; 54:905–921. doi:10.1107/s0907444998003254。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Cho,W.,Stahelin,R.V.C2结构域的膜结合和亚细胞靶向性。 生物化学。 生物物理学。 《学报》。 2006年; 1761:838–849. doi:10.1016/j.bbalip.2006.06.014。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Chung,S.H.,Song,W.J.,Kim,K.,Bednarski,J.J.,Chen,J.,Prestwich,G.D.,Holz,R.W.Raphilin3A的C2结构域以Ca2+依赖的方式特异性结合磷脂酰肌醇4,5-二磷酸囊泡。 体外特征和可能的意义。 生物学杂志。 化学。 1998; 273:10240–10248. doi:10.1074/jbc.273.17.10240。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
科尔巴兰·加西亚(Corbalán-García,S.)、加西亚-加西亚(Garcí)、J.、罗德里格斯·阿尔法罗(Rodríguez-Alfaro,J.a.)、戈梅斯·费尔南德斯(Gómez-Fernández,J.C.)。一种新的磷脂酰肌醇4,5-二磷酸结合位点,位于蛋白激酶Cα的C2结构域。 生物学杂志。 化学。 2003; 278:4972–4980. doi:10.1074/jbc。 M209385200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Corbin,J.A.,Evans,J.H.,Landgraf,K.E.,Falke,J.J.C2结构域特异性膜靶向机制:靶脂质的局部池增强Ca2+亲和力。 生物化学。 2007; 46:4322–4336. doi:10.1021/bi062140c。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Cremona,O.,De Camilli,P.突触膜交通中的磷酰肌醇。 细胞科学杂志。 2001; 114:1041–1052. doi:10.1242/jcs.114.6.1041。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Deak,F.、Shin,O.H.、Tang,J.、Hanson,P.、Ubach,J.,Jahn,R.、Rizo,J.和Kavalali,E.T.、Sudhof,T.C.拉菲林调节SNARE依赖性突触小泡再提时以实现融合。 EMBO J.2006; 25:2856–2866. doi:10.1038/sj.emboj.7601165。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Delaglio,F.、Grzesiek,S.、Vuister,G.W.、Zhu,G.、Pfeifer,J.、Bax,A.NMRPipe:一个基于UNIX管道的多维光谱处理系统。 《生物分子杂志》。 核磁共振。 1995; 6:277–293. doi:10.1007/BF00197809。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Dominguez,C.、Boelens,R.、Bonvin,A.M.HADDOCK:基于生化或生物物理信息的蛋白质-蛋白质对接方法。 美国化学杂志。 Soc.2003年; 125:1731–1737. doi:10.1021/ja026939x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Evans,J.H.,Murray,D.,Leslie,C.C.,Falke,J.J.蛋白激酶Cα向质膜的特异性易位需要通过其C2结构域同时识别Ca2+和PIP2。 分子生物学。 单元格。 2006年; 17:56–66. doi:10.1091/mbc。 E05-06-0499。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Golub,T.,Caroni,P.PI(4,5)P2依赖性微域组件捕获微管以促进和控制前沿运动。 《细胞生物学杂志》。 2005; 169:151–165. doi:10.1083/jcb.200407058。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Grishanin,R.N.,Kowalchyk,J.A.,Klenchin,V.A.,Ann,K.,Earles,C.A.,Chapman,E.R.,Gerona,R.R.,Martin,T.F.CAPS作为一种PIP2结合蛋白在致密囊泡胞吐出的预融合步骤中发挥作用。 神经元。 2004; 43:551–562. doi:10.1016/j.neuron.2004.07.028。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Guerrero-Valero,M.,Marín-Vicente,C.,Gómez-Fernández,J.C.,Corbalán-García,S.经典PKC的C2结构域是具有不同亲和力的特定PtdIns(4,5)P(2)传感结构域,用于膜结合。 分子生物学杂志。 2007; 371:608–621. doi:10.1016/j.jmb.2007.05.086。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Haucke,V.磷酰肌醇对氯氰菊酯介导的内吞作用的调节。 生物化学。 社会事务处理。 2005; 33:1285–1289. doi:10.1042/BST0331285。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Hill,J.R.,Sauer,J.基于从头计算的二氧化硅和沸石催化剂的分子力学势。 1.致密微孔二氧化硅。 《物理学杂志》。 化学。 1994; 98:1238–1244. [ 谷歌学者 ]
Hwang,M.J.,Stockfisch,T.P.,Hagler,A.T.二类力场的推导。 2.烷基官能团和烷烃分子的II类力场CFF93的推导和表征。 美国化学杂志。 Soc.1994年; 116:2515–2525. [ 谷歌学者 ]
Lemmon,M.A.磷脂结合域的膜识别。 自然修订版分子细胞生物学。 2008; 9:99–111. doi:10.1038/nrm2328。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Li,L.,Shin,O.H.,Rhee,J.S.,Arac,D.,Rah,J.C.,Rizo,J.,Sudhof,T.,Rosenmund,C.磷脂酰肌醇磷酸盐作为Ca2+结合到突触素1 C2域的共同激活剂。 生物学杂志。 化学。 2006年; 281:15845–15852。 doi:10.1074/jbc。 M600888200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Maple,J.R.,Hwang,M.-J.,Stockfisch,T.P.,Dinur,U.,Waldman,M.,Ewig,C.S.,Hagler,A.T.二类力场的推导。 烷基官能团和烷烃分子的方法和量子力场。 J.计算。 化学。 1994; 15:162–182. [ 谷歌学者 ]
Marín-Vicente,C.,Gómez-Fernández,J.C.,Corbalán-García,S.蛋白激酶Cα依赖ATP的膜定位受分化PC12细胞中Ca2+内流和磷脂酰肌醇4,5-二磷酸调节。 分子生物学。 单元格。 2005; 16:2848–2861. doi:10.1091/mbc。 E05-01-0067。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Miyazaki,M.、Shirataki,H.、Kohno,H.,Kaibuchi,K.、Tsugita,A.、Takai,Y.鉴定为在Ca2+和磷脂酰丝氨酸存在下与兔红3A相互作用的蛋白质的β-内收蛋白。 生物化学。 生物物理学。 Res.Commun公司。 1994; 205:460–466. doi:10.1006/bbrc.1994.2688。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Montaville,P.、Kim,H.Y.、Vijayan,V.、Becker,S.、Zweckstetter,M。 兔病毒3A的C2A结构域的1H、15N和13C共振分配。 《生物分子杂志》。 核磁共振。 2006年; 36(补充1):20。 doi:10.1007/s10858-005-6051-z。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Montaville,P.,Schlicker,C.,Leonov,A.,Zweckstetter,M.,Sheldrick,G.M.,Becker,S.。C2A-C2B连接子定义了兔亲素-3A的高亲和力Ca2+结合模式。 生物学杂志。 化学。 2007; 282:5015–5025. doi:10.1074/jbc。 M606746200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Ohya,T.、Sasaki,T.,Kato,M.、Takai,Y.Raphilin3通过与Rabaptin5的相互作用参与内吞作用。 生物学杂志。 化学。 1998; 273:613–617. doi:10.1074/jbc.273.1.613。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Osborne,S.L.,Wen,P.J.,Meunier,F.A.磷酰肌醇对神经胞吐的调节:增加了复杂性。 神经化学杂志。 2006年; 98:336–342. doi:10.1111/j.1471-4159.2006.03892.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Rodríguez-Alfaro,J.A.,Gómez-Fernández,J.C.,Corbalán-GarcíA,S.C2结构域富含赖氨酸簇在PKCα依赖磷脂酰丝氨酸活化中的作用。 分子生物学杂志。 2004; 335:1117–1129. doi:10.1016/j.jmb.2003.10.080。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Sanchez Bautista,S.,Marín-Vicente,C.,Gómez Fernández,J.C.,Corbalán-García,S.PKCα的C2结构域是一个Ca2+依赖性PtdIns(4,5)P2传感结构域:对旧途径的新见解。 分子生物学杂志。 2006年; 362:901–914. doi:10.1016/j.jmb.2006.07.093。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Schiavo,G.,Gu,Q.M.,Prestwich,G.D.,Sollner,T.H.,Rothman,J.E.磷酸肌醇结合突触素特异性的钙依赖性转换。 程序。 国家。 阿卡德。 科学。 1996; 93:13327–13332. doi:10.1073/pnas.93.23.13327。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Schuttelkopf,A.W.,van Aalten,D.M.PRODRG:蛋白质-甘氨酸复合物高通量晶体学工具。 《水晶学报》。 D生物结晶仪。 2004; 60:1355–1363. doi:10.1107/S0907444904011679。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Tsuboi,T.,Fukuda,M.Rabbilin的C2B结构域直接与SNAP-25相互作用,并调节PC12细胞中密集核心囊泡胞吐的对接步骤。 生物学杂志。 化学。 2005; 280:39253–39259。 doi:10.1074/jbc。 M507173200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Tsuboi,T.、Kanno,E.、Fukuda,M.兔亲蛋白C2B结构域中的多碱基序列是PC12细胞中囊泡闭锁步骤所必需的。 神经化学杂志。 2007; 100:770–779. doi:10.1111/j.1471-4159.2006.04266.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Tucker,W.C.,Edwardson,J.M.,Bai,J.,Kim,H.J.,Martin,T.F.,Chapman,E.R.通过急性抑制破裂PC12细胞的分泌来鉴定突触蛋白效应器。 《细胞生物学杂志》。 2003; 162:199–209. doi:10.1083/jcb.200302060。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Ubach,J.、Garcia,J.,Nittler,M.P.、Sudhof,T.C.、Rizo,J.兔菲林Janus-face C2B结构域的结构。 自然细胞生物学。 1999; 1:106–112. doi:10.1038/10076。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Wagner,M.L.,Tamm,L.K.重组突触蛋白1a/SNAP25与负电荷脂质相互作用,如平面支撑双层中的横向扩散所测。 生物物理学。 J.2001; 81:266–275. doi:10.1016/S0006-3495(01)75697-4。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Willshaw,A.、Grant,K.、Yan,J.、Rockliffe,N.、Ambavarapu,S.、Burdyga,G.、Varro,A.、Fukuoka,S.和Gawler,D.含有膜联蛋白A4、兔亲素和联会蛋白的新型蛋白质复合物的鉴定。 FEBS信函。 2004; 559:13–21. doi:10.1016/S0014-5793(03)01513-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
山口,T.,Shirataki,H.,Kishida,S.,Miyazaki,M.,Nishikawa,J.,Wada,K.,Numata,S.、Kaibuchi,K.、Takai,Y.Rabphilin-3A,Rab3A p25/smg p25A-结合和磷脂与Ca2+结合域的两个功能不同的域。 生物学杂志。 化学。 1993; 268:27164–27170. [ 公共医学 ] [ 谷歌学者 ]
Zhang,Y.,Luan,Z.,Liu,A.,Hu,G.支架蛋白CASK介导兔菲林3a和β-神经鞘氨醇之间的相互作用。 FEBS信函。 2001; 497:99–102. doi:10.1016/s0014-5793(01)02450-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]