摘要
背景
疲劳是多发性硬化症(MS)患者的主要主诉。然而,人们对其病理生理机制知之甚少。来自慢性疲劳综合征和疾病行为研究的证据表明,免疫和神经内分泌因素可能在疲劳的发展中起到致病作用。
方法
我们比较了15名有明显疲劳的MS患者和15名无疲劳的MS患者的全血促(TNFα、IFNγ)和抗炎细胞因子(IL-10)以及下丘脑-垂体-肾上腺(HPA)轴功能的刺激能力。
结果
促炎细胞因子显著升高(TNFα:478.9v(v)228.2微微克/毫升,p=0.01;干扰素γ:57.6v(v)27.8微微克/毫升;p=0.01)。此外,根据Epworth嗜睡量表测量,TNFα值与日间嗜睡显著相关(r=0.64,p=0.001)。控制疾病活动(根据剑桥多发性硬化症基本评分衡量)、疾病持续时间、扩展残疾状态量表和抑郁进一步增加了细胞因子产生和疲劳的相关性。HPA轴活动与疲劳无关,但与认知障碍有一定相关性。
结论
我们的数据表明,MS中的疲劳至少部分是通过激活促炎细胞因子介导的。与早期发现一致,HPA轴功能障碍似乎与MS疲劳发病机制无关,但似乎与认知障碍有关。我们的研究结果表明,炎症细胞因子水平升高可能与MS疲劳有关。对细胞因子谱的研究可能有助于加深对多发性硬化症疲劳发病机制的理解。
关键词:细胞因子、地塞米松-CRH试验、疲劳、下丘脑-垂体-肾上腺轴、多发性硬化
多发性硬化(MS)是一种炎症和退行性疾病,其病因可能为自身免疫性。1疲劳在多发性硬化症患者中很常见。它也是最具致残性的症状之一,多达三分之二的患者将疲劳描述为他们的主要主诉(有关综述,请参阅Schwid等2).
尽管具有较高的临床相关性,但关于MS疲劳的病理生理学研究很少,其机制尚不清楚。研究发现,当外源性给药时,许多促炎细胞因子会导致疲劳和嗜睡,由此推测疲劳症状的免疫介导过程。三事实上,患有慢性疲劳综合征等疲劳相关疾病的患者,4睡眠呼吸暂停,5糖皮质激素戒断综合征,4和抑郁,6已知已改变外周循环中细胞因子水平,通常倾向于T辅助因子1型促炎因子。
然而,很少有研究调查MS疲劳患者的炎症标记物。焦万诺尼等7在38名MS患者的样本中,未发现疲劳评分与尿新喋呤、CRP和sICAM‐1之间的任何相关性。然而,促炎细胞因子,如IFNγ和TNFα,被认为在疾病行为的发展中起着关键作用,6尚未在MS中对此进行系统检查。
虽然疲劳与MS的疾病亚型、病程或残疾程度没有明显关联,但它与抑郁症状有关。8反之亦然,疲劳是抑郁症的一个重要特征。近年来,很明显,下丘脑-垂体-肾上腺(HPA)轴系统在情绪障碍、焦虑和压力相关病理中会发生改变。9慢性疲劳综合征中也描述了HPA轴功能的改变,其特征是对药理学挑战的反应迟钝。10通过地塞米松-CRH(Dex‐CRH)测试,约30%的MS患者表现出表明HPA过度活动的中央干扰反馈调节。11,12,13然而,还发现了一个HPA活性低下的小亚群。11尚未对伴有明显疲劳的MS患者的HPA反应性进行研究。根据慢性疲劳和抑郁研究的证据,MS疲劳的神经内分泌机制似乎是可能的。已经表明,炎性细胞因子诱导HPA轴的激活。因此,MS患者中枢神经系统内炎性介质的产生不仅可能导致疾病行为和疲劳,还可能激活HPA轴。
本研究的目的是比较有疲劳和无疲劳的MS患者的促炎(IFNγ,TNFα)和抗炎(IL-10)细胞因子的产生以及HPA轴功能。我们假设疲劳与促炎细胞因子的产生和HPA轴负反馈增加有关,对急性刺激反应不足。
方法
学科
患者从我们的MS数据库中招募,并根据疲劳严重程度量表(FSS)分为两组。14FSS平均得分为⩾5的患者被分配到“疲劳”组,而FSS得分<4的患者被分到“无疲劳”组。我们仅招募了根据Poser标准确诊的MS患者,15过去4周内未接受类固醇治疗。排除有临床明显精神疾病的患者。这项研究得到了当地道德委员会的批准。所有受试者都被告知了研究目的,并在进入研究之前获得了书面知情同意书。
临床评分和问卷
所有患者均接受了神经系统筛查,根据Lublin对病程进行分类等.16扩展残疾状态量表(EDSS)得分17由我们门诊部一位经验丰富的神经科医生进行评分。使用符号数字形态测试(SDMT)评估认知损伤。18将正确答案的数量与年龄和教育调整后的健康对照队列进行比较,然后将个人得分转换为低于或高于正常值的标准偏差(SD)。根据剑桥多发性硬化基本评分(CAMBS)进一步对疾病影响进行分类19残疾(0-5:0分,完全独立于5分,完全依赖)、复发(0-5:0分,稳定至5分,需要住院治疗的复发)、最近12年的进展月(分级0-5:0,稳定至5,恶性进展明显)和残疾(分级0-5/0,对生命中的角色无影响至5,不能发挥任何有用的角色)。采用德国版医院焦虑和抑郁量表(HADS)评估情感症状。20我们使用改进的疲劳影响量表(MFIS)进一步评估了疲劳。21Epworth睡眠量表(ESS)22用于评估日间嗜睡。
全血细胞因子刺激
在全血短期培养中测定细胞因子(IFNγ、TNFα、IL‐10)。将400µl全血加入3.2 ml添加有谷氨酸和链霉素/青霉素(100μg/ml)的RPMI(内毒素含量<0.01 EU/ml)的无菌5 ml试管中。我们使用10µg/ml植物血凝素(PHA)作为IFNγ和TNFα的刺激物,使用25µg/ml PHA作为IL‐10的刺激物。还制备了无刺激的对照培养物。将试管加盖并在37°C下培养24小时。之前已使用不同量的PHA(2.5–25µg/ml)和培养时间(3–24小时)确定了最佳刺激条件。IL‐10、IFNγ和TNFα的平均±SDδ变化分别为108±53.2、42.3±41.5和330.6±229.1,均在先前研究的范围内。取下盖子并离心样品。收集上清液并在−80°C下冷冻,直到执行ELISA。所有测试均按照制造商的要求进行(人类IL-10 ELISA、人类TNF-αELISA第2版和人类IFN-γELISA;奥地利维也纳Bender Med Systems)。对探针进行了重复分析。在E‐max ELISA处理器上用620 nm空白过滤器在450 nm处读取平板。IL-10 ELISA的报告敏感性为2 pg/ml,分析内和分析间变异分别为5%和6%。IFNγ检测的灵敏度为1.5 pg/ml,检测内和检测间变异分别为4.5%和5.7%。据报道,TNFαELISA的灵敏度为5.8 pg/ml,批内和批间变异分别为6.9%和7.4%。
Dex‐CRH测试
如前所述进行Dex‐CRH测试。11简言之,患者在试验前一晚23:00时口服1.5 mg地塞米松进行预处理。14:30时插入静脉插管并保持专利。于14:30、15:00、15:30、16:00和16:30 h采血。15:00 h,将100μg合成促肾上腺皮质激素释放激素(CRH;Ferring,Kiel,Germany)重新配制成1 ml 0.09%生理盐水,作为静脉注射。在预冷试管中提取五份血样,用EDTA抗凝,并立即在4°C下离心。血浆被冷冻并储存在−20°C。
激素分析
采用免疫发光两步法(加利福尼亚州圣胡安·卡皮斯特拉诺市Nichols Advantage)测定血浆中促肾上腺皮质激素(ACTH)。两个单克隆抗体,一个发光标记,另一个固定在试管内表面,识别促肾上腺皮质激素上的不同结合位点,形成与试管结合的三明治型复合物。发光信号与促肾上腺皮质激素浓度成正比。检测限为1 pg/ml。分析内和分析间变异系数分别为2.7%和6.4%。使用Elecsys System 2010(Roche,Grenzach‐Whylen,德国)试剂盒,通过双抗体化学发光法测定皮质醇。检测限为3.6 ng/ml。批内和批间变异系数分别为1.3%和1.5%。
统计分析
基线皮质醇和促肾上腺皮质激素(ACTH)以及曲线下面积(AUC)随时间的变化通过梯形估计从Dex‐CRH测试中得出。因为细胞因子和内分泌参数不是正态分布的,所以我们在所有分析中都使用对数转换值。
使用参数分析法分析人口统计学和疾病描述因素、细胞因子和内分泌参数的组间差异(根据FSS截断值,疲劳和无疲劳)t吨独立样本测试。χ2测试用于标称变量。
为了进一步区分MS疲劳与神经内分泌和细胞因子参数的关系,我们使用MS特异性疲劳测量(MFIS)和日间嗜睡评分(ESS)分析了皮尔逊相关系数。
为了控制潜在的混杂因素,如疾病严重程度和情感症状,我们还计算了部分相关性,从统计学上消除了残疾(EDSS,CAMBS)、干扰素药物(干扰素)的影响v(v)其他治疗或不治疗)、病程以及抑郁症状(HADS)。通过计算复发缓解型MS患者和慢性病患者(继发性进展型MS和原发性进展性MS)的相关性,研究疾病过程的可能影响。
结果以平均值±SD表示。所有分析均使用统计软件进行(SPSS 11.0;SPSS,伊利诺伊州芝加哥)。p值小于0.05被认为是显著的。为了检测趋势,接受小于0.10的p值。
结果
人口统计数据
研究包括30名患者(表1)。根据FSS评分,两组患者的差异很大。疲劳患者在疲劳量表(MFIS)和日间嗜睡量表(ESS)中的平均值也明显较高。除了疲劳得分外,两组之间还有其他显著差异。疲劳组在EDSS上表现出明显更高的水平,在CAMBS子量表残疾、进展和残疾上表现出更高的分数。疲劳组在HADS上进一步表现出更多抑郁症状。四名患者的得分高于显性抑郁的分界值(即HADS抑郁量表得分为12分或更高)。19名患者正在接受免疫调节治疗。
表1 研究样本的人口统计数据。
|
疲劳 |
没有疲劳 |
第页 |
| n个 |
15 |
15 |
|
| 年龄 |
46.6±11.69 |
42.87±10.17 |
0.36 |
| 性别,男/女 |
6/9 |
6/9 |
>0.99* |
| MS工作年限 |
13.80±9.68 |
8.60±5.57 |
0.09 |
| EDSS公司 |
4.36±1.49 |
2.30±1.84 |
0.002 |
| FSS公司 |
6.08±0.68 |
1.51±0.69 |
<0.001 |
| 货币金融信息系统 |
58.07±10.55 |
7.53±8.08 |
<0.001 |
| 嵌入式安全子系统 |
10.53±4.71 |
3.27±2.37 |
<0.001 |
| HADS公司 |
7.93±3.30 |
3.13±3.50 |
0.001 |
| 曲面 |
|
|
|
| 残疾 |
2.93±0.25 |
1.93±0.79 |
<0.001 |
| 复发 |
1.33±0.48 |
1.60±0.63 |
0.21 |
| 进展 |
2.40±0.91 |
1.53±0.63 |
0.01 |
| 残疾人 |
3.60±0.82 |
2.00±1.06 |
<0.001 |
| SDMT公司 |
−0.40±1.72 |
0.13±1.30 |
0.35 |
| 疾病病程 |
6个RR,8个SP,1个PP |
11 RR、2 SP、2 PP |
0.07* |
| 治疗 |
6种免疫调节剂,4免疫‐抑制物 |
9种免疫调节剂 |
0.51* |
在疲劳组中,疾病持续时间有延长的统计学趋势(p=0.09)。病程也有所不同:在疲劳组,6名患者出现复发缓解型MS(RRMS),8名患者出现继发性进展型MS(SPMS),1名患者出现原发性进展性MS(PPMS),而在无疲劳组,11名患者出现RRMS,2名患者出现SPMS,2例患者出现PPMS(χ2 = 5.40,p=0.07)。疲劳组有5名患者接受了干扰素治疗,而非疲劳组有6名患者接受干扰素(χ2 = 0.144,p=0.71)。
细胞因子发现
根据FSS分组,MS疲劳患者的平均IFNγ和TNFα生成能力显著高于无疲劳患者(IFNγ:57.6±41.6v(v)27.8±37.1 pg/ml,p=0.01;肿瘤坏死因子α:478.9±209.7v(v)228.2±208.1微微克/毫升,p=0.01)。两组间IL‐0的产生无显著差异(128.2±47.0v(v)97.0±52.3 pg/ml,p=0.10)(图1)。
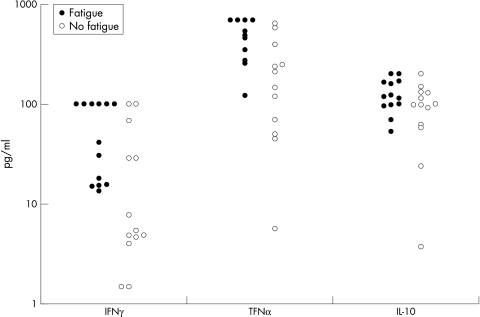
图1 伴有和不伴有疲劳的MS患者中的促炎症(IFNγ,TNFα)和抗炎(IL‐10)细胞因子。每个测量值都用一个点表示。有关平均值和统计差异,请参阅结果部分。
MFIS评分与IFNγ和TNFα显著相关,但与IL‐10生成无关(IFNγ:r=0.45,p=0.02;肿瘤坏死因子α:r=0.45,p=0.03;IL‐10:r=0.26,p=0.20;见图2A、B)。
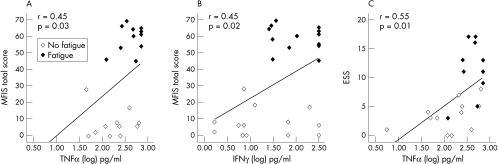
图2 (A,B)MFIS(总分)与(A)TNFα(n=23)和(B)IFNγ(n=26)的相关性。(C) ESS与TNFα的相关性(n=23)。
MFIS的总分、认知和生理亚量表与IFNγ和TNFα的发现同等相关(数据未显示)。根据ESS测量,TNFα是与白天嗜睡显著相关的唯一细胞因子(TNFα:r=0.55,p=0.01,见图2C;干扰素γ:r=0.33,p=0.09;IL‐10:r=0.24,p=0.24)。
值得注意的是,疲劳与细胞因子水平之间的相关性并非由于疾病严重程度、持续时间或抑郁症状的组间差异所致。在统计控制EDSS、病程(年)、疾病严重程度(CAMBS残疾、CAMBS残疾)和进展(CAMBS进展)、抑郁症状(HADS)和干扰素治疗时,部分相关系数实际上增加了(IFNγ:r=0.68,p=0.001;肿瘤坏死因子α:r=0.54,p=0.03)。当分别计算RRMS和慢性MS(SPMS和PPMS)的相关性时,系数实际上增加了(RRMS:IFNγ:r=0.57,p=0.03;肿瘤坏死因子α:r=0.54,p=0.06;SPMS和PPMS:干扰素γ:r=0.47,p=0.15;肿瘤坏死因子α:r=0.53,p=0.12)。
内分泌检查结果
在整个组中,只有三名患者在Dex‐CRH测试中表现出非抑制性,根据皮质醇截断值为40 pg/ml。23在Dex‐CRH测试中,疲劳和非疲劳患者的基线ACTH或皮质醇以及AUC ACTH和皮质醇的反应模式相似(图3)。在控制残疾、病程、抑郁、病程和干扰素药物治疗后,只有皮质醇基线与FSS测量的疲劳之间的相关性显示出趋势(r=0.38,p=0.08)。
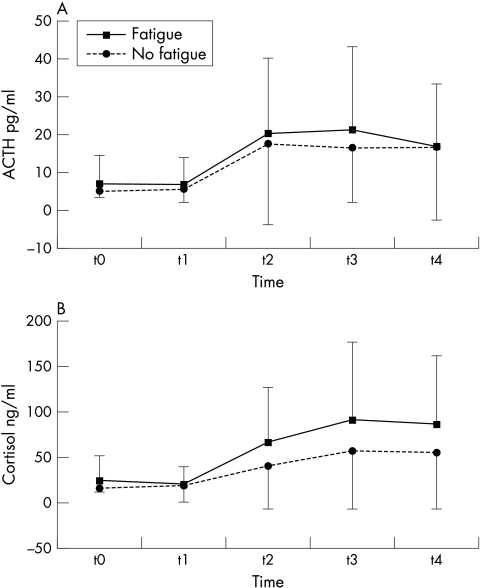
图3 患有疲劳(n=15)和没有疲劳(n=15)的MS患者在Dex‐CRH测试中ACTH和皮质醇血浆浓度的时间进程(SD的平均值)。
基线ACTH或皮质醇、AUC ACTH和皮质醇均与细胞因子水平无显著相关性(在控制上述混杂因素后,所有系数均低于r=0.29)。对我们样本中Dex‐CRH测试的进一步分析显示,6名患者在地塞米松预处理后皮质醇水平较低(<10 pg/ml),ACTH几乎没有刺激作用。虽然这些患者有更大的认知障碍,但他们没有更高的疲劳评分、疾病活动或一般残疾。
抑郁症和认知障碍的影响
HADS评分与任何测得的细胞因子均无关(TNFα:r=0.08,p=0.70;干扰素γ:r=0.08,p=0.67;IL-10:r=−0.001,p=0.99)或内分泌参数(ACTH基线:r=–0.10,p=0.59;平均有效浓度:r=-0.01,p=0.95;皮质醇基线:r=-0.07,p=71;平均零售价:r=0.03,p=0.84)。
然而,认知障碍与地塞米松预处理后ACTH的抑制显著相关(ACTH基线:r=-0.43,p=0.02),而与基线时的皮质醇无关(r=-0.20,p=0.30)。此外,在Dex‐CRH测试中,认知障碍与ACTH AUC的高反应性呈中度相关(r=-0.32,p=0.08;见图4),而皮质醇AUC不相关(r=-0.09,p=0.63)。同样,在控制混杂因素后,相关系数增加(ACTH基线:r=-0.53,p=0.01;皮质醇基线:r=-0.37,p=0.08;促肾上腺皮质激素AUC:r=−0.43,p=0.04;皮质醇AUC:r=-0.22,p=0.32)。
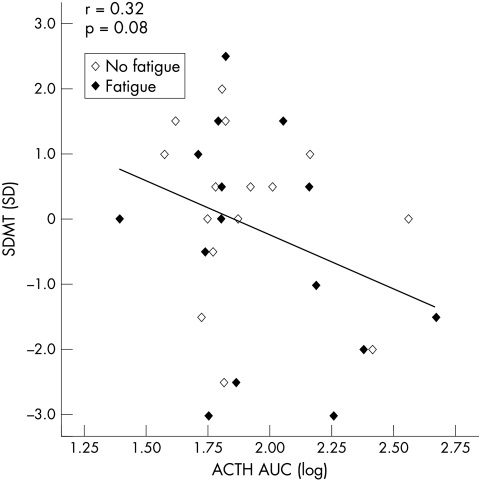
图4 与SDMT相对应的ACTH AUC(log)散点图(带SD)。ACTH AUC值采用对数变换,以任意单位表示(梯形估计)。
讨论
本研究根据FSS调查了伴有明显疲劳的MS患者的细胞因子和内分泌特征,并与FSS评分低的患者进行了比较。伴有疲劳的MS患者对PHA反应的IFNγ和TNFα生成能力显著增强。IL‐0的生产似乎受影响较小。TNFα与疾病活动和疲劳中度相关。根据ESS测量,TNFα也与日间嗜睡有关。因此,我们假设TNFα是MS疲劳的关键介质。此外,白天嗜睡可能是细胞因子介导的疲劳综合征的临床指标。
虽然疲劳和非疲劳患者之间的疾病严重程度存在显著差异,但这种差异不太可能与细胞因子水平的观察结果有关。疲劳组有更多继发性进行性疾病患者。因此,平均疾病持续时间明显更长,平均EDSS更高。一般认为疾病后期炎症活动较少,尤其是在继发性进展期。1因此,在一组晚期疾病患者中预期较高水平的促炎细胞因子是违反直觉的。与这一论点一致,对疾病严重程度(EDSS、病程、CAMBS残疾、CAMBS伤残)进行统计调整,实际上进一步增加了IFNγ和TNFα生成能力与疲劳得分的直接相关性。因此,我们的发现似乎不太可能与疾病的严重程度相混淆。
我们的研究结果表明TNFα在MS疲劳中起着关键作用。最近研究表明,抗肿瘤坏死因子α治疗策略能有效抑制睡眠呼吸暂停综合征患者的疲劳,24强调TNFα在疲劳发病机制中的相关性。我们的发现得到了Flachenecker最近的一项研究的支持等,25在27例FSS评分为⩾4的MS患者中,报告的疲劳评分与TNFαmRNA生成相关。然而,在他们的研究中,IFNγ或IL-10水平与疲劳无关。全血刺激后的细胞因子产生能力更像是一种功能测试,而不是实际转录细胞因子的测量,这可能使我们的方法更加敏感。这些方法上的差异可能解释了关于IFNγ的不同发现。
在之前的一项关于MS神经心理疲劳的研究中,26我们发现,与25名健康对照组相比,23名MS患者的基线细胞因子生成水平没有改变。经过40分钟的认知应激后,MS患者表现出较低的IFNγ产生能力,而IL‐10反应没有改变。这一发现与我们之前的实验性应激研究一致,这些研究表明,在急性实验性生理或心理应激下,MS中的细胞因子反应减弱。27,28在上述研究中,将患有疲劳的MS患者与健康对照组进行了比较,从而排除了对疲劳机制的任何结论。此外,疲劳评分低于本研究。
由于本研究中MS疲劳与促炎细胞因子生成能力增强有关,因此抗炎治疗可能是治疗MS疲劳的替代治疗方案,而非服用促进清醒的药物,如莫达非尼。这一概念需要进一步调查。
疲劳与Dex‐CRH测试的任何参数均无显著相关性。因此,HPA轴的失调似乎不是MS疲劳的一般介质。这一发现证实了之前的研究,这些研究发现疲劳分数与Dex‐CRH测试结果没有相关性。12,13,29然而,所有这些报告,包括本文中的研究,样本量都很小,因此限制了通用性。
在Gottschalk最近的一项研究中等,30据报道,MS疲劳患者的HPA活性增加。当Gottschalk等对来自相同数量患者的数据进行分析,并使用几乎相同的疲劳临界值,他们的样本仅包括RRMS患者,其中大多数患者未经治疗,病程较短,总体残疾较低。相比之下,我们的样本中有很大一部分慢性进行性患者,超过50%的受试者接受了免疫调节或免疫抑制治疗。这可能增加了HPA测量中的个体间差异,进而降低了我们这部分分析的统计能力。也可以想象,RRMS中的疲劳与疾病进展阶段的疲劳相比,与不同的因素有关。这可能部分解释了Gottschalk研究中疲劳与HPA轴功能的更强关联等30与我们的数据相比。显然,有必要对同质患者群体进行更大规模的研究,以阐明炎症、神经变性、神经精神症状和HPA活性对MS疲劳的影响。
在本研究中,我们能够复制我们之前在Dex‐CRH测试中发现的认知功能障碍与高反应性的关联。12使用Dex‐CRH测试和MRI对认知受损和未受损MS患者进行进一步研究,以阐明这种关联的机制。由于我们的样本中抑郁评分较低,只有4名患者的临床临界分高于12分,因此本研究无法得出关于HPA轴与MS抑郁症状之间关系的结论。
到目前为止,建立MS疲劳客观标志物的尝试尚未成功。招募患者研究疲劳必须依赖患者的自我报告,该报告综合了症状和补偿策略。根据定义,疲劳和抑郁症状有相当大的重叠,自我报告测量可能会受到回忆偏差的严重影响。2FSS是最常用的疲劳筛选量表之一,在MS中具有可接受的可靠性和有效性。31然而,这是一种倾向于评估身体疲劳的短期筛选工具。31
我们得出结论,高促炎细胞因子产生能力可能是MS患者疲劳症状的部分原因。我们的数据表明,TNFα对日间嗜睡尤其重要。疲劳严重干扰日常生活活动,被患者描述为最具致残症状之一。2除了测试中枢运动兴奋性、抑制途径和交感功能外,细胞因子产生能力也有助于对患者进行分类。细胞因子谱的研究可能会增加对MS疲劳发病机制的了解,并最终有助于开发更好的症状治疗。
致谢
我们感谢W Tessmer在进行细胞因子研究方面的出色帮助,以及临床化学系R Jung对皮质醇和促肾上腺皮质激素的分析。
缩写
促肾上腺皮质激素
AUC-曲线下面积
CAMBS-剑桥多发性硬化症基本评分
促肾上腺皮质激素释放激素
地塞米松CRH试验
EDSS-扩展残疾状况量表
ESS-Epworth睡眠量表
FSS-疲劳严重程度分级
HADS-医院焦虑和抑郁量表
HPA轴-下丘脑-垂体-肾上腺轴
MFIS-修改的疲劳冲击等级
MS-多发性硬化
PHA-植物血凝素
PPMS-原发性进行性MS
RRMS-复发汇款MS
SD-标准偏差
SDMT-符号数字模式测试
SPMS-次级进行性MS
脚注
本研究得到Gemeinnützige Hertie‐Stiftung(批准号:1.319.120‐01‐01和1.01.1/03/013)的支持。Stefan M Gold的部分资金由德意志联邦基金会(DFG;赠款编号:GO 1357/1‐1)提供
工具书类
-
1.Lucchinetti C、Brueck W、Parisi J。等多发性硬化病变的异质性:脱髓鞘发病机制的意义。《神经年鉴》200047707–717。[内政部] [公共医学] [谷歌学者]
-
2施维德·S·R、科文顿·M、西格尔·B·M。等多发性硬化症中的疲劳:当前认识和未来方向。《康复研究杂志》200239211–224。[公共医学] [谷歌学者]
-
三。Konsman J P、Parnet P、Dantzer R。细胞因子诱导的疾病行为:机制和影响。《神经科学趋势》200225154-159。[内政部] [公共医学] [谷歌学者]
-
4Papanicolau D A、Amsterdam J D、Levine S。等慢性疲劳综合征的神经内分泌方面。神经免疫调节20041165-74。[内政部] [公共医学] [谷歌学者]
-
5Vgontzas A N、Papanicolaou D A、Bixler E O。等睡眠呼吸暂停、白天嗜睡和疲劳:与内脏肥胖、胰岛素抵抗和高细胞因子血症的关系。内分泌代谢杂志2000851151–1158。[内政部] [公共医学] [谷歌学者]
-
6Lee B N、Dantzer R、Langley K E。等癌症相关症状的基于细胞因子的神经免疫学机制。神经免疫调节200411279-292。[内政部] [公共医学] [谷歌学者]
-
7Giovannoni G、Thompson A J、Miller D H。等疲劳与多发性硬化症炎症标记物升高无关。神经病学2001581134。[内政部] [公共医学] [谷歌学者]
-
8Kronecke D C,Lynch S G,Denney D R。多发性硬化症中的疲劳:与抑郁、残疾和疾病模式的关系。Mult Scler 20006(2)131–136。[内政部] [公共医学] [谷歌学者]
-
9Gold P W、Gabri K E、Yasuda M R。等忧郁症和非典型抑郁症的发散性内分泌异常:临床和病理生理意义。《北美内分泌代谢临床》200231(1)37–62。[内政部] [公共医学] [谷歌学者]
-
10Cleare A J.HPA轴与慢性疲劳综合征的发生。内分泌代谢趋势2003155–59。[内政部] [公共医学] [谷歌学者]
-
11Grasser A、Möller A、Backmund A。等多发性硬化症患者下丘脑-垂体-肾上腺系统对联合地塞米松-CRH试验反应的异质性。《实验-临床-内分泌》199610431–37。[内政部] [公共医学] [谷歌学者]
-
12Heesen C、Gold S M、Raji A。等多发性硬化症患者认知障碍与下丘脑-垂体-肾上腺轴失调相关。心理神经内分泌学200227505–517。[内政部] [公共医学] [谷歌学者]
-
13.Fassbender K、Schmidt R、Mossner R。等多发性硬化症患者的情绪障碍和下丘脑-垂体-肾上腺轴功能障碍:与脑炎症的关系。《神经病学档案》19985566–72。[内政部] [公共医学] [谷歌学者]
-
14Krupp L B、LaRocca N G、Muir‐Nash J。等疲劳严重程度量表。适用于多发性硬化症和系统性红斑狼疮患者。神经系统科学档案1989461121-1123。[内政部] [公共医学] [谷歌学者]
-
15Poser C M.多发性硬化症的新诊断标准:研究方案指南。《神经年鉴》198313227–231。[内政部] [公共医学] [谷歌学者]
-
16Lublin F D,Reingold SC,美国国家多发性硬化学会(美国)多发性动脉粥样硬化新药临床试验咨询委员会,定义多发性硬皮病的临床病程:国际调查结果。神经病学199646907–911。[内政部] [公共医学] [谷歌学者]
-
17Kurtzke J M.多发性硬化症神经损伤分级:扩展残疾状况量表。神经病学1983331444-1452。[内政部] [公共医学] [谷歌学者]
-
18Smith A.符号数字模式测试。学习Disord 1968383–91。[谷歌学者]
-
19Mumford C,Compston A.多发性硬化症评分量表的问题:一种新方法——CAMBS评分。《神经学杂志》1993240209–215。[内政部] [公共医学] [谷歌学者]
-
20Zigmond A S,Snaith R P.医院焦虑和抑郁量表。《精神病学学报扫描》198367361–370。[内政部] [公共医学] [谷歌学者]
-
21多发性硬化症委员会临床实践指南疲劳和多发性动脉粥样硬化:多发性硬皮病疲劳的循证管理策略。华盛顿特区:美国残疾退伍军人,1998年10月
-
22霍迪斯·E、扎克尼五世、斯迈思·H。等嗜睡的量化:一种新方法。心理生理学197310431-436。[内政部] [公共医学] [谷歌学者]
-
23Von Bardeleben U,Holsboer F.抑郁症患者对地塞米松-人促肾上腺皮质激素释放激素持续激发的皮质醇反应。神经内分泌杂志19891485-488。[内政部] [公共医学] [谷歌学者]
-
24Vgontzas A N,Zoumakis E,Lin H M。等肿瘤坏死因子‐α拮抗剂依那西普显著降低睡眠呼吸暂停患者的嗜睡。内分泌代谢杂志2004894409–4413。[内政部] [公共医学] [谷歌学者]
-
25Flachenecker P、Bihler I、Weber F。等多发性硬化和疲劳患者的细胞因子mRNA表达。Mult Scler 200410165–169。[内政部] [公共医学] [谷歌学者]
-
26Heesen C、Koehler G、Gross R。等疲劳多发性硬化症患者对认知应激的细胞因子反应改变。Mult Scler 20051151–57。[内政部] [公共医学] [谷歌学者]
-
27Heesen C、Schulz H、Schmidt M。等多发性硬化症急性心理应激的内分泌和细胞因子反应。脑行为免疫200216282–287。[内政部] [公共医学] [谷歌学者]
-
28Heesen C、Gold S M、Hartmann S。等多发性硬化症患者和健康对照者对标准化生理应激的内分泌和细胞因子反应。脑行为免疫200317473–481。[内政部] [公共医学] [谷歌学者]
-
29然后是Bergh F、Kümpfel T、Trenkwalder C。等下丘脑-垂体-肾上腺轴的失调与MS的临床病程有关。神经病学199953772–777。[内政部] [公共医学] [谷歌学者]
-
30Gottschalk M、Kümpfel T、Flachenecker P。等多发性硬化症患者下丘脑-垂体-肾上腺轴的疲劳和调节。神经病学档案200562277–280。[内政部] [公共医学] [谷歌学者]
-
31Tellez N、Rio J、Tintore M。等改良疲劳影响量表是否对MS中的疲劳进行了更全面的评估?Mult Scler 200511198–202。[内政部] [公共医学] [谷歌学者]






