摘要 在人类前列腺腺癌中,已观察到E-cadherin缺失、Gleason评分增加和囊外播散之间的关系。 人类前列腺癌细胞株E-cadherin/catenin表型的进一步表征表明,低分化前列腺癌细胞系(PC-3N来源于PC-3、PC-3和JCA1)中E-cadherin缺失,N-cadherin表达。 我们发现N-钙粘蛋白集中在PC-3N细胞延伸的细胞-细胞接触部位。 N-钙粘蛋白也在前列腺基质成纤维细胞中表达 在体外 前列腺组织。 前列腺基质成纤维细胞和PC-3N细胞的共培养显示N-钙粘蛋白在细胞间接触中的免疫定位。 此外,钙粘蛋白结合蛋白p120的亚型表达 计算机网络 E的表达不同- 与 前列腺癌细胞系的N-钙粘蛋白。 p100亚型在E-cadherin阳性的前列腺癌细胞系中表达更高,而p120主要在N-钙粘蛋白阳性前列腺癌细胞株和前列腺基质成纤维细胞中表达。 腹腔注射SCID小鼠后,N-钙粘蛋白阳性癌细胞系PC-3N表现出对膈肌表面的侵袭性。 侵袭性前列腺癌细胞株获得的N-钙粘蛋白和丢失的E-钙粘蛋白表明从上皮表型向间充质表型发展,这可能使其与周围基质成纤维细胞相互作用并促进转移。
前列腺癌具有高度的生物多样性 1 并且可以作为前列腺内的局部疾病存在,或者变得高度侵袭性并转移到区域淋巴结和骨。 虽然局限性前列腺癌可以成功治疗, 2 当前列腺肿瘤细胞转移到腺体以外时,主要是通过神经束和间质浸润,治疗成功率显著降低。 3-5 转移的过程是多方面的; 然而,促进前列腺癌转移表型传播的分子机制尚不清楚。 前列腺癌的早期侵袭事件是基底细胞成分的丢失或破坏,然后是转化的管腔上皮细胞的遗传和生化功能的获得或丧失。 6 前列腺癌进展过程中一些功能的获得或丧失是由于细胞之间组织结构的改变,由钙粘附素超家族的细胞间粘附受体、整合素家族的细胞外基质粘附受体和细胞外基质成分介导。 7
前列腺上皮细胞结构和功能部分由E-cadherin/catenin复合体维持。 8 E-cadherin是Ca家族的成员 2+ -依赖性整体膜细胞-细胞粘附受体。 9 E-cadherin定位于 附着带 上皮细胞之间的连接 10 与具有激酶、磷酸酶和连环蛋白的多蛋白复合物中的外周基底侧肌动蛋白丝相关。 11 将E-钙粘蛋白锚定在肌动蛋白细胞骨架上的细胞质复合体, 12 包括细胞内蛋白α-catenin,它与vinculin同源, 13 和 犰狳 家族成员β-catenin,γ-catenin/plakoglobin, 14 和p120 ctn公司 . 15 p120 ctn公司 E-cadherin的结合位点不同于β- 连环蛋白 /血小板球蛋白结合位点与p120 ctn公司 不与α-catenin结合。 16 细胞-细胞接触后,E-钙粘蛋白/连环蛋白复合物的粘附通过启动桥粒、紧密连接和间隙连接的形成来建立上皮细胞结构。 17
E-cadherin/catenin功能或表达的改变在肿瘤过程中被发现是转移的一个步骤。 18-21 这种缺失在一定程度上导致了正常上皮样体形态向侵袭性和低分化间充质表型的转变。 22,23 在侵袭性更强的肿瘤细胞系中,E-cadherin水平降低或缺失; 通过全长E-cadherin cDNA的转染可以逆转这种表型。 18 高度侵袭性肿瘤(乳腺癌、黑色素瘤、前列腺癌、非小细胞肺癌)的免疫组织化学分析表明,这些组织的E-cadherin水平降低,表明E-cadherin在组织结构组织中的功能降低。 24 Umbas等人 25 发现Gleason评分高于6的前列腺癌与正常腺上皮相比E-cadherin免疫反应性降低,Gleason分数为9或10的肿瘤E-cadherin免疫反应性低。 此外,在前列腺癌细胞系(DU145、PC-3、PPC-1和TSU-PR1)中,也发现E-cadherin表达降低或缺失。 26 这些研究表明,E-cadherin/catenin粘附途径的下调与前列腺癌中观察到的肿瘤细胞的分化丧失和侵袭行为增加有关。
为了更好地理解前列腺癌侵袭性变异的分子基础,我们检测了四种人前列腺癌细胞系中E-钙粘蛋白/连环蛋白复合物的蛋白质和mRNA表达水平:LNCaP, 27 DU145, 28 PC-3, 29 和JCA1。 30 我们发现前列腺细胞系JCA1和PC-3N(PC-3的衍生物,两者都缺乏E-cadherin)表达的是更大分子量的钙粘蛋白。我们将这种钙粘蛋白鉴定为N-钙粘蛋白,并显示N-钙粘素在侵袭性更强的前列腺腺癌细胞系和前列腺基质成纤维细胞中表达。 此外,钙粘蛋白相关蛋白p120的亚型表达(p120和p100) ctn公司 发现这取决于前列腺癌细胞系中是否表达E-或N-cadherin。 这些结果表明,侵袭性前列腺癌细胞系上皮表型的丧失伴随着N-cadherin/p120的增加 ctn公司 表型。
材料和方法 细胞培养 LNCaP和DU145人前列腺癌细胞系来自美国型培养物收集中心(弗吉尼亚州马纳萨斯)。 Muraki等人之前描述并建立了JCA1细胞的分离。 30 PC-3细胞系最初取自美国类型培养收集,细胞培养的长期传代导致选择具有不同生长、粘附和形态表型(PC-3N)的细胞群体。 所有细胞系均保存在含有10%热灭活胎牛血清(FBS;Intergen,Purchase,NY)和青霉素/链霉素的Dulbecco改良Eagle's培养基(DMEM)中,37°C,5%CO 2 恒定湿度下的大气。
从手术标本中培养人前列腺基质成纤维细胞(PSF)。 通过将前列腺组织切割成1-mm来分离成纤维细胞 三 将其放置在100mm培养皿中并使其附着过夜。 当细胞从外植体移出时,组织保存在含有10%FBS的DMEM中。 用胰蛋白酶/EDTA传代两代后,只有前列腺成纤维细胞保留在培养基中,这表现为没有细胞角蛋白阳性细胞。 在这些研究中使用之前,这些细胞又被保存了两代。
抗体 根据小鼠N-钙粘蛋白COOH末端(残基883-906)的推导氨基酸序列制备了多克隆抗血清(抗泛钙粘蛋白) 31 使用肽CDYDYLNDWGPRFKKLADMYGGGDD(多肽快递,科罗拉多州柯林斯堡)。 如Marcantonio和Hynes所述,该肽与钥匙扣帽贝血蓝蛋白偶联 32 给新西兰白兔注射弗氏不完全佐剂。 在加强注射抗原后采集血清。
实验中使用的小鼠单克隆抗体如下:α-连环蛋白克隆5(肯塔基州列克星敦转导实验室)、E-钙粘蛋白克隆HECD-1(加利福尼亚州旧金山Zymed实验室)、N-钙粘蛋白(A-CAM克隆GC-4;密苏里州圣路易斯西格玛化学公司)、p120 ctn公司 克隆98(转导实验室)。 抗斑球蛋白PG5.1的单克隆小鼠抗体 33 由Franke和Schmelz博士(德国海德堡德国癌症研究中心细胞与肿瘤生物学研究所)慷慨提供。 Nagle等人先前描述了兔细胞角蛋白18A抗体。 34 实验中使用的二级抗体如下:Cy3-共轭亲和山羊抗鼠IgG(H+L)和荧光素(FITC)共轭亲和驴抗兔IgG,购自Jackson ImmunoResearch Laboratories,Inc.(宾夕法尼亚州西格罗夫)。 抗鼠IgG+HRP结合物购自Promega(威斯康星州麦迪逊),抗兔IgG-过氧化物酶结合物购于Boehringer Mannheim(印第安纳波利斯)。
SDS-PAGE和Western Blot 制备细胞裂解物并通过7%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离 35 电泳转移到硝化纤维。 用含有1mmol/L苯基甲基磺酰氟(PMSF)的无钙和无镁磷酸盐缓冲盐水(CMF-PBS)洗涤单层细胞。 细胞在CMF-PBS中刮取,转移到微型离心管中,然后离心。 用2×SDS样品缓冲液(0.25 mol/L Tris-HCl,pH 6.8,10%SDS,25%甘油)对颗粒进行溶解,每车道装载30μg细胞蛋白。 以牛血清白蛋白(BSA)为标准物,采用比新新酸(BCA)分析程序(皮尔斯化学公司,伊利诺伊州罗克福德)测量蛋白质浓度。 用一级抗体检测抗原,然后用过氧化物酶结合的抗鼠IgG或抗兔IgG检测。 通过暴露在X-OMAT AR胶片(柯达,罗切斯特,纽约)上的化学发光(NEN,波士顿,马萨诸塞州)识别蛋白质带。 使用Metamorph 3.0版(宾夕法尼亚州韦斯特切斯特市Universal Imaging Corp.)采集Western印迹图像,使用One-D Scan 1.0版(弗吉尼亚州费尔法克斯市Scanalytics公司CSP Inc.)进行定量密度测定。
为了检测N-钙粘蛋白的非离子洗涤剂溶解度,PC-3N细胞生长到90%的汇合状态。 用CMF-PBS和细胞骨架稳定缓冲液(CSK缓冲液;0.5%Triton X-100,10mmol/L PIPES,pH 6.8,50mmol/L NaCl,3mmol/L MgCl)洗涤细胞3× 2 ,0.3 mol/L蔗糖)在4°C的摇床上添加5分钟。 刮取细胞并离心,通过丙酮沉淀收集洗涤剂可溶性蛋白质组分。 沉淀物以10000 rpm的转速离心20分钟,然后在2×SDS样品缓冲液中重新悬浮。 通过将热的2×SDS样品缓冲液添加到留在平板上的细胞成分中并进行注射器注射,收集不溶性部分。
为了进行免疫沉淀,根据Reyolds等人 15 在含有10 mmol/L Tris、pH7.4、150 mmol/L-NaCl、1 mmol/L-PMSF、1 mmol/L EDTA、0.1 mmol/L-钒酸钠、10μg/ml抑肽酶和10μg/ml亮氨酸肽(Sigma)的缓冲液中加入0.5%诺奈特P-40(NP-40)。 从裂解物中免疫沉淀蛋白质,用SDS-PAGE分离,并转移到硝化纤维素中,如上所述检测抗原。
RNA提取和Northern Blot分析 通过酸性硫氰酸胍-酚氯仿萃取法从培养细胞中制备总RNA。 36 在含有1.85%甲醛的1%琼脂糖凝胶中通过电泳分离20微克的每个RNA样品,并将其转移到Hybond N+尼龙膜(Amersham Life Science,Arlington Heights,IL)上。 N-cadherin mRNA通过Northern blot分析用300-bp 经济效益 从全长N-钙粘蛋白中分离的I cDNA片段(GenBank Accession X54315型 )由John Hempery博士(北卡罗来纳州三角研究园Becton Dickinson研究中心)提供。 37 使用1.7-kb检测E-cadherin mRNA Sma公司 小鼠E-cadherin的I片段(GenBank Accession X06115型 ). 12 血小板球蛋白的检测(GenBank登录 M23410型 )是从Werner Franke博士那里获得的人类cDNA。 38 探针用标记的α随机计时- 32 PdCTP(阿默沙姆)。 在42°C下,在含有0.05 mol/L NaH的6×SSC缓冲液中预混合膜18小时 2 人事军官 4 5×Denhardt’s(50×=%Ficoll,1%聚乙烯吡咯烷酮,1%牛血清白蛋白),1%十二烷基硫酸钠,50%甲酰胺和10μg/ml鲑鱼精子DNA。 39 将变性探针添加到斑点中并杂交过夜。 在65°C下,使用以下条件将斑点依次洗涤30分钟:2×SSC/0.1%SDS、0.3×SSC/0.5%SDS和0.1×SSC/1.0%SDS。 然后将印迹暴露于X-OMAT AR胶片(柯达)。 将加载的归一化与1.2kb的杂交进行了比较 精神分裂症 人类GAPDH的I片段(GenBank Accession J04038号 ).
逆转录聚合酶链反应(RT/PCR)与DNA测序 对PC-3N细胞总RNA逆转录产生的cDNA进行PCR,使用简并引物扩增多种钙粘蛋白亚型。 40 在含有随机六聚体引物、10mmol/l DTT、0.5mmol/l dNTPs、10U RNasin和200U Maloney小鼠白血病病毒逆转录酶(Gibco BRL)的40μl反应混合物中,从1μg DNase I处理的总RNA中扩增PC-3N cDNA,并在42°C下保持60分钟。 然后用80μl H稀释cDNA产物 2 O、 并使用5′寡核苷酸引物AATGAATTCGTNTTYGAYTAYGARGG和3′引物AAtgAATTCRTCNGCNGCNAGYTTYTTRAA将2.5μl的PC-3N cDNA产物用于25μl PCR反应。反应产物随后通过4%琼脂糖凝胶电泳分离(3%Nusieve GTG琼脂糖和1%Seakem ME琼脂糖,FMC BioProducts,Rockland,ME), 提取约150 bp的cDNA片段,用 生态 R1,并连接到pBluescript(Stratagene,La Jolla,CA)。 连接产物转化为XL-1蓝色 大肠杆菌 (Stratagene),31个cDNA插入序列通过双脱氧链终止(Sequenase 2.0,United States Biochemical,Cleveland,OH)测定。
SCID小鼠模型 BALB-c/B-17/IcrACCscid小鼠(亚利桑那州癌症中心SCID菌落)按照美国公共卫生服务局关于动物护理和维护的指南,在特定的无病原体环境中进行维护。 5周龄雄性SCID小鼠腹腔接种5×10 5 DU-145或PC-3N细胞重新悬浮在0.25 ml DMEM无血清培养基中。 根据McCandless等人的研究,接种后42天,处死小鼠,固定并处理膈肌组织。 41 异种移植物固定组织切片,厚度为5μm。 切片脱蜡并用苏木精和伊红染色。
组织制备与免疫细胞化学 人类冷冻前列腺组织来自亚利桑那大学病理组织库。 标本在手术或尸检时获得,snap冷冻在异戊烷中,用氟利昂冷却,并保存在−80°C下。 将6μm厚的冰冻切片置于聚赖氨酸涂层载玻片上,并在−20°C的丙酮中固定10分钟。 然后用2%牛血清白蛋白和2%山羊血清在CMF-PBS中封闭切片1小时,然后用兔多克隆抗细胞角蛋白18抗体和鼠抗N-钙粘蛋白孵育1小时。 清洗后,应用Cy3-结合的抗鼠IgG和FITC-结合的驴抗兔IgG 1小时。 载玻片上装有2%没食子酸正丙酯/90%甘油,pH 8.0。 通过配备有He、Ne和Ar激光器(Zeiss)的激光扫描共聚焦显微镜LSM410观察人类前列腺组织。
对于免疫荧光,细胞生长在玻璃盖玻片上汇合。 细胞在CMF-PBS中的4%(w/v)多聚甲醛中固定5分钟,并在4°C的CSK缓冲液中渗透5分钟。 盖玻片与2%牛血清白蛋白和2%山羊血清在CMF-PBS中孵育,并在25°C下暴露于抗体1小时。 清洗后,应用Cy3-共轭二级抗鼠IgG 1小时。 为了检测PC-3N和PSF共培养物中的N-钙粘蛋白,PSF细胞在玻璃盖玻片上生长到50%的汇合处过夜。 用40μg/ml的DiO(乙醇中的3,3′-二十八烷氧基碳菁高氯酸盐(Molecular Probes,Eugene,OR))标记PC-3N细胞1小时,并用CMF-PBS广泛清洗 4 )用PSF培养物播种24小时。 然后固定细胞,用CSK缓冲液渗透,并如上所述染色N-钙粘蛋白。
细胞聚集分析 按照乌鲁什哈拉和武一的描述进行了细胞聚集实验。 42 单层培养物在2mmol/L钙的存在下用0.01%胰蛋白酶(Worthington Biochemical Corp.,Freehold,NJ)处理2分钟。 在含有10 mmol/L HEPES、pH 7.4和1%BSA且不含钙和镁的Hanks平衡盐溶液(HBSS)中通过离心轻轻清洗胰蛋白酶化细胞。 用巴斯德吸管研磨10次,彻底分离细胞。 5 × 10 5 然后将细胞转移到24孔培养皿中,最后体积为0.5 ml HEPES缓冲HBSS,其中含有1%BSA和100μg/ml DNase I,添加或不添加2mmol/L CaCl 2 .这些板之前涂有聚血红素(Sigma)。 通过添加钙开始细胞-细胞粘附,并在37°C下以80 rpm的速度旋转平板1小时,然后用等体积的8%多聚甲醛将细胞固定在pH 7.4的CMF-PBS中。 对于混合聚集实验,用40μg/ml DiO在37°C下标记PC-3N细胞1小时。 在存在或不存在CaCl的情况下进行细胞聚集 2 和/或N-钙粘蛋白特异性阻断单克隆抗体(A-CAM;克隆GC4)在37°C下以80 rpm的转速持续1小时。 然后按照上述方法固定细胞。 为了进行分析,取下50μl固定骨料,放在载玻片上,并用盖玻片覆盖。 使用20倍物镜(蔡司)在外荧光光学下用FITC滤波器组和相位对比度拍摄骨料。
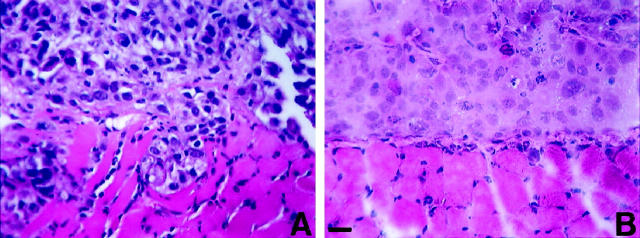
结果 前列腺癌细胞系的侵袭特性 人前列腺癌细胞系LNCaP、DU145、PC-3、JCA1和亚系PC-3N显示出不同的细胞形态 在体外 . 27-30 DU145和LNCaP细胞表现为上皮表型,而PC-3、PC-3N和JCA1细胞在不同程度上表现为组织化程度较低、细长的纺锤状间充质表型。 PC-3N细胞是亲代PC-3细胞系的变体 29 在广泛的继代培养后显示出更像成纤维细胞的表型。PC-3以前已经被证明包含两个不同的亚群。 43 一个群体表达E-钙粘蛋白并表现出上皮表型,另一个群体缺乏E-钙粘蛋白表达并具有更分散的纺锤形表型,类似于PC-3N。 由于人类前列腺癌细胞系PC-3N和DU145具有明显不同的生长特性,我们试图通过SCID小鼠腹腔接种的人类异种模型来表征其侵袭性。 41 苏木精和伊红染色的横切面显示,5周后,PC-3N和DU145细胞随机附着在横膈膜的间皮表面。 PC-3N细胞在膈膜表面生长为小实体瘤。 PC-3N细胞也侵入膈肌横纹肌。 在膈肌内的多个部位检测到侵袭PC-3N细胞的小簇(图1A) ▶ PC-3N人癌的侵袭集落直径始终只有几毫米。 DU145在隔膜表面生长为大的、血管化程度高的肿瘤,但没有侵犯隔膜肌(图1B) ▶ .
图1。
前列腺癌细胞系PC-3N肿瘤的显微照片( 一 )和DU-145( B类 )SCID小鼠膈肌表面。 SCID小鼠( n个 =4)腹腔注射5×10 5 注射后5周处死细胞,将膈肌固定并石蜡处理。 DU145肿瘤已经穿透基底膜,PC-3N已经穿透小鼠的斜肌。 切割五微米切片并脱蜡,以进行苏木精和伊红染色。 刻度,60μm。
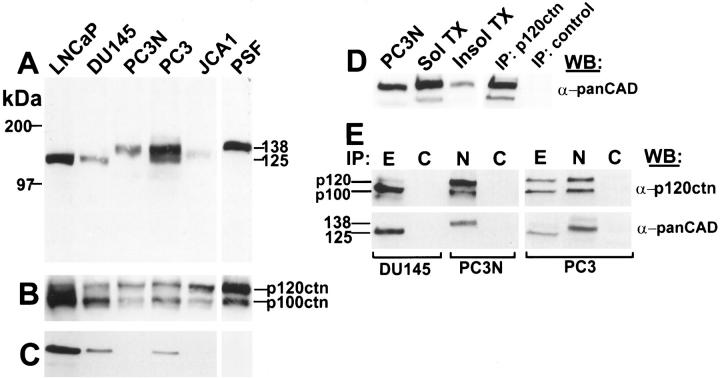
N-Cadherin在PC-3、PC-3N和JCA1前列腺细胞系中的表达 由于PC-3N前列腺癌细胞在SCID小鼠膈肌中的生长和侵袭特征表明细胞间粘附较弱,因此我们对PC-3N和其他四种前列腺癌细胞系的E-cadherin/catenin表达进行了表征。 通过免疫印迹等效数量的细胞蛋白评估E-钙粘蛋白和α-、β-和γ-连环蛋白的表达水平。 数据如图2所示 ▶ ,总结见表1 ▶ 为了检测钙粘蛋白,我们使用针对经典钙粘蛋白家族保守细胞质区域的泛素多克隆抗体对前列腺细胞总裂解物进行免疫印迹 44 (图2A) ▶ 针对该区域制备的抗体已被证明与钙粘蛋白家族的几个成员具有免疫反应性。 免疫印迹分析表明E-cadherin(MW=125 kd)存在于LNCaP、DU145和PC-3中,但在PC-3N和JCA1细胞系中不存在(图2、A和C) ▶ 此外,在PC-3、PC-3N和JCA1腺癌细胞系中检测到较高分子量的钙粘蛋白(138 kd)。 PC-3细胞显示混合钙粘蛋白表型的表达,其中包含E-钙粘蛋白和较大的钙粘蛋白。LNCaP和DU145中未检测到这种未知钙粘蛋白(图2A) ▶ .
图2。
E-cadherin和p120的免疫印迹分析 ctn公司 前列腺癌细胞系(LNCaP、DU-145、PC-3、PC-3N、JCA-1)中的连环蛋白。 在2×SDS样品缓冲液中提取总细胞裂解物,并通过SDS-PAGE分析30μg蛋白质/车道。 电泳后,将蛋白质转移到硝化纤维素膜上,并用能够识别所有经典钙粘蛋白的泛钙粘蛋白多克隆抗体处理过滤器( 一 ),一种抗p120的小鼠单克隆抗体 ctn公司 识别两种亚型p120 ctn公司 和p100 ctn公司 ( B类 ),或抗E-钙粘蛋白的小鼠单克隆抗体( C类 ). 用CSK缓冲液处理培养的PC-3N细胞,测定非离子洗涤剂的溶解度。 收集Triton X-100可溶和不可溶部分。 通过SDS-PAGE分析等量的总蛋白组分,并使用多克隆pan-cadherin抗体对N-钙粘蛋白进行免疫印迹( D类 ). 提取PC-3N细胞并用抗p120免疫沉淀 ctn公司 或正常小鼠IgG。 免疫沉淀用抗泛钙粘蛋白免疫印迹。 车道1 ,PC-3N总蛋白裂解物。 2号车道 ,PC-3N的可溶性蛋白质部分。 3号车道 ,PC-3N细胞的不溶性部分。 4号车道 ,p120免疫沉淀 ctn公司 . 5号车道 ,用小鼠IgG抗体控制免疫沉淀。 ( E类 )使用抗E-钙粘蛋白(E)的小鼠单克隆抗体、抗N-钙粘蛋白的小鼠单抗或不相关的小鼠IgG抗体(C)在前列腺癌细胞系(DU-145,PC-3N,PC-3)中免疫沉淀E-或N-钙粘素。 免疫沉淀部分在SDS-PAGE上分离,转移到硝化纤维素膜上,并用抗p120的单克隆抗体进行免疫印迹 ctn公司 (α-p120 计算机网络 )或多克隆钙粘蛋白抗体(α-panCAD)。 所有免疫印迹均采用化学发光检测试剂。
表1。 前列腺癌细胞系E-Cacherin和Catenin的相对表达水平
DU-145型 * LNCaP公司 PC-3型 PC-3N型 JCA1公司
E-钙粘蛋白 1 3.7 0.4 0 0
α-连环蛋白 1 5.5 ND(无损检测) § 0 0.2
β-连环蛋白 1 3.1 ND(无损检测) 0.9 0
斑球蛋白 1 1.7 ND(无损检测) 0.1 0.3
第120页 计算机网络 (第120页+第100页) † 1 2.5 0.5 0.4 0.8
第120页/第100页 ‡ 0.5 0.3 1.1 2.3 2.9
因为在前列腺癌的恶性进展过程中,连环蛋白,尤其是α-连环蛋白的丢失,已被证明减少了E-cadherin介导的细胞间相互作用, 26,45 我们对α-连环蛋白、β-连环素、γ-连环肽/血小板球蛋白(免疫印迹未显示)和p120进行了表征 ctn公司 通过等量蛋白质的免疫印迹测定前列腺癌细胞系的表达水平。 结果汇总在表1中 ▶ 由于DU145表达的所有连环蛋白和E-钙粘蛋白水平大致相等,因此密度测定值归一化为DU145。 LNCaP和DU145均表达所有连环蛋白,与更分化的表型一致。 然而,连环蛋白在JCA1和PC-3N细胞中的表达水平显示出显著差异。 JCA1缺乏可检测的β-连环蛋白,α-连环素和斑球蛋白水平低于DU145。 另一方面,PC-3N细胞显示血小板球蛋白减少,与Morton等人一致, 26 α-catenin也不存在。
由于其他连环蛋白的表达在所研究的一半前列腺癌细胞系中异常,p120的表达 ctn公司 免疫印迹法检测亚型。 p120 计算机网络 使用的单克隆抗体识别p120和p100亚型中的一个共同表位。 所有细胞系中都存在这两种亚型(图2B) ▶ 然而,与DU145相比,PC-3N和JCA1中p100的表达较低(表1) ▶ 这表明p120和p100的表达依赖于前列腺细胞系中钙粘蛋白的类型。 在只表达E-cadherin(DU145,LNCaP)的前列腺癌细胞系中,p100是主要的亚型,大约比p120高两倍。 相反,p120是PC-3N和JCA1中的主要亚型,它们缺乏E-钙粘蛋白,并表达不同的钙粘蛋白。在显示混合钙粘蛋白群体的PC-3细胞中,p120和p100亚型的表达相同(表1) ▶ .
为了鉴定PC-3N、PC-3和JCA1癌细胞中未知的钙粘蛋白,我们使用基于钙粘蛋白胞质结构域的保守氨基酸序列的简并寡核苷酸引物,通过RT-PCR扩增钙粘蛋白cDNA。 40 从PC-3N cDNA中扩增出约150 bp的单个cDNA带,进行凝胶纯化、亚克隆和测序。 42%的独立克隆的核苷酸序列与人类N-钙粘蛋白的序列一致性为100%。 37 其余克隆均未显示与E-钙粘蛋白或任何其他钙粘蛋白的同源性。这些结果表明,用抗泛钙粘蛋白多克隆抗体在PC-3N细胞中检测到的钙粘蛋白(分子量=138 kd)是N-钙粘蛋白。
第120页 ctn公司 PC-3N细胞中的等位基因与N-钙粘蛋白结合 我们评估了N-钙粘蛋白是否分布在汇合PC-3N细胞的Triton X-100不溶部分,这可能反映了与细胞骨架相关的N-钙粘素(图2D) ▶ 密度分析显示约25%的N-钙粘蛋白存在于PC-3N细胞的洗涤剂不溶部分中(图2D ▶ ,通道2和3),表明N-钙粘蛋白可能与细胞骨架蛋白相关。 我们免疫沉淀p120 计算机网络 从PC-3N的洗涤剂裂解物中,将免疫沉淀转移到硝化纤维素中,并用多克隆pan-cadherin抗体进行印迹。 p120中检测到138 kd的钙粘蛋白 ctn公司 免疫沉淀,表明存在N-钙粘蛋白(图2D ▶ ,车道4)。 在非免疫对照组中未检测到钙粘蛋白带。
为了进一步确定p100与p120亚型的比值是否与特定的钙粘附素亚型相关,我们用E-钙粘附素或N-钙粘附素特异性单克隆抗体免疫沉淀PC-3、DU145和PC-3N细胞,并对p120进行免疫印迹 ctn公司 (图2E) ▶ 在仅表达E-钙粘蛋白的DU145细胞中,p100是主要的同种型。 在只表达N-钙粘蛋白的PC-3N细胞中,p120是主要的亚型。 然而,在同时表达E-和N-钙粘蛋白的PC-3细胞中,用E-钙粘蛋白或N-钙粘素抗体免疫沉淀的裂解物中p100与p120的结合没有差异。 这表明尽管p120和p100亚型都结合N-钙粘蛋白和E-钙粘蛋白,但p120比例的改变 ctn公司 PC-3N和DU145中的亚型是由于亚型表达的差异,而不是由于结合亲和力的差异。
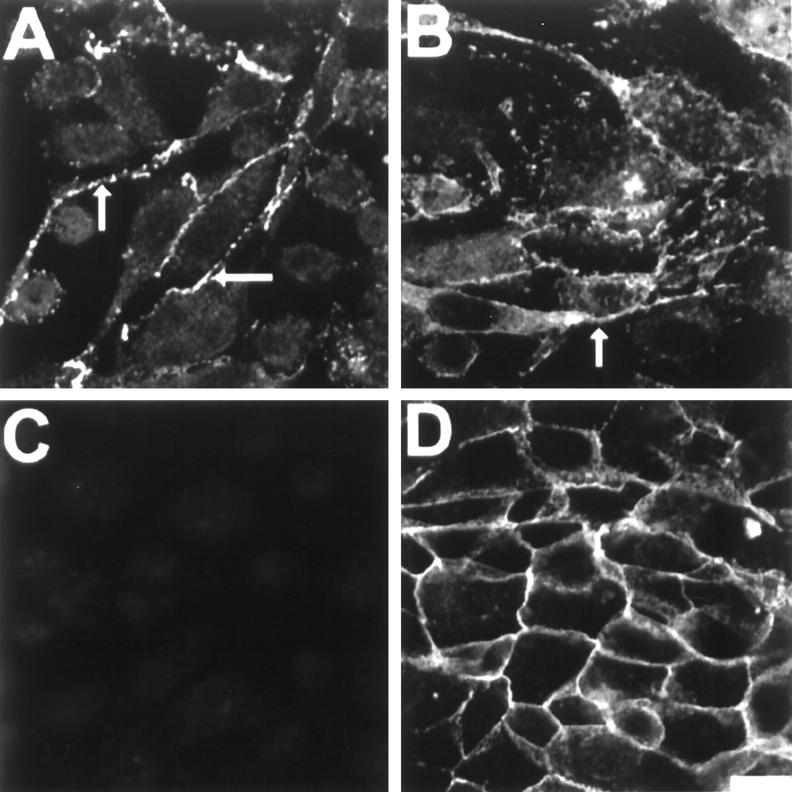
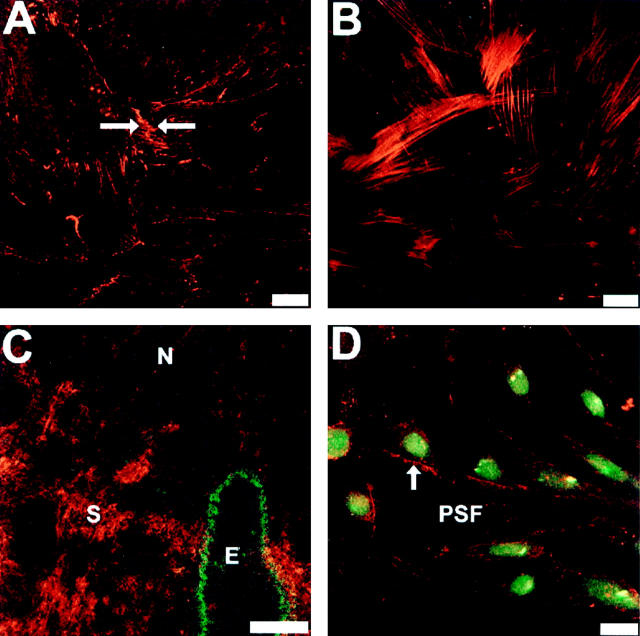
N-钙粘蛋白在PC-3N细胞中的免疫定位 在PC-3N细胞融合培养中,N-钙粘蛋白定位于细胞间粘附接触的部位(图3A) ▶ 纺锤形PC-3N细胞与其相邻细胞形成松散而广泛的细胞接触。 大多数N-钙粘蛋白免疫反应位于细胞投射中(图3A和B ▶ ,箭头)。 此外,连环蛋白p120 ctn公司 免疫标记与N-钙粘蛋白相似(图3B) ▶ 第120页 ctn公司 定位于与N-钙粘蛋白类似的区域,在细胞投射中具有特异性免疫定位。 如预期的那样,在PC-3N中未观察到E-钙粘蛋白免疫反应(图3C) ▶ .N-钙粘蛋白也定位于JCA1和PC-3亚群的细胞-细胞连接处(数据未显示)。 此外,E-cadherin定位于DU145的细胞连接处,显示上皮形态(图3D) ▶ E-cadherin在LNCaP细胞中的表达也类似,在DU145或LNCaP细胞中均未检测到N-cadherin免疫反应(数据未显示)。
图3。
N-钙粘蛋白、E-钙粘蛋白和p120的免疫定位 ctn公司 在PC-3N和DU-145癌细胞系中。 细胞生长在盖玻片上直至汇合,然后用4%PFA固定在CMF-PBS中,并用CSK缓冲液渗透。 使用PC-3N上N-钙粘蛋白的小鼠单克隆抗体进行免疫荧光( 一 ),小鼠抗p120单克隆抗体 ctn公司 在PC-3N细胞上( B类 ),或PC-3N上E-钙粘蛋白的小鼠单克隆抗体( C类 )和DU-145( D类 )单元格。 罗丹明偶联二级抗体用于显示免疫反应性,并通过共焦显微镜拍摄照片。 箭头表示细胞连接和N-钙粘蛋白和p120的定位 ctn公司 到蜂窝扩展。 比例尺,40μm。
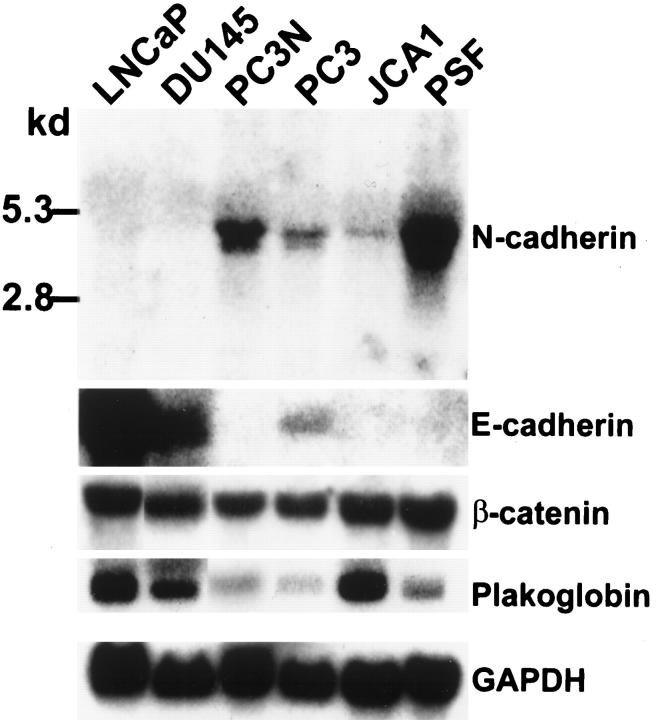
N-Cadherin mRNA在PC-3、PC-3N、JCA1和前列腺基质成纤维细胞中表达 通过Northern印迹分析确定前列腺癌细胞系中稳态N-cadherin mRNA水平的差异表达(图4) ▶ 类似于N-钙粘蛋白蛋白数据,在PC-3、PC-3N和JCA1细胞中检测到N-钙粘蛋白mRNA转录物(4.2kb),但在DU145和LNCaP细胞中未检测到,即使在长期(1周)暴露后也是如此。 相反,E-cadherin mRNA在LNCaP和DU145细胞中表达,但在PC-3N和JCA1细胞中不表达。 在PC-3细胞中检测到E-和N-cadherin mRNA。 因此,与蛋白表达一致,PC-3N和JCA1都缺乏E-cadherin的表达,但也表达N-cadherin。在培养的前列腺基质成纤维细胞中也检测到了N-cadherinmRNA,但没有检测到E-cadherinm RNA(图4) ▶ .
图4。
前列腺癌细胞系和前列腺基质成纤维细胞中E-和N-钙粘蛋白及斑球蛋白的Northern印迹分析。 每个细胞株每行总RNA的20微克被印在尼龙膜上。 300磅 经济效益 以N钙粘蛋白的I片段作为探针检测N钙粘素。 用小鼠E-cadherin的1.7-bp片段作为E-cadherin表达的探针。 用全长斑球蛋白和β-连环蛋白cDNA检测斑球蛋白及β-连环素的表达。 使用1.2-kb GAPDH cDNA片段作为标准化标准。 将杂交膜暴露于X射线胶片上1天(E-cadherin、β-catenin、plakoglobin、GAPDH)和2天(N-cadherin)。 这是两个独立实验的代表性结果。
此外,β-catenin和plakoglobin mRNA的稳态mRNA表达水平与前列腺细胞系中的蛋白表达不一致。 所有前列腺细胞系均表达可检测到的斑球蛋白mRNA水平(图4) ▶ 然而,尽管JCA1中的斑球蛋白水平低于DU145(表1) ▶ ,斑球蛋白mRNA在JCA1中似乎高出三倍 与 DU145。此外,所有前列腺癌细胞系均表达同等水平的β-catenin mRNA,尽管蛋白水平不同(图4) ▶ .
N-钙粘蛋白在前列腺基质成纤维细胞中的免疫定位 和 现场 N-钙粘蛋白的免疫定位显示,PC-3N细胞和前列腺基质成纤维细胞(PSFs)均表达N-钙粘素,并在细胞-细胞边界形成N-钙粘质粘附连接接触(箭头,图5 ▶ ). 图5A ▶ 表明PSF细胞-细胞连接处的N-cadherin表达维持 在体外 所有细胞的N-钙粘蛋白和α-平滑肌肌动蛋白均呈阳性,这证实了培养物中只存在PSF 46,47 (图5B) ▶ 此外,我们在正常人前列腺组织的冰冻切片中免疫定位了N-钙粘蛋白。 前列腺组织切片中的N-钙粘蛋白的免疫反应性在基质细胞和穿透腺体的神经束中强烈检测到,但在正常前列腺上皮腺体中未检测到N-钙粘素,如角蛋白18抗体的共同免疫定位所示(图5C) ▶ .
图5。
前列腺基质成纤维细胞中N-钙粘蛋白的细胞定位 在体外 ( 一 , B类 、和 D类 )以及 就地 ( C类 ). PSF细胞在盖玻片上生长,直至汇合。 细胞用4%PFA固定在CMF-PBS中,用CSK缓冲液渗透,并与小鼠抗N-钙粘蛋白单克隆抗体反应( 一 )或鼠抗α-平滑肌肌动蛋白单克隆抗体( B类 ). 箭头 表示N-钙粘蛋白介导的细胞连接。 抄送: 正常前列腺组织基质成纤维细胞中的N-钙粘蛋白免疫反应(以S表示)。 新鲜冷冻的正常前列腺组织在6μm处切片,并用冷丙酮固定。 上皮角蛋白18和N-钙粘蛋白的共表达是通过用N-钙粘素单克隆抗体和角蛋白18多克隆抗体共同免疫组织来实现的。 N-钙粘蛋白通过罗丹明偶联二级抗体检测,而角蛋白18通过FITC-偶联二级抗原检测。 N表示神经中N-钙粘蛋白的表达,E表示正常上皮腺中的角蛋白18。 医生: N-cadherin在PC-3N和PSF共培养中的表达。 PC-3细胞用40μg/ml的DiO(绿色膜标记细胞)标记,然后接种在PSF培养的盖玻片上24。 这个 箭头 代表N-cadherin在PC-3N和PSF细胞之间的细胞-细胞边界的定位。 通过共焦显微镜拍摄图像。 比例尺,60μm( 一 , B类 、和 D类 )和100微米( C类 ).
PC-3N前列腺癌细胞和前列腺基质成纤维细胞共同培养,以确定N-钙粘蛋白是否定位于细胞间接触部位。 基质成纤维细胞培养过夜,然后添加荧光染料DiO-标记的PC-3N细胞,并再培养24小时。 N-钙粘蛋白的免疫定位显示,在PC-3N细胞和基质成纤维细胞之间的细胞间接触处有N-钙粘素免疫反应位点(箭头,图5D ▶ ). 在单独与二级抗体孵育的样品中未检测到免疫染色(数据未显示)。
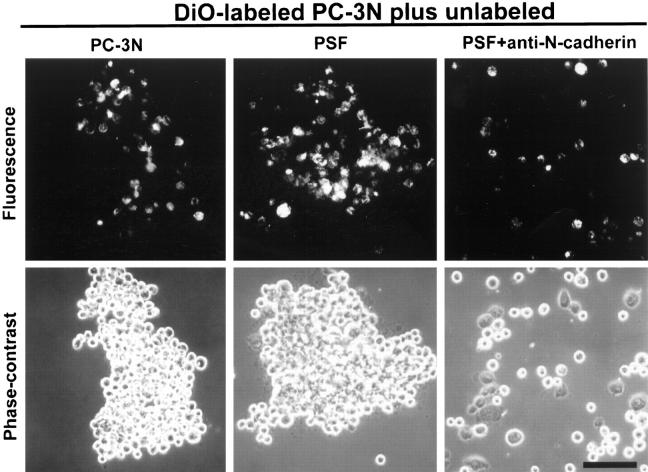
N-钙粘蛋白介导PC-3N细胞和PSFs的细胞聚集 检测前列腺癌细胞和前列腺基质成纤维细胞之间的相互作用是否由N-cadherin介导,这是一种细胞-细胞聚集分析 42 已执行。 在有钙存在的情况下,通过胰蛋白酶将PC-3N细胞分离为单个细胞悬浮液后,用DiO标记的PC-3N电池与未标记的PC-3电池混合,并允许在有钙的情况下聚集(图6) ▶ PC-3N细胞的钙依赖性聚集具有时间依赖性,并在缺乏钙的情况下被阻断 2+ 将功能阻断抗体添加到N-钙粘蛋白中可抑制PC-3N癌细胞的钙依赖性聚集(数据未显示)。
图6。
PC-3N和前列腺基质成纤维细胞的细胞聚集分析。 为了区分PC-3N和PSF细胞,用40μg/ml的DiO标记PC-3N细胞1小时。 在2 mmol/L Ca存在下对所有细胞进行胰蛋白酶化 2+ 以防止钙粘蛋白的破坏。 在聚集试验中,将标记的PC-3N细胞与未标记的PC-3 N或PSF在钙的存在下混合 2+ 此外,在存在抗N-钙粘蛋白阻断抗体的聚集试验中,将标记的PC-3N和PSF细胞混合( n个 = 3). 细胞在37°C的回转振动筛上聚集1小时。 在荧光下拍摄细胞聚集的照片( 顶行 )和相位对比度( 最下面一行 )在相同的字段中。 比例尺,100μm。
PC-3N前列腺癌细胞与基质成纤维细胞之间的同型相互作用也由N-钙粘蛋白介导。等量的前列腺基质成纤维纤维细胞与DiO标记的PC-3N细胞混合。 钙存在时,观察到大细胞-细胞聚集物、PC-3N细胞和PSF细胞。 钙依赖性细胞-细胞聚集体由所有可能的细胞相互作用组成:PC-3N/PC-3N、PC-3N/PSF和PSF/PSF。 在存在N-钙粘蛋白功能性阻断抗体的情况下,这种钙依赖性细胞-细胞聚集基本上被消除。在DU145/PSF细胞和DU145/PC-3N细胞之间未观察到聚集(数据未显示)。 这些发现表明,N-钙粘蛋白的同型相互作用介导PC-3N前列腺癌细胞系和前列腺基质成纤维细胞之间的相互作用。
讨论 本研究结果表明,在缺乏E-cadherin的人前列腺癌细胞系(PC-3N和JCA1)和混合表达E-cadherin-N-cadherin的PC-3细胞中,N-cadherin表达 在体外 和 就地 前列腺基质成纤维细胞与PC-3N癌细胞的共聚集表明,N-钙粘蛋白可以介导这两个细胞群之间的同型粘附。 前列腺癌通过基质侵袭 三 随后神经束膜迁移和穿透包膜并从前列腺逃逸。 4,7 这些数据表明,腺体上皮周围基质细胞和伸入前列腺的神经束中的N-钙粘蛋白的存在可能促进前列腺癌细胞的侵袭和囊外转移。 此外,仅表达N-钙粘蛋白、PC-3N和JCA1的分化程度较低的前列腺细胞系也显示钙粘蛋白相关连环蛋白p120的亚型发生了改变 计算机网络 ,是 型钢混凝土 激酶和酪氨酸激酶生长因子受体。 15 基质细胞和癌细胞之间通过细胞间粘附分子和生长因子进行的细胞间通讯已被证明是肿瘤进展的重要因素。 48,49 Umbas等人 25 研究发现,63%的前列腺肿瘤延伸至前列腺包膜外,E-cadherin表达降低,而前列腺内的肿瘤只有33%。 25
前列腺癌细胞系中N-cadherin的表达与p120的改变有关 ctn公司 p120/p100亚型表达。 至少有四个p120 计算机网络 亚型,被认为是由羧基和NH的选择性剪接产生的 2 -p120的终端 计算机网络 . 15,50,51 不同的p120 ctn公司 亚型被认为在调节细胞间粘附或细胞信号传导的不同效应物的结合中发挥作用。 52 PC-3、PC-3N和DU145细胞的免疫沉淀表明,尽管p120和p100亚型都可以结合E-和N-cadherin,但这种变化是稳态亚型蛋白水平增加的结果。 此外,在高运动性细胞(如成纤维细胞)中也报告了高水平的p120亚型,而p100在上皮细胞中更为丰富。 50 在由 型钢混凝土 激酶。 我们定位了p120 ctn公司 PC-3N细胞的细胞延伸,以及带有抗p120单克隆抗体的免疫沉淀N-钙粘蛋白 ctn公司 使用保持钙粘蛋白/连环蛋白相互作用的条件。 同于p120 计算机网络 调节钙粘蛋白粘附,异型表达的差异可能在调节钙粘素粘附和肿瘤转移潜能中起重要作用。 Reynolds等人 52 证明p120 ctn公司 与所有经典的钙粘蛋白亚型相关,成纤维细胞中p120亚型的过度表达导致细胞形态发生变化,形成树突样延伸,p120亚类型定位于这些延伸。
E-cadherin和/或catenins的下调是上皮性肿瘤侵袭和转移进展的关键步骤。 53-55 在前列腺腺癌中,肿瘤的侵袭性与E-cadherin的丢失有关。 25 E-钙粘蛋白表达缺失的机制可能是突变, 56 删除, 57 超甲基化, 55 和/或catenin表达缺失或改变。 45 我们的结果表明,前列腺癌细胞系中E-钙粘蛋白的缺失伴随着另一种典型的I型钙粘蛋白亚型N-cadherin的意外表达 58 在前列腺癌中经常被删除, 59,60 N-钙粘蛋白已被定位到人类染色体18q11.2。 61
正常前列腺腺上皮中未检测到N-钙粘蛋白的表达,但在前列腺的神经元和基质中发现。 N-钙粘蛋白存在于多种细胞类型中,包括神经元、骨骼肌和心肌细胞、成纤维细胞、间皮细胞和一些肿瘤上皮细胞。 62-66 尽管生长因子和细胞外基质是前列腺肿瘤进展的重要因素,但N-钙粘蛋白介导的前列腺癌基质相互作用可能促进转移。 基质间质-上皮相互作用相互调节前列腺的胚胎发育和分化。 67 此外,研究发现,将前列腺成纤维细胞与前列腺癌细胞共同接种在裸鼠体内可以加速肿瘤生长。 48,49 N-钙粘蛋白在上皮源性肿瘤细胞侵袭中的作用并不局限于前列腺癌。 Islam等人 68 据报道,鳞状细胞癌中N-和E-钙粘蛋白呈反表达,高水平N-钙粘蛋白表达的细胞侵袭性更强。
N-钙粘蛋白同型粘附在不同的细胞类型中发挥不同的作用。 N-钙粘蛋白在维持某些非运动细胞类型(如心肌间盘)的强烈细胞-细胞粘附方面起着重要作用。 69 相反,N-钙粘蛋白也在轴突的动态生长中起着粘附作用,并且其表达也在神经元体的细胞表面上呈空间扩散。 70 与神经元类似,PC-3N癌细胞中的N-钙粘蛋白定位在空间上呈弥散分布,并在细胞延伸中高度表达。 大多数N-钙粘蛋白分子在整个细胞膜中扩散表达,只有一小部分N-钙粘素分子集中在细胞与细胞接触的部位。 这与报道的N-钙粘蛋白的分布相似 71 从神经上皮迁移过来的神经嵴细胞。
浸润性前列腺癌细胞系中N-cadherin的表达可能预示着上皮/间质的转变。 在前列腺癌中,上皮细胞向侵袭性间充质的转化似乎涉及一些特定癌细胞失去和获得功能的事件,包括细胞间和细胞外基质的相互作用。 E-cadherin和某些整合素的缺失与前列腺癌上皮分化的缺失相关。 7,72 这种损失可能导致其他粘附分子的增加,这些粘附分子可能促进前列腺癌的发展和侵袭性,正如本研究中N-钙粘蛋白和连环蛋白表达的改变所表明的那样。 此外,在前列腺癌中,β 4 α高表达整合素 6 和β 1 整合素与高侵袭活性相关,与异二聚体α有关 6 β 1 整合素是赋予侵袭表型的主要候选因子。 73
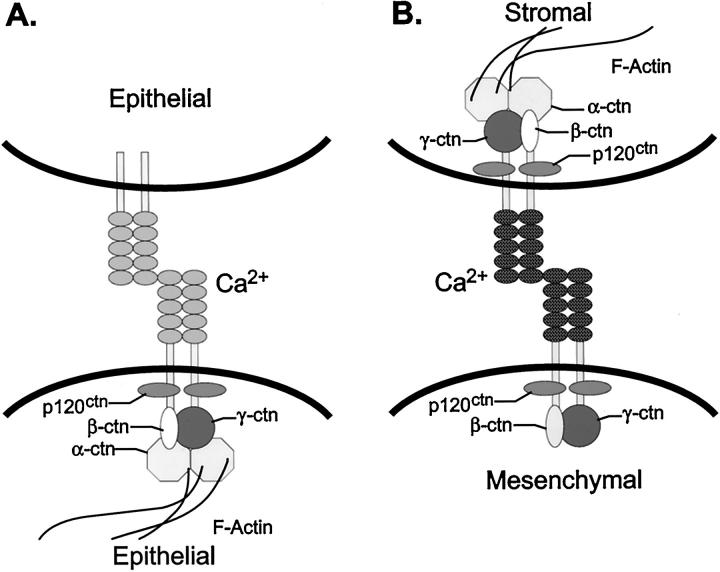
钙粘蛋白的稳定粘附需要细胞外结构域的同型蛋白-蛋白结合,此外,钙粘蛋白细胞质结构域与肌动蛋白细胞骨架形成复合物(图7A) ▶ 由于α-连环蛋白具有肌动蛋白结合活性,它可能将钙粘蛋白/连环蛋白复合物与肌动蛋白细胞骨架联系起来 74 在紧密上皮形态的形成中起重要作用。 75 armadillo家族成员β-连环蛋白和γ-连环蛋白/板球蛋白作为连接α-连环蛋白和羧基末端钙粘蛋白细胞质结构域的中间体。 76 第120页 ctn公司 在相邻膜区结合 77 钙粘蛋白细胞质结构域的一部分,并且可能与其他连环蛋白发挥不同的作用。
图7。
人类前列腺癌中钙粘蛋白细胞-细胞粘附的两种形式。 E-钙粘蛋白介导的上皮细胞-细胞粘附( 一 )和N-钙粘蛋白介导的基质:间充质细胞粘附( B类 )如图所示。 钙粘蛋白显示为二聚体。 犰狳连环蛋白p100/p120 计算机网络 β-catenin(βctn)和γ-catenin/plakoglobin(γctn)将E-cadherin锚定到α-catenin(αctn),后者将复合体连接到外周肌动蛋白细胞骨架。 在 一 描述了稳定的钙粘蛋白同种型粘附。 B类 显示了PC-3N癌细胞中N-cadherin/catenin复合物的已知成分,其优先表达p120 ctn公司 亚型和基质成纤维细胞。 这种细胞与细胞之间的相互作用可能不太稳定,并且与α-连环蛋白损失的亲和力较弱。
这项工作表明,尽管N-钙粘蛋白的表达可能在前列腺癌从上皮细胞向间质的进展中起部分作用,但N-钙粘素可能介导不太稳定的细胞间粘附,并可能导致癌细胞浸润和基质相互作用(图7B) ▶ 正常上皮细胞中N-cadherin的表达导致E-cadherin表达下调和间充质表型分散。 68 PC-3N细胞系具有纺锤状间充质形态,在细胞与细胞接触的部位表达N-钙粘蛋白。 因为α-catenin缺失, 26 PC-3N细胞之间的N-钙粘蛋白粘附可能不太稳定。 我们的结果表明,N-钙粘蛋白介导α-连环蛋白缺乏的PC-3N细胞与基质成纤维细胞之间的粘附,基质成纤维纤维细胞含有正常水平的所有连环蛋白。 PC-3N细胞中的N-钙粘蛋白可能通过细胞间相互作用调节细胞的生长,这可能使PC-3N与周围的前列腺基质成纤维细胞相互作用。 N-cadherin粘附可能解释SCID小鼠异种移植瘤膈横纹肌PC-3N侵袭表型。 PC-3N细胞和膈肌细胞都表达N-钙粘蛋白,可能使这两个细胞群建立同型相互作用。 我们未来的研究方向是确定N-钙粘蛋白是否在与神经束间隙包膜浸润相关的高级别前列腺癌中表达,以及是否与转移相关。
致谢 我们感谢科琳•福布斯、弗吉尼亚•克拉克和卡里姆•萨拉姆的专业技术援助。 我们感谢T.Bowden博士和P.Gentry博士的有益讨论。
脚注
向亚利桑那州健康科学中心外科罗纳德·L·海马克(Ronald L.Heimark)提出转载请求,地址:亚利桑那州图森市坎贝尔镇1501号245084邮箱,邮编:85724。 电子邮件: rheimark@u.arizona.edu。
由癌症生物学培训拨款(T32CA09213)、NIH-CA 56666和ARCS基金会向N.L.T.提供的拨款支持。
工具书类
1 Cussenot O、Valeri A、Berthon P、Fournier G、Mangin P:遗传性前列腺癌和其他前列腺癌遗传易感性。 《国际泌尿外科杂志》1998年第60期增刊2:30-34 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Gittes RF:前列腺癌。 《新英格兰医学杂志》1991,324:236-245 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Villers A、McNeal JE、Redwine EA、Freiha FS、Stamey TA:神经间隙侵犯在前列腺癌局部扩散中的作用。 《泌尿外科杂志》1989,142:763-768 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
4 McNeal JE、Villers AA、Redwine EA、Freiha FS、Stamey TA:前列腺癌的包膜穿透。 对自然历史和治疗的意义。 《美国外科病理杂志》1990年,14:240-247 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
5 Knox JD、Cress AE、Clark V、Manriquez L、Affinito KS、Dalkin BL、Nagle RB:正常前列腺和肿瘤前列腺中细胞外基质分子和α6-整合素的差异表达。 《美国病理杂志》1994,145:167-174 [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
6 Bostwick DG:前列腺上皮内瘤变(PIN)。 泌尿外科1989,34:16-22 [ 公共医学 ] [ 谷歌学者 ]
7 Cress AE,Rabinovitz I,Zhu W,Nagle RB:人类前列腺癌进展中的α6β1和α6β4整合素。 癌症转移评论1995,14:219-228 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
8 Otto T,Rembling K,Goepel M,Meyer-Schwickerath M,Rubben H:E-cadherin:前列腺癌分化和侵袭性的标志物。 泌尿外科研究1993,21:359-362 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9 Takeichi M:经典钙粘蛋白的形态发生作用。 《Curr Opin细胞生物学》1995,7:619-627 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
10 Rajasekaran AK、Hojo M、Huima T、Rodriguez-Boulan E:在紧密连接组装的早期阶段,Catenins和zonula occludens-1形成复合物。 《细胞生物学杂志》1996132:451-463 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Ozawa M,Baribault H,Kemler R:细胞黏附分子uvomorulin的细胞质域与三种不同物种结构相关的独立蛋白质相关。 EMBO J 1989年,8:1711-1717 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12. Nagafuchi A、Shirayoshi Y、Okazaki K、Yasuda K、Takeichi M:通过外源性引入的E-cadherin cDNA转化细胞粘附特性。 《自然》1987,329:341-343 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
13 Herrenknecht K、Ozawa M、Eckerskorn C、Lottspeich F、Lenter M、Kemler R:uvomorulin-anchorage蛋白α-catenin是一种病毒素同源物。 美国国家科学院院刊1991,88:9156-9160 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
14 McCrea PD,Turck CW,Gumbiner B:与E-cadherin相关的果蝇犰狳蛋白(斑球蛋白)的同源物。《科学》1991,254:1359-1361 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
15 Reynolds AB,Daniel J,McCrea PD,Wheelock MJ,Wu J,Zhang Z:一种新连环蛋白的鉴定:酪氨酸激酶底物p120cas与E-cadherin复合物相关。 《分子细胞生物学》1994,14:8333-8342 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
16 Daniel JM,Reynolds AB:酪氨酸激酶底物p120cas直接与E-cadherin结合,但不与腺瘤性息肉病大肠杆菌蛋白或α-钙粘蛋白结合。 分子细胞生物学1995,15:4819-4824 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
17 Boller K,Vestweber D,Kemler R:细胞粘附分子uvomorulin定位于成人肠上皮细胞的中间连接处。 《细胞生物学杂志》1985,100:327-332 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
18 Schipper JH,Frixen UH,Behrens J,Unger A,Jahnke K,Birchmeier W:E-钙粘蛋白在头颈部鳞状细胞癌中的表达:与肿瘤去分化和淋巴结转移呈负相关。 癌症研究1991,51:6328-6337 [ 公共医学 ] [ 谷歌学者 ]
19 Shimoyama Y、Hirohashi S、Hirano S、Noguchi M、Shimosato Y、Takeichi M、Abe O:人类上皮组织和癌中的钙粘蛋白细胞粘附分子。 癌症研究1989,49:2128-2133 [ 公共医学 ] [ 谷歌学者 ]
20 Bussemakers MJ,Schalken JA:细胞粘附分子和蛋白酶在肿瘤侵袭和转移中的作用。 《世界泌尿外科杂志》1996,14:151-156 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
21 Ruijter E、van dK、Aalders T、Ruiter D、Miller G、Debruyne F、Schalken J:前列腺癌中E-cadherin和p53的异质性表达:临床意义。 前列腺癌研究组的BIOMED-II标记物。 Mod Pathol 1998,11:276–281 [ 公共医学 ]
22 Birchmeier C,Birchmeier W,Brand S:癌症进展中的上皮-间质转化。 《安娜特学报》1996,156:217-226 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
23 Birchmeier W,Behrens J:癌中Cadherin的表达:在细胞连接形成和防止侵袭性中的作用。 《生物化学与生物物理学学报》1994,1198:11-26 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
24 Giroldi LA,Schalken J:前列腺癌中细胞间粘附分子E-cadherin表达减少:生物学意义和临床意义。 癌症转移评论1993,12:29-37 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
25. Umbas R、Schalken JA、Aalders TW、Carter BS、Karthaus HF、Schaafsma HE、Debruyne FM、Isaacs WB:细胞粘附分子E-cadherin的表达在高级别前列腺癌中减少或缺失。 癌症研究1992,52:5104-5109 [ 公共医学 ] [ 谷歌学者 ]
26 Morton RA、Ewing CM、Nagafuchi A、Tsukita S、Isaacs WB:人类前列腺癌细胞中E-cadherin水平的降低和α-catenin基因的缺失。 癌症研究1993,53:3585-3590 [ 公共医学 ] [ 谷歌学者 ]
27 Horoszweicz JC、Leong SS、Chu TM、Wajsman ZL、Friedman M、Papsidero L、Kim J、Chai LS、Kakati S、Arya SK、Sandberg AA:LNCaP细胞系——人类前列腺癌研究的新模型。 摘自:G.P.Murphy(编辑),前列腺癌模型。 1980年,纽约,Alan R.Liss公司,第115–132页 [ 公共医学 ]
28 Stone KR、Mickey DD、Wunderli H、Mickel GH、Paulson DF:人前列腺癌细胞系(DU 145)的分离。 国际癌症杂志1978,21:274-281 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
29. Kaighn ME、Narayan KS、Ohnuki Y、Lechner JF、Jones LW:人前列腺癌细胞系(PC-3)的建立和鉴定。 投资Urol 1979,17:16-23 [ 公共医学 ] [ 谷歌学者 ]
30 Muraki J、Addonizio JC、Choudhury MS、Fischer J、Eshghi M、Davidian MM、Shapiro LR、Wilmot PL、Nagamatsu GR、Chiao JW:建立新的人类前列腺癌细胞系(JCA-1)。 泌尿外科1990,36:79-84 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
31 宫崎骏S、岛村K、Hatta M、长崎A、鼻子A、松下M、Hatta K、武一M:神经钙粘蛋白:在选择性细胞-细胞粘附中的作用。 《科学》1989,245:631-635 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
32 Marcantonio EE,Hynes RO:整合素β1亚单位保守细胞质域的抗体与脊椎动物、无脊椎动物和真菌中的蛋白质反应。 细胞生物学杂志1988,106:1765-1772 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
33 Cowin P、Kapprell HP、Franke WW、Tamkun J、Hynes RO:血小板球蛋白:一种常见于不同类型细胞间粘附连接的蛋白质。 细胞1986,46:1063-1073 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
34 Nagle RB、McDaniel KM、Clark VA、Payne CM:抗角蛋白抗体在人类肿瘤诊断中的应用。 《美国临床病理杂志》1983年,79:458-466 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35. 莱姆利英国:T4噬菌体头部组装过程中结构蛋白的裂解。 自然1970,227:680-685 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
36 Chomczynski P,Sachi N:通过酸胍硫氰酸苯酚-氯仿萃取进行RNA分离的单步方法。 《Ana Biochem》1987,162:156-159 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
37 Reid RA,Hemperly JJ:人类N-钙粘蛋白:核苷酸和推导的氨基酸序列。 核酸研究1990,18:5896。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
38 Franke WW、Goldschmidt MD、Zimbelmann R、Mueller HM、Schiller DL、Cowin P:人类血小板球蛋白(常见连接斑块蛋白)的分子克隆和氨基酸序列。 美国国家科学院院刊1989,86:4027-4031 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
39 Roark EF、Paradies NE、Lagunowich LA、Grunwald GB:内源性蛋白酶、mRNA水平和胰岛素作为视网膜发育过程中N-钙粘蛋白下调的多种机制的证据。 发展1992,114:973-984 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
40 铃木S、萨诺K、田原浩H:钙粘蛋白家族的多样性:神经组织中八种新钙粘蛋白的证据。 细胞调节1991,2:261-270 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
41 McCandless JR、Cress AE、Rabinovitz I、Payne CM、Bowden GT、Knox JD、Nagle RB:检测上皮性肿瘤侵袭早期事件的人类异种移植模型。 国际癌症杂志1997年,10:279-285 [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
42 Urushihara H、Takeichi M、Hakura A、Okada TS:BHK细胞及其转化衍生物聚集的不同阳离子要求。 细胞科学杂志1976,22:685-695 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
43 Rokhlin OW,Cohen MB:人类前列腺癌细胞系上细胞粘附分子的表达。 前列腺1995,26:205-212 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
44 Geiger B、Volberg T、Ginsberg D、Bitzur S、Sabanay I、Hynes RO:与N-钙粘蛋白的C末端24个氨基酸残基反应的广谱泛钙粘蛋白抗体。细胞科学杂志,1990年,97:607-614 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
45. Shimazui T、Bringuier PP、van BH、Ruijter E、Akaza H、Debruyne FM、Oosterwijk E、Schalken JA:α-catenin表达降低与局部肾细胞癌患者预后不良相关。 国际癌症杂志1997,74:523-528 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
46 Ronnov-Jessen L,Celis JE,Van DB,Petersen OW:成纤维细胞相关抗原:成纤维细胞的特征和平滑肌分化基质细胞的免疫反应性。 组织化学与细胞化学杂志1992,40:475–486 [ 内政部 ] [ 公共医学 ]
47 Lazard D、Sastre X、Frid MG、Glukhova MA、Thiery JP、Koteliansky VE:正常和恶性人类乳腺组织的肌上皮和基质肌成纤维细胞中平滑肌特异性蛋白的表达。 美国国家科学院院刊1993,90:999-1003 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
48 Gleave ME,Hsieh JT,von EA,Chung LW:前列腺和骨成纤维细胞在体内诱导人前列腺癌生长:前列腺癌生长和转移中双向肿瘤-基质细胞相互作用的意义。 《Urol杂志》1992,147:1151-1159 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
49 Camps JL、Chang SM、Hsu TC、Freeman MR、Hong SJ、Zhau HE、von Eschenbach AC、Chung LW:成纤维细胞介导的体内人类上皮性肿瘤生长加速。 美国国家科学院院刊1990,87:75-79 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
50 Mo YY,Reynolds AB:小鼠p120亚型的鉴定和人类肿瘤细胞系中p120cas亚型的异质表达。 癌症研究1996,56:2633-2640 [ 公共医学 ] [ 谷歌学者 ]
51 Keirsebilck A、Bonne S、Staes K、van HJ、Nollet F、Reynolds A、van RF:人类p120ctn-catenin基因(CTNND1)的分子克隆:多个选择性剪接亚型的表达。 基因组学1998,50:129–146 [ 内政部 ] [ 公共医学 ]
52 Reynolds AB,Daniel JM,Mo YY,Wu J,Zhang Z:新型连环蛋白p120cas结合经典钙粘蛋白并在NIH3T3成纤维细胞中诱导异常形态表型。 实验细胞研究1996,225:328-337 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
53 Oka H、Shiozaki H、Kobayashi K、Inoue M、Tahara H、Kobayashi T、Takatsuka Y、Matsuyoshi N、Hirano S、Takeichi M:人类乳腺癌组织中E-cadherin细胞粘附分子的表达及其与转移的关系。 癌症研究1993,53:1696-1701 [ 公共医学 ] [ 谷歌学者 ]
54 Shiozaki H、Tahara H、Oka H、Miyata M、Kobayashi K、Tamura S、Iihara K、Doki Y、Hirano S、Takeichi M:人类癌症中免疫活性E-cadherin粘附分子的表达。 《美国病理杂志》1991,139:17-23 [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
55 Graff JR、Herman JG、Lapidus RG、Chopra H、Xu R、Jarrard DF、Isaacs WB、Pitha PM、Davison NE、Baylin SB:人类乳腺癌和前列腺癌中的E-cadherin表达因DNA超甲基化而沉默。 癌症研究1995,55:5195-5199 [ 公共医学 ] [ 谷歌学者 ]
56 Giroldi LA、Bringuier PP、de WM、Jansen C、van BA、Schalken JA:E盒在抑制E-cadherin表达中的作用。 生物化学与生物物理研究通讯1997,241:453-458 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
57 Carter BS、Ewing CM、Ward WS、Treiger BF、Aalders TW、Schalken JA、Epstein JI、Isaacs WB:人类前列腺癌16q和10q染色体的等位基因缺失。 美国国家科学院院刊1990,87:8751-8755 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
58 Bussemakers MJ、van BA、Voller M、Smit FP、Schalken JA:钙依赖性细胞粘附分子P-和E-钙粘蛋白的基因在人类基因组中串联排列。 生物化学与生物物理研究通讯1994,203:1291-1294 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
59 Pan Y、Matsuyama H、Wang N、Yoshihiro S、Haggarth L、Li C、Tribukait B、Ekman P、Bergerheim US:染色体16q24缺失和E-cadherin表达降低:可能与前列腺癌的转移潜能有关。 前列腺1998,36:31-38 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
60 Suzuki H,Komiya A,Emi M,Kuramochi H,Shiraishi T,Yatani R,Shimazaki J:人类原发性和转移性前列腺癌中染色体臂16q的三个不同的常见缺失区域。 基因染色体癌1996,17:225-233 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
61 Wallis J,Fox MF,Walsh FS:人类N-钙粘蛋白基因的结构:YAC分析和18q11.2的精细染色体定位。 基因组学1994,22:172-179 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
62 Hazan RB、Kang L、Whooley BP、Borgen PI:N-钙粘蛋白促进浸润性乳腺癌细胞与基质之间的粘附。 Cell Adhes Commun 1997年,4:399-411 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
63 Hatta K,Takeichi M:与鸡发育早期形态发生事件相关的N-钙粘蛋白粘附分子的表达。 自然1986,320:447-449 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
64 Duband JL、Dufour S、Hatta K、Takeichi M、Edelman GM、Thiery JP:鸟类胚胎体细胞发生过程中的粘附分子。 细胞生物学杂志1987,104:1361-1374 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
65 Hatta K,Takagi S,Fujisawa H,Takeichi M:与鸡胚形态发生过程相关的N-钙粘蛋白细胞粘附分子的时空表达模式。 发育生物学1987,120:215-227 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
66 Wheelock MJ,Knudsen KA:鸡肉中的N-钙粘蛋白相关蛋白。 分化1991,46:35-42 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
67. Hayward SW,Rosen MA,Cunha GR:正常前列腺和肿瘤前列腺的间质上皮相互作用。 Br J Urol 1997,79增刊2:18-26 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
68 Islam S,Cary TE,Wolf GT,Wheelock MJ,Johnson KR:人类鳞癌细胞的N-钙粘蛋白表达诱导了分散的成纤维细胞表型,细胞间粘附受到破坏。 《细胞生物学杂志》1996135:1643-1654 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
69. Goncharova EJ,Kam Z,Geiger B:培养心肌细胞肌原纤维生成中粘附连接成分的发育。 发展1992,114:173-183 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
70 Letourneau PC、Shattuck TA、Roche FK、Takeichi M、Lemmon V:神经生长锥向雪旺细胞的迁移涉及钙依赖性粘附分子N-cadherin。Dev Biol 1990,138:430-442 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
71 Monier-Gavelle F,Duband JL:体外控制迁移神经嵴细胞中N-钙粘蛋白介导的细胞间粘附。 细胞科学杂志1995,108:3839-3853 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
72 Nagle RB,Hao J,Knox JD,Dalkin BL,Clark V,Cress AE:正常和恶性前列腺组织中半桥粒和细胞外基质蛋白的表达。 《美国病理杂志》1995年,146:1498-1507 [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
73 Rabinovitz I,Nagle RB,Cress AE:人前列腺癌细胞中整合素α6的表达与体内外迁移和侵袭表型相关。 临床实验Metast 1995,13:481-491 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
74 Rimm DL、Koslov ER、Kebriaei P、Cianci CD、Morrow JS:α1(E)-catenin是一种肌动蛋白结合和捆绑蛋白,介导F-actin附着到膜粘附复合物。 美国国家科学院院刊1995,92:8813-8817 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
75 Watabe M,Nagafuchi A,Tsukita S,Takeichi M:在分散的癌系中,通过激活E-钙粘蛋白-连环蛋白粘附系统来诱导极化的细胞-细胞结合和延缓生长。 细胞生物学杂志1994,127:247-256 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
76 Kemler R:从钙粘蛋白到连环蛋白:细胞质-蛋白质相互作用和细胞粘附的调节。 《趋势遗传学》1993,9:317-321 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
77 Yap AS、Niessen CM、Gumbiner BM:钙粘蛋白细胞质尾部的膜旁区域支持侧向聚集、粘附增强以及与p120ctn的相互作用。 《细胞生物学杂志》1998,141:779-789 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]