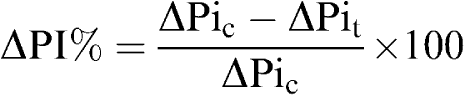摘要
本研究使用对照甘丙肽敲除(GAL-KO)和GAL-1R受体敲除(GAL-1R-KO)小鼠研究甘丙肽(GAL)对小鼠心脏胆碱能(迷走神经)活性抑制的影响。
在戊巴比妥麻醉的小鼠中,每30秒对支配心脏的迷走神经进行一次超分子刺激,使脉冲间隔(PI)增加约50毫秒或使心率降低约100次/分−1这种反应通过静脉注射GAL(剂量范围为0.8至13 nmol kg−1)以剂量依赖的方式。
在GAL-KO小鼠中,大剂量GAL对PI(ΔPI)增加的抑制程度与对照小鼠的ΔPI没有不同,而先前显示能减弱小鼠迷走神经抑制活性的神经肽Y(NPY)在GAL-KO小鼠中引起了ΔPI的相对抑制。
在GAL-1R-KO小鼠中,静脉团注GAL对迷走神经活动没有抑制作用。
在对照组小鼠中,在普萘洛尔存在下以25 V、10 Hz的频率刺激交感神经2分钟,可引起ΔPI的长期衰减。NPY Y的存在降低了对ΔPI的抑制作用2拮抗剂BIIE0246。
在GAL-1R-KO小鼠中,普萘洛尔刺激交感神经引起ΔPI衰减,与BIIE0246存在时对照小鼠的反应无显著差异。在GAL-1R-KO小鼠中给予BIIE0246后,交感神经刺激后对ΔPI的抑制被消除。
这些发现支持了以下观点:小鼠心脏副交感神经元的神经末梢同时具有GAL-1R和NPY Y2当被激活时,减少乙酰胆碱释放的受体。
关键词:甘丙肽、甘丙肽敲除、GAL-1R受体敲除、神经肽Y、BIIE0246、副交感、交感神经、小鼠、心脏
介绍
甘丙肽(GAL)是一种29/30氨基酸神经肽,1983年首次从猪肠中分离得到(立元等., 1983)广泛分布于中枢和外周神经系统。在许多自主神经节中发现,并与包括心血管系统在内的几个系统的器官功能的交感神经控制有关。它具有多种生物活性,影响认知/记忆、感觉/疼痛处理、进食行为和神经递质/激素分泌,其作用是通过调节的通过特异性受体(Crawley,1996年;Iismaa&Shine,1999年). 放射性配体分析使用125I-GAL表明在大鼠孤束核(nTS)和迷走神经背侧运动核(dmnX)中存在GAL神经元介导的突触前和突触后活动。在nTS的内侧亚核、室周区和dmnX的内侧部分内发现高密度GAL免疫反应性神经末梢。高密度125在nTS的整个内侧和外侧部分也发现了I-GAL结合位点(Harfstrand公司等., 1987). 在nTS和dmnX中均存在GAL,表明GAL在迷走神经控制/调节中发挥作用。
在中枢,GAL与神经递质共存,包括蓝斑中的去甲肾上腺素(NAd)和投射到海马体的基底前脑神经元中的乙酰胆碱(ACh)(梅兰德等., 1985). 在猴海马中,GAL抑制钾诱发的ACh释放和毒蕈碱受体介导的磷酸肌醇周转刺激,作为胆碱能功能的调节剂(Fisone公司等., 1991). 在猫的外周,在星状神经节、腹腔神经节、下腰神经节和骶交感神经节中发现大量GAL免疫反应阳性神经元,许多神经元与含有神经肽Y(NPY)的细胞共定位(库默,1987年). 在猫的副交感神经下颌下神经节和蝶腭神经节中也检测到GAL阳性细胞体(林德等., 1989).
在心脏中,GAL引起猫心脏迷走神经活动的长期衰减,对血压(BP)没有影响,而NPY增加BP,但对心脏迷走活动没有抑制作用(雷文顿等., 1990). 在澳大利亚负鼠(刷尾负鼠)在胸交感神经节中,GAL而非NPY与NAd共存(莫里斯等., 1992). 在这个物种中,外源性GAL(而非NPY)减弱了心脏迷走神经活动,模拟了交感神经刺激的作用并增加了血压(Courtice公司等., 1993). 虽然尚未在人类交感神经中检测到GAL,但在肾上腺髓质和胰腺组织中检测到了GAL,据报道,运动后人类的血浆GAL水平升高(Legakis公司等., 2000). 人类静脉输注GAL可能通过减少窦性心律失常增加了静息心率(HR)(凯里等., 1993). GAL还被认为是人类交感神经传递的调节剂,因为它降低了吡斯他明诱导的胆碱能增强对NAd释放的增强作用(德格利·乌贝蒂等1996年). 提示GAL通过减少交感节后神经元的节前胆碱能刺激来减少NAd的释放。
已克隆了三个GAL受体;它们是GAL-1R、GAL-2R和GAL-3R(帕克等., 1995;霍华德等., 1997;小科拉科夫斯基等1998年). 在小鼠心脏中检测到一个受体(GAL-1R)(王等., 1997)和GAL-1R已在小鼠全心制剂中鉴定(徐等., 1995). 在人类中,GAL-1R受体在外周有大量表达,在心脏中表达水平最高(沙利文等., 1997).
本研究的目的是检测GAL对小鼠心脏迷走神经活动的影响。观察外源性GAL对麻醉对照、GAL-KO和GAL-1R-KO小鼠心脏迷走神经活动的影响。
方法
动物
所有实验均获得新南威尔士州动物护理和伦理委员会的批准,并符合澳大利亚国家卫生和医学研究委员会的动物使用规范。
靶向破坏神经递质GAL、甘丙肽敲除的小鼠纯合子(GAL-KO,129 SvJ背景;威尼克等1998年)以及阻断甘丙肽1R受体敲除的纯合子(GAL-1R-KO,129 SvJ背景;雅各比等2002年,2002年b)年龄在12至30周之间,由Tiina Iismaa博士(澳大利亚达林赫斯特加文医学研究所)繁殖。每个基因敲除组的对照小鼠背景相同。
实验程序
用五巴比妥钠(Nembutal,Boehringer Ingelhiem;30mg/kg−1,腹腔注射)。在整个实验期间,根据需要给予补充剂量的麻醉剂(用生理盐水稀释1:10)。气管在每只小鼠颈部高位插管,并连接到一个正压啮齿动物呼吸机上(Ugo Basile 6025)。在实验期间,每只小鼠都进行人工通风。调整呼吸频率和潮气量并监测血气通过血气分析仪(Corning 278血气分析仪),用于微调通风参数(第页O(运行)2≈80毫米汞柱,第页一氧化碳2≈40 mmHg,pH 7.4)。在整个实验期间,对血气进行了多次检查,如有必要,还对呼吸泵的潮气量或频率进行了调整。调整后,再次检查血气。股动脉插管以连续记录动脉血压通过Statham生理压力传感器(P23XL),股静脉插管给药。监测温度通过直肠探头,保持在37±1°C。皮下针电极用于记录心电图(ECG),心电图显示在存储示波器(Gould 1401)上,以监测脉冲间隔(PI)记录的正确触发。ECG用于在使用Neurolog模块(Digitimer,英格兰:NL 200、303、601)进行处理后获得PI(心跳间隔时间)。PI和BP均记录在Grass测谎仪(79型,Grass仪器)上,并使用数据采集和分析系统(Grass仪器,Polyview)进行数字存储。切断颈部高位迷走神经前后,分别测定静息PI(心跳间隔时间)和平均动脉压(MAP)。切断神经以消除迷走神经介导的对心率的反射效应,这种反射效应是在注射肽后血压升高时发生的。
Vagal隔离
清除右迷走神经外周端的结缔组织,将其置于铂电极上,每隔30秒用方波刺激器(Grass SD9)以7.5 V、1 ms、2–4 Hz的超高电压刺激5秒。所选择的使用频率是PI增加了~50 ms(即在151 ms的静息PI下,50 ms的PI增加相当于HR减少98次/min−1对于对照组小鼠(心率从397次变为299次−1);心率下降111次/分−1对于静息PI为141 ms的GAL-KO小鼠(HR从425次变为314次−1:请参阅图1a顶部面板);在静息PI为130ms的GAL-1R-KO小鼠中,50ms的PI增加相当于128次/分的HR减少−1(心率从461次变为333次−1)在相应的对照小鼠中,心率变化为145次/min−1(心率从496次变为351次,最小−1:请参阅图1a底部面板)。迷走神经刺激诱发的PI(ΔPI)变化与刺激频率呈线性关系,而与静息PI无关(参见帕克等., 1984)刺激迷走神经后心率下降的幅度取决于静息心率,而不是线性相关。我们选择使用ΔPI,因为它与刺激频率呈线性关系。
图1。
对照组(□),GAL-KO小鼠(▪). 图(a)显示了具有完整迷走神经(实心条)和切断迷走神经后(阴影条)的对照和GAL-KO小鼠的静息PI的顶部面板,平均值±s.e.m。直方图显示GAL-KO小鼠的PI与对照组没有差异。切断迷走神经后,两组小鼠的PI均显著降低。神经切断前后,两组小鼠的PI无显著差异。两组小鼠的MAP无差异。*P(P)<0.05. 底部面板显示对照组和GAL-1R-KO小鼠静息PI的平均值±s.e.m.,迷走神经完整(实心条)和切断迷走神经后(阴影条)显示在面板(a)中。直方图显示GAL-1R-KO小鼠的PI与对照组无差异。切断迷走神经后,两组小鼠的PI均显著降低。神经切断前后,两组小鼠的PI无显著差异。小组(b)中,两组小鼠的MAP无差异。**P(P)<0.01.
交感神经隔离
在小鼠中,由于心脏神经的大小和位置,无法像在大鼠中那样识别心脏神经(史密斯-怀特等., 2002). 因此,位于颈部、迷走神经背侧和颈动脉附近的一条细神经被追踪到心脏,并在受到刺激时通过心脏加速被识别为交感神经分支。向心脏方向刺激神经,引起心率增加,可被普萘洛尔阻断,血压略有增加,与交感神经激活一致。将神经从所有组织中取出,以避免刺激扩散,并放置在铂电极上,在未受刺激时保持覆盖和湿润。用刺激参数刺激神经:25 V,1 ms,以10 Hz的频率持续2 min。较低电压10 V,6 Hz在短时间内抑制迷走神经性心动过缓,并在服用与NAd作用一致的普萘洛尔后被废除。较高刺激诱发的抑制存活β-肾上腺素受体阻滞。交感神经刺激期间,迷走神经不受刺激。
记录程序和分析
心脏交感神经刺激和GAL团注被提议用来减弱随后由迷走神经刺激引起的心脏减慢。我们将刺激迷走神经引起的PI(ΔPI)增加抑制百分比的大小解释为NPY和相关类似物的连接前活性的指示(波特等., 1989). 这是使用以下公式计算的:
ΔPic(c)是控制期迷走神经刺激诱发的PI增加和ΔPIt吨是治疗期的反应。治疗期是指出现肽或交感神经刺激后PI增加的变化。ΔPi的计算方法为Polyview公司(Grass Instruments)通过迷走神经刺激后PI增加产生的曲线下区域。T型50是从最大限度抑制迷走神经刺激引起的PI增加中恢复抑制反应的一半时间。记录刺激迷走神经诱发的静息PI和ΔPI,以区分对HR的直接影响和对迷走神经通路的直接影响。
我们将给药后收缩压(ΔBP)的增加解释为连接后NPY活性的测量(波特等., 1989),并使用以下等式计算得出:ΔBP mmHg=BPc(c)−英国石油公司t吨,其中BPc(c)是控制收缩压和血压t吨是指治疗期间的收缩压。
增加NPY或Gal的静脉注射剂量后,生成每个测量参数的剂量-反应曲线。测量的参数为:刺激迷走神经诱发PI增加的最大抑制率(ΔPI%);抑制反应的半恢复时间(T型50,最小值);血压最大增加(ΔBP,mmHg);BP变化的持续时间(BP持续时间,min)。
数据分析
在最初的研究中,男性和女性的数据被汇总在一起,而这些研究的结果没有差异。数据表示为平均值±标准误差(s.e.m.)。所有数据均呈正态分布。组间比较以单向方式进行方差分析。如果显示出显著差异,学生的t吨-试验用于确定哪种剂量与对照反应有显著差异。在适当的情况下P(P)-使用Dunn–Sidak方法校正值。P(P)-<0.05的值被认为是显著的。
实验方案
药物按50份等分给药μ静脉滴注。用药后,静脉插管用50μ1升加热的肝素盐水。GAL和NPY的剂量范围为2.5至40μ克千克−1(GAL:0.8至13毫摩尔千克−1和NPY:0.5至10 nmol kg−1). NPY剂量高于10 nmol kg−1被认为不在生理范围内。允许延长GAL注射之间的时间间隔,以防止对GAL的快速反应(乌尔曼等., 1992).
以前,我们报道过NPY通过激活Y抑制大鼠的心脏迷走神经活动2受体(史密斯-怀特等., 2001);因此,Y的选择性拮抗剂2受体(S公司)-N个2-[[1-[2-[4-[(R(右),S公司)-5,11-二氢-6(6小时)-氧二苯并[b,e]氮杂吡啶-11-基]-1-哌嗪基]-2-氧代乙基]环戊基]乙酰基]-N个-[2-[1,2-二氢-3,5(4H(H))-二氧-1,2-二苯基-3-H(H)-1,2,4-三唑-4-y]乙基]-精氨酸酰胺(BIIE0246;杜德等., 1999)给对照组和GAL-1R-KO小鼠服用,以阻断NPY在刺激交感神经后对ΔPI的抑制作用,因此仅显示内源性释放的GAL对ΔP1的影响。此处使用的BIIE0246剂量高于之前在大鼠体内使用的剂量(史密斯-怀特等., 2001),以完全阻断而不仅仅是减少NPY对ΔPI的诱发抑制作用。BIIE0246的效果通过缺少Y进行测试2-选择性给予NPY Y后介导的心脏迷走神经抑制活性2激动剂,N-乙酰基[亮氨酸28,31]NPY 24-36岁。由于BIIE0246的剂量很高,抑制活性的恢复不在实验的时间范围内。
药物
BIIE0246是Henri Doods博士(德国Biberach Boehringer Ingelheim Pharma)赠送的礼物。市售药物有:NPY、鼠/人(Calbiochem-Novabiochem AG Läufelfingen,瑞士);GAL,大鼠(Peninsula Laboratories,Inc.,Belmont,CA,U.S.A.);普萘洛尔(澳大利亚新南威尔士州Castle Hill Sigma-Aldrich私人有限公司)。所有药物均溶于0.09%盐水中。药丸剂量以摩尔千克计−1基础。普萘洛尔(1 mg/kg−1)在初步鉴定交感神经后给小鼠注射,以消除NAd引起的抑制活动,并防止由于心率增加对已经快速跳动的心脏产生不必要的反射效应。服用普萘洛尔并没有显著降低小鼠的静息心率。
除Y外,所有药物都很容易溶解在盐水中2拮抗剂BIIE0246。这种合成拮抗剂首先用甲醇处理,然后用生理盐水处理。车辆对小鼠的测量参数没有影响。
结果
对照组、GAL-KO和GAL-R-KO小鼠的静息PI和MAP
迷走神经完整的GAL-KO小鼠的静息PI与对照组小鼠相比无显著差异:(对照组:176±5 ms,341次/min−1,n个=10; GAL-KO:171±10 ms,351次/分−1,n个=16)。对照小鼠的MAP与GAL-KO小鼠的MAP没有差异(对照:72±6mmHg;GAL-KO:67±6mmHg)。这显示在的上面板中图1(b).
切断迷走神经后,对照组PI降至151±8ms(397次/min)−1)至141±11 ms(425次最小跳动−1)GAL-KO小鼠。两组小鼠神经切断前后PI值均有显著性差异(P(P)<0.05),组间无显著差异。这可以在的上面板中看到图1(a).
迷走神经完整的GAL-1R-KO小鼠的静息PI与对照小鼠相比没有显著差异;控制:155±5 ms(最小387次−1),n个=10; GAL-1R-KO:158±5 ms(最小380次−1),n个=10.对照组小鼠72±4 mmHg的MAP与GAL-1R-KO组小鼠70±3 mmHg无差异。这显示在的底部面板中图1(b).
切断迷走神经后,对照组PI降至121±5ms(496次/min)−1)至130±6 ms(462次最小跳动−1)GAL-1R-KO小鼠。而两组小鼠神经切断前后的PI有显著差异(P(P)<0.01),切断迷走神经前后各组间无显著性差异。这显示在的底部面板中图1(a).
GAL对对照、GAL-KO和GAL-1R-KO小鼠心脏迷走神经活动的影响
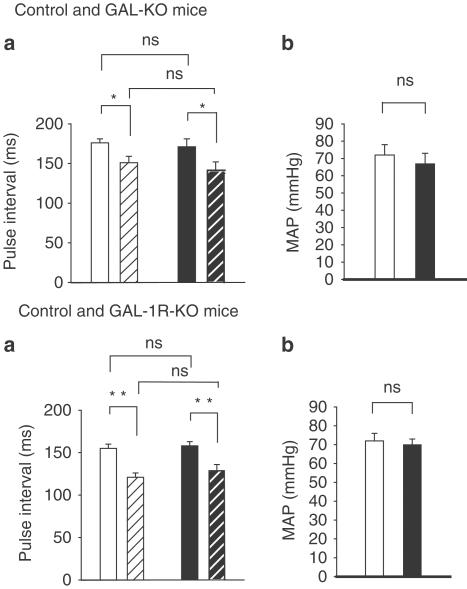
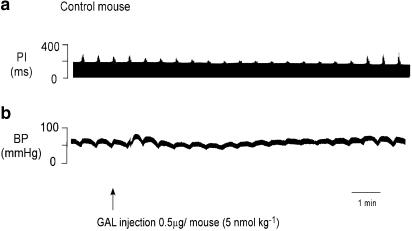
在对照小鼠中,静脉注射GAL(0.8–13 nmol kg−1;n个=4-6)以剂量依赖的方式减弱了迷走神经刺激引起的PI增加。对照组小鼠的ΔPI范围为33±7至78±9.5%。这个T型50范围为2±0.5至7±1min。GAL可增加血压,但这种作用不具有剂量依赖性。ΔBP范围为11±2至15±3 mmHg,持续时间为3±1–4.5±1 min。图2显示了一只老鼠5 nmol kg的测谎曲线−1GAL剂量。图3显示了该组的剂量-反应数据。
图2。
测谎图显示在对照小鼠中静脉注射GAL的效果。注射GAL后,迷走神经减慢心脏的能力减弱,血压暂时升高10 mmHg。注射后3分钟,这只小鼠的MAP略有下降。GAL对静息PI无影响。
图3。
对照组(▵),GAL-KO小鼠(▵)。对照组和GAL-KO小鼠中GAL产生的剂量-反应曲线的结果。图(a)测量迷走神经刺激引起的PI(ΔPI%)增加的百分比变化,(b)测量抑制作用恢复到一半的时间(T型50),(c)测量血压变化(ΔBP,mmHg),(d)测量血压效应持续时间(BP持续时间,min)。在对照小鼠中,每剂量GAL的ΔPI%都会增加(n个=4–6). 在GAL-KO小鼠中,GAL的抑制作用与对照小鼠无显著差异(n个=5–7). 在对照组和GAL-KO小鼠中T型50剂量超过6 nmol kg−1被削弱了。在两组小鼠中,GAL轻微增加了血压,但无论是幅度还是持续时间都没有显著差异。
在GAL-KO小鼠中,静脉注射GAL(0.8–13 nmol kg−1;n个=5–7)剂量依赖性地减弱迷走神经刺激诱发的PI增加。对照组小鼠的ΔPI抑制率为37±7至72±6%。这个T型50范围为2.5±1至4±1 min。GAL与对照组一样,增加了血压,且该效应不具有剂量依赖性。ΔBP范围为8±2~9±1.5 mmHg,持续时间为4±1.5~5±2 min。对照组小鼠静脉注射GAL引起的升压反应和对心脏迷走神经活动的抑制作用与GAL-KO组小鼠的反应无显著差异,如图3.
在GAL-1R-KO小鼠中,静脉注射一剂GAL(0.8–13 nmol kg−1;n个=3-4)在该范围内的任何剂量下,迷走神经刺激诱发的PI增加均未减弱。与对照组一样,GAL增加了血压,并且这种作用不依赖于剂量。ΔBP的范围为8±2至9.5±1 mmHg,持续时间为4.5±1.5–5±1.5 min。对照小鼠注射GAL后的ΔBP与GAL-1R-KO小鼠(未显示)的ΔBP无显著差异。
NPY对对照组和GAL-KO小鼠血压和心脏迷走神经活动的影响
在对照小鼠中,静脉注射NPY(0.5–10 nmol kg−1;n个=5–7)以剂量依赖性方式减弱迷走神经刺激诱发的ΔPI。对照组小鼠的ΔPI范围为13±10%至67±7%。这个T型50范围为0.5至5±1分钟。静脉注射NPY后的ΔBP呈剂量依赖性。ΔBP范围为25±6至60±3 mmHg,持续时间为7±1–12±1 min。
在GAL-KO小鼠中,静脉注射NPY后迷走神经刺激引起的ΔPI衰减具有剂量依赖性。GAL-KO小鼠的ΔPI范围为11±4%至72±2%。这个T型50范围为1±0.5至6±0.5 min。静脉注射NPY后的ΔBP呈剂量依赖性。ΔBP范围为22±3~60±10 mmHg,持续时间为6±0.5~10±2 min。对照组小鼠静脉注射NPY引起的升压反应和对心脏迷走神经活动的抑制作用与GAL-KO组小鼠无显著差异,如图4.
图4。
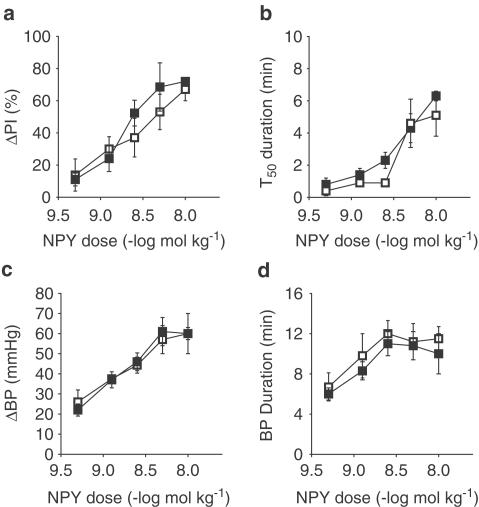
对照组(□),GAL-KO小鼠(▪). 对照组和GAL-KO小鼠NPY的剂量-反应曲线结果。图(a)测量刺激迷走神经引起的PI增加百分比变化(ΔPI%),(b)是抑制作用恢复一半的时间(T型50),(c)测量血压变化(ΔBP,mmHg),(d)测量血压效应持续时间(BP持续时间,min)。在对照小鼠中,每剂量NPY的ΔPI%都会增加(n个=5–7). 在GAL-KO小鼠中,GAL的抑制作用与对照小鼠无显著差异(n个=7)。在对照和GAL-KO小鼠中T型50随着NPY剂量的增加而增加,但反应无显著差异。在这两组小鼠中,NPY以剂量依赖性的方式增加了血压,在幅度或持续时间上没有显著差异。
小鼠心脏交感神经刺激
刺激三只小鼠的交感神经可使PI降低约75 ms(即HR增加约260次/min−1; 从~340至600)。刺激神经时血压也升高。以6 Hz、1 ms、10 V(S6)的频率刺激神经2 min,可减弱刺激迷走神经引起的ΔPI。一只老鼠的测谎仪轨迹如所示图5,面板(a)。对迷走神经活动的抑制作用持续时间很短,在普萘洛尔(1 mg kg)存在时消除−1(未显示)。在较高的刺激频率10 Hz、1 ms、25 V(S10)持续2 min后,迷走神经刺激诱发的ΔPI被长时间抑制,ΔPI=92±2%,T型50=7±1分钟,n个=3,如所示图5,面板(b)。在普萘洛尔(1 mg kg−1),ΔPI被抑制80±3%T型506±1分钟,n个=4,与ΔPI的控制响应显著不同,但没有T型50,如所示图6,面板(a)。
图5。
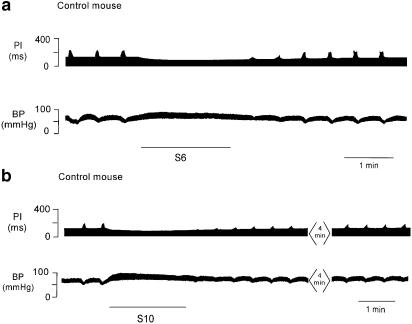
一只对照小鼠的图表记录器中的测谎曲线(a)显示交感神经以6 Hz刺激2分钟后的ΔPI(S6)。交感神经刺激后,短时间迷走神经刺激引起的ΔPI衰减。刺激交感神经时血压升高,PI降低。同一只小鼠在交感神经刺激(黑线)以10 Hz的频率增加2分钟(S10)后,图表记录仪中的测谎曲线(b)显示出对ΔPI的抑制作用。刺激频率越高,ΔPI抑制和ΔBP越大。对迷走神经的刺激在交感神经刺激期间停止。
图6。
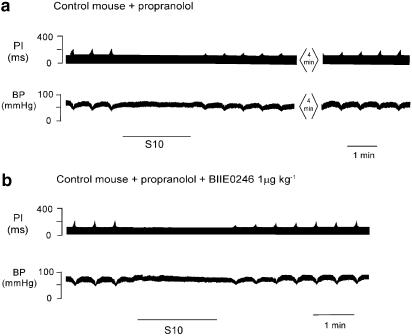
图记录仪显示普萘洛尔(10 Hz,持续2分钟,S10)存在时交感神经刺激(黑线)的多谱仪轨迹(a)。刺激交感神经后,刺激迷走神经引起的ΔPI持续衰减仍很明显(上图)。微量元素(b)显示了大剂量Y后30分钟对心脏交感神经ΔPI的影响2拮抗剂BIIE0246。拮抗剂存在时,ΔPI的衰减降低。在使用普萘洛尔的交感神经刺激期间,血压没有显著升高。交感神经刺激期间,迷走神经刺激停止。
剂量为Y后30分钟2拮抗剂BIIE0246(1μ摩尔千克−1),交感神经刺激对迷走神经活动的抑制作用减弱,ΔPI,57±3%T型502.5±0.5分钟,n个=3.诱发抑制与对照反应和普萘洛尔作用下的反应均存在显著差异,尽管只有T型50对于对照组显示出显著差异。一只老鼠的测谎仪轨迹如所示图6,面板(b)。组数据如所示图8.
图8。
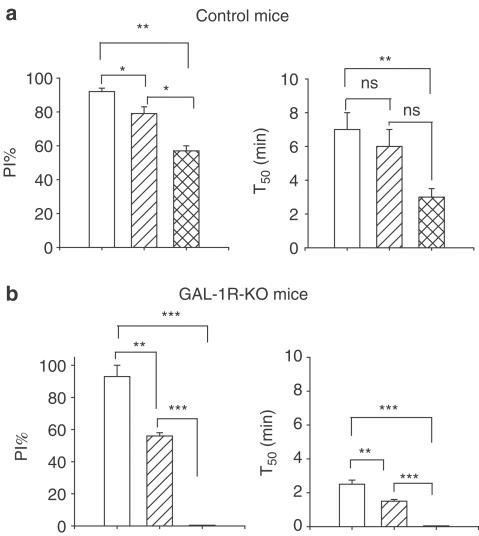
面板(a)是四只对照小鼠的结果总结,显示了在大剂量普萘洛尔(阴影条)和普萘洛耳和NPY Y存在的情况下,刺激心脏交感神经(开条)后,对ΔPI的最大抑制百分比和恢复时间的影响2拮抗剂,BIIE0246(交叉阴影条)。在这两种拮抗剂存在的情况下,交感神经刺激后PI增加仍有一些衰减。面板(b)是对三只GAL-1R-KO小鼠的结果的总结,显示了在心得安(阴影条)和心得安和NPY Y的存在下,刺激心脏交感神经(开条)后,对ΔPI的最大抑制率和半恢复时间的影响2拮抗剂,BIIE0246(交叉阴影条)。在一次剂量的普萘洛尔注射后,衰减显著降低,随后服用BIIE0246后消失。显示出显著差异;**P(P)<0.01;***P(P)<0.001.
刺激交感神经对GAL-1R-KO小鼠心脏迷走神经活动的影响2拮抗剂BIIE0246
在刺激GAL-1R-KO小鼠的交感神经(S10)一段时间后,心脏迷走神经活动被抑制93±7%T型502.5±0.25分钟,n个=3.在普萘洛尔(1 mg kg)存在的情况下−1),心脏迷走神经活动被抑制了56±2%T型501.5±0.5分钟,n个=5.如所示图7,顶部面板。
图7。
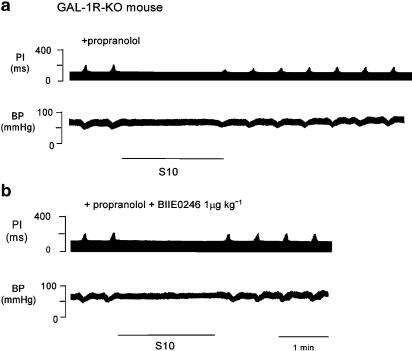
面板(a)显示了一只GAL-1R-KO小鼠的记录仪记录的测谎曲线,显示了10 Hz、25 V、持续2 min的心脏交感神经刺激对ΔPI的影响(S10)。在交感神经刺激和普萘洛尔的存在下,心脏迷走神经活动减弱。注意,普萘洛尔刺激交感神经后PI没有增加。图(b)显示了一只GAL-1R-KO小鼠的测谎图轨迹,显示了在普萘洛尔存在下,在10Hz、25V下刺激2分钟(S10)对心脏交感神经周期ΔPI的影响。一次剂量的Y后30分钟2拮抗剂BIIE0246,交感神经刺激后对ΔPI的抑制被取消。
一次剂量的Y后30分钟2拮抗剂BIIE0246(1μ摩尔千克−1),交感神经刺激对迷走神经活动的抑制作用被消除,P(P)<0.001,n个=3.一只老鼠的测谎曲线如所示图7,底部面板。小鼠交感神经刺激效应的分组数据和总结如所示图8.
讨论
本研究的目的是确定GAL在心血管功能自主控制中的作用。在麻醉小鼠中,静脉注射GAL以剂量依赖的方式减弱了迷走神经减慢心脏的能力。GAL对GAL-KO小鼠的抑制作用不因GAL的缺失而改变,但在GAL-1R-KO小鼠中则不存在。
在对照组和GAL-KO组中,高剂量GAL表现出快速反应,在记录的反应持续时间中,这种效应更为明显。GAL还增加了对照组和GAL-KO小鼠的血压;然而,在一半的受试小鼠中,血压升高后继而降低。这种双相反应可能解释了为什么GAL不会以剂量依赖的方式增加血压。对BP的影响与NPY在小鼠中诱发的有效影响形成对比(史密斯-怀特等., 2002)和其他物种(雷文顿等., 1987;莫里亚蒂等., 1992;乌尔曼等., 1992). 在GAL-KO小鼠中,外源性NPY的心脏迷走神经抑制作用和BP效应没有改变。这些结果表明,在没有GAL的情况下,GAL或NPY受体介导的效应都没有改变。
如之前在其他物种中所示,电刺激小鼠的心脏交感神经可以增加心率(利德尔和谢林顿,1929年;Yasunaga&Nosaka,1979年). 在小鼠交感神经刺激一段时间后,随后的心脏迷走神经活动持续衰减。对其他物种的观察表明,这种效应是由刺激期间交感神经释放的多种递质介导的(波特,1985年;雷文顿等., 1990;Courtice公司等., 1993;史密斯-怀特等., 1999). 虽然NAd已被证明抑制心脏迷走神经活动,但其作用持续时间很短(波特,1988). 据报道,NAd对迷走神经传递的抑制作用是通过激活前连接介导的α1-肾上腺素受体,但交感神经活动停止后活性迅速减弱(韦策尔等., 1985). 我们发现迷走神经活动受到抑制,随后交感神经受到延长的刺激。抑制作用持续时间长,在普萘洛尔的存在下减弱,NPY Y进一步减弱2拮抗剂BIIE0246。在对照组小鼠中,普萘洛尔将交感神经刺激后的抑制作用降低了约10%,在服用BIIE0246后进一步降低了20%。剩余的抑制作用归因于GAL在这些小鼠中的作用。这表明,在实验条件下,NPY在该物种胆碱能传递的调节中起着次要作用。
刺激GAL-1R-KO小鼠的交感神经对心脏迷走神经活动产生抑制作用,其程度与对照小鼠相似,但在普萘洛尔的作用下降低了50%,并在服用Y后消失2拮抗剂BIIE0246。肾上腺素受体激活抑制作用的增强表明GAL-1R受体可能影响交感神经NAd的释放;然而,确定这种影响是在神经节还是神经末梢超出了本研究的范围。给药选择性拮抗剂后,NAd和NPY引起的抑制作用的半恢复时间在对照小鼠中没有显著改变,尽管总的持续时间缩短表明GAL对延长迷走神经活动的抑制作用有显著影响。我们注意到,与对照组和GAL-KO小鼠相比,GAL-1R-KO小鼠对麻醉的反应不同,在实验期间需要更频繁地补充麻醉剂;因此,在这些小鼠中观察到的恢复时间减半可能归因于清醒。
在麻醉的GAL-KO和GAL-1R-KO小鼠中,静息PI(或HR)和BP与对照小鼠没有差异。切断迷走神经后,敲除组和对照组小鼠的PI降低(或HR增加)相似,表明神经中GAL的缺失或GAL-1R受体的缺失不会改变心脏的自主神经活动。这表明GAL通过外周途径激活其对迷走神经传递的抑制作用。
这项研究的发现支持了这样的观点,即小鼠心脏副交感神经细胞同时拥有GAL和NPY受体,当它们被激活时,可以减少胆碱能传递。我们认为,刺激交感神经后,GAL和NPY都会减弱随后的心脏迷走神经活动,GAL的作用占主导地位。迄今为止,小鼠是第一个显示GAL和NPY均抑制心脏迷走神经活动的物种,因为在之前研究的所有物种中,GAL或NPY介导了这种重要的功能保守性。该物种交感神经优先释放GAL可能有助于延长交感刺激的效果,而不会显著增加与NPY相关的升压活性。
致谢
我们感谢Henri Doods博士赠送BIIE0246,感谢David Wynick教授提供GAL-KO小鼠,感谢Y.J.Hort博士提供技术援助,感谢澳大利亚国家卫生和医学研究委员会支持这项工作。
缩写
- ACh公司
乙酰胆碱
- BIIE0246公司
((S公司)-N个2-[[1-[2-[4-[(R(右),S公司)-5,11-二氢-6(6小时)-氧二苯并[b,e]氮杂吡啶-11-基]-1-哌嗪基]-2-氧代乙基]环戊基]乙酰基]-N个-[2-[1,2-二氢-3,5(4H(H))-二氧-1,2-二苯基-3-H(H)-1,2,4-三唑-4-y]乙基]-精氨酸)
- dmnX公司
迷走神经背侧运动核
- 女孩
甘丙肽
- GAL-KO公司
甘丙肽淘汰赛
- GAL-1R-KO型
甘丙肽1R受体敲除
- NAd公司
去甲肾上腺素
- NPY(净现值)
神经肽Y
- nTS(纳秒)
孤束核
- 圆周率
脉冲间隔
- ΔPI
脉冲间隔变化
工具书类
-
CAREY D.G.、IISMAA T.P.、HO K.Y.、RAJKOVIC I.A.、KELLY J.、KRAEGEN E.W.、FERGUSON J.、INGLIS A.S.、SHINE J.、CHISHOLM D.J.人类甘丙肽对人体的强效作用:生长激素分泌和迷走神经阻断。临床杂志。内分泌。代谢。1993;77:90–93. doi:10.1210/jcem.77.1.7686918。[内政部] [公共医学] [谷歌学者]
-
COURTICE G.P.、POTTER E.K.、MCCLOSKEY D.I.通过甘丙肽而非神经肽Y抑制毛茸茸尾负鼠的心脏迷走神经活动。《生理学杂志》。1993;461:379–386. doi:10.1113/jphysiol.1993.sp019518。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
CRAWLEY J.N.微审查。甘丙肽-乙酰胆碱相互作用:与记忆和阿尔茨海默病的相关性。生命科学。1996;58:2185–2199. doi:10.1016/0024-3205(96)00093-8。[内政部] [公共医学] [谷歌学者]
-
DEGLI UBERTI E.C.、BONDANELLI M.、MARGUTTI A.、AMBROSIO M.R.、VALENTINI A.、CAMPO M.、FRANCESCHETTI P.、ZATELI M.C.、PANSINI R.、TRASFORINI G.正常受试者急性服用人甘丙肽可降低吡斯他明诱导的胆碱能增强对去甲肾上腺素和胰腺多肽释放的增强作用。神经内分泌学。1996;64:398–404. doi:10.1159/000127143。[内政部] [公共医学] [谷歌学者]
-
DOODS H.、GAIDA W.、WIELAND H.A.、DOLLINGER H.、SCHNORRENBERG G.、ESSER F.、ENGEL W.、EBERLEIN W.、RUDOLF K.BIIE0246:一种选择性高亲和力神经肽YY2受体拮抗剂。《欧洲药学杂志》,1999年;384:R3–R5。doi:10.1016/s0014-2999(99)00650-0。[内政部] [公共医学] [谷歌学者]
-
FISONE G.、BARTFAI T.、NILSSON S.、HKFELT T.加拉宁抑制钾诱发的乙酰胆碱释放和毒蕈碱受体介导的刺激猴海马切片中的磷脂酰肌醇周转。《大脑研究》1991;568:279–284. doi:10.1016/0006-8993(91)91409-t。[内政部] [公共医学] [谷歌学者]
-
HARFSTRAND A.,FUXE K.,MELANDER T.,HÖKFELT T.,AGNATI L.F.中枢甘丙肽神经元心血管作用的证据:关注与α2-肾上腺素能和神经肽Y机制的相互作用。心血管杂志。药理学。1987;10:S199–S204。[公共医学] [谷歌学者]
-
HOWARD A.D.、TAN C.、SHAO L.L.、PALYHA O.C.、MCKEE K.K.、WEINBERG D.H.、FEIGHNER S.D.、CASCIERI M.A.、SMITH R.G.、VAN DER PLOEG L.H.、SULLIVAN K.A.甘丙肽新受体的分子克隆和表征。FEBS信函。1997;405:285–290. doi:10.1016/s0014-5793(97)00196-8。[内政部] [公共医学] [谷歌学者]
-
IISMAA T.P.、SHINE J.甘丙肽和甘丙肽受体。研究探针。单元格。1999年差异;26:257–291. doi:10.1007/978-3-540-49421-8_12。[内政部] [公共医学] [谷歌学者]
-
JACOBY A.S.、HOLMES F.E.、HORT Y.J.、SHINE J.、IISMAA T.P.对Galr1敲除小鼠的表型分析揭示了Galr1甘丙肽受体调节癫痫活动但不调节神经再生的作用。莱特。佩普特。科学。2002a年;8:139–146.[谷歌学者]
-
JACOBY A.S.、HORT Y.J.、CONSTANTINESCU G.、SHINE J.、IISMAA T.P.GALR1甘丙肽受体在甘丙肽调节神经内分泌功能和癫痫发作活动中的关键作用。《分子脑研究》2002b;107:195–200. doi:10.1016/s0169-328x(02)00451-5。[内政部] [公共医学] [谷歌学者]
-
KOLAKOWSKI L.F.、JR、O'NEILL G.P.、HOWARD A.D.、BROUSSARD S.R.、SULLIVAN K.A.、FEIGHNER S.D.、SAWZDARGO M.、NGUYEN T.、KARGMAN S.、SHAO L.L.、HRENIUK D.L.、TAN C.P.、EVANS J.、ABRAMOVITZ M.、CHATEAUNEUF A.、COULOMBE N.、NG G.、JOHNSON M.P.、THARIAN A.、KHOSHBOUEI H.、GEORGE S.R.,SMITH R.G.、O'DOWD B.F。克隆人甘丙肽受体GALR2和GALR3的分子特征和表达。神经化学杂志。1998;71:2239–2251. doi:10.1046/j.1471-4159.1998.71062239.x。[内政部] [公共医学] [谷歌学者]
-
猫的椎旁交感神经元中同时存在KUMMER W.Galanin和神经肽Y样免疫反应。神经科学。莱特。1987;78:127–131. doi:10.1016/0304-3940(87)90620-3。[内政部] [公共医学] [谷歌学者]
-
LEGAKIS I.N.、MANTZOURIDIS T.、SARAMANTIS A.、PHENEKOS C.、TZIORAS C.、MOUNTOKALAKIS T.中年人在正常运动测试后,人甘丙肽分泌增加。恩多克。2000年决议;26:357–364. doi:10.3109/07435800009066173。[内政部] [公共医学] [谷歌学者]
-
LIDDELL E.G.T.,SHERRINGTON C.《哺乳动物生理学》,实践练习课程,1929年,伦敦:克拉伦登出版社;38–47.ed.利德尔,E.G.T.&谢林顿,C[谷歌学者]
-
LINDH B.、LUNDBERG J.M.、HKFELT T.NPY-、甘丙肽-、VIP/PHI-、CGRP-和P物质免疫反应性神经元亚群及其投射。细胞组织研究1989;256:259–273. doi:10.1007/BF00218883。[内政部] [公共医学] [谷歌学者]
-
MELANDER T.、HOKFELT T.、ROKAEUS A.、FAHRENKRUG J.、TATEMOTO K.、MUTT V.几种哺乳动物胃肠道中加兰素样免疫反应的分布。细胞组织研究1985;239:253–270. doi:10.1007/BF00218003。[内政部] [公共医学] [谷歌学者]
-
MORIARTY M.、GIBBINS I.L.、POTTER E.K.、MCCLOSKEY D.I.神经肽Y和甘丙肽对犬心脏迷走神经活动抑制作用的比较。神经科学。莱特。1992;139:275–279. doi:10.1016/0304-3940(92)90570-w。[内政部] [公共医学] [谷歌学者]
-
MORRIS J.L.、GIBBINS I.L.、HOLMGREN S.甘丙肽在刷尾负鼠的血管交感神经元中比NPY更常见。雷古尔。佩普。1992;37:101–109. doi:10.1016/0167-0115(92)90659-i。[内政部] [公共医学] [谷歌学者]
-
PARKER E.M.、IZARELLI D.G.、NOWAK H.P.、MAHLE C.D.、IBEN L.G.、WANG J.、GOLDSTEIN M.E.从Rin14B胰岛素瘤细胞克隆和鉴定大鼠GALR1甘丙肽受体。Brain Res.Mol.Brain Res.1995年;34:179–189。doi:10.1016/0169-328x(95)00159-p。[内政部] [公共医学] [谷歌学者]
-
PARKER P.、CELLER B.G.、POTTER E.K.、MCCLOSKEY D.I.迷走神经刺激和心脏减慢。J.汽车。神经。系统。1984年;11:226–231. doi:10.1016/0165-1838(84)90080-8。[内政部] [公共医学] [谷歌学者]
-
POTTER E.K.交感神经刺激后心脏迷走神经活动的长期非肾上腺素能抑制:神经肽Y的神经调节。莱特。1985;54:117–121. doi:10.1016/s0304-3940(85)80065-3。[内政部] [公共医学] [谷歌学者]
-
POTTER E.K.作为自主神经递质的神经肽Y。药理学。疗法。1988;37:251–273. doi:10.1016/0163-7258(88)90028-9。[内政部] [公共医学] [谷歌学者]
-
POTTER E.K.、MITCHELL L.、MCCLOSKEY M.J.D.、TSENG A.、GOODMAN A.E.、SHINE J.、MCBLOSKEY D.I.神经肽Y和相关肽的连接前后作用。雷古尔。佩普。1989;25:167–177. doi:10.1016/0167-0115(89)90258-9。[内政部] [公共医学] [谷歌学者]
-
REVINGTON M.L.、MCCLOSKEY D.I.、POTTER E.K.神经肽Y对麻醉大鼠苯肾上腺素升压反应和交感神经系统激活的影响。临床。实验药理学。生理学。1987;14:703–710. doi:10.1111/j.1440-1681.1987.tb01895.x。[内政部] [公共医学] [谷歌学者]
-
REVINGTON M.,POTTER E.K.,MCCLOSKEY D.I.麻醉猫交感神经刺激和甘丙肽后心脏迷走神经活动的长期抑制。《生理学杂志》。1990;431:495–503. doi:10.1113/jphysiol.1990.sp018342。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
SMITH-WHITE M.A.、HARDY T.A.、BROCK J.A.、POTTER E.K.选择性神经肽Y Y(2)受体拮抗剂BIIE0246对周围神经效应器连接处Y(2。英国药理学杂志。2001;132:861–868. doi:10.1038/sj.bjp.0703879。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
SMITH-WHITE M.A.、HERZOG H.、POTTER E.K.神经肽Y(2)受体在调节心脏副交感神经传递中的作用。雷古尔。佩普。2002;103:105–111. doi:10.1016/s0167-0115(01)00368-8。[内政部] [公共医学] [谷歌学者]
-
SMITH-WHITE M.A.、WALLACE D.、POTTER E.K.麻醉大鼠心脏的交感-副交感相互作用。J.汽车。神经。系统。1999;75:171–175. doi:10.1016/s0165-1838(98)00169-6。[内政部] [公共医学] [谷歌学者]
-
SULLIVAN K.A.、SHAO L.L.、CASCIERI M.A.人类和大鼠GALR1受体的药理学特征和组织分布。生物化学。生物物理学。Res.社区。1997;233:823–828. doi:10.1006/bbrc.1997.6542。[内政部] [公共医学] [谷歌学者]
-
TATEMOTO K.、ROKAEUS A.、JORNVALL H.、MCDONALD T.J.、MUTT V.加拉宁——一种来自猪肠的新型生物活性肽。FEBS信函。1983;164:124–128页。doi:10.1016/0014-5793(83)80033-7。[内政部] [公共医学] [谷歌学者]
-
ULMAN L.G.、POTTER E.K.、MCCLOSKEY D.I.交感神经活动和甘丙肽对麻醉猫心脏迷走神经活动的影响。《生理学杂志》。1992;448:225–235. doi:10.1113/jphysiol.1992.sp019038。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
WANG S.、HE C.、MAGUIRE M.T.、CLEMMONS A.L.、BURRIER R.E.、GUZZI M.F.、STRADER C.D.、PARKER E.M.、BAYNE M.L.小鼠GalR1甘丙肽受体的基因组组织和功能特征。FEBS信函。1997;411:225–230. doi:10.1016/s0014-5793(97)00695-9。[内政部] [公共医学] [谷歌学者]
-
WETZEL G.T.、GOLDSTEIN D.、BROWN J.H.大鼠心房乙酰胆碱释放可通过α1-肾上腺素能受体进行调节。循环。1985年决议;56:763–766. doi:10.1161/01.res.56.5.763。[内政部] [公共医学] [谷歌学者]
-
WYNICK D.、SMALL C.J.、BACON A.、HOLMES F.E.、NORMAN M.、ORMANDY C.J.,KILIC E.、KERR N.C.、GHATEI M.、TALAMANTES F.、BLOOM S.R.、PACHNIS V.Galanin调节催乳素释放和催乳素增殖。程序。国家。阿卡德。科学。美国1998年;95:12671–12676. doi:10.1073/pnas.95.21.12671。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
XU Y.,JOHANSSON O.,ROKAEUS A.心脏内甘丙肽免疫反应的分布和色谱分析。肽。1995;16:73–79. doi:10.1016/0196-9781(94)00147-x。[内政部] [公共医学] [谷歌学者]
-
YASUNAGA K.,NOSAKA S.大鼠心脏交感神经:解剖和功能特征。日本。《生理学杂志》。1979;29:691–705. doi:10.2170/jjphysiol.29.691。[内政部] [公共医学] [谷歌学者]