细胞内病原体细胞生物学的最新发展已经开始解释微生物在宿主体内感染和发育的策略。 其中, 布鲁氏菌属 spp.是引起布鲁氏菌病的革兰氏阴性兼性细胞内病原体,布鲁氏菌是一种广泛分布的人畜共患病,影响从海豚、家畜到人类等多种哺乳动物( 24 ). 布鲁氏菌属 在许多发展中国家仍然普遍存在,并在那里造成重大经济损失( 77 ). 人类布鲁氏菌病是一种具有多种病理表现的衰弱性疾病,包括发热和虚弱,在慢性病例中可导致心内膜炎、关节炎、脑膜炎、骨关节并发症和神经系统疾病( 12 , 37 ). 在包括牛、羊和山羊在内的家畜中,其病理学特征是女性胎盘和胎儿组织定植导致流产,男性不育( 65 ).
属的成员 布鲁氏菌属 与植物或动物细胞周围或细胞内病原体密切相关,如 农杆菌属 , 根瘤菌 、和 巴尔通体 物种( 47 ). 流产布鲁氏菌 能够在吞噬细胞的膜结合隔室内繁殖( 5 )和非专业吞噬细胞( 16 , 17 )单元格。 间接证据表明布鲁氏菌抑制吞噬体和溶酶体之间的融合( 26 ). 超微结构研究表明,增殖细菌位于类似内质网的核糖体样细胞器中( 2 , 16 , 17 , 44 ). 最近,我们展示了 B.流产 分布于自噬体样空泡中( 53 ). 然而,细菌在入侵早期使用的隔间的特征和 布鲁氏菌属 -含有吞噬体的物质尚未被描述。
迄今为止,已知许多细胞内病原体会阻断或改变宿主细胞内膜结合隔室的交通和/或成熟( 25 , 52 , 63 ). 吞噬级联中的膜交通是一个复杂的过程。 吞噬体与溶酶体融合成为吞噬溶酶体的早期模型得到了其他模型的补充,这些模型支持吞噬体在与溶酶体室融合之前逐渐成熟的观点( 6 , 68 ). 越来越多的吞噬体生物发生方面的研究表明,与含有病原体的液泡相比较,最有用的信息来自含有惰性颗粒或固定颗粒的吞噬体的分子特征( 8 , 15 , 68 ). 在吞噬细胞中,在内化的最初几分钟内,质膜蛋白大部分从惰性的含有颗粒的吞噬体中去除( 49 ). 吞噬体内单体GTPase rab5的存在证明了早期内吞小室和吞噬途径之间的相互作用( 14 , 43 ). 早期吞噬体成熟为晚期吞噬体的过程可以通过早期内吞细胞器标记的丢失和晚期内吞细胞的标记获得来揭示,例如GTPase rab7或甘露糖6-磷酸受体(M6PRs)( 14 , 51 , 56 ). 与溶酶体区室的融合表现为溶酶体蛋白的稳定积累,如酸性水解酶组织蛋白酶D或溶酶体相关膜蛋白(LAMP)在吞噬体上的稳定积累( 14 , 49 ).
已知细胞内病原体以多种方式改变其环境,以避免固有宿主细胞防御系统的降解。 在专业吞噬细胞中, 分枝杆菌属 残留在早期内胚体隔室内( 10 , 11 )排除液泡ATP酶,从而抑制细菌吞噬体的酸化( 69 ). 嗜肺军团菌 与自噬体结合,并利用宿主细胞的自噬机制在被ER包围的核糖体分泌的细胞器内繁殖( 71 )很少与内体级联相互作用( 61 ). 在非吞噬细胞中, 沙眼衣原体 包涵体与内吞途径完全分离( 31 , 72 )并可能代表转高尔基体网络的一个异常隔室,细菌从该隔室诱导鞘磷脂并入含病原体的液泡( 30 )主要由衣原体来源的蛋白质构成( 58 ). 贝氏柯克斯体 在酸化的隔间中繁殖( 55 )并诱导宿主细胞溶酶体融合( 42 ). 鼠伤寒沙门菌 绕过晚期内胚体隔室,靶向含有溶酶体膜糖蛋白的囊泡,这可能是转高尔基体网络直接传递的结果( 28 ). 原生动物 弓形虫 主动侵入宿主细胞( 18 )并在来源于宿主质膜的融合不全寄生液泡中繁殖( 70 )与宿主线粒体和内质网相关( 64 ). 真核单细胞鞭毛虫 克氏锥虫 在其进入位置招募溶酶体( 73 ):一旦进入宿主细胞,寄生虫就能降解溶酶体膜,允许在胞浆中自由复制( 三 ). 相反, 福氏志贺氏菌 和 单核细胞增多性李斯特菌 不以溶酶体为靶点,但也能溶解其内化室并在受感染细胞的细胞质中复制( 27 , 32 )都能通过肌动蛋白推动细胞内运动( 19 , 50 ).
我们之前已经观察到 布鲁氏菌属 能够侵入HeLa细胞,并且强毒株2308(S2308)分布在核糖体相关的多膜隔室中( 53 ). 在本研究中,我们详细介绍了强毒株和弱毒株的细胞内交通 布鲁氏菌属 HeLa细胞中的菌株,我们发现这两种菌株都能与绕过晚期而非早期内胚小室的自噬体结合。 在感染后期,毒力菌株被输送到宿主ER,在那里发生大量的细胞内细菌复制,而非致病菌株在其液泡与溶酶体融合后被降解。
材料和方法 细菌。 B.流产 S19是一种在世界范围内用作活疫苗的弱毒株(科罗拉多州丹佛市Professional Biological Co.); S2308为CO 2 -独立毒力平滑菌株(由J.-M.Verger,INRA,Nouzilly,France提供); 和S2.13、S65.21和S65.21- bvrR公司 已在前面描述过( 66 ). 细菌在37°C的胰蛋白酶大豆肉汤(TSB)(Difco,Detroit,Mich.)中培养至固定相,小份在-70°C的TSB–30%甘油中冷冻。 对于每个实验,通过孵育50μl解冻的等分试样(约5×10 10 CFU/ml)置于5 ml TSB中,在37°C下搅拌15至17小时,以允许细菌生长。 通过比较600 nm处的光密度和标准曲线来确定细菌数量。
抗体和荧光探针。 兔多克隆抗早期内体抗原1(EEA1)(由挪威奥斯陆挪威镭医院H.Stenmark提供); 亲和纯化兔多克隆抗阳离子非依赖性M6PR(CI-M6PR)(B.Hoflack,法国里尔巴斯德研究所); 山羊多克隆抗阳离子依赖性M6PR(K.von Figura,德国哥廷根大学); 兔多克隆抗rab7( 46 ); 兔多克隆抗人LAMP1和LAMP2(M.Fukuda,加州拉霍亚伯纳姆研究所); 兔多克隆抗组织蛋白酶D(S.Kornfeld,密苏里州圣路易斯华盛顿大学医学院); 亲和纯化兔抗rab6(B.Goud,居里研究所,法国巴黎); 小鼠单克隆抗原(H.P.Hauri,瑞士巴塞尔巴塞尔大学); 兔多克隆抗ec61β、兔多克隆抗体BiP和兔多克隆抗核蛋白(B.Dobberstein,海德堡大学,德国海德堡); 兔多克隆抗凝血酶(A.Helenius,瑞士苏黎世生物化学研究所); 小鼠单克隆抗蛋白二硫键异构酶(PDI)(J.Stow,澳大利亚布里斯班昆士兰大学); 牛和兔多克隆抗体- B.流产 使用S2308抗体。 二级抗体为异硫氰酸荧光素(FITC)结合驴抗兔免疫球蛋白G(IgG)、FITC结合驴抗羊IgG; FITC-偶联驴抗鼠IgG、德克萨斯红结球山羊抗鼠Ig G(法国马赛免疫技术公司Jackson ImmunoResearch Laboratories,Immunotech)和10-nm-黄金结球山羊抗体IgG(加利福尼亚州特梅库拉Chemicon International)。 使用的荧光探针为单丹酰卡达韦(MDC)和染色乳胶珠(直径0.798μm)(Sigma,St.Quentin-Fallavier,法国)。
动物细胞。 HeLa细胞生长在75厘米 2 ,烧瓶(Falcon;Becton-Dickinson,Paramus,N.J.),37°C,5%CO 2 Dulbecco最小基本培养基(法国Cergy-Potoise的GIBCO-BRL)中的空气,含有10%胎牛血清和2 mM谷氨酰胺,不含抗生素(细胞培养基)。 在第1代和第15代之间使用细胞,每周分裂1/10或1/4两次。 对于单层接种,24孔组织培养板(Falcon)接种500μl培养基,其中含有10 4 或10 5 细胞,每孔(对于共焦显微镜分析,细胞放置在含有12 mm直径玻璃盖玻片的24孔组织培养板中)。
细菌接种和乳胶粒的吸收。 我们之前制定了一个HeLa细胞感染各种菌株的方案 B.流产 ( 53 , 66 ). 毒性平滑的对数期培养 流产布鲁氏菌 S2308,衰减平滑 B.流产 第19节( 53 )和的变种 B.流产 S2.13、S65.21和S65.21- bvrR公司 ( 66 )通过培养5×10制备 10 (CFU)在37°C下于5 ml TSB中放置15 h。 在HeLa细胞生长过夜后,从24孔组织板中取出培养基,并用500μl标准化细菌悬浮液(500个细菌/细胞)或1/2000稀释液的10%染色乳胶珠溶液接种细胞。 培养板在400× 克 室温下,置于5%CO下的培养箱中 2 37°C(接种点)下的大气。 20分钟后,用细胞培养基清洗细胞五次,以去除非粘附细菌或多余的乳胶珠,并用每毫升补充50μg庆大霉素(Sigma)的细胞培养基进一步培养单层,以杀死细胞外布鲁氏菌。 在长期实验中,该培养基被替换两次:在1小时用每毫升含有25μg庆大霉素的新鲜培养基替换,在24小时用每ml补充5μg庆大霉素的培养基替换。我们之前表明,在接种后4小时,在每个感染细胞中检测到一到三个来自S2308和S19的细胞内细菌( 53 ). 在这些条件下,我们观察到35%到55%的HeLa细胞被感染,并且感染细胞的百分比没有随时间变化( 53 ). 使用上述不同突变体,100%的细胞平均感染20种细胞外细菌,每个感染细胞少于1种细胞内细菌( 66 ).
分析和定量免疫荧光。 在接种后的不同时间,清洗盖玻片以去除非粘附细菌(五次在细胞培养基中,一次在磷酸盐缓冲液[PBS]中),并在室温下在3%多聚甲醛中固定20分钟(或在−20°C的甲醇中固定4分钟以检测ER或高尔基标记物)。 然后在PBS中清洗细胞一次,用PBS–50%NH培养10分钟 4 Cl以淬灭游离醛基,并在PBS–5%马血清–0.1%皂苷溶液中连续培养针对不同宿主细胞内标记物的一级抗体和荧光二级抗体的适当稀释液(室温下每次培养30分钟)。 然后用PBS和蒸馏水清洗单层膜,并用Mowiol溶液将其安装在玻片上(德国法兰克福赫斯特)。 使用TCS 4D显微镜(德国海德堡莱卡激光技术公司)在油浸条件下进行间接免疫荧光和共聚焦分析。 为了确定噬菌体中细菌或乳胶粒的百分比(以整个研究中使用的不同标记的存在为特征),我们首先在德克萨斯红(或罗丹明)通道中计数至少80个细胞内细菌(通过间接免疫荧光显示)或乳胶粒(红色自荧光发射)。 通过FITC通道进一步观察细胞内细菌或乳胶珠,以确定与研究的细胞内标记物共定位的粒子百分比(通过间接免疫荧光显示)。
MDC内部化。 为了进行自噬体标记,用细菌接种细胞1小时,用细胞培养基洗涤五次,然后用无血清细胞培养基在50μg/ml庆大霉素存在下培养30分钟。然后用500μl 0.05 mM MDC培养单层细胞30分钟( 7 )在无血清细胞培养基中加入庆大霉素。 最后,用细胞培养基清洗细胞两次,用PBS清洗一次,然后进行间接免疫荧光分析。 使用配备A系统过滤器(激发过滤器,340至380 nm,屏障过滤器,430 nm)的MRC600共焦显微镜(德国海德堡蔡司公司)分析载玻片。
布雷费尔丁A和前溶血素治疗。 用S2308接种细胞1 h,并在庆大霉素(25μg/ml)存在下进一步培养24 h。感染的单层细胞然后用布氏菌素a(10μg/ml,Sigma)处理30 min或用前溶血素(0.38 nM)处理30分钟( 1 )在37°C下持续55分钟。 然后对单层膜进行清洗、固定和处理,以进行双重间接免疫荧光分析,方法是使用抗凝素和抗S2308血清对布雷费尔丁A处理的细胞进行检测,使用抗凝血酶和抗S2304血清对前溶血素处理的细胞进行检测。
冷冻切片的免疫标记和电子显微镜。 在直径为10-cm的培养皿上生长的HeLa细胞被细菌感染24小时。接种期结束后,用PBS清洗细胞,并在添加庆大霉素(50μg/ml)的细胞培养基中进一步培养。 接种后48小时,清洗单层膜,用8%的副甲醛溶液在0.1 M磷酸盐缓冲液中固定1小时,然后用橡皮警察从培养皿中刮下。 细胞在Eppendorf管中造粒,再悬浮在10%的明胶溶液中,然后再次造粒。 将试管浸入冰水中以快速固化明胶并切开,将明胶包埋的细胞颗粒切成小块,并用15%聚乙烯吡咯烷酮–2.3 M蔗糖渗透过夜。 然后,将细胞块安装在样本存根上,浸泡在液氮中,并在徕卡超切切片机中进行冷冻切片。 将用于电子显微镜的超薄切片(60至80 nm)转移到Formvar-carbon涂层网格中,用PBS–2%鱼皮明胶–0.1%牛血清白蛋白(BSA)–0.12%甘氨酸溶液封闭15分钟,在封闭溶液中与一级抗体孵育30分钟,进行单次免疫标记, 用PBS–20 mM Tris–0.1%BSA溶液清洗,并在PBS-Tris-BSA溶液中用二级抗体孵育30分钟。 网格用乙酸铀-甲基纤维素处理,并用1010电子显微镜观察(日本东京,Jeol)。
结果 强毒性和弱毒性 B.流产 这些菌株首先针对LAMP阳性、组织蛋白酶D阴性的液泡,绕过晚期而非早期内体。 在最近的一项研究中( 53 ),我们表明 布鲁氏菌属 菌株S19不能在HeLa细胞内有效繁殖。 在S2308感染期间,观察到约10小时的延迟期,在此期间,细胞内发现了细菌,但没有有效复制,随后是细菌大量复制的指数增长期。 在目前的工作中,我们首先关注的是 布鲁氏菌属 -在感染的最初几个小时内含有吞噬体,并比较了强毒株和弱毒株的细胞内命运。 作为对照,我们将乳胶珠内化,已知乳胶珠会从早期吞噬体转移到晚期吞噬体,并最终融合到溶酶体中( 68 ).
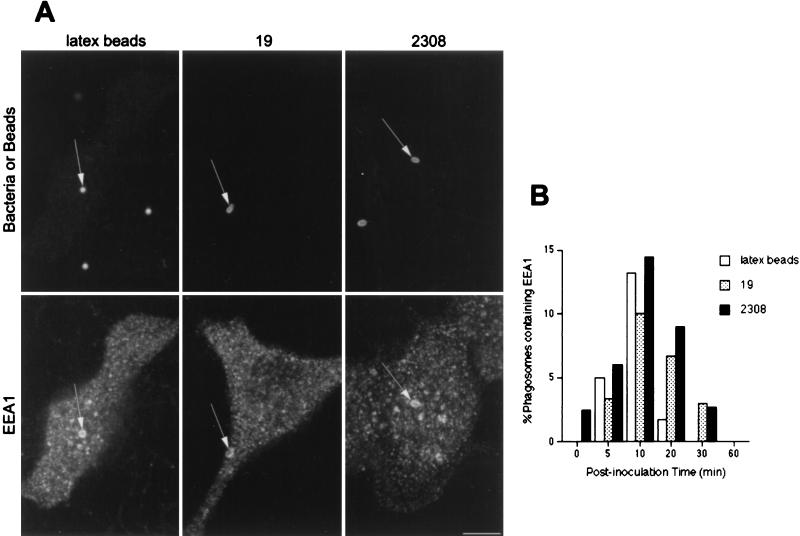
接种后5至15分钟,在以EEA1存在为特征的早期吞噬体中发现S2308和S19(图。 1 ). 用乳胶珠观察到相同的结果(图。 1 A) ●●●●。 这些数据证实了含有惰性颗粒或布鲁氏菌的吞噬体与早期内脏小室的相互作用( 43 , 52 ). 在所有研究样品中,接种后10分钟内,约10%至15%的颗粒与早期内体标记物共定位(图。 1 B) ●●●●。 细菌和乳胶珠与EEA1的共定位水平较低(~15%),这表明它们与早期内胚体隔室的快速和短暂相互作用,或者大多数细菌或乳胶珠(~80%)避免与EEA1阳性结构相互作用。 由于含有乳胶珠的吞噬体与早期内吞小室之间的相互作用已通过分子和形态学分析证明( 14 , 15 ),我们支持前一个假设。
图1。
在中检测到EEA1 布鲁氏菌属 -含有吞噬体。 用S2308或S19接种HeLa细胞或用乳胶珠喂养不同时间达20分钟,然后进行单(乳胶珠)或双间接免疫荧光处理(对于培养时间超过20分钟的细胞,清洗细胞并用含有庆大霉素的新鲜细胞培养基进一步培养)。 (A) 内化后10分钟,EEA1(下面板)和乳胶珠、S19和S2308(上面板)的分布。 (B) 吞噬体获取EEA1的动力学。 内化颗粒用EEA1标记(图A中的箭头),接种后10分钟内EEA1的获取量最大(B)。 在面板B中,数据是两个不同实验的平均值。 按照材料和方法中的描述计算含有EEA1的吞噬体的百分比。 棒材,5μm。
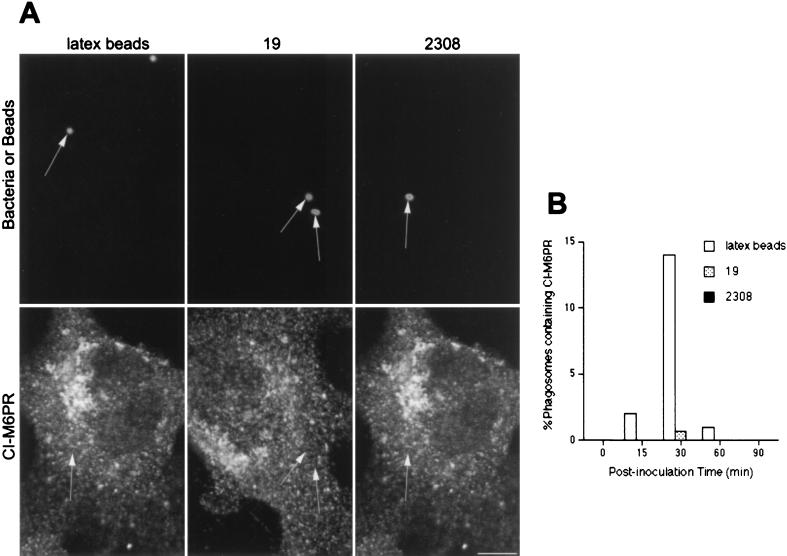
接下来我们分析了在吞噬体中是否能发现布鲁氏菌或乳胶粒,吞噬体表达晚期内吞体标记,如前溶酶体CI-M6PR( 56 )或rab7( 9 , 45 ). 接种后30分钟,在CI-M6PR阳性的隔室中发现约20%的乳胶珠(图。 2 ). 相反,在CI-M6PR阳性结构中从未发现S2308(图。 2 A) ,并且只有不到1%的S19吞噬体含有晚期内体标记物(图。 2 B) ●●●●。 当使用抗rab7或抗CD-M6PR抗体时,发现类似结果(未显示)。 溶酶体前体标记水平很低 布鲁氏菌属 -与乳胶珠相比,含有吞噬体的噬菌体表明两者在细胞内的转运有明显差异 布鲁氏菌属 与惰性颗粒的菌株相比。
图2。
布鲁氏菌属 -含有吞噬体可避免与CI-M6PR阳性隔间相互作用。 HeLa细胞用乳胶珠喂养或接种S2308或S19不同时间,并进行免疫荧光处理,如图图例所示。 1 (A)接种后30分钟CI-M6PR(下面板)和乳胶珠、S19和S2308(上面板)的分布。 (B) 吞噬体获取CI-M6PR的动力学。 请注意,只有乳胶珠被抗CI-M6PR抗体修饰(图A中的箭头)。 接种后30分钟,在晚期吞噬体中发现一些S19细菌,而在含有乳胶珠的吞噬体(B)中观察到CI-M6PR的最大获取时间为30分钟。 在面板B中,数据是两个不同实验的平均值。 如材料和方法中所述,计算含有CI-M6PR的吞噬体的百分比。 棒材,5μm。
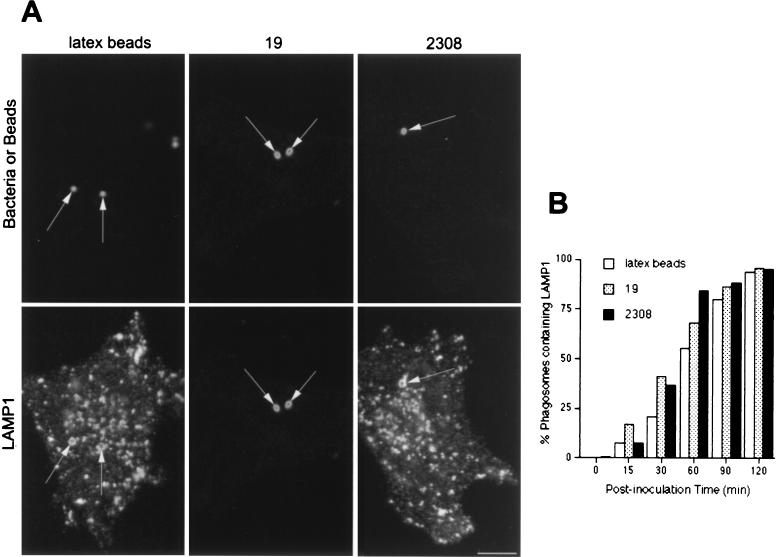
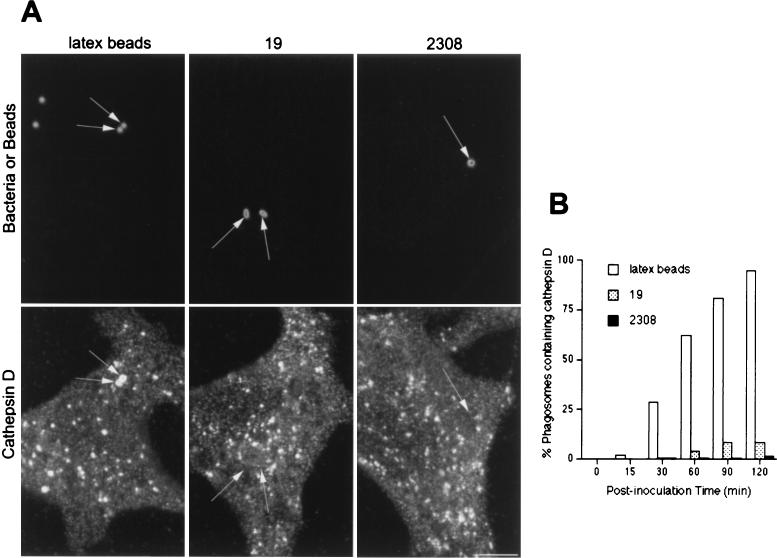
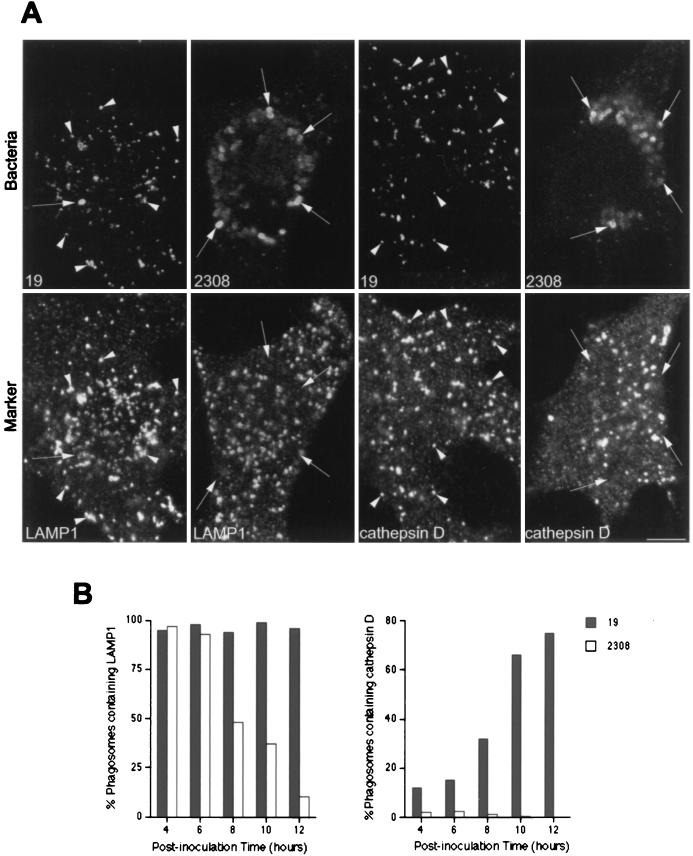
有人提出致病性 布鲁氏菌属 菌株抑制细菌室和溶酶体之间的融合( 26 ). 因此,我们通过以下方法比较了溶酶体相关蛋白的获得 布鲁氏菌属 -和含有吞噬体的乳胶珠。 强毒性和弱毒性 布鲁氏菌属 -含有吞噬体以及含有乳胶珠的吞噬体,逐渐累积LAMP1(图。 三 )和LAMP2(未显示),并且在接种后120分钟时,>95%的疫苗被标记为LAMP1(图。 三 B) ●●●●。 为了进一步描述 布鲁氏菌属 -含有吞噬体和溶酶体,我们分析了溶酶体酸水解酶组织蛋白酶D的分布。组织蛋白酶D被纳入含有乳胶珠的隔间,其动力学与LAMP1相同(图。 三 B和 4 B) ●●●●。 相比之下,在接种后的~2小时,这种溶酶体酶存在于含有毒性S2308的不到10%的吞噬体中,存在于含有减毒S19的~20%的吞噬体(图。 4 B) ●●●●。 综上所述,这些结果表明,虽然含有乳胶珠的吞噬体遵循从早期到晚期的吞噬途径,最终到达溶酶体,但其毒性和衰减 布鲁氏菌属 菌株暂时位于早期吞噬体中,但绕过与含有M6PR和rab7的晚期内吞隔室的相互作用,靶向不含组织蛋白酶D的含有LAMP1和2的隔室。
图3。
LAMP1分布于 布鲁氏菌属 -含有吞噬体。 用乳胶珠喂养HeLa细胞或接种S2308或S19不同时间,并进行免疫荧光处理,如图图例所示。 1 (A)接种后1小时LAMP1(下面板)和乳胶珠、S19和S2308(上面板)的分布。 (B) 吞噬体获取LAMP1的动力学。 LAMP1标签在两个 布鲁氏菌属- 和含有乳胶珠的吞噬体(如图A所示),LAMP1阳性率>80% 布鲁氏菌属- 内化90分钟时含有吞噬体(B)。 在面板B中,数据是来自两个不同实验的平均值。 按照材料和方法中的描述计算含有LAMP1的吞噬体的百分比。 棒材,5μm。
图4。
Cathspin D不表达于 布鲁氏菌属 -含有吞噬体。 HeLa细胞用乳胶珠喂养或接种S2308或S19不同时间,并进行免疫荧光处理,如图图例所示。 1 .(A)接种后1 h组织蛋白酶D(下部面板)和乳胶珠、S19和S2308(上部面板)的分布。 (B) 吞噬体获取组织蛋白酶D的动力学。 虽然含有乳胶珠的吞噬体被组织蛋白酶D大量标记(图A中的箭头),但溶酶体标记在 布鲁氏菌属- 包含吞噬体(如图A所示)。 只有少数含有S2308(<1%)或S19(<5%)的吞噬体在接种后2 h与组织蛋白酶D共定位(B)。 在面板B中,数据是两个不同实验的平均值。 如材料和方法中所述,计算含有组织蛋白酶D的吞噬体的百分比。 棒材,5μm。
布鲁氏菌属 菌株分布在自噬体中。
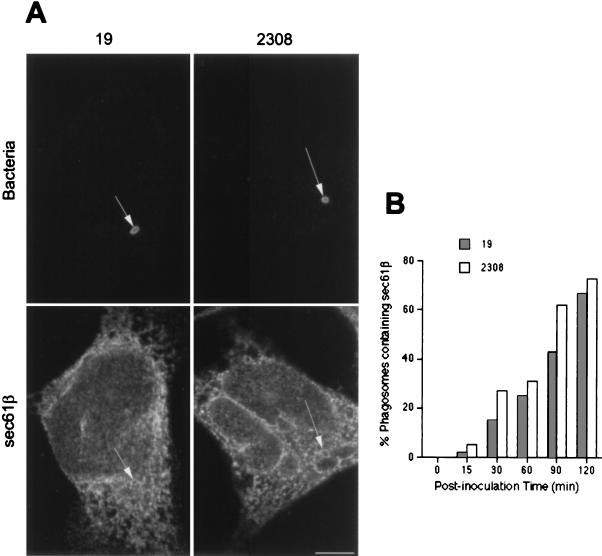
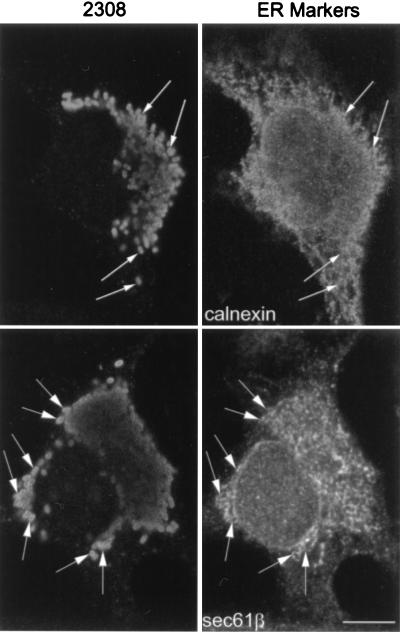
使用电子显微镜和嵌入Epon的切片,我们最近观察到 布鲁氏菌属 在HeLa细胞感染后的自噬体样结构中发现( 53 ). 一些研究小组提出,自噬体起源于内质网的内陷,以隔离细胞质物质( 23 , 48 ). 为了测试LAMP阳性但组织蛋白酶D阴性的细菌室可能的自噬体起源,我们寻找了内质网标记物在 布鲁氏菌属 -含有吞噬体。 分子sec61β是I型和II型信号锚定蛋白在内质网膜插入期间的主要交联伙伴的亚单位( 33 )在接种后的~1小时内,发现其修饰细胞内S2308和S19(图。 5 A) ●●●●。 乳胶珠从未对ER标记呈阳性(未显示)。 sec61β掺入的动力学 布鲁氏菌属 -含有吞噬体(图。 5 B) 与LAMP1相似(图。 三 B) ●●●●。 然而,膜ER蛋白核糖蛋白( 40 )也不是管腔ER标记BiP/GRP78( 76 )在中找到 布鲁氏菌属 -包含隔间(未显示),表明细菌可能与源自内质网的特定亚隔间相互作用。已显示二氨基苯乙酮自荧光化合物MDC在自噬体中特异性积累( 7 ). 该分子被用作检测自噬空泡的探针,以确定 布鲁氏菌属 分布于MDC阳性的隔室中。 事实上,在感染后2小时,两种致病性S2308(图。 6 )在自身荧光探针聚集的隔间中发现了减弱的S19(未显示),因此可以将其定义为自噬体。
图5:。
布鲁氏菌属- 含吞噬体表达ER标记sec61β。 HeLa细胞用S2308或S19接种不同时间,并进行免疫荧光处理,如图图例所述。 1 (A)接种相应细菌后1 h sec61β(下面板)的分布(上面板)。 (B) 吞噬体获取sec61β的动力学。 S2308和S19均位于标有sec61β的隔间中(面板A中的箭头)。 sec61β被纳入 布鲁氏菌属- 含有吞噬体(B),其动力学类似于LAMP1(图。 三 ). 在面板B中,数据是两个不同实验的平均值。 按照材料和方法中的说明计算含有sec61β的吞噬体的百分比。 棒材,5μm。
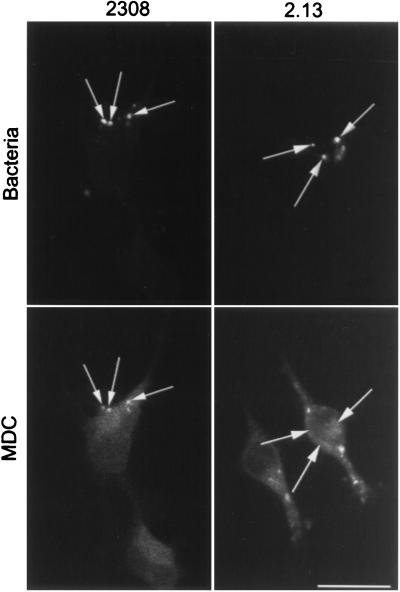
图6。
MDC与含有S2308的吞噬体共定位。 用S2308或S2.13接种HeLa细胞1h,洗涤,然后用去除胎牛血清和谷氨酰胺并补充庆大霉素的细胞培养基进一步培养30min。 然后将单层与MDC(0.05mM)一起孵育30分钟,洗涤,并进行免疫荧光处理。 只有含有S2308(箭头)的囊泡才能大量标记MDC。 棒材,10μm。
最近,Sola-Linda等人( 66 )以第一个为特征 布鲁氏菌属 描述了双组分监管系统,命名为BvrS-BvrR,用于 布鲁氏菌属 毒力相关的感觉蛋白和调节蛋白。 与S2308和S19相比, 黑色 和 bvrR公司 突变株很少侵袭HeLa细胞,并且很快瞄准含有组织蛋白酶D的隔间。 因此,我们通过分析MDC在感染细胞中的分布来研究这些细菌是否能够通过自噬体转运。 如图所示。 6 ,该标记没有标记包含突变菌株2.13或65.21(未显示)的隔间,表明 背景S背景R 突变的布鲁氏菌并没有针对自噬小室,并且证明MDC在 布鲁氏菌属 -含有吞噬体。 第65.21条- bvrR公司 ,包含允许表达 bvrR公司 ,恢复S2308的毒力表型( 66 )以及获取MDC标记的自噬体(未显示)。 我们之前通过双重免疫荧光分析了亲本细菌和突变细菌在腹腔巨噬细胞和HeLa细胞中的细胞内分布( 66 ). 与含有致病性亲本的吞噬体相反 布鲁氏菌属 未与组织蛋白酶D阳性隔间融合的菌株,发现含有S2.13或S65.21突变的液泡在感染1小时后与组织酶D共定位,并在溶酶体中降解,因此遵循与乳胶珠类似的细胞内途径(图。 三 和 4 ).
S2308复制室缺乏溶酶体标记,而S19经历降解。 接种后2小时内,包括毒性和减毒 布鲁氏菌属 菌株似乎遵循相同的细胞内途径,位于自噬体中。 然而,我们之前观察到S19不能在HeLa细胞中繁殖,并且在接种后24小时,大多数S19细菌在溶酶体中降解( 53 ). 我们询问自噬体是细胞内细菌复制发生的最后一个隔室,还是自噬液泡只是强毒布鲁氏菌用来达到其最终细胞内生态位的短暂隔室。 为了解决这个问题,我们研究了在强毒株的指数生长期,即接种后>10小时,S19和S2308在感染的HeLa细胞中的细胞内分布。 我们首先分析了LAMP在 布鲁氏菌属 -包含隔间。 从8小时起,含有S2308的吞噬体将LAMP1排除在外(图。 7 B) 这表明处于指数生长期的细菌可能位于不同于自噬液泡的隔室中,或引起自噬体生化特性的改变。 S2308感染细胞的超微结构分析表明,无法从吞噬体中排除LAMP1的罕见毒力细菌表现出明显的降解迹象,而健康复制细菌位于LAMP1阴性的隔间(图。 8 ). 相反,减弱的S19和细菌降解产物位于LAMP1阳性囊泡中(图。 7 A) ●●●●。 研究LAMP2的分布时,也得到了类似的结果(未显示)。 通过研究溶酶体标记物组织蛋白酶D在含有S19的吞噬体中的分布,证实了S19的降解。 含有S19的隔室逐渐获得酸性水解酶,在接种后12小时,>95%的含有S19的吞噬体对组织蛋白酶D呈阳性(图。 7 B) 从而证实减毒S19与溶酶体相互作用。
图7。
S2308在LAMP1-和组织蛋白酶D阴性隔间中增殖。 用S2308和S19接种HeLa细胞1h,洗涤,然后用庆大霉素细胞培养基进一步培养。 在接种后的不同时间,固定单层并进行双重间接免疫荧光处理。 (A) 接种后24小时,LAMP1(两个左下面板)和组织蛋白酶D(两个右下面板)与指示细菌(上面板)的分布。 (B) 吞噬体中LAMP1(左侧)和组织蛋白酶D(右侧)获取动力学。 S19在接种后24小时(A)后降解,完整的细菌(箭头)和降解产物(箭头)与溶酶体标记LAMP1和组织蛋白酶D共定位。此外,S19逐渐获得组织蛋白酶B(右图)。 S2308能够在LAMP1和组织蛋白酶D阴性隔间(a)中增殖。 从接种后8小时起,LAMP就被排除在含有S2308的吞噬体之外(B,左图)。 在面板B中,数据是两个不同实验的平均值。 按照材料和方法中的描述计算含有LAMP1或组织蛋白酶D的吞噬体的百分比。 棒材,5μm。
图8。
接种后48小时,在LAMP1阳性的隔室中检测到罕见的S2308生物体。 用S2308感染HeLa细胞单层24小时,清洗,并在细胞培养基中用庆大霉素进一步孵育24小时。然后固定单层并进行冷冻切片、免疫标记和电子显微镜分析。 在切片上标记LAMP1,然后标记10-nm-金结合抗体。 显微照片显示两种细菌。右侧的细菌显示降解迹象,其液泡对LAMP1呈阳性反应(箭头)。 相反,左边的健康细菌没有LAMP1。 条形,200 nm。
凶猛的 布鲁氏菌属 在ER中乘以。 Cheville组的几个超微结构研究表明,在Vero细胞中 布鲁氏菌属 在粗略ER的堆栈中乘数( 16 , 17 ). 为了解决这个问题,我们在接种后24小时分析了含有细菌的隔室中ER标记的存在。 sec61β标记出现在位于宿主细胞核周区的S2308复制室中(图。 9 ). 当我们研究ER膜结合凝集素calnexin的分布时也观察到同样的结果( 74 )在S2308感染细胞中(图。 9 ). 有趣的是,由于细胞内大量增殖而爆炸的细胞释放的囊泡中存在的细菌对sec61β呈阳性(未显示),这表明布鲁氏菌和含有这种ER标记的隔间之间存在强烈的相互作用。 虽然布鲁氏菌与核磷蛋白或BiP之间没有明确的共定位,但ER免疫荧光信号在细菌复制发生的核周区域更为强烈(未显示)。
图9:。
S2308在内质网中增殖。HeLa细胞感染S2308 1 h,清洗,并用添加庆大霉素的细胞培养基进一步培养。 接种后24小时,固定细胞并进行双重免疫荧光处理。 增殖细菌位于与sec61β(下面板)和calnexin(上面板)分布相匹配的核周隔室(箭头)。 棒材,5μm。
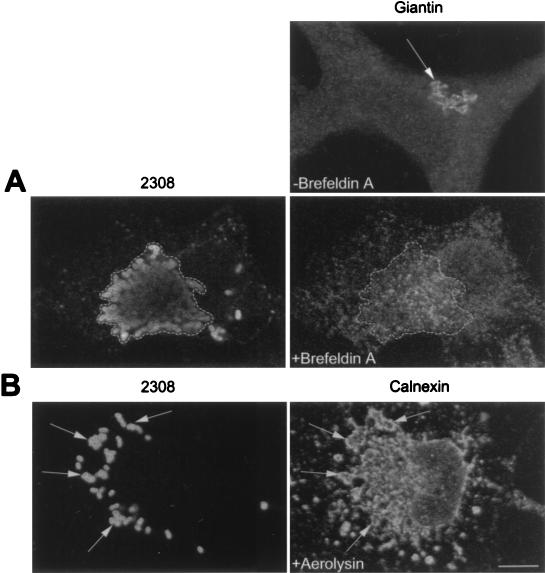
细菌复制发生的细胞内生态位可能具有一些ER标记,但可能不会保留ER的功能特征,或者可能不会被宿主细胞识别为ER。 为了研究这一点,我们接下来利用了真菌代谢物brefeldin A,它能使高尔基成分迅速重新分布到内质网( 39 ). 我们推断,如果 布鲁氏菌属 复制区室保留被识别为ER的能力,布雷菲尔丁A处理应诱导高尔基体标记物与细菌区室的共定位。 用S2308接种细胞1 h,然后在庆大霉素存在下进一步培养24 h。然后用brefeldin a(10μg/ml)处理感染的单层细胞30 min,清洗、固定并用识别高尔基体标记物giantin的抗血清进行免疫荧光处理( 57 ). 如图所示。 10 A、 布雷费尔丁A处理后,高尔基体室重新分配到内质网,并与增殖S2308的细胞内分布紧密匹配,这表明复制室 布鲁氏菌属 保留ER的至少一个功能特征,并且可以被感染细胞识别。 抗rab6血清也获得了类似的结果(未显示)。
图10。
S2308复制室保留了ER的功能特征。用S2308感染细胞1小时,清洗,并在庆大霉素存在下用细胞培养基进一步培养。 接种后24小时,用布雷费尔丁A(10μg/ml)(A)培养细胞30分钟,或用前溶血素(0.38 nM)(B)培养细胞55分钟。 然后固定单层并进行双重间接免疫荧光处理。 (A) 右上角的面板显示了未处理细胞中高尔基体室的分布(由抗凝素抗体检测到[箭头])。 下部面板显示了同一个brefeldin A处理的细胞中giantin(右面板)和S2308(左面板)的分布。 高尔基体重新分布在与细菌分布相匹配的细胞内位置(由虚线分隔的区域定义)。 (B) 前溶血素处理细胞中calnexin(右面板)和S2308(左面板)的分布。 细菌复制室杂乱无章,与液泡状ER共存(箭头所示)。 棒材,5μm。
此外,我们还研究了来自 嗜水气单胞菌 在里面 布鲁氏菌属 -感染细胞。 Abrami等人( 1 )已经证明,在原毒素与BHK细胞上的80-kDa糖基磷脂酰肌醇锚定蛋白结合后,原溶血素被宿主细胞蛋白酶加工成其成熟形式,并创建一个通道,导致内质网的急剧空泡化。 用前溶血素处理的HeLa细胞显示ER的选择性紊乱(图。 10 B) ●●●●。 细菌复制室也呈液泡状,并与calnexin共定位(图。 10 B) ,通过包含S2308的生态位确认保留了功能ER特征。
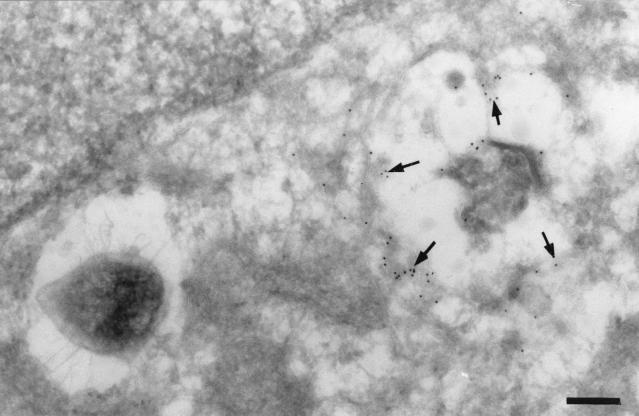
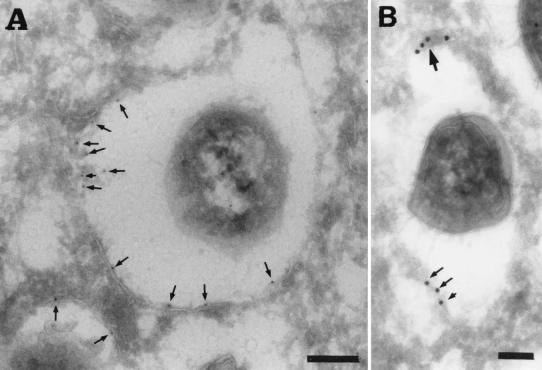
这个 布鲁氏菌属 用免疫电镜对复制室进行了进一步表征。 PDI,一种丰富的内质网蛋白,催化二硫醇氧化和二硫键还原及异构化( 35 ),存在于含有增殖细菌的隔间的膜中(图。 11 )以及与布鲁氏菌相邻的区域。 总之,这些结果证实了先前的研究表明 布鲁氏菌属 在与内质网相关的核周隔室中复制,如sec61β、calnexin和PDI的存在所示,保留内质网的功能特征,如高尔基体在内质网上的重新分布所示 布鲁氏菌属 -用布雷费尔丁A处理后含有隔间,用溶血素处理感染细胞后细菌复制隔间空泡化也证明了这一点。
图11:。
S2308位于PDI-阳性隔间内。 用S2308感染HeLa细胞单层24小时,清洗,并在细胞培养基中用龙胆素进一步孵育24小时。然后固定单层并进行冷冻切片、免疫标记和电子显微镜分析。 切片标记PDI,然后标记10-nm-金结合抗体。 箭头表示与含菌液泡相关的PDI的特定标记。 (A) 条形,200 nm。 (B) 条形,100 nm。
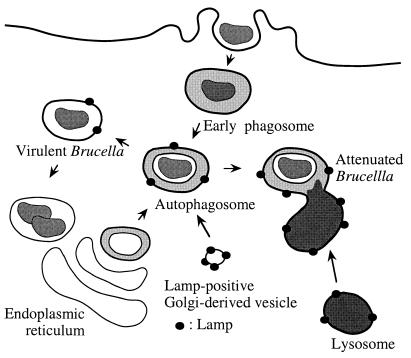
讨论 细胞内寄生虫颠覆吞噬途径是建立适当复制生态位的一般机制。 在本研究中,我们提供的证据表明 B.流产 能够通过首先与早期内体相互作用入侵HeLa细胞; 然后利用宿主细胞的自噬机制,最终定位到内质网,内质网可以定义为细菌增殖室。 模型描述了 布鲁氏菌属 细胞内途径如图所示。 12 .
图12:。
细胞内流量的建议模型 B.流产 在HeLa细胞中。 在入侵后10分钟内,在EEA1阳性的早期隔室中发现了强毒株S2308和弱毒株S19,该隔室能够与来源于内质网的自噬体融合,并富含可能来自转高尔基网络的LAMP分子。S19因此无法抑制其自噬小体的成熟, 与溶酶体融合并导致其降解。 相反,S2308改变了自噬体的成熟途径,并利用逆行运输系统进入内质网,在那里发生大规模复制。
早期关于 B.流产 细胞内流量主要集中在感染期间相对较晚的事件上( 16 , 17 ). 在这项研究中,我们检测了以下细胞内途径 布鲁氏菌属 在入侵后的最初几分钟内。 我们发现,在接种后的第一至10分钟内,细菌获得早期内体标记物,如EEA1,表明 布鲁氏菌属 -含有吞噬体的噬菌体能够与来自HeLa细胞的早期内体相互作用(图。 1 )正如我们之前在小鼠腹腔巨噬细胞中观察到的( 52 ). 细胞内寄生虫与早期内体隔室的相互作用并不罕见。 例如, 结核分枝杆菌 和 禽分枝杆菌 在人类单核细胞来源的巨噬细胞中,吞噬体与早期内体相互作用( 10 , 13 ). 这个 牛分枝杆菌 吞噬体保留早期内吞GTPase rab5,但选择性地排除晚期内吞GTPase rab7,这表明在早期和晚期吞噬体之间的一个阶段,分枝杆菌吞噬体成熟受阻( 75 ). 最近的数据表明 鼠伤寒沙门氏菌 在靶向含Lgp的囊泡之前获得EEA1( 67个 ).
在短暂通过早期内体后, 布鲁氏菌属 ,比如 鼠伤寒沙门氏菌 ( 28 ),绕过晚期内胚体隔室(图。 2 ). 然而,与 沙门氏菌 布鲁氏菌随后位于溶酶体隔室中,其靶向具有自噬小泡特征的隔室(图。 6 ). 自噬是一种广泛使用的维持细胞内环境稳定的途径( 23 ). 为了应对多种细胞条件,细胞器和部分细胞质被隔离在称为新生自噬体的液泡中。 这些液泡与溶酶体融合后获得降解酶,液泡内容物被降解( 23 , 48 ). 基于组织化学和形态学观察,自噬空泡的几种起源被提出,包括内质网、高尔基复合体、质膜、管状溶酶体,以及一种形成自噬体的特殊细胞器,称为吞噬体( 60 ). 尽管这一争议尚未完全解决,但大量证据表明自噬体是由粗面内质网的无核糖体区域形成的( 21 , 22 ). 我们确定了 布鲁氏菌属 -通过几条证据证明吞噬体是自噬体。 首先,自体荧光化合物MDC,它已被证明在自噬液泡中特异性积累( 7 )接种后约2小时与内化细菌共定位(图。 6 ). 其次,ER标记sec61β(但不是核黄素或BiP)也在 布鲁氏菌属 -包含隔间(图。 5 )与LAMP1和LAMP2一起,但不包括组织蛋白酶D(图。 三 和 4 )证实了新生自噬空泡的ER相关起源假说。 然而,Biederbick和合作者( 7 )在对PaTu8902细胞进行亚细胞分离后,无法在MDC标记的空泡中检测到sec61β或易位链相关膜蛋白。 这表明,在自噬空泡形成后,ER标记蛋白可能会迅速消失,或者MDC只在成熟的自噬液泡中积累,其特征是存在溶酶体酶,如溶酶体酸性磷酸酶( 7 ). 因为我们检测到sec61β而不是组织蛋白酶D 布鲁氏菌属 -与自噬体相关,这种差异可以用HeLa细胞中初生和成熟自噬空泡中MDC的积累来解释。 另一种解释可能是 布鲁氏菌属 修改自噬体的性质,使其能够在新生的自噬空泡中存在MDC。 如上所述,其他ER标记如BiP或核黄素的存在 布鲁氏菌属 -未观察到含有吞噬体(图。 5 ). Dunn的研究还表明,免疫电子显微镜检测到,相当大比例的自噬体似乎缺乏粗糙的内质网蛋白,这可能是由于蛋白质从自噬空泡循环到内质网所致( 23 ). 最后,我们之前展示了 B.流产 位于自噬空泡中,并证明自噬抑制剂如3-甲基腺嘌呤可降低细菌产量,而血清饥饿会增加感染水平( 41 , 53 ).
布鲁氏菌从早期内体到自噬体的转运表明了自噬和内吞途径的融合。 尽管这个问题仍有争议( 22 , 36 ),一些研究小组认为,内吞体和吞噬体确实能够与新生的自噬空泡融合( 29 , 54 ). 特别令人感兴趣的是Liou等人的工作( 38 )其中,通过改进冰冻切片技术和对自噬体形成不同阶段的分辨率,已表明内体优先与新生自噬小体融合,而不是与晚期自噬空泡融合。 因此,可以想象 布鲁氏菌属 位于早期隔室的细胞利用内吞和自噬途径之间的衔接与新生的自噬空泡相互作用。 然而,两个区室之间是否发生融合,或者早期吞噬体是否含有 布鲁氏菌属 被新生的自噬体隔离仍有待阐明。
这个 布鲁氏菌属 双组分调节系统BvrS-BvrR已被证明对宿主细胞的侵袭和体内毒力至关重要( 66 ). 在这项工作中,我们还表明 bvrS公司 和 bvrR公司 突变菌株无法通过自噬囊泡转运(图。 6 ),这表明该系统也能够感知细胞内刺激,而进入自噬体是该操纵子在细胞内环境中的功能之一,如补体S65.21- bvrR公司 应变恢复了进入该隔间的能力(未显示)。
一旦布鲁氏菌到达自噬液泡 布鲁氏菌属 -含有吞噬体的细胞似乎无法与内吞小室融合,内吞小体小室中装有新的外源性给药物质。 有几条证据支持这一观点。 首先,已经内化了几个小时的细菌无法通过新内化的BSA-FITC到达( 第51页 ). 第二,细胞内 布鲁氏菌属 能够在细胞外培养基中保持庆大霉素杀菌浓度的实验条件下增殖( 5 , 53 ). 相反,在 李斯特菌属 细菌无法逃逸到细胞质的感染,抗生素被输送到含有寄生虫的吞噬体并被杀死( 20 ).
自噬体的成熟似乎是逐步发生的。 第一步是通过新生的自噬体获得新合成的溶酶体膜相关蛋白。 其次,成熟室的酸化是通过H的加入发生的 + -ATP酶,最后是溶酶体来源的酸性水解酶的传递,可以降解针孔内材料( 23 ). 事实上,Aplin等人( 4 )已有研究表明,诺卡唑治疗会导致缺乏酸性水解酶的酸性自噬体的积累,这支持了液泡酸化和水解酶获得是独立事件的概念。 含有S2308-和S19-的吞噬体在接种后约2小时内出现了LAMP1和LAMP2,但没有组织蛋白酶D,这也支持自噬空泡逐步成熟的模型。
在接种后的后期(24小时),含有S19的噬菌体减弱后获得组织蛋白酶D,表明发生了与溶酶体的融合(图。 7 )提示S19不能控制自噬体成熟。 与这些数据一致,接种后48小时,S19感染细胞中的细菌增殖最小( 53 ),细菌降解产物散布在宿主细胞的细胞质中(图。 7 ). S19是通过自发突变获得的无毒菌株,其唯一已知的遗传缺陷是赤藓糖醇分解代谢基因缺失( 59 ). 毒性降低是由于其不能代谢赤藓糖醇( 67 ). 然而,赤藓糖醇代谢缺陷不太可能是其无法在HeLa细胞中增殖的原因。 由于S19和S2308之间的关键区别似乎是后者对自噬体成熟的抑制,我们认为S19的致病性降低在于其对自噬体中存在的环境刺激(例如酸化)无反应能力 这可能激活毒力基因,以表达重塑自噬体的重要蛋白。 在没有这种应激反应的情况下,酸性水解酶被输送到含有S19的自噬体,细菌被破坏。
自噬体不是S2308的复制室。 如图所示。 7 ,在一个没有LAMP1且没有MDC标记(未显示)的隔间中发现增殖细菌。 相反,sec61β在感染的早期阶段被保留下来,并观察到calnexin标记(图。 9 ),表明 布鲁氏菌属 -包含吞噬体与内质网相互作用,如之前的工作所示( 2 , 16 , 17 , 44 ). The strong labeling of the布鲁氏菌属 抗sec61β和抗alnexin抗体的增殖区室以及抗BiP或抗ibophorin抗体的弱标记可以解释为与特定ER亚区的相互作用。 在内质网中普遍存在的另一种蛋白质PDI被检测到位于内质网的膜上 布鲁氏菌属 增殖室,强调含有S2308的室和ER的相互作用。 brefeldin A诱导细菌周围高尔基复合体的重新分布,以及原溶血素诱导细菌复制室的空泡化,这表明S2308细菌能够与保留内质网功能特性的室相结合。
另一种已知与宿主细胞自噬机制相关的细菌病原体是 嗜肺军团菌 ( 71 ). There are similarities and differences between the invasion strategies of布鲁氏菌属 和 军团菌 .同时 军团菌 通过一个叫做卷曲吞噬作用的过程被内化( 34 ), 布鲁氏菌属 似乎是通过拉链吞噬作用内化的( 53个 ). 在这两种情况下,自噬空泡都与核糖体有关。 斯旺森和伊斯伯格( 71 )注意核糖体的存在 嗜肺军团菌 复制液泡将这种细胞器与自吞噬体区分开来,自吞噬体被认为是由无核糖体的粗糙-ER膜产生的。 在 B.流产 ,与 布鲁氏菌属 -自噬体形成过程中游离核糖体的隔离可能产生含有吞噬体的吞噬体( 23 , 53 ). 斯旺森和伊斯伯格( 71 )建议 军团菌 自噬体起源于内质网直接在已经存在的细胞内细菌周围内陷,第三层膜的缺失被解释为温和的洗涤剂处理造成的伪影。 然而,他们的工作中没有研究早期事件(<1小时) 布鲁氏菌属 , 军团菌 首先内化于早期的内胚体室,能够与已经形成的自噬体相互作用。 第三层膜的缺失可以解释为内体室与新生自噬体的融合。 然而,这种融合是如何实现的,以及细菌是如何最终在双层膜结合的隔间中被发现的,还有待解释。 于 军团菌 brefeldin A治疗感染会导致高尔基复合体在细菌复制室周围的重新分布 布鲁氏菌属 .
协会 布鲁氏菌属 和 军团菌 与宿主一起,内质网可以被解释为病原体获得内质网中合成或转运的代谢物的一种手段。虽然一些实验室适应的菌株在以铵盐为唯一氮源的最小培养基中生长,但其营养需求 布鲁氏菌属 都很复杂( 12 ). 多种氨基酸对生长至关重要,对大蛋白的水解活性非常有限。 因此,与宿主内质网的结合可能是一种利用内质网生物合成酶、其蛋白传导通道或肽转运体增加小肽局部供应的策略( 62 ).
在目前的工作中,我们分析了 布鲁氏菌属 从感染的第一阶段到细菌的复制室,我们首次发现在HeLa细胞中存在特定的细胞内标记 布鲁氏菌属 -含有吞噬体。 进一步的工作应确定使 布鲁氏菌属 利用自噬机制。 寻找毒力因子可能是针对 布鲁氏菌属 以及相关的细胞内病原体。 此外,对这种引人入胜的寄生虫的研究将为理解动物细胞内吞、外吐和自噬之间的联系提供更多的见解。
鸣谢 我们感谢Margaret Lindsay在冷冻切片和电子显微镜分析样品处理方面提供的出色技术援助。 我们感谢Denis Allemand和Jean Jaubert允许我们使用摩纳哥科学中心欧洲科学观测站的共焦显微镜设施。
J.Pizarro-Cerdá得到了国际抗癌联盟ICREET第678号研究金的支持,目前得到了法国国家科学研究中心BDI-PVD奖学金的支持。 A.Solar-Landa由基金会Ramon Areces支持。 这项工作得到了INSERM(Nord-Sod编号4N004B和94NS2)的资助; INSERM、CNRS和LNFCC des Bouches du Rhóne向J.-P.Gorvel和E.Moreno提供的机构拨款; 澳大利亚国家卫生和医学研究委员会向Robert G.Parton拨款(981206); 瑞士国家科学基金会向F.G.van der Goot拨款,CICYT向I.Lopez-GoñI拨款(BIO96-1398-C02-01)。
参考文献
1 Abrami L、Fivaz M、Glauser P-E、Parton R G、van der Goot F G。成孔毒素与GPI锚定蛋白相互作用,导致内质网空泡化。 细胞生物学杂志。 1998; 140:525–540. doi:10.1083/jcb.140.3.525。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
2 Anderson T D,Cheville N F.实验性胎盘炎中流产布鲁氏菌感染滋养层细胞的超微结构形态计量学分析。 细菌复制发生在粗面内质网中。 《美国病理学杂志》。 1986; 124:226–237. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Andrews N W,Whitlow M B.克氏锥虫分泌低pH值下活性溶血素的研究。分子生物化学寄生虫。 1989; 33:249–256. doi:10.1016/0166-6851(89)90086-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
4 Aplin A、Jasionowski T、Tuttle D L、Lenk S E、Dunn W A。细胞骨架元素是形成和成熟自噬空泡所必需的。 细胞生理学杂志。 1992; 152:458–466. doi:10.1002/jcp.1041520304。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
5 Baldwin C L,Winter A J.巨噬细胞和布鲁氏菌。 免疫精液。 1994; 60:363–380. [ 公共医学 ] [ 谷歌学者 ]
6 Beron W,Alvarez-Dominguez C,Mayorga L,Stahl P D.吞噬途径的膜转运。 趋势细胞生物学。 1995年; 5:100–104. doi:10.1016/s0962-8924(00)88958-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
7 Biederbick A、Kern H F、Elsässer H P.单丹酰尸胺(MDC)是自噬空泡的体内特异标记物。 欧洲细胞生物学杂志。 1995年; 66:3–14. [ 公共医学 ] [ 谷歌学者 ]
8 Burkhardt J、Huber L A、Dieplinger H、Blocker A、Griffiths G、Desjardins M。利用双向凝胶电泳深入了解复杂的细胞器吞噬体。 电泳。 1995年; 16:2249–2257. doi:10.1002/elps.11501601357。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9 Chavrier P、Parton R G、Hauri H P、Simons K、Zerial M。低分子量GTP结合蛋白在细胞外和细胞内的定位。 单元格。 1990; 62:317–329. doi:10.1016/0092-8674(90)90369-p。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
10 Clemens D L.结核分枝杆菌吞噬体的特征。 微生物趋势。 1996; 4时13分至118分。 doi:10.1016/0966-842X(96)81528-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
11 Clemens D L,Horwitz M A.结核分枝杆菌吞噬体的特征和吞噬体成熟受到抑制的证据。 《实验医学杂志》,1995年; 181:257–270。 doi:10.1084/jem.181.1.257。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Corbel M J、Brinley-Morgan W J、Brucella Meyer和Shaw属1920、173AL。 收录人:Krieg N R,Holt J C,编辑。 Bergey的系统细菌学手册。 第1卷。 马里兰州巴尔的摩:威廉和威尔金斯公司。; 1984年,第377-388页。 [ 谷歌学者 ]
13 de Chastelier C,Lang T,Thilo L.与含有枯草芽孢杆菌或乳胶珠的吞噬体相比,巨噬细胞内寄生虫鸟分枝杆菌的吞噬作用。 欧洲细胞生物学杂志。 1995年; 第68:167–182页。 [ 公共医学 ] [ 谷歌学者 ]
14 Desjardins M、Celis J E、Meer G V、Dieplinger H、Jahraus A、Griffiths G、Huber L A。吞噬体的分子特性。 生物化学杂志。 1994; 269:32194–32200. [ 公共医学 ] [ 谷歌学者 ]
15 Desjardins M,Huber L,Parton R,Griffiths G。吞噬体的生物发生通过与内吞器的一系列连续相互作用进行。 细胞生物学杂志。 1994; 124:677–688. doi:10.1083/jcb.124.5.677。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
16 Detilleux P G,Deyoe B L,Cheville N F.布鲁氏菌在Vero细胞中的进入和胞内定位:荧光和电子显微镜。 兽医病理学。 1990; 27:317–328. doi:10.1177/030098589002700503。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
17 Detilleux P G,Deyoe B L,Cheville N F.流产布鲁氏菌在体外非吞噬细胞细胞中的穿透和细胞内生长。 感染免疫。 1990; 58:2320–2328. doi:10.1128/iai.58.7.2320-2328.1990年。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
18 Doborowski J M,Sibley L D。弓形虫对哺乳动物细胞的侵袭是由肌动蛋白细胞骨架提供动力的。 单元格。 1996; 84:933–939. doi:10.1016/s0092-8674(00)81071-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 Dramsi S、Lebrun M、Cossart P.单核细胞增生性李斯特菌入侵哺乳动物细胞的分子和遗传决定因素。 当前顶级微生物免疫学。 1996; 209:61–77. doi:10.1007/978-3-642-85216-94。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
20 Drevets D A,Canono B P,Leenen P J M,Campbell P A。庆大霉素杀死细胞内单核细胞增生李斯特菌。 感染免疫。 1994; 62:2222–2228. doi:10.1128/iai.62.6.2222-2228.1994。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
21 Dunn W A.自噬机制的研究:自噬空泡的形成。 细胞生物学杂志。 1990; 110:1923–1933. doi:10.1083/jcb.110.6.1923。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
22 Dunn W A.自噬机制的研究:自噬空泡的成熟。 细胞生物学杂志。 1990; 110:1935-1945年。 doi:10.1083/jcb.110.6.1935。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
23 Dunn W A.自噬和溶酶体介导的蛋白质降解的相关机制。 趋势细胞生物学。 1994; 4:139–143. doi:10.1016/0962-8924(94)90069-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
24 Enright F M.家畜布鲁氏菌感染的发病机制和病理生物学。 In:尼尔森K,邓肯B,编辑。 动物布鲁氏菌病。 佛罗里达州博卡拉顿:CRC出版社。; 1990年,第301-320页。 [ 谷歌学者 ]
25 Finlay B B,Falkow S.重新审视了微生物致病性的常见主题。 微生物分子生物学评论1997; 61:136–169. doi:10.1128/mmbr.61.2.136-169.1997。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
26 Frenchick P J,Markham R J F,Cochrane A H。强毒流产布鲁氏菌可溶性提取物对巨噬细胞吞噬体-溶酶体融合的抑制作用。 美国兽医研究杂志1985; 46:332–335. [ 公共医学 ] [ 谷歌学者 ]
27 Gaillard J L,Berche P,Mounier J,Richard S,Sansonetti P J。单核细胞增生李斯特菌在人肠细胞样细胞系Caco-2中渗透和细胞内生长的体外模型。 感染免疫。 1987; 55:2822–2829. doi:10.1128/iai.55.11.2822-2829.1987。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
28 Garcia-del Portillo F,Finlay B B.将鼠伤寒沙门氏菌靶向含有溶酶体膜糖蛋白的囊泡,绕过含有甘露糖6-磷酸受体的隔室。 细胞生物学杂志。 1995年; 129:81–97. doi:10.1083/jcb.129.1.81。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
29 Gordon P B,Höyvick H,Seglen P O。自噬和内吞之间的溶酶体前体和溶酶体连接。 《生物化学杂志》1992; 283:361–369. doi:10.1042/bj2830361。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
30 Hackstadt T,Rockey D D,Heizen R A,Scidmore M A。沙眼衣原体在高尔基体向质膜的转运过程中阻断了一条外显途径,以获得内源性合成的鞘磷脂。 EMBO J.1996; 15:964–977. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
31 Heizen R A,Scidmore M A,Rockey D D,Hackstadt T。与内吞和外吞途径的差异相互作用区分了贝氏柯克氏菌和沙眼衣原体的寄生液泡。 感染免疫。 1996; 64:796–809. doi:10.1128/iai.64.3.796-809.1996。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 High N,Mounier J,Prévost M-C,Sansonetti P J.福氏志贺氏菌的IpaB导致进入上皮细胞并从吞噬空泡中逃逸。 EMBO J.1992; 11:1991–1999. doi:10.1002/j.1460-2075.1992.tb05253.x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
33 High S、Andersen S S、Gorlich D、Hartmann E、Prehn S、Rapoport T A、Dobberstein B。Sec61β在细胞膜插入期间与新生的I型和II型信号锚蛋白相邻。 细胞生物学杂志。 1993; 121:743–750. doi:10.1083/jcb.121.4.743。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
34 Horwitz M A.军团病细菌(嗜肺军团菌)的吞噬作用是通过一种新的机制发生的:在伪足线圈内吞噬。 单元格。 1984; 36:27–33. doi:10.1016/0092-8674(84)90070-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35 Laboissiere M C,Sturley S L,Raines R T。蛋白质二硫键异构酶的基本功能是解读非天然二硫键。 生物化学杂志。 1995年; 270:28006–28009. doi:10.1074/jbc.270.47.28006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
36 Lawrence B P,Brown W J.自噬空泡与培养肝细胞中预先存在的溶酶体迅速融合。 细胞科学杂志。 1992; 102:515–526. doi:10.1242/jcs.102.3.515。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
37 Liautard J P.专业吞噬细胞与布鲁氏菌属微生物之间的相互作用。 1996; 12:197–206. [ 公共医学 ] [ 谷歌学者 ]
38 Liou W,Geuze H J,Geelen M J H,Slot J W。自噬和内吞途径在新生的自噬液泡处汇合。 细胞生物学杂志。 1997; 136:61–70. doi:10.1083/jcb.136.1.61。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
39 Lippencott-Schwartz J,Yuan L C,Bonifacino J S,Klausner R D。短纤维蛋白A处理的细胞中高尔基体蛋白快速重新分布到内质网:高尔基体细胞膜循环的证据。 1989; 56:801–813. doi:10.1016/0092-8674(89)90685-5。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
40 Marcantonio E E,Amar-Costesec A,Kreibick G.多肽易位装置到含有核糖蛋白和核糖体的内质网区域的分离。 二、。 大鼠肝微粒体亚组分含有等摩尔量的核糖蛋白和核糖体。 细胞生物学杂志。 1984; 99:2254–2259. doi:10.1083/jcb.99.6.2254。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
41 Martys J L,Wjassow C,Gangi D M,Kielian M,McGraw T E,Backer J M.中国仓鼠卵巢细胞中Wortmannin-sensitive贩运途径。 对内吞和溶酶体分选的不同影响。 生物化学杂志。 1996; 271:10953–10962. doi:10.1074/jbc.271.18.10953。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
42 Maurin M、Benoliel A-M、Bongrand P、Raoult D。贝氏柯克斯体感染细胞系的吞噬体在持续感染期间保持酸性pH值。 感染免疫。 1992; 60:5013–5016. doi:10.1128/iai.60.12.5013-5016.1992。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
43 Mayorga L S,Francisco B,Stahl P D。在完整细胞和无细胞系统中新形成的吞噬体与内体的融合。 生物化学杂志。 1991年; 266:6511–6517. [ 公共医学 ] [ 谷歌学者 ]
44 Meador V P,Deyoe B L.牛胎盘中流产布鲁氏菌的细胞内定位。 兽医病理学。 1989; 26:513–515. doi:10.1177/030098588902600609。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
45 Méresse S、Gorvel J-P、Chavrier P。GTPase rab7参与晚期内体和溶酶体之间的运输。 细胞科学杂志。 1995年; 108:3349–3358. doi:10.1242/jcs.108.11.3349。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
46 Méresse S、AndréP、Mishal Z、Barad M、Brun N、Desjardins M、Gorvel J-P。含有rab7的晚期内体隔室的流式细胞术分选和生化表征。 电泳。 1997; 14:2682–2688. doi:10.1002/elps.1150181425。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
47 Moreno E、Stackebrandt E、Dorsch M、Wolters J、Busch M、Mayer H.Brucella abortus 16S rRNA和脂质A揭示了与变形杆菌类α-2亚类成员的系统发育关系。细菌。 1990; 172:3569–3576。 doi:10.1128/jb.172.7.3569-3576.1990。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
48 Mortimore G E、Miotto G、Venerando R、Kadowaki M.Autophagy。 收录人:Lloyd M,Mason J,编辑。 亚细胞生物化学。 27.溶酶体生物学。 纽约,N.Y:Plenum Press; 1996年,第93–135页。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
49 Oh Y K,Swanson J A.吞噬颗粒进入巨噬细胞溶酶体后的不同命运。 细胞生物学杂志。 1996; 132:585–593. doi:10.1083/jcb.132.4.585。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
50 Parsot C,Sansonetti P J.志贺氏菌感染的侵袭和发病机制。 当前顶级微生物免疫学。 1996; 209:25–42. doi:10.1007/978-3642-85216-9_2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
51 Pitt A、Mayorga L S、Stahl P D、Schwartz A L。成熟吞噬体蛋白质组成的变化。 临床投资杂志。 1992; 90:1978–1983. doi:10.1172/JCI116077。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
第51页。 Pizarro-Cerdá,J.和J.-P.Gorvel。 未发布的结果。
52 Pizarro-CerdáJ、Moreno E、Desjardins M、Gorvel J-P。当细胞内病原体侵入细胞生物学和免疫学的前沿时。 组织病理学。 1997; 13:1027–1038. [ 公共医学 ] [ 谷歌学者 ]
53 Pizarro-CerdáJ、Moreno E、Sanguedolce V、Mége J-L、Gorvel J-P。流产毒力布鲁氏菌避免溶酶体融合,并分布在自噬小室中。 感染免疫。 1998; 66:2387–2392. doi:10.1128/iai.66.5.2387-2392.1998。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
53a条。 Pizarro-Cerdá,J.、P.Montcourrier和J.-P.Gorvel。 未发布的结果。
54 Punonen E L、Autio S、Kaija H、Reunanen H。在培养的大鼠成纤维细胞中,自噬空泡与溶酶体前室融合。 欧洲细胞生物学杂志。 1993; 6:54–66. [ 公共医学 ] [ 谷歌学者 ]
55 Rabinovitch M,Veras P S T。亚马逊利什曼原虫和贝氏柯克斯体的共居。 微生物趋势。 1996; 4:158–161. doi:10.1016/0966-842x(96)10027-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
56 Rabinowitz S,Horstmann H,Gordon S,Griffiths G.腹膜巨噬细胞内吞和吞噬溶酶体区室的免疫细胞化学特征。 细胞生物学杂志。 1992; 112:95–112. doi:10.1083/jcb.116.1.95。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
57 Ralston E,Ploug T.培养的骨骼肌小管中的GLUT与转铁蛋白受体分离,并储存在与TGN相关的囊泡中。 细胞科学杂志。 1996; 109:2967–2978. doi:10.1242/jcs.109.13.2967。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
58 Rockey D D,Fischer E R,Hackstadt T.使用荧光和电子显微镜对正在发育的鹦鹉热衣原体包涵体进行时间分析。 感染免疫。 1996; 64:4269–4278. doi:10.1128/iai.64.10.4269-4278.1996。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
59 Sangari F J、Garcia-Lobo J M、Aguero J。流产布鲁氏菌疫苗株S19携带赤藓糖醇分解代谢基因缺失。 FEMS微生物快报。 1994; 121:337–342. doi:10.1111/j.1574-6968.1994.tb07123.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
60 Seglen P.O.对分离肝细胞自噬蛋白降解的调节。 收录人:Glaumann H,Ballard F J,编辑。 溶酶体:它们在蛋白质分解中的作用。 纽约,N.Y:学术出版社。; 1987年,第371-414页。 [ 谷歌学者 ]
61 Shuman H A,Horwitz M A。嗜肺军团菌对单核吞噬细胞的侵袭。 当前顶级微生物免疫学。 1996; 209:99–112. doi:10.1007/978-3-642-85216-96。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
62 Simon S M,Blobel G.内质网中的蛋白质传导通道。 单元格。 1991年; 65:371–380. doi:10.1016/0092-8674(91)90455-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
63 Sinai A P,Joiner K A.安全港:非致病菌液泡的细胞生物学。 微生物年鉴。 1997; 51:415–462. doi:10.1146/annurev.micro.51.1.415。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
64 Sinai A P,Webster P,Joiner K A.宿主细胞内质网和线粒体与弓形虫寄生液泡膜的关联——一种高亲和力相互作用。 细胞科学杂志。 1997; 110:2117–2128. doi:10.1242/jcs.110.17.2117。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
65 Smith L D,Ficht T A.布鲁氏菌的发病机制。 微生物评论。 1990; 17:209–230. doi:10.3109/10408419009105726。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
66 Solar-Landa A、Pizarro-CerdáJ、GrillóM-J、Moreno E、Moriyón I、Blasco J-M、Gorvel J-P、Lopez-GoñI I。流产布鲁氏菌中存在对植物病原体和内共生体起关键作用的双组分调控系统,控制细胞入侵和毒力。 摩尔微生物。 1998; 29:125–138. doi:10.1046/j.1365-2958.1998.00913.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
67 Sperry J A,Robertson D C.通过流产布鲁氏菌中赤藓糖醇分解代谢抑制生长。 细菌杂志。 1975; 124:391–395. doi:10.1212/jb.124.1.391-397.1975。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
67a页。 斯蒂尔·莫蒂默(Steele-Motimer,O.)和B.B.芬利(B.B.Finlay)。 未发布的结果。
68 Storrie B,Desjardins M。溶酶体的生物发生:是一个接吻和奔跑、持续融合和裂变的过程吗? 生物论文。 1996; 18:895–903。 doi:10.1002/bies.950181108。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
69 Sturgill-Koszycki S、Schlesinger P H、Chakraborty P、Haddix P L、Collins H L、Fok A K、Allen R D、Gluck S L、Heuser J、Russell D G。通过排除囊泡质子ATP酶产生的分枝杆菌吞噬体缺乏酸化。 科学。 1994; 263:678–681. doi:10.1126/science.8303277。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
70 Suss-Toby E,Zimmerberg J,Ward G E.弓形虫入侵:寄生液泡由宿主细胞质膜形成,并通过裂变孔收缩。 美国国家科学院院刊,1996年; 93:8413–8418. doi:10.1073/pnas.93.16.8413。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
71 Swanson M S,Isberg R R。嗜肺军团菌与巨噬细胞内质网的关联。 感染免疫。 1995年; 63:3609–3620. doi:10.1128/iai.63.9.3609-3620.1995。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
72 Taraska T、Ward D M、Ajioka R S、Wyrick P B、Davis-Kaplan S R、Davis C H、Kaplan J。晚期衣原体包涵体膜并非来源于内吞途径,宿主蛋白相对不足。 感染免疫。 1996; 64:3713–3727. doi:10.1128/iai.64.9.3713-3727.1996。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
73 Tardieux I、Webster P、Ravesroot J、Boron W、Lunn J A、Heuser J E、Andrews N W。溶酶体招募和融合是锥虫入侵哺乳动物细胞所需的早期事件。 单元格。 1992; 71:1117–1130. doi:10.1016/s0092-8674(05)80061-3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
74 Tatu U,Helenius A.新合成的糖蛋白、钙连蛋白和内质网中常驻伴侣网络之间的相互作用。 细胞生物学杂志。 1997; 136:555–565. doi:10.1083/jcb.136.3555。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
75 Via L E、Deretic D、Ulmer R J、Hible N S、Huber L A、Dereti V。分枝杆菌吞噬体成熟的阻滞是由rab5和rab7控制的阶段之间的囊泡融合阻塞引起的。 生物化学杂志。 1997; 272:13326–13331. doi:10.1074/jbc.272.20.13326。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
76 Vogel J P,Misra L M,Rose M D。BiP/GRP78功能缺失阻碍了酵母分泌蛋白的移位。 细胞生物学杂志。 1990; 110:1885–1895. doi:10.1083/jcb.110.6.1885。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
77 Zavala I、Nava A、Guerra J、Quiros C.布鲁氏菌病。 《美国临床传染病》1994; 8:225–241. [ 公共医学 ] [ 谷歌学者 ]