背景 磷酸化是一种主要的翻译后机制,非常适合于对细胞外信号作出反应,使转录因子活性发生快速变化[ 1 , 2 ]. 在物理或化学应激期间,编码细胞保护性热休克或应激蛋白(HSPs)的基因转录增加。 这种增强表达主要由脊椎动物细胞中的热休克因子1(HSF1)或非脊椎动物细胞的同源因子(HSF)介导。 HSF/HSF1持续存在于细胞中,但仅在细胞受到压力时激活。 人们早就知道HSF/HSF1在应激细胞中过度磷酸化[ 三 - 5 ].
人类HSF1的激活至少分两步进行。 第一步是形成因子同源三聚体,该三聚体能够结合存在于 热休克蛋白 基因,但本质上缺乏转录活性。 在第二步中,这些HSF1同源三聚体被转化为转录活性形式[ 6 - 8 ]. 在暴露于高温的细胞中,观察到HSF1过度磷酸化之前获得了HSEDNA结合活性[ 9 ]. 这一结果表明,过度磷酸化可能在第二激活步骤中发挥调节作用,使因子具有反式激活竞争性。 一些额外的观察结果与HSF1的过度磷酸化是诱导因子转录能力所必需或增强的假设相一致:(i)在这一研究的范围内,导致HSF1活化的所有条件也诱导因子的过度磷酸化度。 (ii)相反,诸如水杨酸盐、吲哚美辛、甲萘醌和过氧化氢等只能触发HSF1激活第一步的化合物也不能促进因子过度磷酸化[ 8 , 10 , 11 ]. (iii)Ser/Thr蛋白激酶抑制剂减少,Ser/Thr磷酸酶抑制剂增强,HSF1活性[ 11 - 17 ]. 对于所研究的抑制剂,发现它们不影响HSF1 DNA结合活性[ 11 ](另请参见[ 18 ]).
迄今为止,还没有对应激诱导的HSF/HSF1磷酸化进行全面分析。 然而,Ser的磷酸化 230 据报道,人类HSF1通过增强其转录能力而促进因子的热激活[ 19 ]. 也有人提出Thr磷酸化 142 人类HSF1的表达可能对因子活性至关重要[ 20 ]. 此外,还鉴定了几个磷酸化抑制因子活性的HSF/HSF1残基[ 9 , 21 - 30 ]. 在人类HSF1中,这些残留物是Ser 303 ,序列号 307 和Ser 363 本研究试图结合系统诱变和物理分析,对热应激细胞中HSF1的磷酸化进行广泛的解释。
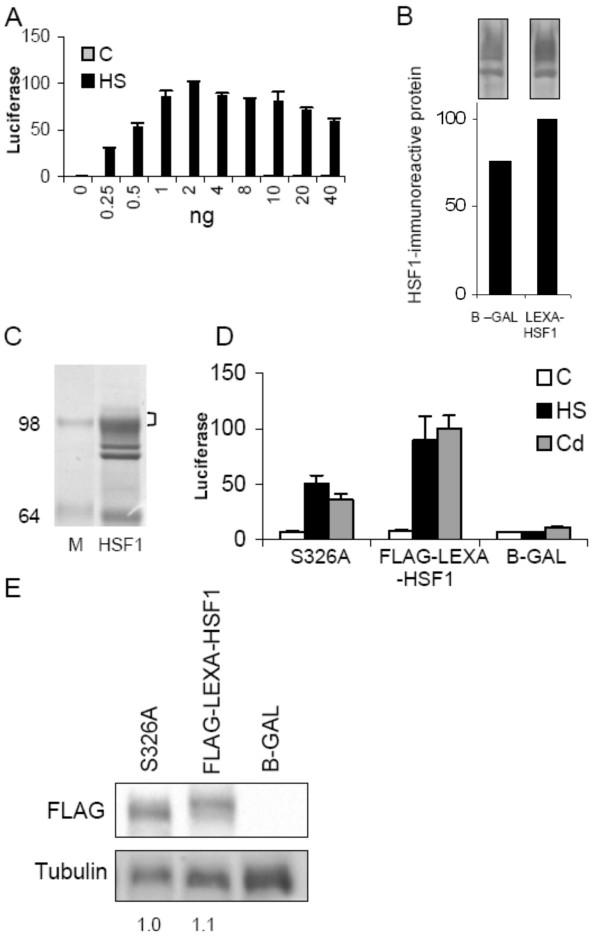
结果 检测HSF1突变体的反式激活试验的验证 在嵌合转录因子LEXA-(人)HSF1中,529残基人HSF1多肽的DNA-结合域(残基1-78)被细菌阻遏物LEXA的DNA结合域(残留物1-87)取代[ 7 ]. 根据以往的研究,LEXA-HSF1的调节类似于HSF1[ 7 ]. 通过双重荧光素酶试验评估LEXA-HSF1的反式激活,该细胞共转染了一个对LEXA-HSF1(LEXA-fLUC)有反应的萤火虫荧光素酶基因,并且组成性表达 雷尼利亚 荧光素酶基因(pRL-TK或pRL-CMV)。 报告者活动表示为萤火虫和 雷尼利亚 荧光素酶活性。 为了能够识别只有轻微功能损伤的LEXA-HSF1突变体,反式激活分析需要敏感地检测转录因子活性的变化。 为了确定在所选实验条件下该分析是否具有这种能力,96个培养物被转染不同数量的表达构建物LEXA-HSF1(图 1安培 ). 当数量低于约2 ng/培养物时,报告活性与转染的表达构建物数量成比例增加。 因此,在这些低DNA浓度下,LEXA-HSF1活性的变化肯定反映在报告基因活性的比例变化中。 大多数后续转染是在每96周培养基中使用0.5 ng或更少的表达构建物进行的。 转染0.5 ng构建物LEXA-HSF1后,通过western blot估计HSF1总浓度增加了30%(图 1磅 ). 假设典型的转染效率为20–40%,该结果表明转染细胞平均表达相当数量的LEXA-HSF1和内源性HSF1。 因此,在这些条件下,外源性HSF1形式没有或只有最低程度的过度表达,外源性HSF1形式遇到的调控环境可能与内源性因子暴露的调控环境相似。 这与早期关于HSF1磷酸化的几项研究不同,其中包括我们自己小组的一项研究[ 28 ],其中研究外源性HSF1形式显著过度表达。 这种过度表达的一个已知结果是,在没有应激的情况下,大量外源性因子积累为DNA-结合三聚体[ 7 ]. 在本文所用分析中转染的低水平表达结构中,没有出现这种结果(如图 3A级 ).
图1。
验证使用的反式激活分析、突变S326A的反式活化分析以及分离用于磷酸化分析的FLAG-HSF1 . ( A类 )用报告基因混合物(LEXA-fLUC和pRL-CMV)和0-40 ng LEXA-HSF1共同转染96周培养皿中细胞的反式激活分析。 C: 控制未加热电池; HS:电池在44°C下进行标准热处理30分钟。 ( B )用0.5 ngβ-半乳糖苷酶表达结构(B-GAL)或0.5 ng LEXA-HSF1转染的细胞中HSF1-免疫活性蛋白的相对量。 转染后一天制备的提取物通过抗HSF1蛋白印迹分析。 给出了HSF1信号的量化,如顶部插入部分所示。 请注意,插入物仅显示印迹的相关(扫描)部分,即大约60–100 kD的多肽大小。 HSF1形式出现在代表非特异性信号的单个频带之上的几个紧密间隔的频带。 ( C )含有免疫隔离FLAG-HSF1的考马斯蓝染色凝胶。 M: 分子量为kD的标记如左图所示。 注意,通过平行抗-HSF1蛋白质印迹(未显示),在98kD标记处和下方出现的条带簇被鉴定为HSF1形式。 ( D类 )转染荧光素酶报告基因混合物和表达结构(0.5 ng)共同转染细胞中的HSF1形式对FLAG-LEXA-HSF1替代突变体S326A、亲本FLAG-LEXA-HSF1或B-GAL的活性的比较。转染后一天,细胞暴露于300μM CdCl 2 持续2小时(Cd)或进行标准热处理(HS),或未经处理(C)。 显示了处理后6 h测定的萤火虫荧光素酶相对活性。 ( E类 )在C下分析平行(热处理)培养物的FLAG western blot,比较转染后一天FLAG-LEXA-HSF1突变体S326A和亲本FLAG-LEXA-HSF1的表达水平。 微管蛋白信号被用作负荷控制。 印迹下方的数字表示在FLAG印迹中突变S326A和亲本FLAG-LEXA-HSF1信号的定量比较。
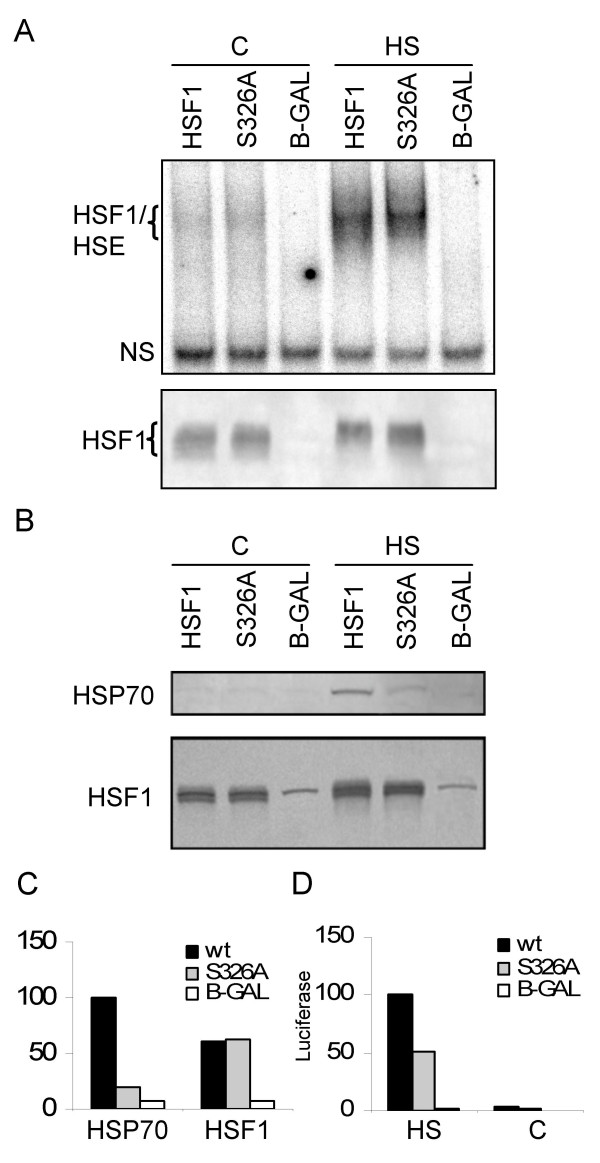
图3。
HSF1阴性小鼠胚胎成纤维细胞的比较分析 . ( A类 )HSF1和HSF1突变体S326A DNA结合能力的比较。 使用HSE DNA探针和热处理或非热处理细胞的提取物进行电泳迁移率变化分析,这些细胞已于一天前转染凝胶顶部所示的结构。 凝胶下方显示了相同样品的抗HSF1蛋白印迹,报告了不同结构HSF1形式的相对表达水平。 HSF1/HSE:HSF1-DNA复合物; NS:非特异性信号,用作未加热细胞样品组的负荷控制,以及独立用于热处理细胞样品组; HS:43°C热处理30分钟; C: 未经热处理。 ( B )热诱导内源性反式激活 热休克蛋白70 用少量上述印迹所示的构建体和荧光素酶报告基因HSP70fLUC和pRL-CMV转染的细胞中的基因。 转染后一天,培养物要么未经处理(C),要么在43°C下热处理30分钟(HS)。 在37°C下进一步培养6小时后制备提取物,并用于蛋白质印迹。 顶部印迹用识别HSP70的抗体探测,而底部印迹用HSF1抗体探测。 底部印迹显示突变型和野生型HSF1形式积累到类似水平。 注意,在所有通道中都存在弱非特异性信号,该信号恰好与转染的HSF1形式共同迁移。 ( C )B.数据的定量比较( D类 )对B中HSP70进行分析的相同提取物中的相对荧光素酶报告活性。本图显示了几个独立实验之一的代表性结果。
LEXA-HSF1的丙氨酸扫描 制备LEXA-HSF1或FLAG-LEXA-HSF1的替代突变体(FLAG-tagged-LEXA-HSF1),其共同覆盖LEXA-HSSF1中HSF1序列的所有92个Ser、Thr和Tyr残基。 进行反激活分析以比较突变因子和亲本因子在暴露于44°C/30分钟热处理或未经热处理的细胞中的转录增强能力。 值得注意的是,这种热处理只导致最小的细胞死亡。 结果表明,大多数突变体保留了各自亲本因子的强热诱导性(表 1 ). 9个突变体(突出显示)的诱导活性比亲本因子低两个以上的平均标准偏差(2×10.3%)。 其中5个突变体仅轻度受损,但4个突变体S326A/T328A、T400A/S(403/404)A、S(457/458/461)A和T511A/S513A活性显著降低。 突变体S326A/T328A和T511A/S513A表达到正常水平。 然而,突变体T400A/S(403/404)A积累到明显较低的水平,突变体S(457/458/461)A被蛋白质水解切割(western blot数据未显示)。 这些结果表明,残基326、328、511和/或513的磷酸化可能在热应激激活HSF1中起重要作用。 突变株S(303/307)A和S307A分别约为150%和50%,比热处理细胞中的亲本因子更活跃(表 1 ).
表1。
构造 相对荧光素酶
C 标准偏差 高速 标准偏差
LEXA-HSF1公司 0.50 0.1 100 13.5
LEXA-HSF1(F) 0.32 0.1 100 6.3
T97A型 0.83 0.3 122 5
T120A/S121A(F) 0.59 0.1 115 4.7
S123A/T124A型 0.65 0.6 95 6.6
S127A型 0.50 0 84 5.1
S136A/T138A(F) 0.23 0.1 112 11.6
T142A(F)型 0.22 0 83 11
S156A(法语) 0.29 0 102 6.1
南(174/195/199) 0.30 0 105 8.2
S216A型 0.52 0.1 77 10.5
S218A(F) 0.31 0 117 9.5
S221A(F) 0.64 0.4 70 8.3
Y225A/S(226/230)A(F) 0.39 0 92 5.8
S(237/241/244)A/Y240A 0.54 0.1 126 6.4
Y247A/S(248/249)A(F) 0.72 0.1 127 2.2
S(250/251)A/Y253(F) 1.21 0.3 99 16.6
南(260/261)甲 0.84 0.2 119 19.1
S266A/T269A(F) 0.95 0.3 83 11.8
S275A型 1.05 0.3 75 5.5
第279页 0.51 0 103 24.7
S290A型 0.32 0 101 13.5
S291A型 1.43 0.4 80 4.1
S292A型 1.47 0.6 84 3.1
S303A系列 0.97 0.3 81 13.9
S307A(F) 0.36 0 148 33.7
南(303/307)甲(女) 1.27 0.5 249 16.9
S314A(F) 0.34 0 131 18.3
S(319/320)A/T323A型 0.83 0.2 78 10.8
S326A/T328A型 2.15 1 46 1.9
S333A(F) 0.37 0 103 9.3
S338A(F) 0.51 0.1 88 10.1
S344A(F) 0.47 0.1 101 13.4
T346A(F) 0.60 0.1 108 15
T349A(F) 0.35 0.1 95 12.6
T(355/357)A(F) 0.34 0 129 12.6
S(363/368)A/T(367/369)A(F) 1.05 0.6 92 14.4
S375A型 2.13 1.9 73 13.6
S385A(F) 0.57 0.1 121 5.7
S393A型 1.38 0.6 83 14.9
T400A/S(403/404)甲(甲) 0.57 0.2 63 2.9
T411A/S412A(F) 0.57 0 85 6.3
S(419/421)A/T423A(F) 0.48 0 101 6.7
428A系列 0.88 0.1 75 9.6
S(434/435/438)甲 1.39 0.1 81 12.9
S444A系列 1.27 0.2 88 13.2
南(457/458/461)甲(女) 0.49 0.1 7 0.3
Y468A/T469A型 2.12 1.9 103 16.6
S(480/485)A/T483A 0.47 0.1 80 4
S(498/501)A/Y499A 1.08 0.1 80 9.2
T511A/S513A(F) 0.44 0.1 22 1
T516A/S518A(F) 0.87 0.1 78 8.1
T527A/S529A 1.14 0.2 91 4.6
S121A型 1.73 0.2 106 12.1
S230A型 1.64 0.3 101 22.7
S319A系列 0.60 0.1 105 14.3
S320A型 0.36 0.1 91 12.8
T323A型 1.97 0.5 102 17.6
S326A型 1.66 0.3 40 8.1
S419A系列 1.67 0.2 104 17.8
热处理细胞分离的HSF1中磷酸化的残基 在第一系列实验中,前一天转染表达结构FLAG-HSF1的培养物与 32 人事军官 4 然后在44°C下热处理45分钟。 使用抗FLAG树脂免疫沉淀外源性HSF1。 在染色的高分辨率Tris-Tricine SDS-PAGE凝胶中(图 1摄氏度 )免疫分离的HSF1表现为两个尖锐的条带和一个迁移较慢的扩散区域,其中包含最高度磷酸化的形式(也有最强烈的放射性标记;数据未显示)。 来自后一区域的蛋白质(参见图中的括号 1摄氏度 )进行胰蛋白酶或胰蛋白酶/糜蛋白酶消化。 磷酸肽通过HPLC分离,通过质谱(MALDI-MS)初步鉴定,并通过常规和/或放射化学测序确认。 在随后的实验中,采用串联质谱法(LC/MS/MS)分析未标记、纯化的FLAG标记HSF1中的肽,这些肽用胰蛋白酶、胰蛋白酶/糜蛋白酶或内蛋白酶Glu-C或AspN消化。 这些分析结果明确鉴定了HSF1序列第121、230*、292、303*、307*、314、319、326、344、363*、419和444位的磷丝氨酸(表 2 ; * 之前报告的站点)。 未发现磷酸化的Thr或Tyr残基。 该分析涵盖了>90%的HSF1序列。 没有获得关于残基176–184、202–206、225–227、241–256、270–284和427–432的信息。
表2。
肽 N个 磷残渣 挖掘。
VEEA公司 pS公司 PGRP公司 pS公司 S公司 虚拟磁盘 T型 陆上通信线 pS公司 PTALIDSILR公司 4 314, 319, 326 事务处理。
VKEEPP公司 pS公司 PPQ(购买力平价) pS公司 公共关系 2 303, 307 事务处理。
GHTDTEGRPP公司 pS公司 PPP公司 TST公司 北京 三 363 事务处理。
VVHIEQGGLVKPERDD公司 T型 EFQHPCFLR公司 1 (97) 事务处理。
GHTDTEGRPP公司 pS公司 PPP公司 TST公司 北京* 2 363 事务处理。
VKEEPP公司 pS公司 PPQ(购买力平价) pS公司 公关* 2 303, 307 事务处理。
质量保证基金 pS公司 LEHVHGSGPY公司* 1 230 事务处理。
VEEA公司 pS公司 PGRP公司 pS公司 SVDTLL公司 pS公司 PTALIDSILR公司* 三 314, 319, 326 Trp、Chytrp。
VEEASPAGRPSSVDTLL公司 pS公司 P(P) T型 ALIDSILR公司 2 326 Trp、Chytrp。
VEEA公司 pS公司 PGRPSSVDTLL公司 pS公司 松土 2 314, 326 Trp、Chytrp。
VKEEPP公司 pS公司 PPQSPR公司 1 303 Trp、Chytrp。
GHTDTEGRPP公司 pS公司 PPPTSTPEK公司 2 363 Trp、Chytrp。
千伏特 pS公司 VSTLKS公司 1 121 Trp、Chytrp。
PLSS公司 pS公司 PLVR公司 1 292 Trp、Chytrp。
pS公司 LEHVHGSGPY公司
1 230 Trp、Chytrp。
DARGHTDTEGRPP公司 pS公司 PPPTSTPEKCLSVACL公司 2 363 天冬氨酸
DERPL公司 不锈钢 pS公司 PLVRVK公司 2 292 天冬氨酸
DLF公司 pS公司 PSVTVP公司 1 419 天冬氨酸
DSSLASIQELL公司 pS公司 PQEPPRPPEAENSSP公司 1 444 AspN蛋白
DTLL公司 pS公司 PTALI公司 1 326 天冬氨酸
PASVTALTDARGHTDTEGRPP公司 pS公司 PPPTSTPE公司 1 363 谷氨酸-C
陆上通信线 pS公司 PQEPPRPPEAEN公司 1 444 谷氨酸-C
国家环保总局 pS公司 VTALTDARGHTDTE公司 1 344 谷氨酸-C
A类 pS公司 PGRPSSVDTLL程序 pS公司 PTALID公司 2 314, 326 谷氨酸-C
低频 pS公司 PSVTVPD(虚拟专用数据库) 1 419 谷氨酸-C
HSF1残基Ser的磷酸化 326 根据上述丙氨酸扫描结果,HSF1残基326、328、511和/或513被认为是调控磷酸化的潜在位点。 这些残留物中只有Ser 326 在热休克细胞的HSF1中发现磷酸化。 在早期的丙氨酸扫描中,并非所有通过质谱和/或测序确定为磷酸化目标的残基都被单独替换。 为了排除磷酸化残基的取代效应以某种方式被掩盖或以其他方式被调节的可能性(在Ser 326 )利用同一突变体中存在的其他取代基,制备单个取代基,并在反式激活试验中进行检测。 除S326A取代外,磷酸化丝氨酸的所有取代都显示出与母体因子相当的热诱导活性(表 1 ,底部)。 S326A替代物的活性仅为母体因子的40%左右(个别实验中为35-55%)。 测试是否替换Ser 326 S326A突变体不仅受到热诱导活性的影响,还受到化学诱导的HSF1活性的影响 2 .CdCl诱导 2 被发现与热诱导损伤相似(图 一维 ). 注意,如图所示的抗FLAG蛋白印迹所示,这种活性降低的表型并不是由于突变体积累水平降低所致 1E级 对整个S326A编码序列进行核苷酸测序,证实其不包含任何额外突变。 此外,在单独的诱变实验中获得的突变体S326A的第二个拷贝与原始拷贝具有类似的应激诱导活性受损。
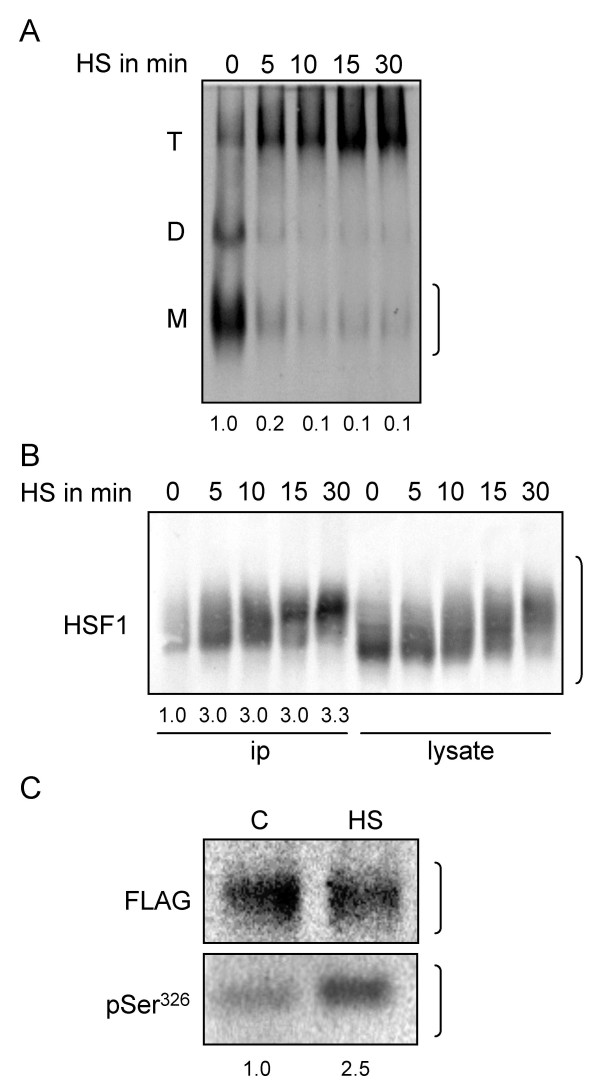
HSF1残基Ser的快速磷酸化 326 在热应激期间 磷酸肽抗体(以下称为pSer 326 抗体)的制备用于特异性监测Ser的磷酸化 326 HSF1的整体磷酸化(即所有可用位点的磷酸化)和Ser的特定磷酸化的热诱导率 326 在图中所示的实验中,对因子齐聚和因子齐聚进行了比较 2 (面板A和B)。 培养物要么未经热处理,要么在44°C下热处理5、10、15或30分钟。HSF1三聚化通过天然抗HSF1印迹进行评估。 从单体形式消失后可以看出,大多数HSF1在热处理5分钟内已经或正在变成低聚物(图 2安培 ). 用于检查整体和序列号 326 -特异性磷酸化,使用pSer免疫沉淀HSF1 326 抗体。 免疫沉淀HSF1(图 2B型 用抗HSF1 western blot检测提取物(“裂解物”通道)中的HSF1和HSF1。 为了更好地解析不同的HSF1物种,继续电泳,直到50 kDa标记迁移到凝胶末端(图中仅显示了包含HSF1形式的区域,即大约70 kD的蛋白质大小 2B型 ). 结果表明,非应激细胞中含有少量HSF1,可以通过pSer免疫沉淀 326 抗体(“ip”,第一道)。 注意,正如预期的那样,最快速迁移的免疫沉淀HSF1形式比提取物中存在的最快物种慢(比较0分钟“ip”和“裂解物”通道)。 细胞热处理后,pSer从提取物中沉淀的HSF1数量 326 抗体增加了约3倍(见“ip”通道下方的定量)。 仅经过5分钟的热处理,这种增加就基本完成了。 从快速迁移到缓慢迁移的HSF1物种的转变所揭示的整体磷酸化发生得更慢,并在整个30分钟的热处理过程中持续(“裂解物”通道)。 pSer也观察到缓慢迁移物种的类似逐渐转移 326 -包含HSF1物种(“ip”车道)。 因此,热处理似乎导致Ser的磷酸化水平显著增加 326 这种磷酸化的增加与因子寡聚反应发生的速度一样快,并先于大多数其他位点的磷酸化。
图2。
热诱导HSF1寡聚和磷酸化 ( A类 )天然抗HSF1印迹显示内源性HSF1在44°C(HS)下热处理的时间内发生热诱导齐聚反应。 T: HSF1三聚体; D: 异二聚体; M: 单体。 ( B )本文采用与A中用于HSF1寡聚化分析的培养物平行的培养物来检测全局或序列 326 -内源性HSF1的特异性磷酸化。 所示的抗HSF1蛋白印迹报告了不同表观大小(反映不同磷酸化水平)的HSF1形式在提取物样品(裂解物)或由pSer从相同提取物中免疫沉淀的蛋白质中的分布 326 抗体(ip)。 所示的印迹部分仅显示大于约70kD的蛋白质信号。 ( C )热诱导Ser磷酸化的检测 326 使用抗pSer的western blot 326 抗体。 用少量FLAG-HSF1转染平行培养物。 一天后,培养物要么未经处理(C),要么在44°C(HS)下热处理30分钟,然后在热处理后立即进行蛋白质印迹处理。 抗pSer 326 丝氨酸诱导的blot报告 326 通过加热磷酸化和平行的抗FLAG印迹显示,在抗pSer中比较了相似量的FLAG-HSF1 326 污点。 密度测定数据显示在斑点下方。 印迹一侧的括号表示扫描区域的长度。 在A中,单体信号被量化。
热诱导Ser磷酸化 326 第二次实验证实,HSF1在Ser 326 被抗pSer检测到 326 western印迹。 由于抗体的亲和力低,HSF1需要在western blot之前进行富集。 用少量表达构建物FLAG-HSF1转染大培养物(100 mm平板中)。 一天后,一半培养物在44°C下热处理30分钟,并使用抗FLAG树脂对标记的HSF1进行免疫沉淀。 然后使用pSer通过western blot分析免疫隔离材料 326 和FLAG抗体(图 2摄氏度 ). 从热处理和未处理的细胞中回收FLAG-HSF1的效果相当(顶部的抗FLAG印迹)。 与pSer反应的热处理细胞中的因子比未经热处理的细胞中的大得多(2.5倍) 326 抗体。
Ser的磷酸化 326 特别增强HSF1交易激活能力 检查Ser替代的影响 326 在其他野生型HSF1背景中,使用McMillan等人之前制备的HSF1阴性小鼠细胞系[ 31 ]. 在转染HSF1、取代突变体S326A(在野生型HSF1而非LEXA-HSF1背景中)和对照蛋白β-半乳糖苷酶的表达构建体一天后进行分析。 首先,我们检测了Ser的磷酸化 326 影响了HSF1激活的第一步,这一步涉及HSE DNA结合活动的获取和核定位。 电泳迁移率变化分析表明,野生型HSF1和突变型S326A的HSE DNA结合活性被热诱导到相似的水平(图 3A级 ). 通过细胞提取物的标准分级和抗HSF1蛋白印迹分析细胞核定位。 热处理细胞的核部分中存在相当数量的野生型HSF1和突变型S326A(数据未显示)。 因此,Ser的磷酸化 326 不影响HSF1激活的第一步。 为了探索第二个激活步骤,即获得反式激活能力,HSF1-阴性细胞与上述表达结构以及报告结构HSP70-fLUC和rLUC共同转染。 培养物要么未经处理,要么在43°C下热处理30分钟,然后再培养6小时。 通过内源性HSP70的western blot来评估反激活能力(图 三 面板B和C)和荧光素酶分析(图 三维 ). 与表达野生型HSF1的细胞相比,表达HSF1 S326A突变的细胞中内源性HSP70的热诱导表达减少了80%。 转染荧光素酶报告子减少50%。 HSP70和荧光素酶之间RNA/蛋白质稳定性的差异可能解释了对HSP70表达的更大影响。
讨论 本研究首次尝试以综合的方式检测暴露于应激状态的细胞中HSF1的磷酸化。 尽管HSF/HSF1在暴露于各种应激事件的细胞中被激活,但为了能够完成彻底的分析,我们决定关注细胞中HSF1的磷酸化,以应对单一类型的应激,即热应激。 我们的研究在人类HSF1中鉴定了12个丝氨酸残基,这些残基在热应激细胞中被磷酸化。 其中八个残基代表以前未知的磷酸化位点,即Ser 121 ,序列号 292 ,序列号 314 ,序列号 319 ,序列号 326 ,序列号 344 ,序列号 419 和Ser 444 .之前发现磷酸化的所有残基的磷酸化 体内 ,即Ser 230 ,序列号 303 ,序列号 307 和Ser 363 ,已确认。 Thr无磷酸化 142 或观察到任何其他Thr或Tyr残留。
由于无法预测各种磷酸化事件对人类HSF1激活的重要性, 我们努力确保本研究中使用的基本反式激活分析能够报告HSF1突变体的活性甚至相对轻微的损伤,并在与内源性因子所遇到的条件差异尽可能小的条件下检查外源性HSF1形式。 尽管HSF1缺陷小鼠细胞可用,并在随后的实验中使用,但我们的最初目标是鉴定人类细胞中功能缺陷的人类HSF1突变体。 因此,在LEXA-HSF1背景下制备了突变体,使我们能够在含有内源性HSF1的细胞中测试突变的效果。 由于过度磷酸化预计会影响HSF1转录能力,而不是HSE DNA结合能力,因此使用与HSF1相同的HSF1形式,除了替代的DNA结合域外,似乎是合理的。 由于明显的原因,当需要建立检测条件时,活性受损的HSF1突变体不可用。 在没有这种突变的情况下,确定了检测条件,在该条件下,报告活性与转染的LEXA-HSF1表达构建物的数量成比例增加。 在所选条件下,外源性HSF1(即LEXA-HSF1)与内源性HSF1在可比水平上表达。 因此,这些条件也满足了我们的第二个标准,即在与内源性HSF1相似的细胞内情况下检测外源性HSF1。 先前的观察表明,外源性HSF1在无应激条件下实质性过度表达是三聚体和DNA结合的,而内源性HSF1则不是三聚体,在相同条件下是DNA结合的[ 7 ]. 在本研究中使用的反式激活分析中,外源性HSF1在没有应激的情况下没有特异性结合DNA。
本研究中使用的反式激活分析与早期研究中使用分析之间的上述差异为观察到的突变株S(303/307)a和S307A表型差异提供了一个现成的解释。 我们实验室在之前的一项研究中对后一种替代物(也在LEXA-HSF1背景中)进行了检测,发现它们在没有应激的情况下是活跃的[ 28 ](另请参见[ 9 , 23 , 25 ]). 在这项早期的研究中,HSF1形式实质上过度表达,导致在没有应激的情况下同源三聚体因子的积累。 因此,这些实验只能评估突变对HSF1转录能力的影响。 当使用本研究的检测方法进行检测时,外源性HSF1形式的检测寡聚化受到调节 307 和Ser 303 /序号 307 如果突变只影响HSF1的反式激活能力,而不影响寡聚化,那么在没有胁迫的情况下,替换可能是不活跃的。 如表所示 1 ,观察到了这一预期结果。 然而,在热应激细胞中 307 和Ser 303 /序号 307 替代超过了母因子的活性。 这一发现与Ser磷酸化的作用一致 303 和Ser 307 在热应激期间或更可能在应激恢复期间HSF1活性下调。 其他人之前已经提出过这样的角色(例如[ 23 , 27 , 32 ]). 与这一假设相一致的是,在从脉冲标记的细胞中分离的HSF1的胰蛋白酶消化物中 32 人事军官 4 在44°C/45分钟的热处理过程中,肽297–309是放射性标记最强的肽之一(未显示)。 这一发现暗示Ser的磷酸化 303 和/或序列号 307 发生在热处理过程中。 Hietakangas等人最近证实 303 使用识别pSer的磷酸肽抗体通过western blot实验诱导磷酸化 303 [ 33 ]. 作为Ser 303 磷酸化可能需要事先磷酸化Ser 307 [ 23 ],Ser磷酸化 307 也可能是热诱导的。
本研究鉴定了HSF1残基Ser 326 在热应激激活因子的过程中作为调节磷酸化的主要靶点。 荧光素酶报告物分析表明 326 导致HSF1的热诱导活性至少加倍。 以内源性HSP70为终点的反式激活分析表明,HSF1活性的增强转化为HSP70积累的五倍增加。 虽然我们的研究没有解决这个问题,但似乎观察到的HSP70表达的五倍增强可能是由Ser磷酸化引起的 326 在生理上很重要。 先前的一项研究表明,热诱导HSP70表达的五到八倍受损导致受影响的小鼠胚胎成纤维细胞的耐热性显著降低[ 34 ]. Ser的磷酸化 326 对暴露于CdCl应激的细胞中诱导的HSF1活性也有显著作用 2 .
我们的分析表明,单独地,在热处理细胞中被鉴定为磷酸化的其他残基的磷酸化没有显著促进HSF1活性。 有人认为,可能需要对其中几个残基进行磷酸化才能产生明显的检测效果。 尽管这种可能性没有被彻底检查,但包括或不包括S326A替代的几种替代组合通过反式激活试验进行了测试(数据未显示)。 这些实验未能发现磷酸化对除Ser以外的残基的功能性影响的证据 326 令人费解的是,HSF1在许多残基上磷酸化(例如,Ser 121 ,序列号 230 ,序列号 292 ,序列号 314 ,序列号 319 ,序列号 344 ,序列号 419 和Ser 444 )其磷酸化似乎不影响因子活性。 不能正式排除这种可能性,即由于外源性和内源性HSF1磷酸化的差异,其中一些残基的磷酸化可能反映出伪影。 更合理的解释可能是,这种磷酸化可能与本研究未测试的条件有关。 这些条件可能包括用于激活HSF1的不同类型的应力或不同水平的应力。 它们甚至可能与使用的反式激活分析的差异有关,这可能导致对HSF1激活的不同方面进行优先评估。 后一种解释可能适用于Ser的磷酸化 230 以前有报道通过热应激激活HSF1[ 19 ]. HSF1不仅反式激活HSP基因,还参与调节几个重要的信号通路(例如[ 35 - 38 ]). Ser残基的磷酸化对HSP表达的调节似乎是无偿的,可能影响HSF1与这些其他途径的成分的相互作用并改变其活性。
与早期工作一致,热应激诱导HSF1快速三聚体化。 Ser磷酸化的实质性增强 326 这是由热应激引起的,发生在相似的时间框架内。 这种快速的Ser磷酸化速率 326 与对HSF1热应激激活至关重要的磷酸化事件的预期相符。 可通过其对凝胶流动性的影响来监测的大多数其他磷酸化事件发生得较慢。 因此,这些后期事件中的一些可能需要事先磷酸化Ser 326 然而,这种磷酸化至少有一部分是独立于Ser而发生的 326 通过观察突变株S326A的热诱导SDS-PAGE迁移率变化(数据未显示),建议进行磷酸化。
本研究提供了证据表明,Ser的磷酸化 326 刺激HSF1的转录增强活性,但不刺激其DNA结合活性。 这种磷酸化如何导致HSF1转录活性的增加尚待阐明。 Ser替代的观察 326 由于天冬氨酸和谷氨酸均未再现磷酸化对因子活性的影响(数据未显示),这表明该机制并非基于简单的电荷排斥。 也许,Ser的磷酸化 326 诱导局部构象变化,影响伴侣复合物或另一调节蛋白与附近调控域的结合,已知调控域参与抑制转录活性[ 6 ]. 或者,pSer 326 可能是未知共激活物结合位点的一个关键方面。 磷酸化丝氨酸的蛋白激酶的鉴定 326 在热应激细胞中,有助于确定残基的磷酸化水平是否受到积极调节,如果是这样的话,还有助于确定应激诱导的机制。 不幸的是,搜索Ser 326 使用NetPhosp程序嵌入蛋白激酶位点[ 39 ]没有提供任何关于候选蛋白激酶的有用信息。
结论 本文涉及人类HSF1的调节,HSF1是介导人类细胞对物理和化学应激的转录反应的关键因子,也是其他重要信号通路(例如[ 35 - 38 ]). HSF1甚至被发现可以调节衰老和与年龄相关的疾病[ 40 , 41 ]. 为了更好地描述细胞通过短暂上调HSP基因表达来应对各种应激的机制, 了解HSF1的磷酸化在多大程度上调节这些反应,以及发现HSF1本身的磷酸化/去磷酸化是如何受应激调节的,这将是很重要的。 此外,可以预期,对HSF1调节性磷酸化的彻底了解将提高我们对该因子与其他途径相互作用的控制因素以及可能的控制因素的认识, 通过最终鉴定参与HSF1磷酸化和去磷酸化的调节蛋白激酶和磷酸酶,从而确定与其他调节系统的新联系。 本研究代表了对这些更大目标的初步贡献。 我们对热应激细胞中HSF1磷酸化的系统分析确定了12个磷酸化Ser残基,其中8个之前未知。 突变和功能实验表明,新鉴定的磷酸化Ser 326 在HSF1转录活性的热激活中起着重要作用,这一事实证明,取代该残基可将HSP70的积累减少几倍。 Ser代换的表型 303 和Ser 307 观察到,这与之前提出的HSF1失活中这些残基磷酸化的功能一致。 虽然在本研究中没有其他磷丝氨酸的功能作用的证据, 了解热活化HSF1中磷酸化的大多数或所有残基的身份,将大大有助于进一步指导实验,以测试其磷酸化在HSF1参与的各种过程和相互作用中的潜在重要性。 不能排除的是,通过使用不同的反式激活分析,可以发现后一种磷在HSF1活性的热调节中的功能,但在本研究中未被检测到。
方法 抗体 磷酸酶 326 -制备了针对肽CSVDTLLpSTAL的特异性兔多克隆抗体。 抗血清在固定化磷酸化肽和非磷酸化肽上进行了正亲和性和负亲和性纯化。 对于免疫沉淀,使用Seize初级免疫沉淀试剂盒(Pierce)将纯化抗体交联到树脂。 HSF1抗血清来自StressGen Biotechnologies; FLAG抗体M5、FLAG树脂M2和微管蛋白抗体来自Sigma; HSP70抗体4G4来自亲和生物试剂。 小鼠单克隆抗体4G4是针对人类Hsp70的抗体,也能识别小鼠Hsp70。 抗体信号通过化学荧光检测,并在分子动力学风暴系统上进行定量。
细胞培养 Hela-CAT细胞[ 42 ]保持在37°C和5%CO 2 在含有10%胎牛血清、100U/ml青霉素和100μg/ml链霉素的DMEM中。 如McMillan等人所述,HSF1阴性小鼠胚胎成纤维细胞在补充的DMEM中生长[ 31 ].
表达结构和定点突变 将编码完整(人类)HSF1(残基1-529)、LEXA-HSF1(包含LEXA残基1-87和人类HSF1残基79-529)和氨基末端FLAG标记衍生物的序列亚克隆到pcDNA3.1(+)(Invitrogen)中,将这些序列置于CMV启动子的控制下[ 7 ]. 这些结构分别命名为HSF1、LEXA-HSF1、FLAG-HSF1和FLAG-LEXA-HSF1。 对于丙氨酸扫描,使用LEXA-HSF1和FLAG-LEXA-HSF1作为QuikChange的模板 R(右) 定点突变(Stratagene指导手册)。 互补引物对用Ala密码子替换单个或多个Ser、Thr或Tyr密码子。 通过限制性分析、兔网织红细胞裂解物转录和翻译系统(T7-Quick TNT系统,Promega)中的表达和核苷酸序列分析,对潜在突变基因进行了表征。 使用相同的方法,还将几个突变引入HSF1的构建中。 所用的β-半乳糖苷酶表达结构(B-GAL)为pcDNA3.1/His/LacZ(Invitrogen)。
转活化分析 报告器构造LEXA fLUC已在前面进行了描述[ 42 ]. 报告基因HSP70-fLUC是通过将人类HSP70B基因的启动子和RNA先导序列亚克隆到含有萤火虫荧光素酶基因的质粒中获得的。 包含构造性表达的 雷尼利亚 荧光素酶基因(pRL-TK,pRL-CMV)来自Promega。 使用Lipofectamine 2000(Gibco)的快速转染方案转染96周培养板中的培养物。 通常,每个孔在25μl Opti-MEM中接受0.75–1.0μl Lipofectamine 2000,在25μl Opti-MEM中接受DNA主混合物(88.25 ng),该混合物由80 ng LEXA fLUC或HSP70 fLUC、0.25 ng pRL Tk或0.1 ng pRL CMV、0.1–0.5 ng LEXA-HSF1或HSF1(或突变体)组成 随后添加100μl DMEM中的80000个细胞。 通常,转染分三次进行。 将转染细胞培养16–20小时,在44°C下热处理30分钟(除非另有说明),或不进行热处理,并在6–7小时后收获。 为了表达萤火虫荧光素酶和回收萤火虫萤光素酶,优化了热处理和细胞收获之间的时间长度 雷尼利亚 荧光素酶活性。 使用双荧光素酶试剂盒(Promega)和Stratec平板光度计测量荧光素素酶活性。 通常,荧光素酶活性测定是一式三份的。
电泳迁移率变化分析 根据制造商的说明,用Lipofectamine PLUS、25 ng HSF1或突变HSF1表达构建体和2.975μg B-GAL在100 mm直径的细胞中转染,培养24小时,然后进行热处理或不处理。 PBS洗涤的细胞再次悬浮在缓冲液C中(20 mM Hepes,pH7.9,0.42 M NaCl,1.5 mM MgCl 2 ,0.2 mM EDTA,0.5 mM二硫苏糖醇,“完全”蛋白酶抑制剂鸡尾酒(罗氏),25%甘油)。 提取物通过三个快速冷冻和解冻循环以及离心澄清制备。 同样的方案也用于制备天然凝胶电泳用提取物。 立即使用提取物或将提取物储存在-70°C下。 电泳迁移率变化分析基本上如前所述进行[ 7 ]. 使用分子动力学磷光体成像仪对信号进行检测和量化。
亚细胞分离 如前一节所述转染细胞。 根据制造商的协议,使用来自皮尔斯的NE-PER核和细胞质提取试剂进行分馏。 通过以下内源性HSF1(其定位已事先确定)验证了方案的正确操作。
HSF1磷酸肽的分析及磷酸化残基的鉴定 9.0 × 10 6 将32μg FLAG-HSF1表达构建物转染150 mm培养皿中的Hela-CAT细胞。 对于涉及放射性标记磷酸肽分析的实验,转染20小时后,用含5%FCS的25 ml无磷DMEM清洗每个培养物一次,并在相同培养基中培养1小时。 培养基被进一步含有2 mCi 32 正磷酸盐(NEX011,NEN)和细胞在37°C下培养3小时。 在44°C下热处理45分钟后,用冰镇PBS清洗细胞,并在室温下在添加0.5 mM NaV的3 ml Mper缓冲液(Pierce)中孵育15分钟以进行裂解 三 、5 mM NaF、150 mM NaCl、1μM ocadaic acid和“完整”蛋白酶抑制剂鸡尾酒(罗氏)。 去除碎片后,将提取物与80μl FLAG M2树脂在4°C下培养过夜。 用含有150 mM NaCl的Mper缓冲液和仅用Mper缓冲溶液对树脂进行广泛清洗,用120μl 6X SDS-PAGE样品缓冲液洗脱FLAG-HSF1。 Tris-Tricine高分辨率SDS-PAGE凝胶电泳后[ 43 ]FLAG-HSF1经考马斯染色,含有磷酸化程度最高的物种的凝胶块由耶鲁大学凯克基金会生物技术资源实验室(Kenneth Williams)处理,用于蛋白质水解消化、质谱分析、放射化学和正常肽序列测定。 在其他实验中,使用类似的方案制备未标记的纯化FLAG-HSF1。 使用Finnigan LCQ DECA四极离子阱质谱仪上的微柱反相高效液相色谱-纳米电喷雾串联质谱法,在哈佛微化学设施中对这些制剂进行序列分析。
其他方法 对于大多数免疫沉淀和HSF1表达实验,细胞在添加150 mM NaCl和罗氏“完全”蛋白酶抑制剂鸡尾酒的MPer缓冲液中进行裂解。 使用Bradford分析(Bio-Read实验室的蛋白质分析试剂)测量提取物中的蛋白质浓度。 结果用于调整待比较提取物中的蛋白质浓度。
作者的贡献 TG完成了本文介绍的大部分实验工作。 他还准备了所有的桌子,设计了所有的数字。 FB制备了第一组LEXA-HSF1替代突变体。 他还设计了研究中使用的所有寡核苷酸引物,并分析了所有序列信息。 WSL开展或监督了使用LC/MS/MS鉴定HSF1磷酸化残基的所有工作,解释了获得的所有数据,并参考了实验设计。 RV构思了这项研究,参与了其设计和协调,并起草了手稿。 所有作者都阅读并批准了手稿。
致谢 致谢 我们感谢Ivor J.Benjamin提供HSF1缺陷细胞系,感谢Corneliu Sologon提供验证性实验,感谢Guenther Kraus和James Hnatyszyn提供核苷酸测序,感谢Kenneth Williams提供质谱分析。 劳伦斯·博伊西(Lawrence Boise)和詹纳罗·德乌索(Gennaro D'Urso)批判性地阅读了手稿。 这项工作得到了NIH Grant GM31125的支持。
参与者信息 Toumy Guettouche,电子邮件: toumy.guettouche.b@bayer.com。
Frank Boellmann,电子邮件: red_moon_rise@yahoo.com。
William S Lane,电子邮件: hmf@harvard.edu。
Richard Voellmy,电子邮件: hsfpharma@excit.com。
工具书类
Hunter T,Karin M.磷酸化对转录的调节。 单元格。 1992; 70:375–387. doi:10.1016/0092-8674(92)90162-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Hunter T.Signaling–2000年及以后。 单元格。 2000; 100:113–127. doi:10.1016/S0092-8674(00)81688-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Sorger PK,佩勒姆HRB。 酵母热休克因子是一种必需的DNA结合蛋白,具有温度依赖性磷酸化作用。 单元格。 1988; 54:855–864. doi:10.1016/S0092-8674(88)91219-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Sorger PK、Lewis MJ、Pelham HRB。 热休克因子在酵母和HeLa细胞中的调节不同。 自然。 1987; 329:81–84. doi:10.1038/329081a0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Sarge KD,Murphy SP,Morimoto RI。热休克因子1对热休克基因转录的激活涉及寡聚化、DNA结合活性的获得和核定位,并且可以在没有应激的情况下发生。 分子细胞生物学。 1993; 13:1392–1407. doi:10.1128/mcb.13.3.1392。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Green M,Schuetz TJ,Sullivan EK,Kingston RE。调节转录激活域功能的人类HSF1的热休克反应域。 分子细胞生物学。 1995; 15:3354–3362. doi:10.1128/mcb.15.6.3354。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Zuo J,Rungger D,Voellmy R.人类热休克转录因子1的多层调控。 分子细胞生物学。 1995; 15:4319–30. doi:10.1128/mcb.15.8.4319。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Cotto JJ,Kline M,Morimoto RI。热休克因子1 DNA结合的激活先于应激诱导的丝氨酸磷酸化。 多步骤调控途径的证据。 生物化学杂志。 1996; 271:3355–3358. doi:10.1074/jbc.271.7.3355。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Kline MP,Morimoto RI。热休克因子1转录激活域的抑制由组成性磷酸化调节。 分子细胞生物学。 1997; 17:2107–2115. doi:10.1128/mcb.17.4.2107。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Bruce JL、Price BD、Coleman CN、Calderwood SK。氧化损伤快速激活热休克转录因子,但无法增加热休克蛋白水平。 1993年癌症研究; 53:12–15. [ 公共医学 ] [ 谷歌学者 ]
Xia W,Voellmy R.热休克转录因子1的过度磷酸化与活性因子三聚体的转录活性和缓慢解离相关。 生物化学杂志。 1997; 272:4094–4102. doi:10.1074/jbc.272.7.4094。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Chang NT、Huang LE、Liu AYC。 冈田酸显著增强热诱导的hsp70启动子活性。 生物化学杂志。 1993; 268:1436–1439. [ 公共医学 ] [ 谷歌学者 ]
鄂尔多斯G,Lee YJ。 staurosporine对HT-29细胞HSP70热休克基因转录的影响。 生物化学与生物物理研究委员会。 1994; 202:476–483. doi:10.1006/bbrc.1994.1953。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Yamamoto N、Smith NW、Maki A、Berezeski IK、Trump BF。细胞溶质Ca2+和蛋白激酶在hsp70基因诱导中的作用。 《肾脏国际》1994; 45:1093–1104. doi:10.1038/ki.1994.146。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Ohnishi K,Wang X,Takahashi A,Matsumoto H,Ohnishe T。蛋白激酶抑制剂H-7抑制热休克转录因子1的热诱导激活。 摩尔细胞生物化学。 1999年; 197:129–135. doi:10.1023/A:1006937513154。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Baek SH、Lee UY、Park EM、Han MY、Lee YS、Park YM。 蛋白激酶Cdelta在向HSF和HIF-1传递缺氧信号中的作用。 《细胞生理学杂志》。 2001; 188:223–235。 doi:10.1002/jcp.1117。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Park J、Li AY。 JNK磷酸化HSF1转录激活域:JNK在调节热休克反应中的作用。 《细胞生理学杂志》。 2001; 82:326–338. doi:10.1002/jcb.1163。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Fritsch M,Wu C.果蝇热休克转录因子的磷酸化。 细胞应激伴侣。 1999年; 4:102–117. doi:10.1379/1466-1268(1999)004<; 0102:PODHST>; 2.3.CO; 2 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Holmberg CI、Hietakangas V、Mikhailov A、Rantanen JO、Kallio M、Meinander A、Hellman J、Morrice N、MacKintosh C、Morimoto RI、Eriksson JE、Sistonen L.丝氨酸230的磷酸化促进热休克因子1的诱导转录活性。 EMBO J.2001; 20:3800–3810. doi:10.1093/emboj/20.14.3800。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Soncin F、Zhang X、Chu B、Wang X、Asea A、Stevenson MA、Sacks DB、Calderwood SK。热休克因子-1的转录活性和DNA结合涉及CK2对苏氨酸142的磷酸化。 生物化学与生物物理研究委员会。 2003; 303:700–706. doi:10.1016/S0006-291X(03)00398-X。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Hoj A,Jacobsen BK。关闭热休克转录因子所需的短元素:磷酸化增强失活的证据。 EMBO J.1994; 13:2617–2624. doi:10.1002/j.1460-2075.1994.tb06552.x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Mivechi NF,Giaccia AJ。 有丝分裂原激活的蛋白激酶在NIH3T3细胞中充当热休克反应的负调节器。 1995年癌症研究; 55:5512–5519. [ 公共医学 ] [ 谷歌学者 ]
Chu B,Zhong R,Soncin F,Stevenson MA,Calderwood SK。通过糖原合成酶激酶3和蛋白激酶Calpha和Czeta对两个不同的丝氨酸残基进行磷酸化,37℃下热休克因子1的转录活性受到抑制。 生物化学杂志。 1998; 273:18640–18646. doi:10.1074/jbc.273.29.18640。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Chu B,Soncin F,Price BD,Stevenson MA,Calderwood SK。丝裂原活化蛋白激酶和糖原合成酶激酶3的顺序磷酸化抑制热休克因子-1的转录激活。 生物化学杂志。 1996; 271:30847–30857. doi:10.1074/jbc.271.48.30847。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Knauf U,Newton EM,Kyriakis J,Kingston RE。通过磷酸化抑制控制温度下人类热休克因子1的活性。 基因开发1996; 10:2782–2793. doi:10.1101/gad.10.21.2782。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Newton EM、Knauf U、Green M、Kingston RE。人体热休克因子1的调节域足以感知热应激。 分子细胞生物学。 1996; 16:839–846. doi:10.1128/mcb.16.3.839。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
He B、Meng YH、Mivechi NF。糖原合成酶激酶3beta和细胞外信号调节激酶通过促进热休克后转录活性颗粒的消失而使热休克转录因子1失活。 分子细胞生物学。 1998; 18:6624–6633. doi:10.1128/mcb.18.11.6624。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
夏伟,郭毅,维拉波阿N,左J,Voellmy R.通过体内标记因子32P的磷酸肽分析探讨热休克因子HSF1的转录激活。 生物化学杂志。 1998; 273:8749–8755。 doi:10.1074/jbc.273.15.8749。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Dai R,Frejtag W,He B,Zhang Y,Mivechi NF.c-Jun NH2-末端激酶靶向和热休克因子-1磷酸化抑制其转录活性。 生物化学杂志。 2000; 275:18210–18218. doi:10.1074/jbc。 M000958200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Xavier IJ、Mercier PA、McLoughlin CM、Ali A、Woodgett NJR、Ovsenek N.糖原合成酶激酶3beta负调控热休克因子1的DNA结合和转录活性。 生物化学杂志。 2000; 275:29147–29152。 doi:10.1074/jbc。 M002169200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
McMillan DR、Xiao X、Shao L、Graves K、Benjamin IJ。 靶向性破坏热休克转录因子1可消除耐热性和对热诱导凋亡的保护。 生物化学杂志。 1998; 273:7523–7528. doi:10.1074/jbc.273.13.7523。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Wang X、Grammatikakis N、Siganou A、Stevenson MA、Calderwood SK。应激期间细胞外信号调节蛋白激酶1(ERK)、14-3-3ε和热休克因子1之间的相互作用。 生物化学杂志。 2004; 279:49469–49469. doi:10.1074/jbc。 M406059200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Hietakangas V、Ahlskog JK、Jakobsson AM、Hellesuo M、Sahlberg NM、Holmberg CI、Mikhailov A、Palvimo JJ、Pirkkala L、Sistonen L。丝氨酸303的磷酸化是热休克因子1应激诱导SUMO修饰的先决条件。 分子细胞生物学。 2003; 23:2953–2968. doi:10.1128/MCB.23.82953-2968.2003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Huang L,Mivechi NF,Moskophidis D.深入研究体内主要应激诱导的hsp70分子伴侣的调节和功能:对hsp70.1或hsp70.3基因靶向基因断裂小鼠的分析。 分子细胞生物学。 2001; 21:8575–8591. doi:10.1128/MCB.21.24.8575-8591.2001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Xie Y,Zhong R,Chen C,Calderwood SK。热休克因子1包含两个调节C-fos和C-fms基因转录抑制的功能域。 生物化学杂志。 2003; 278:4687–4698. doi:10.1074/jbc。 M210189200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Jones TJ,Li D,Wolf IM,Wadekar SA,Periyasamy S,Sanchez ER。组成型活性热休克因子1增强糖皮质激素受体介导的基因表达。 摩尔内分泌。 2004; 18:509–520. doi:10.1210/me.2003-0366。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Stephanou A,Latchman DS。STAT家族转录因子对热休克蛋白基因的转录调控。 基因表达。 1999年; 7:311–319. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Xie Y,Chen C,Stevenson MA,Auron PE,Calderwood SK。热休克因子1通过与白介素6核因子的物理相互作用抑制白介素-1β基因的转录。 生物化学杂志。 2002; 277:11802–11810. doi:10.1074/jbc。 M109296200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Blom N,Gammeloft S,Brunak S.真核蛋白质磷酸化位点的基于序列和结构的预测。 分子生物学杂志。 1999年; 294:1351–1362. doi:10.1006/jmbi.1999.3310。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Hsu AL,Murphy CT,Kenyon C.DAF-16和热休克因子对衰老和年龄相关疾病的调节。 科学。 2004; 300:1142–1145. doi:10.1126/science.1083701。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Morley JF,Morimoto RI.热休克因子和分子伴侣对秀丽栉孔扇贝寿命的调节。 分子生物学细胞。 2004; 15:657–664. doi:10.1091/mbc。 E03-07-0532。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Guo Y,Guettouche T,Fenna M,Boellmann F,Pratt WB,Toft DO,Smith DF,Voellmy R。多聚丙酮复合物抑制热休克因子1转录活性机制的证据。 生物化学杂志。 2001; 276:45791–45799. doi:10.1074/jbc。 M105931200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Schager H,von Jagow G.Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳用于分离1至100kDa范围内的蛋白质。 分析生物化学。 1987; 166:368–379. doi:10.1016/0003-2697(87)90587-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]