图1。TGF-β1诱导C4-I和HTB-35细胞的上皮-间充质转化(一个–C类). 将人宫颈鳞癌细胞系C-4I和HTB-35细胞培养48 h,并添加10 ng/mL TGF-β1。未经处理的细胞在相同条件下生长并用作对照。实时PCR分析显示,与未经处理的对照组相比,E-cadherin转录水平在第页在TGF-β1刺激的C-4I细胞中<0.01,而在HTB-35中,E-钙粘蛋白mRNA水平的下降在第页< 0.05. 请注意,如qPCR所测,TGF-β1导致两种癌细胞系中的波形蛋白表达显著增加((一个),第页与未经治疗的对照组相比,C-4I细胞和第页HTB-35细胞与未经处理的对照组相比<0.01),并通过Western blot分析证明((B类)20μg总细胞裂解物进行SDS-PAGE,然后进行免疫印迹和化学发光检测;β-肌动蛋白作为负载对照)。实验重复三次,结果相似;实时PCR数据以平均值±SD表示(一个),显示了具有代表性的免疫印迹(B类). 细胞与TGF-β1孵育48小时后,两种细胞系都发生了形态学变化,如相差显微镜所示(C类). TGF-β1处理后C-4I和HTB-35细胞散射增强。
图1。TGF-β1诱导C4-I和HTB-35细胞的上皮-间充质转化(一个–C类). 将人宫颈鳞癌细胞系C-4I和HTB-35细胞培养48 h,并添加10 ng/mL TGF-β1。未经处理的细胞在相同条件下生长并用作对照。实时PCR分析显示,与未经治疗的对照相比,E-钙粘蛋白转录水平在第页在TGF-β1刺激的C-4I细胞中<0.01,而在HTB-35中,E-钙粘蛋白mRNA水平的下降在第页< 0.05. 请注意,如qPCR所测,TGF-β1导致两种癌细胞系中的波形蛋白表达显著增加((一个),第页与未经治疗的对照组相比,C-4I细胞和第页HTB-35细胞与未经处理的对照组相比<0.01),并通过Western blot分析证明((B类)20μg总细胞裂解物进行SDS-PAGE,然后进行免疫印迹和化学发光检测;β-actin作为负荷控制)。实验重复三次,结果相似;实时PCR数据以平均值±SD表示(一个),显示了具有代表性的免疫印迹(B类). 细胞与TGF-β1孵育48小时后,两种细胞系都发生了形态学变化,如相差显微镜所示(C类). TGF-β1处理后C-4I和HTB-35细胞散射增强。
图2。咖啡因(CA)和二甲双胍(Met)对体外C4-I细胞迁移的影响(一个,B类). 将C4-I细胞培养至亚汇合状态,然后在细胞单层上划痕。然后,添加测试化合物(100μM的CA和/或10 mM的Met)培养细胞,并添加/不添加10 ng/mL的TGF-β1培养24小时。对于每个划痕,分别在0小时和24小时通过倒置光学显微镜(德国汉堡奥林巴斯IX-70)获得图像。使用图像J(v1.44;美国马里兰州贝塞斯达国立卫生研究院),移民率被量化为刮痕减少的变化。注意,CA/Met在TGF-β1处理的细胞中引起最大的划痕减少((B类),第页CA/Met与对照组相比<0.01,第页CA/Met vs.Met<0.05,第页<0.05(CA/Met vs.CA)以及TGF-β1未经处理的细胞((B类),第页CA/Met与对照组相比<0.05,第页CA/Met vs.Met<0.05,第页CA/Met与CA的对比<0.05)。所有条形图显示三个实验的平均值,误差条形图表示平均值的标准误差(B类).
图2。咖啡因(CA)和二甲双胍(Met)对体外C4-I细胞迁移的影响(一个,B类). 将C4-I细胞培养至亚汇合状态,然后在细胞单层上划痕。然后,将细胞与加入测试化合物(100μM的CA和/或10mM的Met)和加入/不加入10ng/mL TGF-β1孵育24小时。对于每个划痕,在0小时和24小时通过倒置光学显微镜(Olympus IX-70,Hamburg,Germany)获得图像。使用图像J(v1.44;美国马里兰州贝塞斯达国立卫生研究院),移民率被量化为刮痕减少的变化。注意,CA/Met在TGF-β1处理的细胞中引起最大的划痕减少((B类),第页CA/Met与对照组相比<0.01,第页CA/Met vs.Met<0.05,第页<0.05(CA/Met vs.CA)以及TGF-β1未经处理的细胞((B类),第页CA/Met与对照组相比<0.05,第页CA/Met vs.Met<0.05,第页CA/Met与CA的对比<0.05)。所有条形图显示三个实验的平均值,误差条形图表示平均值的标准误差(B类).
图3。咖啡因(CA)和二甲双胍(Met)对HTB-35细胞体外迁移的影响(一个,B类). 将HTB-35细胞培养至亚汇合状态,然后在细胞单层上制作损伤线。然后,添加受试化合物(100μM的CA和/或10 mM的Met)并添加/不添加10 ng/mL的TGF-β1培养细胞24小时。展示了在用100μM浓度的CA、10 mM Met或这两种化合物处理细胞后,在HTB-35细胞系上进行划痕试验的代表性图像。抓取后0和24小时拍摄图像(一个). CA和/或Met对细胞运动的影响通过伤口愈合试验测定,并在孵育24小时后表现为每次划痕的减少((一个)使用Image J程序分析各创面的变化;图像J v1.44;美国马里兰州贝塞斯达国立卫生研究院)。请注意,Met的影响大于CA((B类),第页<0.05(CA vs.Met)和CA/Met在HTB-35细胞系中((B类),第页<0.05(Met vs.Met/CA)。此处显示的数据来自重复三次的具有代表性的实验,结果类似(一个,B类). 划痕试验的量化表示为平均值±SD(B类).
图3。咖啡因(CA)和二甲双胍(Met)对HTB-35细胞体外迁移的影响(一个,B类). 将HTB-35细胞培养至亚汇合状态,然后在细胞单层上制作损伤线。然后,添加受试化合物(100μM的CA和/或10 mM的Met)并添加/不添加10 ng/mL的TGF-β1培养细胞24小时。展示了在用100μM浓度的CA、10 mM Met或这两种化合物处理细胞后,在HTB-35细胞系上进行划痕试验的代表性图像。抓取后0和24小时拍摄图像(一个). CA和/或Met对细胞运动的影响通过伤口愈合试验测定,并在孵育24小时后表现为每次划痕的减少((一个)使用Image J程序分析各创面的变化;图像J v1.44;美国国立卫生研究院,马里兰州贝塞斯达)。请注意,Met的影响大于CA((B类),第页<0.05(CA vs.Met)和CA/Met在HTB-35细胞系中((B类),第页<0.05(Met vs.Met/CA)。此处显示的数据来自重复三次的具有代表性的实验,结果类似(一个,B类). 划痕试验的量化表示为平均值±SD(B类).
图5。咖啡因(CA)和二甲双胍(Met)对C4-I细胞中调节EMT的转录因子表达的影响。用TGF-β1(10 ng/mL)加CA(100μM)和/或Met(10 mM)处理细胞48小时。同时,将两种细胞系的培养物与受试化合物一起培养,但不添加TGF-β1。关键EMT启动子的表达国民账户体系(一个),ZEB1号机组(B类); 扭转1(C类)和扭转2(D类)通过qPCR在mRNA水平上进行评估。通过western blot检测蜗牛1的蛋白质水平((一个),右侧面板)。如材料和方法中所述,在SDS-PAGE分离细胞裂解物后制备免疫印迹(将20μg总细胞裂解物进行SDS-PAGE,然后进行免疫印迹和化学发光检测,并使用β-肌动蛋白作为蛋白质负载对照)。在TGF-β1刺激的细胞中((一个),左侧面板)和蛋白质量((一个)SNAI)被CA和CA/Met显著下调。Met下调扭转-1表达和CA降低的mRNA扭转2。数据根据标准化GAPDH公司转录本作为参考基因,RNA表达水平用2−ΔΔC类t吨方法(*第页<0.05和**第页与对照组相比<0.01,# 第页<0.05和## 第页与TGF-β1对照组相比<0.01)。条形图代表三个实验的相对平均转录物丰度±SD。结果来自三个独立的实验。
图5。咖啡因(CA)和二甲双胍(Met)对C4-I细胞中调节EMT的转录因子表达的影响。用TGF-β1(10 ng/mL)加CA(100μM)和/或Met(10 mM)处理细胞48小时。同时,将两种细胞系的培养物与受试化合物一起培养,但不添加TGF-β1。关键EMT启动子的表达国民账户体系(一个),ZEB1号机组(B类); 扭转1(C类)和扭转2(D类)通过qPCR在mRNA水平上进行评估。通过western blot检测蜗牛1的蛋白质水平((一个),右侧面板)。按照材料和方法中的描述,在对细胞裂解物进行SDS-PAGE分离后,制备免疫印迹(20μg总细胞裂解物经过SDS-PACE,然后进行免疫印迹和化学发光检测,并使用β-肌动蛋白作为蛋白载量控制)。在TGF-β1刺激的细胞中((一个),左侧面板)和蛋白质量((一个)SNAI)被CA和CA/Met显著下调。Met下调扭转-1表达和CA降低mRNA扭转2。数据根据标准化GAPDH公司转录本作为参考基因,RNA表达水平用2−ΔΔC类t吨方法(*第页<0.05和**第页与对照组相比<0.01,# 第页<0.05和## 第页与TGF-β1对照组相比<0.01)。条形图代表三个实验的相对平均转录物丰度±SD。结果来自三个独立的实验。
图6。咖啡因(CA)和二甲双胍(Met)对明胶酶表达的影响基质金属蛋白酶-9 (一个)和基质金属蛋白酶-2 (C类)和组织抑制剂TIMP-1公司(B类)和TIMP-2型(D类)在C4-I细胞中。将细胞在加入受试化合物(100μM的CA和/或10mM的Met)和加入/不加入10ng/mL TGF-β1的情况下孵育48小时。然后分离和纯化mRNA以进行实时PCR检查。在TGF-β1刺激的细胞中,CA和CA/Met导致mRNA水平下降基质金属蛋白酶-9(第页与对照组相比<0.01),其特定组织抑制剂的mRNA随之增加TIMP-1公司(第页与对照组相比<0.01)。TGF-β1处理细胞与CA/Met的孵育减弱了血管生成分子的表达VEGFA(血管内皮生长因子)(E类). 此处显示的数据重复三次,结果相似,并以平均值±SD表示(B类).
图6。咖啡因(CA)和二甲双胍(Met)对明胶酶表达的影响基质金属蛋白酶-9 (一个)和基质金属蛋白酶-2 (C类)和组织抑制剂TIMP-1公司(B类)和TIMP-2型(D类)在C4-I细胞中。加入测试化合物(100μM的CA和/或10 mM的Met)并加入/不加入10 ng/mL的TGF-β1培养细胞48 h。然后分离和纯化mRNA以进行实时PCR检测。在TGF-β1刺激的细胞中,CA和CA/Met导致mRNA水平下降基质金属蛋白酶-9(第页与对照组相比<0.01),其特定组织抑制剂的mRNA随之增加TIMP-1公司(第页与对照组相比<0.01)。TGF-β1处理细胞与CA/Met的孵育减弱了血管生成分子的表达VEGFA(血管内皮生长因子)(E类). 此处显示的数据重复三次,结果相似,并以平均值±SD表示(B类).
图7。Met抑制HTB-35细胞中间充质标志物Vimentin的表达。用TGF-β1(10 ng/mL)加CA(100μM)和/或Met(10 mM)处理细胞48小时。同时,用测试化合物处理细胞培养物,但不添加TGF-。使用2−ΔΔC类t吨方法(GAPDH公司是一个参考基因)。western blot检测波形蛋白的蛋白水平(右图)。如材料和方法中所述,在SDS-PAGE分离细胞裂解物后制备免疫印迹(对20μg总细胞裂解物进行电泳,使用β-肌动蛋白作为蛋白质负载对照)。在TGF-β1刺激的细胞中,Met单独使用并与CA一起使用可显著降低波形蛋白的转录水平(VIM1型). 误差条表示三份结果(qPCR分析*第页<0.05和**第页与对照组相比<0.01,# 第页<0.05和## 第页与TGF-β1对照组相比<0.01)。
图7。Met抑制HTB-35细胞中间充质标志物波形蛋白的表达。用TGF-β1(10ng/mL)加CA(100μM)和/或Met(10mM)处理细胞48小时。同时,用测试化合物处理细胞培养物,但在不添加TGF-β1的情况下生长。使用2−ΔΔC类t吨方法(GAPDH公司是一个参考基因)。western blot检测波形蛋白的蛋白水平(右图)。按照材料和方法中的描述,在SDS-PAGE分离细胞裂解物后,制备免疫印迹(20μg总细胞裂解物进行电泳,β-actin用作蛋白质负载控制)。在TGF-β1刺激的细胞中,Met单独使用并与CA一起使用可显著降低波形蛋白的转录水平(VIM1型). 误差条表示三份结果(qPCR分析*第页<0.05和**第页与对照组相比<0.01,# 第页<0.05和## 第页与TGF-β1对照组相比<0.01)。
图8。Met在缺氧条件下抑制HTB-35细胞中CAIX的表达。细胞在常压(21%O)下培养2或缺氧(5%O2用CA、Met或这两种化合物进行24小时qPCR分析,以评估HIF-1α在常氧和缺氧条件下的表达(一个). RNA表达HIF1A型用2确定-ΔΔC类t吨方法。mRNA水平HIF1A型缺氧后显著增加((一个),第页与对照组相比<0.01)。相反,Met单独和CA一起下调HIF1A型((B类),第页与Met对照组相比<0.01,第页与CA/Met对照组相比<0.01)。RT-PCR分析显示,低氧时暴露于Met和CA/Met的细胞中CAIX的表达显著降低((C类),HPRT1型是一个参考基因)。此处显示的数据代表了三个具有类似结果的实验(C类).
图8。Met在缺氧条件下抑制HTB-35细胞中CAIX的表达。细胞在常压(21%O)下培养2水平)或缺氧(5%O2用CA、Met或这两种化合物进行24小时qPCR分析,以评估HIF-1α在常氧和缺氧条件下的表达(一个). RNA表达HIF1A型用2确定−ΔΔC类t吨方法。mRNA水平HIF1A型缺氧后显著增加((一个),第页与对照组相比<0.01)。相反,Met单独和CA一起下调HIF1A型((B类),第页与Met对照组相比<0.01,第页与CA/Met对照组相比<0.01)。RT-PCR分析显示,低氧时暴露于Met和CA/Met的细胞中CAIX的表达显著降低((C类),HPRT1型是一个参考基因)。此处显示的数据代表了三个具有类似结果的实验(C类).
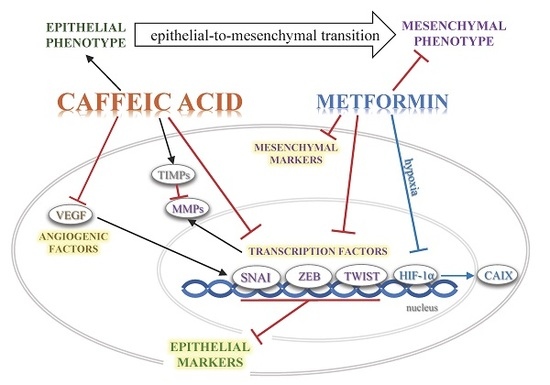
图9。CA和Met在抑制TGF-β1诱导的宫颈癌细胞EMT表型中的作用示意图。(↑-激活,Ⱶ-抑制)。