过度内质网应激与肝脏和脂肪组织线粒体动力学、线粒体吞噬和细胞凋亡受损相关,但与肌肉无关
摘要
1.简介
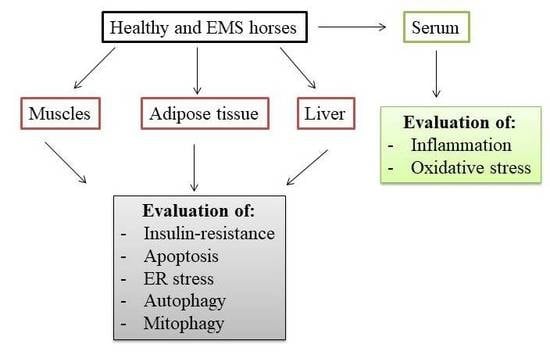
2.结果
2.1. 氧化应激与炎症
2.2. 胰岛素抵抗
2.3. 细胞凋亡
2.4. 内质网应激
2.5. 自噬
2.6。 线粒体和线粒体动力学
3.讨论
4.材料和方法
4.1. 马的选择和EMS诊断
4.2. 肌肉、脂肪和肝脏的采集
4.3. 肌肉、脂肪和肝脏蛋白质的分离
4.4. 西方印迹法
4.5. 酶联免疫吸附试验
4.6. 免疫荧光和透射电镜
4.7. 血清分析中的氧化应激因素
4.8条。 基因表达分析
4.9. 统计
5.结论
致谢
作者贡献
利益冲突
缩写
工具书类
Geor,R.J。; M.E.McCue。; Schultz,N.马代谢综合征表型的当前认识。 J.马兽医。 科学。 2013 , 33 , 841–844. [ 谷歌学者 ] [ 交叉参考 ] Fantuzzi,G.脂肪组织、脂肪因子和炎症。 过敏临床杂志。 免疫学。 2005 , 115 , 911–919. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 辛格,G。; Granger,D.N.,炎症反应是与肥胖和胰岛素抵抗相关的微血管功能障碍的基础。 微循环 2007 , 14 , 375–387. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 塔德罗斯,E.M。; N.弗兰克。; Donnell,R.L.马代谢综合征对马静脉注射脂多糖后炎症反应的影响。 美国兽医协会。 物件。 2013 , 74 , 1010–1019. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Basinska,K。; Marycz,K。; Śmieszek,A。; Nicponán,J.《马代谢综合征威尔士小马皮下脂肪组织中IL-6和TNF-α的产生和分布及其与血清浓度的相关性》。 J.兽医。 科学。 2015 , 16 , 113–120. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] T.A.伯恩斯。; Geor,R.J。; M.C.穆奇。; 麦卡琴,L.J。; Hinchcliff,K.W。; Belknap,J.K.,胰岛素抵抗和胰岛素敏感性轻种马皮下和内脏脂肪组织仓库中促炎细胞因子和趋化因子基因表达谱。 J.兽医。 实习生。 医学。 2010 , 24 , 932–939. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Fujita,T.代谢综合征中的胰岛素抵抗和盐敏感性高血压。 Nephrol公司。 拨号。 移植。 2007 , 22 , 3102–3107. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Tangvarasitichai,S.氧化应激、胰岛素抵抗、血脂异常和2型糖尿病。 世界糖尿病杂志 2015 , 6 , 456–480. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 苏西,H。; Clément,K。; Dugail,I.肥胖中脂肪组织自噬状态:表达和通量——图片的两面。 自噬 2016 , 12 , 588–589. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 美国奥兹坎。; 曹琦。; Yilmaz,E。; 李·A·H。; 北卡罗莱纳州岩口市。; Ozdelen,E。; Tuncman,G。; 哥尔根,C。; Glimcher,L.H。; Hotamisligil,G.S.内质网应激与肥胖、胰岛素作用和2型糖尿病有关。 科学类 2004 , 306 , 457–461. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Cnop,M。; Foufelle,F。; Velloso,L.A.内质网应激、肥胖和糖尿病。 摩尔医学趋势。 2012 , 18 , 59–68. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 萨帕兰塔,J。; García-Macia,M。; Singh,R.自噬和线粒体在肥胖和2型糖尿病中的作用。 货币。 糖尿病评论。 2017 , 13 , 352–369. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] M.E.McCue。; Geor,R.J.公司。; Schultz,N.马代谢综合征:一种受遗传和环境影响的复杂疾病。 J.马兽医。 科学。 2015 , 35 , 367–375. [ 谷歌学者 ] [ 交叉参考 ] VanderJagt,D.J。; 哈里森,J.M。; 拉特利夫,D.M。; 洛杉矶Hunsaker。; Vander Jagt,D.L.IDDM受试者的氧化应激指数,有无长期糖尿病并发症。 临床。 生物化学。 2001 , 34 ,265–270。 [ 谷歌学者 ] [ 交叉参考 ] 马丁·加兰,P。; 卡拉斯科萨,A。; Gussinyé,M。; Domínguez,C.患有或不患有亚临床并发症的年轻糖尿病患者的糖尿病相关氧化应激和抗氧化状态的生物标志物。 自由基。 生物医学。 2003 , 34 , 1563–1574. [ 谷歌学者 ] [ 交叉参考 ] Ogihara,T。; Asano,T。; 安藤,K。; 千叶,Y。; 坂田,H。; 阿奈,M。; Shojima,N。; 小野,H。; Onishi,Y。; Fujishiro,M。; 等。血管紧张素II诱导的胰岛素抵抗与胰岛素信号增强有关。 高血压。 达拉斯德克萨斯州1979 2002 , 40 , 872–879. [ 谷歌学者 ] [ 交叉参考 ] 巴德尔,A.L。; MacLeod,K.M.链脲佐菌素糖尿病大鼠血管平滑肌中诱导型一氧化氮合酶表达和活性的证据。 《药理学杂志》。 实验治疗师。 2001 , 296 , 252–259. [ 谷歌学者 ] [ 公共医学 ] 蒂奇,M。; Lortz,S。; Drinkgern,J。; Lenzen,S.抗氧化酶基因表达与胰岛素生成细胞抗氧化防御状态之间的关系。 糖尿病 1997 , 46 ,1733年至1742年。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Isogawa,A。; 山冈,M。; 亚诺,M。; Shiba,T.血清超氧化物歧化酶活性与代谢综合征成分或颈动脉内膜中层厚度相关。 糖尿病研究临床。 实际。 2009 , 86 , 213–218. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Talior,I。; 雅科尼,M。; 北巴山。; Eldar Finkelman,H.在肥胖、胰岛素抵抗小鼠的脂肪细胞中,葡萄糖摄取的增加促进了氧化应激和PKCδ的激活。 美国生理学杂志。 内分泌。 Metab公司。 2003 , 285 ,E295–E302。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Rudich,A。; Tirosh,A。; Potashnik,R.公司。; Hemi,R。; Kanety,H。; Bashan,N.长期氧化应激损害3T3-L1脂肪细胞中胰岛素诱导的GLUT4易位。 糖尿病 1998 , 47 , 1562–1569. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Nayak,D.U。; 卡门,C。; W.H.弗里希曼。; Vakili,B.A.抗氧化维生素、酶和合成氧衍生自由基清除剂在预防和治疗心血管疾病中的应用。 心脏病。 马里兰州哈格斯敦 2001 , 三 , 28–45. [ 谷歌学者 ] [ 交叉参考 ] Ford,E.S.《美国成年人维生素补充剂使用与糖尿病发病率》。 美国流行病学杂志。 2001 , 153 , 892–897. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Codogno,P。; Meijer,A.J.自噬:肥胖与胰岛素抵抗之间的潜在联系。 单元格元数据。 2010 , 11 , 449–451. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 蒙哥马利,M.K。; Turner,N.线粒体功能障碍和胰岛素抵抗:最新进展。 恩多克。 连接。 2014 , 4 ,R1–R15。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 加泰隆,V。; Gómez-Ambrosi,J。; 罗德里格斯,A。; 拉米雷斯,B。; 安德拉达,P。; Rotellar,F。; 瓦伦蒂,V。; 蒙卡达,R。; 马蒂,P。; 席尔瓦,C。; 等。肥胖患者内脏脂肪组织中S6K1的表达上调,并与胰岛素抵抗和炎症相关。 《糖尿病学报》。 2015 , 52 , 257–266. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Ribel-Madsen,R。; 弗里德里希森,M。; 瓦格,A。; Poulsen,P.双胞胎中的视黄醇结合蛋白4。 糖尿病 2009 , 58 , 54–60. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 陈,C.-H。; 谢天杰。; 林,K.-D。; Lin,H.-Y。; Lee,M.-Y。; 洪,W.-W。; 小平。; Shin,S.-J.未结合视黄醇结合蛋白4浓度增加通过受体介导的信号传导诱导细胞凋亡。 生物学杂志。 化学。 2012 , 287 , 9694–9707. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 米纳米诺,T。; 奥里莫,M。; 清水,I。; Kunieda,T。; 横山由纪夫。; 伊藤,T。; 野岛,A。; Nabetani,A。; Oike,Y。; Matsubara,H。; 等。脂肪组织p53在胰岛素抵抗调节中的关键作用。 自然医学。 2009 , 15 , 1082–1087. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 背面,S.H。; 考夫曼,R.J.内质网应激与2型糖尿病。 每年。 生物化学评论。 2012 , 81 , 767–793. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] M.V.马查多。; Yang,Y。; Diehl,A.M.抑制的好处:IL-13在肝脏葡萄糖稳态中的关键作用。 临床杂志。 投资。 2013 , 123 , 115–117. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] M.E.吉恰尔迪。; Gores,G.J.细胞凋亡:急慢性肝损伤的机制。 肠子 2005 , 54 , 1024–1033. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Sims-Robinson,C。; 贝克曼,A。; Rosko,A。; 格拉瑟,R。; Feldman,E.L.《氧化胆固醇在糖尿病诱导的脑溶酶体功能障碍中的作用》。 摩尔神经生物学。 2016 , 53 , 2287–2296. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 斯科特,I。; Youle,R.J.线粒体分裂与融合。 生物化学论文。 2010 , 47 , 85–98. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Barazzoni,R.调节线粒体分裂以降低糖尿病氧化应激。 糖尿病 2012 , 61 , 1915–1917. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 王,Q。; 张,M。; 托雷斯,G。; Wu,S。; 欧阳,C。; 谢,Z。; Zou,M.-H.二甲双胍通过抑制Drp1介导的线粒体分裂抑制糖尿病加速的动脉粥样硬化。 糖尿病 2017 , 66 , 193–205. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Schuver,A。; N.弗兰克。; 沙梅罗伊,K.A。; Elliott,S.B.通过马的口服糖试验评估胰岛素和葡萄糖动力学。 J.马兽医。 科学。 2014 , 34 , 465–470. [ 谷歌学者 ] [ 交叉参考 ] Marędziak,M。; Marycz,K。; Lewandowski,D。; Siudziñska,A。; Śmieszek,A.静磁场促进马脂肪基质细胞(EqASCs)中富含VEGF和BMP-2的膜源性微泡(MVs)的合成和分泌,这是兽医再生医学的一种新方法。 体外细胞。 开发生物。 阿尼姆。 2015 , 51 , 230–240. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Kornicka,K。; Marycz,K。; 托马谢夫斯基,K.A。; Marędziak,M。; Šmieszek,A.年龄对人脂肪源性基质干细胞(hASCs)成骨和成脂分化潜能的影响以及分化过程中应激因素的影响。 氧化物。 医学细胞。 朗格夫。 2015 , 2015 , 309169. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ]