摘要 K-Cl共转运体KCC2在神经元氯离子调节中起着关键作用。 在成熟的中枢神经元中,KCC2负责低细胞内Cl − 浓度([Cl − ] 我 )形成GABA超极化的基础 A类 受体介导的反应。 在各种生理和病理生理条件下,KCC2功能和表达发生了快速变化。 在这里,我们表明,在急性大鼠海马脑片上应用蛋白质合成抑制剂环己酰亚胺和依米汀对KCC2总蛋白水平和K-Cl协同转运蛋白功能没有影响。 此外,用leupeptin阻断组成溶酶体降解并没有引起KCC2蛋白水平的显著变化。 这些发现表明KCC2总蛋白库的基本周转率较低。 在存在谷氨酸受体激动剂NMDA的情况下,KCC2总蛋白水平在4小时内下降到约30%,这种作用被钙激活蛋白酶钙蛋白酶抑制剂钙肽和MDL-28170阻断。 海马脑片在镁中孵育诱导的类间质活动 2+ -游离溶液导致KCC2介导的Cl快速减少 − CA1锥体神经元的转运效率与总KCC2蛋白和质膜KCC2蛋白的减少平行。 这些作用被钙蛋白酶抑制剂MDL-28170阻断。 综上所述,这些发现表明钙蛋白酶激活导致KCC2断裂,从而调节GABA能信号。
材料和方法 实验得到了赫尔辛基大学当地动物伦理委员会的批准。
药物。 如果没有其他说明,药物来自Tocris Bioscience。
大脑切片。 从出生后第15-20天的雄性Wistar大鼠制备急性400μm横向和冠状海马切片。 在斩首之前,使用氟烷(Sigma)进行麻醉。 快速取出大脑并浸入冰镇蔗糖基切割液中,该切割液含有(单位:m 米 ):87氯化钠,2.5氯化钾,0.5氯化钙 2 ,25氯化钠 三 ,1.25 NaH 2 人事军官 4 ,7氯化镁 2 、50蔗糖和25 d日 -葡萄糖,与95%O平衡 2 和5%CO 2 使用Campden 7000smz振动切片机(Campden Instruments)切割切片。 在实验开始之前,让切片在36°C下在含有(m)的溶液中恢复1 h 米 ):124氯化钠,3氯化钾,2氯化钙 2 ,25氯化钠 三 ,1.1 NaH 2 人事军官 4 ,2 MgSO 4 ,6氯化镁 2 、和10 d日 -葡萄糖,与95%O平衡 2 和5%CO 2 .
为了进行质量控制,将来自特定动物的切片子集并行用于蛋白质分析和电生理记录(见讨论)。
定量免疫印迹。 如上所述制备用于免疫印迹的海马切片。 它们在RIPA缓冲液(150 m 米 氯化钠、1%Triton X-100、0.5%脱氧胆酸、0.1%十二烷基硫酸钠和50 m 米 Tris-Cl,pH 8.0)与蛋白酶抑制剂混合物(完整的Mini-EDTA无蛋白酶抑制剂混合物;罗氏)。 通过SDS-PAGE分离蛋白质。 在含有80 m的SDS-PAGE样品缓冲液中进行加载 米 三重HCl、2%十二烷基硫酸钠、10%甘油、5.3%β-巯基乙醇和2%溴酚蓝。 电泳分离后,蛋白质在含有25 m的转移缓冲液中电泳转移至硝化纤维素膜(PerkinElmer) 米 特里斯,192米 米 甘氨酸和10%甲醇,pH 8.3。 TBST/牛奶中的膜被堵塞(20 m 米 特里斯,150米 米 NaCl、0.1%吐温20和0.5%脱脂干乳(pH 7.5)在室温下放置1小时。 用TBST/牛奶中稀释的相应抗血清在冰箱中搅拌培养过夜。 兔抗人KCC2(1:1000;针对大鼠KCC2的929–1045氨基酸残基饲养; 路德维希等人,2003年 )和兔抗-NTD-KCC2(1:2000;针对大鼠KCC2的氨基酸残基1-93饲养; Blaesse等人,2006年 )用于KCC2和兔抗tubulin(1:2000;Nordic BioSite,目录号PRB-435P),用于神经元III类微管蛋白。
二级抗体,驴抗兔IgG辣根过氧化物酶偶联物(1:3000;GE Healthcare)和山羊抗鼠IgG Horsradish过氧化物酶偶联剂(1:3000,Dako),在室温下在TBST/牛奶中搅拌2–4小时。 使用增强化学发光试剂盒(Pierce)和LAS-3000文件系统(Fujifilm)检测免疫反应性。
通过高级图像数据分析软件(Raytest)或ImageJ对化学发光信号进行量化( http://rsb.info.nih.gov/ij/ ). 所有测量值均在相机灵敏度的线性范围内。 量化后,使用Paint Shop Pro X(Corel)对图中包含的代表性图像进行亮度和对比度优化。
体外 钙蛋白酶裂解试验。
将大鼠脑匀浆稀释至约1-2 mg/ml蛋白质,最终体积为500μl(通过DC蛋白质检测试剂盒进行评估;Bio-Rad)。 在钙蛋白酶分析缓冲液(100 m)中以31.5 U/ml的浓度添加大鼠钙蛋白酶-2(即m-calpain;Calbiochem) 米 HEPES,50米 米 氯化钠,0.1%Triton X-100,20 m 米 氯化钙 2 和20米 米 二硫苏糖醇)。 通过添加0.1,在10、20或30分钟后停止裂解反应 米 EDTA和蛋白酶抑制剂(完整的无EDTA的迷你蛋白酶抑制剂混合物;罗氏)。 在一些实验中,钙蛋白酶-2与100μ 米 MDL-28170浸泡5分钟。
钙蛋白酶激活的离子霉素测定。 直接提高细胞内钙 2+ 浓度([Ca 2+ ] 我 ),用50μ 米 离子霉素(Ascent Scientific),钙 2+ 离子载体,在32°C下放置4小时。用离子霉素和30μ 米 MDL-28170与MDL-2817030预孵育30分钟。
表面表达分析。 最近开发的蛋白酶方法( Khirug等人,2010年 ; Ahmad等人,2011年 )用于分析KCC2的表面表达。 简单地说,用鳕鱼胰蛋白酶(Zmetech)处理横向海马脑片,这种蛋白酶在低温下保持活性,同时阻止膜蛋白的运输。 切片在冰上与鳕鱼胰蛋白酶(2 U/ml)孵育60分钟。 添加胰蛋白酶抑制剂苯甲基磺酰氟(100μ 米 ;冰上5分钟)。 均质后,在6%丙烯酰胺凝胶上分离30μg蛋白质,并如上所述进行免疫印迹分析。
电生理记录。 使用EPC 10放大器和Pulse软件(HEKA),在32°C下对视觉识别的CA1锥体神经元进行细胞贴附和全细胞斑贴记录。 贴片吸管由硼硅酸盐玻璃(哈佛仪器)制成,其电阻范围为4.5至6.5 MΩ。 吸管溶液包括(单位:m 米 ): 30 N个 -甲基- d日 -葡聚糖-HCl、95 K-葡萄糖酸盐、1 EGTA、5 HEPES、10 d日 -葡萄糖、2 Mg-ATP、20蔗糖、0.1 Alexa Fluor 488、2 NaOH和5.4 KOH,pH 7.3。 为了进行记录,将切片放置在浸没式记录室中,并以3.5 ml/min的速度持续灌注含有(m 米 ):124氯化钠,3.5氯化钾,2氯化钙 2 ,25氯化钠 三 ,1.1 NaH 2 人事军官 4 ,2 MgSO 4 、和10 d日 -葡萄糖,与95%O平衡 2 和5%CO 2 pH 7.4。 根据计算的液结电位校正膜电位值( 巴里,1994年 ). 省略镁可诱导类干预活性 2+ 在恢复后和录音期间从细胞外溶液中提取( 安德森等人,1986年 ; Mody等人,1987年 ; Rivera等人,2004年 ). 一些切片在0-Mg条件下未能产生类发作间期活性 2+ 因此,在使用电流灯进行全细胞记录和免疫印迹之前,活性得到了验证 我 =10μ存在时,电池连接模式下的0配置 米 布美他尼和1μ 米 CGP 55845。 在大多数情况下,KCC2介导的Cl − 挤压(见下文)是在0-Mg条件下每片一个细胞中测量的 2+ 条件,当记录两个细胞时,仅在第一个细胞中评估网络活动。 使用WinEDR软件分析峰值频率(英国格拉斯哥斯特拉斯克莱德大学John Dempster博士)。 在使用钙蛋白酶抑制剂MDL-28170的实验中,用30μ 米 MDL-28170在Mg之前完成 2+ 被省略。 暴露于30μ 米 MDL-28170或100μ 米 环己酰亚胺在整个实验中保持不变。 在0.5μ 米 TTX(Ascent Scientific),10μ 米 CNQX(Ascent Scientific),10μ 米 布美他尼和1μ 米 CGP 55845。 密封破裂后,让每个神经元与移液管溶液平衡至少5-10分钟。接受接触电阻稳定在10-20 MΩ之间、静息膜电位低于−55 mV的细胞进行分析。 KCC2介导的Cl的疗效 − 根据Δ量化挤压 E类 GABA公司 ,它被测量为GABA反转电位之间的差值 A类 -介导电流( E类 γ-氨基丁酸 )在胞体和沿顶端树突50μm处( Khirug等人,2010年 ). 将膜电位保持在−50 mV,以减少向外泄漏Cl的驱动力 − 电导并将其对测得Cl的贡献降至最低 − 挤压。 在当前条件下,Cl − 30m荷载 米 将生成 E类 GABA公司 根据Goldman-Hodgkin–Katz电压方程计算得出的−39.5 mV( Farrant和Kaila,2007年 ). 事实上,体细胞的对照测量 E类 GABA公司 得出−40.7±0.41 mV的值( n个 =26),证明体细胞[Cl − ] 我 的CA1锥体神经元被钳制在[Cl − ]移液管。 因此,在这些条件下,枝晶的负偏差 E类 GABA公司 从体值(即Δ E类 GABA公司 )是Cl功效的定量测量 − 挤压( Jarolimek等人,1999年 ; Khirug等人,2005年 ). 体细胞和树突状细胞 E类 GABA公司 通过以5 mV的增量和10 s的步长间隔在不同的保持电位下依次夹紧膜电位,从电流-电压关系中确定值。 在每个电压阶跃开始后50 ms,对笼状GABA进行光解,以激发局部GABA A类 受体介导电流( Khirug等人,2005年 ). 至此,1米 米 通过配备注射器和100μm内径石英针(WPI)的UltraMicroPump II以1–2μl/min的流速输送溶解在细胞外溶液中的DPNI标记GABA,并使用连续发射二极管激光器(Excelsior 375;光谱物理)的375 nm输出进行局部光解。 使用电子快门(AA光电)将激光脉冲的持续时间设置为10 ms,使用LUMPlanFI 60×浸水物镜(Olympus)将~10μm的非老化点聚焦在胞体或50μm以外的顶端树突上。 为了准确测量与躯体的距离,使用贴片吸管对Alexa Fluor 488(生命科技)进行透析,并使用Radiance 2100共焦显微镜(Bio-Rad)追踪树突。
统计分析。 数据呈正态分布时,采用单向方差分析对各组进行比较。 Kruskal–Wallis与Mann–Whitney的单因素方差分析 事后(post-hoc) 如果分布不正常,则使用检验。 使用Statistica(StatSoft)和WinStat(R.Fitch Software)进行统计分析。
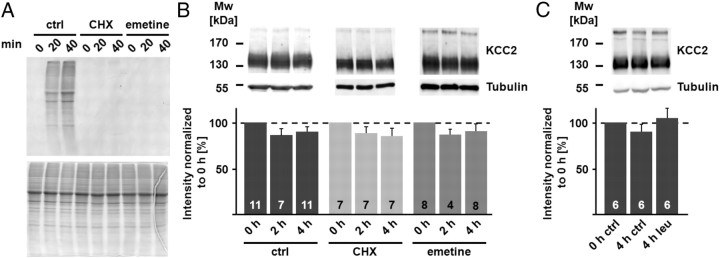
结果 蛋白质合成的总阻滞数小时内不会影响海马脑片中KCC2蛋白水平或功能 在稳态条件下,蛋白质合成速率等于降解速率。 因此,海马脑片暴露于蛋白质合成抑制剂将阻止新KCC2蛋白质分子的合成,之后蛋白质降解率被视为KCC2蛋白质水平的下降。 我们首先在100μ 米 。如所示 图1 A类 ,这两种药物都完全阻止了 35 S-蛋氨酸,展示了快速高效的蛋白质合成阻断。 令人惊讶的是(参见。 Rivera等人,2004年 )KCC2蛋白总量在4 h内没有变化,无论是在对照条件下还是在环己酰亚胺或依米汀存在下( 图1 B类 ;对照组、放线菌酮和依米汀4h后的蛋白质水平:90.3±5.2%、85.3±8.4%和90.6±8.0% n个 = 11, n个 =7,以及 n个 分别=8; 第页 = 0.824). 尽管两种不同的蛋白质合成抑制剂得到了一致的结果,但应该注意的是,环己酰亚胺不仅可以阻止某些蛋白质的合成,还可以阻止某些蛋白的降解( 崔等,2002 ). 因此,我们使用另一种方法来研究KCC2的周转。 膜蛋白主要通过溶酶体途径降解( 派珀和卢西奥,2007年 )leupeptin能有效阻止溶酶体降解,而不影响蛋白质合成( Seglen等人,1979年 ). 在总KCC2蛋白库周转率较高的情况下,不仅在蛋白质合成受阻的情况下KCC2蛋白水平可能下降,而且在蛋白质降解受阻后KCC2也可能增加。 与蛋白质合成抑制剂获得的结果一致,亮肽(50μ 米 )在4小时内未引起KCC2蛋白水平的显著变化( 图1 C类 ;与0小时对照组相比,在leupeptin存在下孵育4小时后KCC2蛋白水平为105.1±10.6%; n个 = 6).
图1。
阻断蛋白质合成不会影响KCC2蛋白水平。 A类 ,应用100μ 米 环己酰亚胺(CHX)或100μ 米 依米汀抑制了[ 35 S] 海马脑片中的蛋氨酸(放射自显影图,上图)。 SDS-PAGE显示装载了类似数量的蛋白质(考马斯染色凝胶,底部)。 B类 、海马脑片匀浆在CHX和依米汀中孵育的免疫印迹。 微管蛋白信号(55 kDa)证实,装载了类似数量的蛋白质。 在蛋白质合成停止后4小时,KCC2信号(~140 kDa)与相应的对照(ctrl)没有显著差异(ctrl:90.3±5.2%;CHX:85.3±8.4%;emetine:90.6±8.0%; 第页 = 0.824). 通过Kruskal–Wallis单因素方差分析(ANOVA)和Mann–Whitney的排名评估统计显著性 事后(post-hoc) 测试。 C类 ,涂抹50μ 米 leupeptin(leu)作用4h后,海马脑片KCC2蛋白水平无明显变化(105.1±10.6%)。 通过单因素方差分析评估统计显著性。 的值 n个 如条形图所示。 误差条表示SEM。
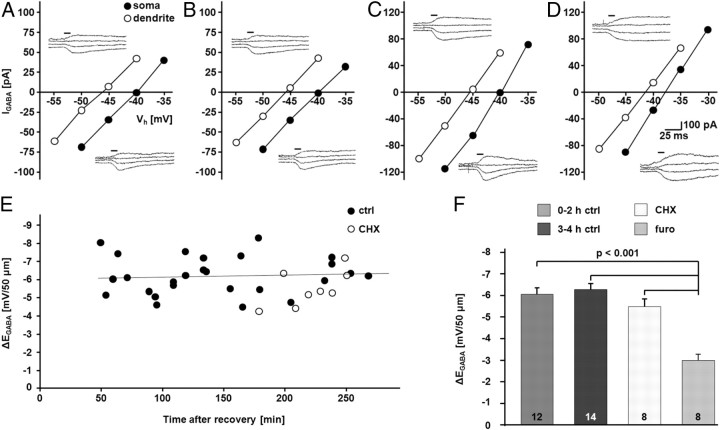
为了研究阻断蛋白合成对功能性KCC2池的影响,我们使用电生理分析测定KCC2介导的Cl − 挤压( Khirug等人,2005年 ; Li等人,2007年 ). 因为在生化分析中,两种蛋白质合成抑制剂的结果相似( 图1 ),我们仅在功能测定中使用环己酰亚胺。 施加定义的体细胞氯 − 通过贴片吸管的负荷可以评估氯的疗效 − 挤压。 如前所示( Khirug等人,2005年 , 2008 , 2010 ; Blaesse等人,2006年 ; Li等人,2007年 ; Gauvane等人,2011年 ),KCC2的功能表达导致[Cl的体脂蛋白梯度 − ] 我 ,可以在中作为梯度测量 E类 GABA公司 体细胞和树突状细胞之间(Δ E类 GABA公司 ). 值得注意的是,Δ的控制水平 E类 GABA公司 在0–4小时的实验时间内保持不变(0–2小时:−6.05±0.31 mV/50μm; n个 =12个单元格; 3-4小时:−6.28±0.28 mV/50μm; n个 =14个单元格)。 而KCC2抑制剂速尿的应用(1.5 m 米 ,连续存在10μ 米 布美他尼; 见材料和方法; Payne等人,2003年 ; Blaesse等人,2009年 )导致Δ显著降低 E类 GABA公司 (0-4小时:−3.03±0.30毫伏/50微米; n个 =8个单元; 第页 <0.001),环己酰亚胺对Δ无影响 E类 GABA公司 在孵育的第四个小时内测量时(−5.52±0.36 mV/50μm; n个 =8个单元; 图2 ).
图2。
阻断蛋白质合成不会影响KCC2功能。 A类 – F类 、无咖啡因诱导的GABA的全细胞、补丁灯记录 A类 -介导电流( 我 GABA公司 )和 E类 GABA公司 在CA1锥体神经元中人工施加体细胞氯 − 负荷显示,CA1区锥体神经元能够产生对呋塞米(furo)敏感的躯体震颤Δ E类 GABA公司 在控制条件下稳定至少4h。 CHX(100μ 米 )未引起Δ变化 E类 GABA公司 . A类 – D类 ,示例 E类 GABA公司 在体细胞和树突顶端50μm处进行记录。 I–V型 曲线基于 我 GABA公司 在不同的保持电位下( V(V) 小时 ). A类 ,0–2小时控制; B类 ,3-4小时控制; C类 ,瑞士; D类 ,愤怒。 由水平条指示的未老化闪光。 E类 ,Δ的散点图 E类 GABA公司 随着时间的推移,在对照组和CHX治疗的CA1神经元中。 该线表示控制单元的线性拟合。 F类 ,Δ的量化 E类 GABA公司 在控制条件下(0–2小时:−6.05±0.31 mV/50μm;3–4小时:–6.28±0.28 mV/50微米),随时间变化显示出稳定的梯度。 Δ E类 GABA公司 不受CHX影响(−5.52±0.36 mV/50μm),但对速尿敏感(0-4小时:−3.03±0.30 mV/50微米; 第页 < 0.001). 实验是在10μ 米 布美他尼。 使用Scheffe’s单因素方差分析评估统计显著性 事后(post-hoc) 测试。 的值 n个 如条形图所示。 误差条表示SEM。
KCC2是钙激活蛋白酶钙蛋白酶的底物 在对照条件下,mRNA翻译的停止对KCC2蛋白水平和功能没有影响,这表明在病理生理条件下,KCC2的快速下降不能仅由KCC2转录和翻译的变化介导。
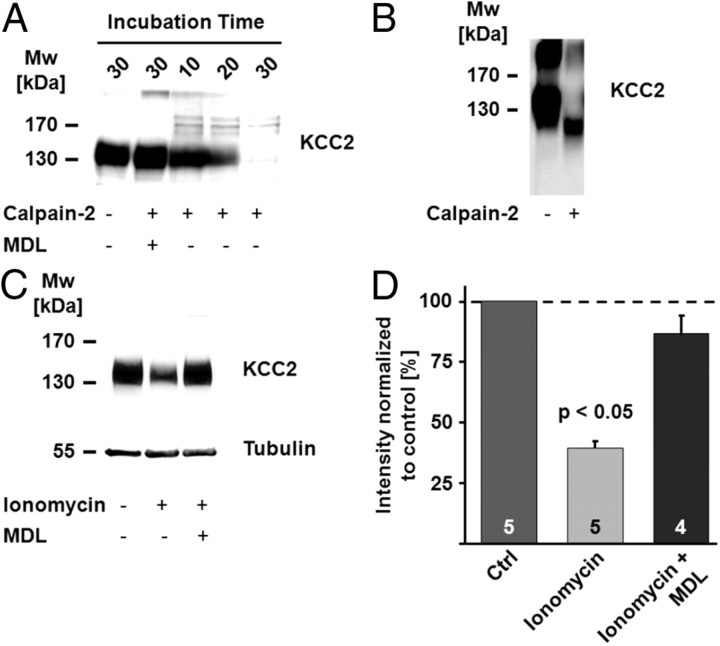
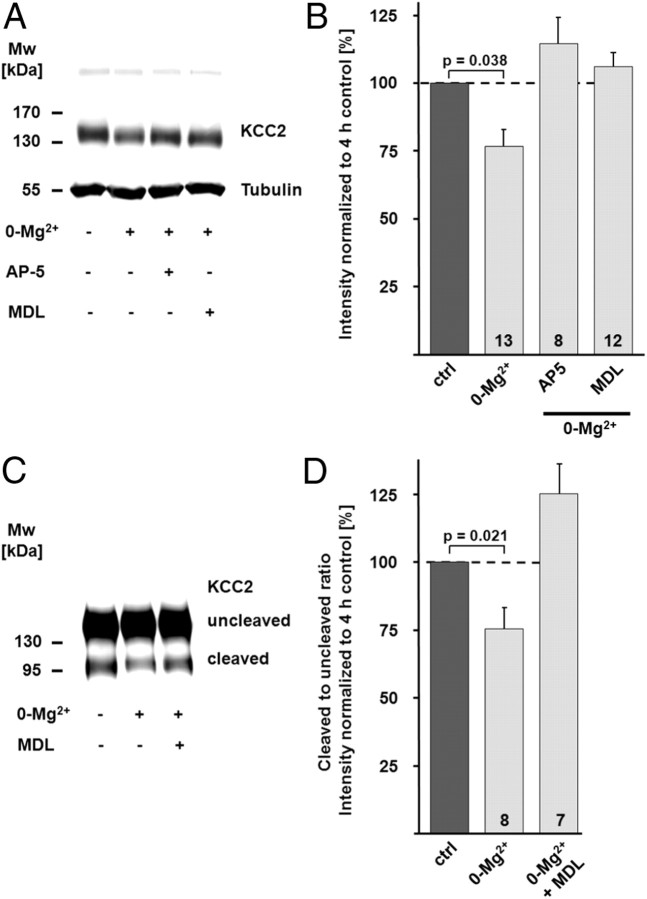
据推测,KCC2序列中已鉴定的两个PEST结构域可能参与蛋白酶如钙蛋白酶对KCC2的调节( Mercado等人,2006年 ). 引人注目的是,当大鼠脑匀浆暴露于31.5 U/ml重组大鼠钙蛋白酶-2达30分钟时,KCC2免疫反应几乎完全丧失( 图3 A类 )钙蛋白酶抑制剂MDL-28170阻断了这种作用。 用于产生抗KCC2抗体的肽覆盖编码PEST结构域的区域。 因此,在~140 kDa时免疫反应信号强度的降低可以通过蛋白质的完全降解或形成表位的区域中离散的钙蛋白酶介导的裂解来解释。 一种针对KCC2 N末端结构域的抗体(抗NTD-KCC2; Blaesse等人,2006年 )检测到一个分子量为~100 kDa的片段( 图3 B类 )表明细胞质C末端结构域(CTD)的大部分被切割。基于已知CTD对KCC2功能的重要性( Mercado等人,2006年 ; Acton等人,2012年 ),截短的蛋白质可能没有作为K-Cl协同转运蛋白的功能。
图3。
KCC2是钙蛋白酶底物。 A类 当大鼠脑匀浆暴露于31.5 U/ml重组大鼠钙蛋白酶-2时,免疫印迹中的KCC2信号降低。 30分钟后观察到KCC2免疫信号几乎完全丢失。钙蛋白酶抑制剂MDL-28170(MDL)阻断了KCC2信号的减少。 B类 ,使用针对KCC2 N末端表位(抗NTD-KCC2)的抗体进行免疫印迹,显示KCC2的截短N末端片段,分子量(Mw)为~100 kDa。 C类 , D类 ,离子霉素触发KCC2蛋白水平下降。 C类 ,在钙存在下孵化脑片 2+ 离子载体离子霉素(50μ 米 ;4 h)导致KCC2蛋白水平明显降低,当离子霉素与MDL-28170联合应用时,这种效果被阻断。 D类 定量免疫印迹信号的平均值显示,离子霉素治疗后KCC2显著降低(39.6±2.6%; 第页 < 0.05). 离子霉素加MDL-28170样品的平均值与对照组无差异(Ctrl;86.6±8.3%; 第页 = 0.477). 使用Scheffe's的单向方差分析评估统计显著性 事后(post-hoc) 测试。 的值 n个 如条形图所示。 误差条表示SEM。
为了测试KCC2是否是神经元中的钙蛋白酶底物,我们在存在离子霉素的情况下培养脑片。 离子霉素触发[Ca的增加 2+ ] 我 通常用于激活钙蛋白酶 在体外 (例如。, Gil Parrado等人,2002年 )和 体内 ( 斯德哥尔摩等人,2005年 ). 大脑切片在50μ 米 4小时后,离子霉素导致KCC2蛋白水平下降( 图3 C类 , D类 ; 39.6 ± 2.6%; n个 = 5; 第页 <0.05),联合应用MDL-28170(86.6±8.3%; n个 = 4).
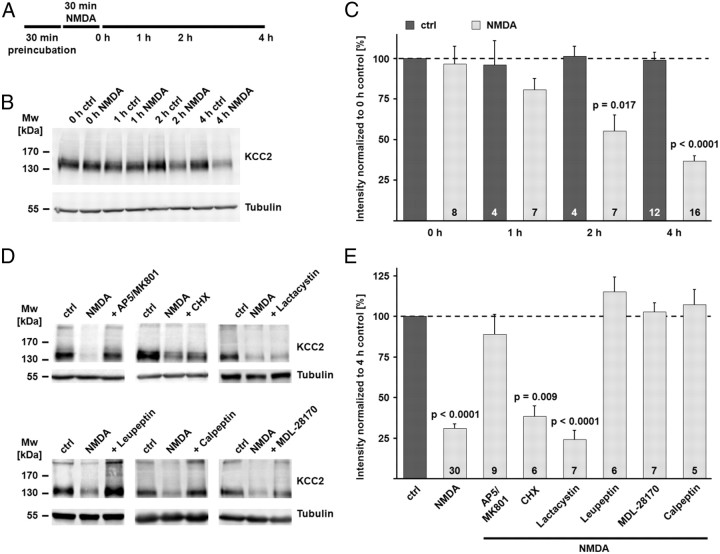
将海马脑片在谷氨酸受体激动剂NMDA存在下孵育30分钟,可快速激活钙蛋白酶,如典型钙蛋白酶底物谱蛋白的降解所示( Siman和Noszek,1988年 ; Zhou和Baudry,2006年 ). 我们在0.5μ 米 TTX阻断动作电位,50μ 米 苦毒毒素阻断GABA A类 受体和1μ 米 CGP 55845至GABA区块 B类 受体。 预培养结束时,NMDA(100μ 米 )已添加。 海马脑片在NMDA中30分钟孵育的结束时间定义为0小时( 图4 A类 ). NMDA孵育结束后1 h KCC2蛋白水平明显下降(0 h对照组KCC2蛋白含量的80.6±7.0%),2 h后显著下降(55.1±9.8%; 第页 =0.017),4h后更大(36.6±3.4%; 第页 < 0.0001; 图4 B类 , C类 ). 有趣的是,与之前的结果相比( Rivera等人,2004年 )海马脑片KCC2蛋白水平在恢复后5小时的实验时间窗内在控制条件下保持稳定(98.7±5.0%)。 在进一步的实验中,NMDA对蛋白质降解的下游机制进行了更详细的研究( 图4 D类 , E类 ). 用NMDA处理30分钟并再保存4小时的切片证实了NMDA诱导的KCC2降解(在4小时对照中为KCC2蛋白水平的31.0±3.0%; 第页 < 0.0001). NMDA受体(NMDAR)阻滞剂AP5和MK-801(100和10μ 米 分别)阻断了KCC2的降解(89.0±12.1%),这一效果与之前的结果一致,表明NMDAR的抑制阻止了钙蛋白酶的激活( Siman等人,1989年 ; Zhou和Baudry,2006年 ; Xu等人,2007年 ). 因为已经证明环己酰亚胺可以阻止某些蛋白质的降解( 崔等,2002 ),我们测试了环己酰亚胺在NMDA测定中的作用。 环己酰亚胺对NMDA诱导的KCC2降解无影响(38.5±6.3%; 第页 =0.009(与对照组相比)。 而蛋白酶体抑制剂乳酸菌素(1μ 米 )不能阻止KCC2的下调(24.3±5.7%; 第页 与对照组相比<0.0001),蛋白酶抑制剂leupeptin(50μ 米 )阻断KCC2蛋白的下降(115.3±8.8%)。 最有趣的是,两种钙蛋白酶抑制剂MDL-28170和钙肽(各30μ 米 )在NMDA兴奋毒性模型中,两者均完全阻断了KCC2的降解(102.9±5.7%和107.3±9.2%)。
图4。
NMDA诱导的兴奋毒性导致钙蛋白酶介导的KCC2降解。 A类 ,实验设计方案。 在存在不同抑制剂组合的情况下预孵育冠状脑片(详细信息请参见材料和方法)。 预培养结束时,NMDA(100μ 米 )添加30分钟。NMDA培养结束时间定义为0小时。 B类 NMDA孵育诱导KCC2蛋白水平快速下降。 Tubulin被用作负荷控制。 C类 NMDA孵育后,定量免疫印迹信号的平均值显示KCC2信号显著降低(1 h后0 h对照组KCC2蛋白水平的80.6±7.0%;2 h后55.1±9.8%;4 h后36.6±3.4%),而信号在对照条件下保持稳定(4 h后98.7±5.0%)。 D类 , E类 ,NMDA在NMDAR拮抗剂AP5和MK-801(100和10μ 米 )阻断KCC2降解(89.0±12.1%)。 蛋白质合成抑制剂环己酰亚胺对NMDA诱导的KCC2降解没有影响(38.5±6.3%)。 蛋白酶体抑制剂乳酸菌素(1μ 米 )未阻止KCC2的下调(24.3±5.7%)。 溶酶体降解抑制剂leupeptin(50μ 米 )阻断KCC2蛋白下降(115.3±8.8%)。 两种钙蛋白酶抑制剂MDL-28170(MDL)(30μ 米 )和钙肽(30μ 米 )两者均阻断了NMDA诱导的KCC2降解(102.9±5.7%和107.3±9.2%)。 通过Kruskal–Wallis单因素方差分析(ANOVA)和Mann–Whitney的排名评估统计显著性 事后(post-hoc) 测试。 的值 n个 如条形图所示。 误差条表示SEM。
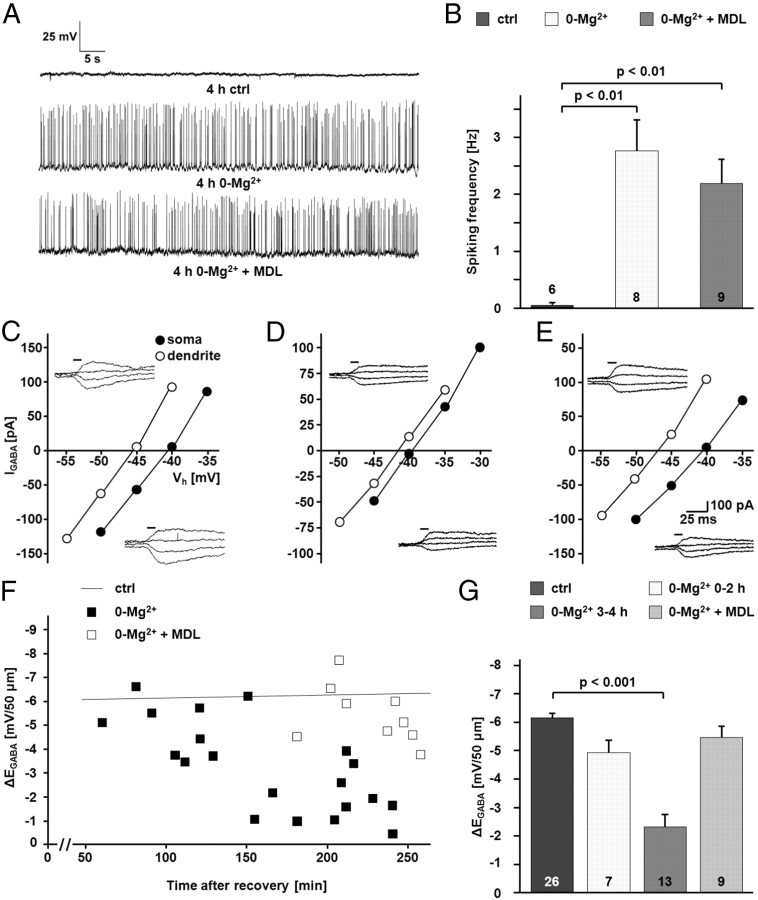
抑制钙蛋白酶防止活性诱导的KCC2功能下调 为了研究钙蛋白酶介导的KCC2降解在KCC2功能活性依赖性下调中的可能作用,我们在Mg中孵育了横向海马脑片 2+ -含或不含钙蛋白酶抑制剂MDL-28170(30μ 米 ). 镁 2+ 戒断诱导的发作间期样活动,量化为细胞附着模式下记录的尖峰频率(2.77±0.57 Hz vs 0.032±0.03 Hz n个 =8和 n个 =0-Mg的6个电池 2+ 和控制; 第页 < 0.01). MDL-28170没有改变发作间期样事件的频率(2.2±0.43 Hz; n个 =9个单元格; 与0-Mg相比无显著差异 2+ 和 第页 与对照组相比<0.01; 图5 A类 , B类 ). K-Cl协同转运的疗效,用Δ测量 E类 GABA公司 来自0-Mg的CA1锥体神经元 2+ -孵育切片显示出时间依赖性下降,在3-4小时后具有统计学高度显著性(−2.33±1.62 mV/50μm; n个 = 13; 第页 < 0.001; 图5 C–G类 ). MDL-28170可阻止KCC2功能的活性依赖性下调,且Δ E类 GABA公司 第4小时测量值与对照值无差异(5.44±0.40 mV/50μm; n个 = 9; 图5 C–G类 ). 与此相一致,免疫印迹显示在镁中孵育4小时的切片CA1区KCC2蛋白水平降低 2+ -游离生理溶液(76.7±6.0%); n个 = 13; 第页 = 0.038; 图6 A类 , B类 ). NMDAR拮抗剂AP5(50μ 米 ; 114.4 ± 9.4%; n个 = 8; 第页 与0-Mg相比=0.001 2+ )以及钙蛋白酶抑制剂MDL-28170(106.0±5.2%; n个 = 12; 第页 与0-Mg相比=0.010 2+ ),阻止KCC2下调( 图6 A类 , B类 ). 与NMDA模型中的下调相比,KCC2蛋白水平的降低较小( 图4 ). 这种差异的一个解释是,虽然NMDA暴露会影响切片制备中突触连接和断开的神经元,但切片中的所有CA1神经元不太可能被招募到发作间期样活动中。
图5。
间质样活性导致KCC2的钙蛋白酶依赖性功能失活。 A类 电流钳记录显示,海马脑片在镁中孵育诱导CA1锥体细胞神经元活动增加 2+ -游离生理溶液。 钙蛋白酶抑制剂MDL-28170并未阻止活性增加。 B类 ,电流钳记录的量化。 镁的峰值频率增加 2+ -自由生理溶液显著(0-Mg为2.77±0.57 Hz vs 0.032±0.03 Hz 2+ 和控制(ctrl); 第页 < 0.01). 当生理溶液中存在MDL-28170(MDL)时,频率也会增加(2.2±0.43 Hz;与0-Mg相比没有显著差异 2+ 和 第页 与对照组相比<0.01)。 C类 – E类 , 无鞘诱导I的样本记录 GABA公司 在胞体和顶端树突50μm处。 I–V型 曲线基于I GABA公司 在不同的保持电位下( V(V) 小时 )在控制条件下( C类 ),单位:Mg 2+ -游离生理溶液( D类 )、和(单位:Mg) 2+ -MDL-28170存在下的游离生理溶液( E类 ). F类 ,Δ的散点图 E类 GABA公司 随着时间的推移,保存在镁中的神经元 2+ -含或不含MDL-28170的自由生理溶液。 为了进行比较,表示中所示控制单元的线性拟合的线 图2 包括在内。 G公司 ,Δ的量化 E类 GABA公司 显示Cl中MDL-28170敏感性降低 − 镁孵育切片中神经元的挤压 2+ -游离生理溶液(0-Mg 2+ :−2.33±1.62 mV/50μm; MDL-28170:5.44±0.40 mV/50μm; 第页 < 0.001). 所示的合并对照数据 图2 包括在内进行比较。 使用Scheffe’s单因素方差分析评估统计显著性 事后(post-hoc) 测试。 的值 n个 如条形图所示。 误差条表示SEM。
图6。
间质样活性导致KCC2总蛋白水平和表面表达的钙蛋白酶依赖性降低。 省略镁可诱导类干预活性 2+ 来自细胞外溶液。 切片保存在Mg中 2+ -释放生理溶液,直到将其用于实验。 A类 , B类 用从成对对照切片(ctrl)和在Mg中孵育的切片中分离的CA1区蛋白样品在免疫印迹中定量和归一化KCC2免疫反应 2+ -游离生理溶液(0-Mg 2+ ). 0-Mg中KCC2蛋白水平 2+ 组与对照组相比显著降低(76.7±6.0%; 第页 = 0.038). NMDAR拮抗剂AP5(114.4±9.4%的对照; 第页 与0-Mg相比=0.001 2+ )以及钙蛋白酶抑制剂MDL-28170(MDL)(对照组的106.0±5.2%); 第页 与0-Mg相比=0.010 2+ ),阻止了0-Mg 2+ -诱导KCC2下调。 微管蛋白信号证实装载了类似数量的蛋白质。 C类 , D类 ,用鳕鱼胰蛋白酶对海马脑片进行蛋白酶处理后,从0-Mg分离的CA1区样本中显示出较低的表面KCC2水平 2+ 片。 D类 ,KCC2的表面/细胞内(裂解/未裂解)比率归一化为对照组的相应值。 KCC2表面/细胞内比率较低(75.7±8.0%; 第页 =0.021),0-Mg 2+ 片。 当存在钙蛋白酶抑制剂MDL-28170时,KCC2的表面表达没有显著变化(对照组的112.2±11.1%; 第页 =0.0037(与0-Mg相比) 2+ ). 通过Kruskal–Wallis单因素方差分析(ANOVA)和Mann–Whitney的排名评估统计显著性 事后(post-hoc) 测试。 值为 n个 如条形图所示。 误差条表示SEM。
如鳕鱼胰蛋白酶试验所示,KCC2总蛋白水平的降低与活性诱导的转运体表面表达的降低平行( 图6 C类 , D类 ). 0-Mg中的表面/细胞内比率较低 2+ 样品(75.7±8.0%; n个 = 8; 第页 =0.021(标准化后与对照组相比),MDL-28170阻断了该效应(112.2±11.1%; n个 = 7; 第页 与0-Mg相比=0.004 2+ ).
这些发现证明了钙蛋白酶在调节神经元Cl中的关键作用 − NMDAR激活时的挤出能力。
讨论 我们研究的主要发现是KCC2,一种有助于GABA发育和可塑性的蛋白质 A类 受体介导信号( Blaesse等人,2009年 )树突棘和谷氨酸能突触的成熟和功能( Li等人,2007年 ; Gauvane等人,2011年 ; Khalilov等人,2011年 ; Fiumelli等人,2012年 )是钙激活蛋白酶钙蛋白酶的底物。
KCC2降解增强导致GABA能信号的快速变化 目前使用环己酰亚胺、依米汀和亮普汀获得的数据都表明KCC2的基本周转率很低( 图1 ). 然而,之前在神经元培养中获得的leupeptin数据( Lee等人,2010年 )以及我们之前对KCC2表层油气藏的切片分析( Rivera等人,2004年 )表明人员流动率很高。 这里的数据表明,钙蛋白酶的激活可以导致KCC2蛋白水平的快速变化。 而我们之前在生化实验中看到,在控制条件下(即在标准生理溶液中),KCC2总蛋白库不断减少(0.2%/min)( Rivera等人,2004年 ),本研究中的KCC2蛋白水平在对照条件下以及在没有蛋白质合成的情况下恢复后至少5小时保持稳定。 以前和现在数据之间的差异很可能归因于研究中的非最佳切片制备和维护条件 Rivera等人(2004年) 影响[Ca 2+ ] 我 水平,从而影响钙蛋白酶活性( 图3 C类 , D类 ). 与上述研究相反,其中一些用于蛋白质分析的切片是使用组织切碎器切割的( Thomas-Crusells等人,2003年 ; Rivera等人,2004年 ),当前工作中使用的所有切片都是使用振动器切割的。 此外,先前研究中用于切片和回收/储存的标准生理溶液被蔗糖基切割溶液和高镁替代 2+ 恢复/存储解决方案。 最重要的是,在目前的生化实验中,对高切片质量的控制是基于使用切片的子集(如 图4 C类 )其中,给定动物的切片批次被用于与视频显微镜平行的电生理记录(见材料和方法)。
切片制备中神经元活性的基础水平似乎在KCC2转换的调节中没有起到主要作用,因为KCC2的稳定性在存在时没有差异(对照组在 图4 B类 )或者没有Na + -通道阻滞剂TTX(对照组 图1 B类 ). 因为μ-和m-钙蛋白酶亚型的半衰期都是几天( Zhang等人,1996年 )观察到的KCC2稳定性不太可能被抑制 从头开始 翻译是由于目前实验时间窗口4h内钙蛋白酶水平降低。
KCC2总蛋白的低周转率与几项研究报告的KCC2介导的Cl疗效的快速功能变化不一致 − 基因表达变化引起的挤压(对于原始参考, Blaesse等人,2009年 ). 目前的数据清楚地表明,需要提高KCC2的降解率才能快速降低KCC2蛋白水平。 钙蛋白酶介导的KCC2裂解可能是KCC2降解增强的主要机制之一,而转录水平的变化( Rivera等人,2002年 ; Huberfeld等人,2007年 )与长期影响有关。 进一步研究KCC2磷酸化状态的变化是否参与钙蛋白酶介导的KCC2裂解的调控,这也被认为是触发降解增强的原因。 已经证明,在HEK细胞和培养的海马神经元中激活毒蕈碱能乙酰胆碱受体(mAChRs)后,KCC2的溶酶体降解增加( Lee等人,2010年 ). Tyr的磷酸化 903/1087 KCC2蛋白的磷酸化似乎是溶酶体降解的主要触发因素,当注射mAChR激动剂毛果芸香碱诱导成年小鼠癫痫发作时,这种磷酸化也会发生,同时KCC2蛋白水平也会快速下降( Lee等人,2010年 ). 虽然这一发现表明KCC2的降解速率确实发生了变化 体内 不同条件下KCC2的合成和降解速率 体内 需要在未来的工作中解决。与Tyr磷酸化相反 903/1087 在匹罗卡品模型中,谷氨酸能NMDAR介导的活性导致EDTA敏感的KCC2下调,已被证明与丝氨酸的蛋白磷酸酶1-依赖性去磷酸化一致 940 ( Lee等人,2011年 ).
脚注 本研究得到了芬兰科学院(P.B.,K.K.)、Sigrid Jusélius基金会、Letten基金会和Jane and Aatos Erkko基金会(K.K.K)的资助。 K.K.是芬兰分子和综合神经科学研究卓越中心的成员。 我们感谢Britta Haas提供的出色技术援助。 抗NTD-KCC2抗体是Hans Gerd Nothwang博士(德国奥尔登堡Carl von Ossietzky大学)慷慨捐赠的。
工具书类
Acton BA、Mahadevan V、Mercado A、Uvarov P、Ding Y、Pressey J、Airaksinen MS、Mount DB、Woodin MA。超极化GABA能量传输需要KCC2 C终端ISO域。 神经科学杂志。 2012; 32:8746–8751. doi:10.1523/JNEUROSCI.6089-11.2012。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Ahmad F,Coleman SK,Kaila K,Blaesse P.表面表达分析:使用冷适应胰蛋白酶的蛋白酶裂解方法。 生物技术。 2011; 50:255–257. doi:10.2144/000113651。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Anderson WW、Lewis DV、Swartzwelder HS、Wilson WA。 无镁培养基激活大鼠海马薄片中的癫痫样事件。 1986年《大脑研究》; 398:215–219. doi:10.1016/0006-8993(86)91274-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Baliova M,Jursky F.甘氨酸转运体GlyT1A和GlyT1B N端细胞质域中的钙蛋白酶敏感区。 神经化学研究2005; 30:1093–1100. doi:10.1007/s11064-005-7520-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Baliova M,Betz H,Jursky F.钙蛋白酶介导的神经元甘氨酸转运体GlyT2蛋白水解裂解。 神经化学杂志。 2004; 88:227–232. doi:10.1046/j.1471-4159.2003.02192.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Bano D、Young KW、Guerin CJ、Lefeuvre R、Rothwell NJ、Naldini L、Rizzuto R、Carafoli E、Nicotera P.兴奋毒性下质膜Na+/Ca2+交换器的裂解。 单元格。 2005; 120:275–285. doi:10.1016/j.cell.2004.11.049。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Barry PH.JPCalc,一个软件包,用于计算斑贴、细胞内、上皮和双层测量中的液结电位校正,以及校正结电位测量。 神经科学方法杂志。 1994; 51:107–116. doi:10.1016/0165-0270(94)90031-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Bi X,Chen J,Baudry M.大鼠脑内钙蛋白酶活性、GluR1受体和红藻氨酸治疗效果的发育变化。 神经科学。 1997; 81:1123–1135. doi:10.1016/s0306-4522(97)00218-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
活页夹DK、Croll SD、Gall CM、Scharfman HE。 BDNF和癫痫:太多的好事? 《神经科学趋势》。 2001; 24:47–53. doi:10.1016/s0166-2236(00)01682-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Bingol B,Sheng M.重建的解构:蛋白质水解在神经可塑性和疾病中的作用。 神经元。 2011; 69:22–32. doi:10.1016/j.neuron.2010.11.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Blaesse P、Guillemin I、Schindler J、Schweizer M、Delpire E、Khiroug L、Friauf E、Nothwang HG。 KCC2的低聚化与抑制性神经递质的发展相关。 神经科学杂志。 2006; 26:10407–10419. doi:10.1523/JNEUROSCI.3257-06.2006。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Blaesse P、Airaksinen MS、Rivera C、Kaila K.阳离子氯协同转运蛋白和神经元功能。 神经元。 2009; 61:820–838. doi:10.1016/j.neuron.2009.03.003。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Buddhala C、Suarez M、Modi J、Prentice H、Ma Z、Tao R、Wu JY。 脑谷氨酸脱羧酶65的钙蛋白酶裂解是病理性的,会损害GABA神经传递。 公共科学图书馆一号。 2012; 7:e33002。 doi:10.1371/journal.pone.0033002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Cui G,Dean WL,Delamere NA。环己酰亚胺对培养的人类晶状体上皮细胞NA,K-ATP酶活性的影响。 投资眼科视觉科学。 2002; 43:2714–2720. [ 公共医学 ] [ 谷歌学者 ]
Denny JB、Polan-Curtain J、Ghuman A、Wayner MJ、Armstrong DL。 钙蛋白酶抑制剂阻止长期增强。 1990年《大脑研究》; 534:317–320. doi:10.1016/0006-8993(90)90148-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Dong YN,Waxman EA,Lynch DR。突触后密度-95和NMDA受体2亚单位的相互作用控制钙蛋白酶介导的NMDA受体裂解。 神经科学杂志。 2004; 24:11035–11045. doi:10.1523/JNEUROSCI.3722-04.2004。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Farrant M,Kaila K。GABAA受体信号的细胞、分子和离子基础。 2007年脑研究进展; 160:59–87. doi:10.1016/S0079-6123(06)60005-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
冯志浩、郝杰、叶莉、大姚C、闫N、闫Y、朱莉、史FD。 顽固性癫痫患者颞叶前新皮质mu-calpan的过度表达与临床病理特征相关。 扣押。 2011; 20:395–401. doi:10.1016/j.seizure.2011.01.010。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Fiumelli H,Cancedda L,Poo MM。通过突触后Ca2+依赖性调节KCC2功能,通过活动调节GABA能传递。 神经元。 2005; 48:773–786. doi:10.1016/j.neuron.2005.10.025。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Fiumelli H、Briner A、Puskarjov M、Blaesse P、Belem BJ、Dayer AG、Kaila K、Martin JL、Vutskits L。阳离子-氯协同转运蛋白KCC2在体内树突棘突发生中的离子转运依赖性作用。 大脑皮层。 2012年doi:10.1093/cercor/bhs027。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
藤川总经理。 长时间癫痫发作和细胞损伤:了解两者之间的联系。 《癫痫行为》2005年第7期增刊; 3:S3–S11。 doi:10.1016/j.yebeh.2005.08.003。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Gascón S、Sobrado M、Roda JM、Rodríguez-Peña a、Díaz-Guerra M。兴奋毒性和局灶性脑缺血诱导NMDA受体NR2A和NR2B亚基的截短以及支架蛋白PSD-95的裂解。 分子精神病学。 2008; 13:99–114. doi:10.1038/sj.mp.4002017年。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Gauvane G、Chamma I、Chevy Q、Cabezas C、Irinopoulou T、Bodrug N、Carnaud M、Lévi S、Poncer JC。 神经元K-Cl共转运体KCC2影响突触后AMPA受体含量和树突棘的侧向扩散。 美国国家科学院院刊2011; 108:15474–15479. doi:10.1073/pnas.1107893108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Gil-Parrado S、Fernández-Montalván A、Assfalg-Machleidt I、Popp O、Bestwater F、Holloschi A、Knoch TA、Auerswald EA、Welsh K、Reed JC、Fritz H、Fuentes-Provior P、Spiess E、Salvesen GS、Machleitt W.Ionomycin激活的钙蛋白酶触发细胞凋亡。 Bcl-2家族成员可能扮演的角色。 生物化学杂志。 2002; 277:27217–27226. doi:10.1074/jbc。 M202945200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Gomes JR、Lobo AC、Melo CV、Inácio AR、Takano J、Iwata N、Saido TC、de Almeida LP、Wieloch T、Duarte CB。 在兴奋毒性条件下,囊泡GABA转运体裂解后,截短的转运体在非突触体部位积聚。 神经科学杂志。 2011; 31:4622–4635. doi:10.1523/JNEUROSCI.3541-10.2011。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Gulyás AI、sík A、Payne JA、Kaila k、Freund TF。KCI共转运体KCC2在大鼠海马兴奋性突触附近高度表达。 欧洲神经病学杂志。 2001; 13:2205–2217. doi:10.1046/j.0953-816x.2001.01600.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Huberfeld G、Wittner L、Clemenceau S、Baulac M、Kaila K、Miles R、Rivera C。人类颞叶癫痫中氯稳态扰动和GABA能信号传导。 神经科学杂志。 2007; 27:9866–9873. doi:10.1523/JNEUROSCI.2761-07.2007。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Hübner CA、Stein V、Hermans-Borgmeyer I、Meyer T、Ballanyi K、Jentsch TJ。KCC2的破坏揭示了K-Cl协同转运在早期突触抑制中的重要作用。 神经元。 2001; 30:515–524. doi:10.1016/s0896-6273(01)00297-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Jarolimek W,Lewen A,Misgeld U。一种对速尿敏感的K+-Cl-协同转运蛋白可对抗培养的大鼠中脑神经元细胞内Cl-的积累和耗竭。 神经科学杂志。 1999; 19:4695–4704. doi:10.1523/JNEUROSCI.19-12-04695.1999。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Kampfl A、Posmantur RM、Zhao X、Schmutzhard E、Clifton GL、Hayes RL。创伤性脑损伤后钙蛋白酶蛋白水解的机制:对病理学和治疗的影响:对病理和治疗的意义:综述和更新。 神经创伤杂志。 1997; 14:121–134. doi:10.1089/neu.1997.14.121。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Khalilov I、Chazal G、Chudotvorova I、Pellegrino C、Corby S、Ferrand N、Gubkina O、Nardou R、Tyzio R、Yamamoto S、Jentsch TJ、Hübner CA、Gaiarsa JL、Ben-Ari Y、Medina I。胚胎KCC2缺陷海马体中突触活动增强和癫痫样事件。 前细胞神经科学。 2011; 5:23. doi:10.3389/fncel.2011.00023。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Khirug S、Huttu K、Ludwig A、Smirnov S、Voipio J、Rivera C、Kaila K、Khiroug L。培养和急性切片中幼鼠海马神经元功能性KCC2表达的独特特性。 欧洲神经病学杂志。 2005; 21:899–904. doi:10.1111/j.1460-9568.2005.03886.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Khirug S、Yamada J、Afzalov R、Voipio J、Khiroug L、Kaila K。皮层主要神经元轴突起始段的GABA能去极化是由Na-K-2Cl共转运体NKCC1引起的。 神经科学杂志。 2008; 28:4635–4639. doi:10.1523/JNEUROSCI.0908-08.2008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Khirug S、Ahmad F、Puskarjov M、Afzalov R、Kaila K、Blaesse P。一次癫痫发作会导致新生大鼠海马中KCC2的快速功能激活。 神经科学杂志。 2010; 30:12028–12035. doi:10.1523/JNEUROSCI.3154-10.2010。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Kneussel M,Betz H.发育突触后部位抑制性神经递质受体的聚集:膜激活模型。 《神经科学趋势》。 2000; 23:429–435. doi:10.1016/s0166-2236(00)01627-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Lee HH,Jurd R,Moss SJ。酪氨酸磷酸化调节氯化钾共转运体KCC2的膜转运。 分子细胞神经科学。 2010; 45:173–179. doi:10.1016/j.mcn.2010.06.008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Lee HH、Deeb TZ、Walker JA、Davies PA、Moss SJ。NMDA受体活性下调KCC2,导致GABAA受体介导的电流去极化。 自然神经科学。 2011; 14:736–743. doi:10.1038/nn.2806。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Li H、Khirug S、Cai C、Ludwig A、Blaesse P、Kolikova J、Afzalov R、Coleman SK、Lauri S、Airaksinen MS、Keinänen K、Khiroug L、Saarma M、Kaila K、Rivera C。KCC2与树突细胞骨架相互作用,促进脊椎发育。 神经元。 2007; 56:1019–1033. doi:10.1016/j.neuron.2007.10.039。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
刘杰、刘MC、王凯。 中枢神经系统中的钙蛋白酶:从突触功能到神经毒性。 科学信号。 2008; 1:re1。 doi:10.1126/stke.114re1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Löscher W,Puskarjov M,Kaila K.阳离子氯共转运蛋白NKCC1和KCC2是新型抗癫痫和抗癫痫治疗的潜在靶点。 神经药理学。 2012年doi:10.1016/j.neuropharm.2012.05.045。 新闻界。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Ludwig A,Li H,Saarma M,Kaila K,Rivera C.在没有GABA能和谷氨酸能传播的情况下KCC2的发育上调。 欧洲神经病学杂志。 2003; 18:3199–3206. doi:10.1111/j.1460-9568.2003.03069.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Lynch G,Baudry M.记忆的生物化学:一个新的特定假设。 科学。 1984; 224:1057–1063. doi:10.1126/science.6144182。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Mercado A、Broumand V、Zandi-Nejad K、Enck AH、Mount DB。 KCC2中的C末端结构域提供了构成性K+-Cl−共输运。 生物化学杂志。 2006; 281:1016–1026. doi:10.1074/jbc。 M509972200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Mody I,Lambert JD,Heinemann U。低细胞外镁在大鼠海马脑片中诱导癫痫样活动和扩散性抑郁。 神经生理学杂志。 1987; 57:869–888. doi:10.1152/jn.1987.57.3.869。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
尼克松·RA。 钙激活中性蛋白酶(CANP)对视网膜神经节细胞神经元和视神经胶质中Fodrin的降解:神经元中CANP活性的优先定位。 神经科学杂志。 1986; 6:1264–1271. doi:10.1523/JNEUROSCI.06-05-01264.1986。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Payne JA、Rivera C、Voipio J、Kaila K.神经沟通、发育和创伤中的氯离子共转运体。 《神经科学趋势》。 2003; 26:199–206. doi:10.1016/S0166-2236(03)00068-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Piper RC,Luzio JP。用于溶酶体降解的完整膜蛋白的泛素依赖性分类。 当前Opin细胞生物学。 2007; 19:459–465. doi:10.1016/j.ceb.2007.07.002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Pottorf WJ,2nd,Johanns TM,Derrington SM,Strehler EE,Enyedi A,Thayer SA。谷氨酸诱导的蛋白酶介导的大鼠海马神经元质膜Ca2+泵活性丧失。 神经化学杂志。 2006; 98:1646–1656. doi:10.1111/j.1471-4159.2006.04063.x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Rechsteiner M,Rogers SW公司。 PEST序列和蛋白水解调控。 生物化学科学趋势。 1996; 21:267–271. [ 公共医学 ] [ 谷歌学者 ]
Rivera C、Voipio J、Payne JA、Ruusuvuori E、Lahtinen H、Lamsa K、Pirvola U、Saarma M、Kaila K。K+/Cl−共转运体KCC2在神经元成熟过程中使GABA超极化。 自然。 1999; 397:251–255. doi:10.1038/16697。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Rivera C,Li H,Thomas-Crusells J,Lahtinen H,Viitanen T,Nanobashvili A,Kokaia Z,Airaksinen MS,Voipio J,Kaila K,Saarma M.BDNF诱导的TrkB活化下调K+-Cl−协同转运蛋白KCC2,并损害神经元Cl−挤压。 细胞生物学杂志。 2002; 159:747–752. doi:10.1083/jcb.200209011。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Rivera C、Voipio J、Thomas-Crusells J、Li H、Emri Z、SipiläS、Payne JA、Minichiello L、Saarma M、Kaila K。神经元特异性K-Cl协同转运蛋白KCC2活性依赖性下调机制。 神经科学杂志。 2004; 24:4683–4691. doi:10.1523/JNEUROSCI.5265-03.2004。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Schafer DP、Jha S、Liu F、Akella T、McCullough LD、Rasband MN。轴突起始段细胞骨架的破坏是神经元损伤的一种新机制。 神经科学杂志。 2009; 29:13242–13254. doi:10.1523/JNEUROSCI.3376-09.2009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Seglen PO,Grinde B,Solheim AE.氨、甲胺、氯喹和亮氨酸蛋白酶对分离大鼠肝细胞蛋白质降解溶酶体途径的抑制。 欧洲生物化学杂志。 1979; 95:215–225. doi:10.1111/j.1432-1033.1979.tb12956.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Sha D、Jin Y、Wu H、Wei J、Lin CH、Lee YH、Buddhala C、Kuchay S、Chishti AH、Wu JY。 多钙蛋白在脑L-谷氨酸脱羧酶蛋白水解裂解中的作用。 脑研究2008; 1207:9–18. doi:10.1016/j.braines.2008.02.033。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Sierra--Paredes G,Cornes JM,Sierra-Marcuño G。钙蛋白酶抑制剂I延缓自由运动大鼠海马体中的癫痫发作抵消。 神经科学快报。 1999; 263:165–168. doi:10.1016/s0304-3940(99)00136-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Siman R,Noszek JC。 兴奋性氨基酸激活钙蛋白酶I并诱导体内结构蛋白分解。 神经元。 1988; 1:279–287. doi:10.1016/0896-6273(88)90076-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Siman R,Baudry M,Lynch G.脑饲料:钙蛋白酶I(一种内源性钙激活蛋白酶)的底物。 美国国家科学院院刊,1984年; 81:3572–3576. doi:10.1073/pnas.81.11.3572。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Siman R、Noszek JC、Kegerise C.Calpain I的激活与海马损伤的兴奋性氨基酸诱导特别相关。 神经科学杂志。 1989; 9:1579–1590. doi:10.1523/JNEUROSCI.09-05-01579.1989。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
斯德哥尔摩D,Bartoli M,Sillon G,Bourg N,Davoust J,Richard I.通过多光子FRET在活体小鼠中成像钙蛋白酶活性。 分子生物学杂志。 2005; 346:215–222. doi:10.1016/j.jmb.2004.11.039。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Thomas-Crusells J,Vieira A,Saarma M,Rivera C。监测海马急性切片制备表面膜转运的新方法。 神经科学方法杂志。 2003; 125:159–166. doi:10.1016/s0165-0270(03)00050-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Tyagarajan SK,Ghosh H,Yéveness GE,Nikonenko I,Ebeling C,Schwerdel C,Sidler C,Zeilhofer HU,Gerrits B,Muller D,Fritschy JM.通过GSK3β依赖性磷酸化gephyrin调节GABA能突触形成和可塑性.美国国家科学院院刊2011; 108:379–384. doi:10.1073/pnas.1011824108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Villa PG、Henzel WJ、Sensenbrenner M、Henderson CE、Pettmann B.钙蛋白酶抑制剂,而非半胱氨酸蛋白酶抑制剂,可防止细胞凋亡过程中肌动蛋白水解和DNA断裂。 细胞科学杂志。 1998; 111:713–722. doi:10.1242/jcs.111.6.713。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
von Reyn CR、Spaethling JM、Mesfin MN、Ma M、Neumar RW、Smith DH、Siman R、Meaney DF。 钙蛋白酶介导电压门控钠通道α亚单位的蛋白水解。 神经科学杂志。 2009; 29:10350–10356. doi:10.1523/JNEUROSCI.2339-09.2009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Wake H、Watanabe M、Moorhouse AJ、Kanematsu T、Horibe S、Matsukawa N、Asai K、Ojika K、Hirata M、Nabekura J。神经元应激反应中KCC2磷酸化的早期变化导致功能下调。 神经科学杂志。 2007; 27:1642–1650. doi:10.1523/JNEUROSCI.3104-06.2007。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Wang N,Chen W,Linsel-Nitschke P,Martinez LO,Agerholm-Larsen B,Silver DL,Tall AR。ABCA1中的PEST序列通过钙蛋白酶调节降解,并通过apoA-I临床研究杂志调节ABCA1的稳定性。 2003; 111:99–107. doi:10.1172/JCI16808。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
魏杰、林奇、吴赫、金毅、李毅、吴杰。 钙蛋白酶对脑谷氨酸脱羧酶65的活性依赖性裂解。 神经化学杂志。 2006; 98:1688–1695. doi:10.1111/j.1471-4159.2006.04074.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
吴海燕,林奇博士。钙蛋白酶与突触功能。 摩尔神经生物学。 2006; 33:215–236. doi:10.1385/MN:33:215。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Xu W,Wong TP,Chery N,Gaertner T,Wang YT,Baudry M.Calpain介导的mGluR1α截短:兴奋毒性的关键步骤。 神经元。 2007; 53:399–412. doi:10.1016/j.neuron.2006.12.020。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Zadran S、Jourdi H、Rostamiani K、Qin Q、Bi X、Baudry M。脑源性神经营养因子和表皮生长因子通过丝裂原活化蛋白激酶依赖性磷酸化激活神经元间钙蛋白酶。 神经科学杂志。 2010年a; 30:1086–1095. doi:10.1523/JNEUROSCI.5120-09.2010。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Zadran S,Bi X,Baudry M.神经元中钙蛋白酶-2的调节:对突触可塑性的影响。 摩尔神经生物学。 2010年b; 42:143–150. doi:10.1007/s12035-010-8145-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Zhang W,Lane RD,Mellgren RL.主要钙蛋白酶同工酶是长寿蛋白质。 培养细胞中钙蛋白酶耗竭反义策略的设计。 生物化学杂志。 1996; 271:18825–18830. doi:10.1074/jbc.271.31.18825。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Zhou M,Baudry M。NMDA神经毒性的发育变化反映了NMDA受体亚单位组成的发育变化。 神经科学杂志。 2006; 26:2956–2963. doi:10.1523/JNEUROSCI.4299-05.2006。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]