摘要 到目前为止,内源性脑源性神经营养因子(BDNF)的生物合成已经在神经元中进行了检测,在神经元中,BDNF以一种活动依赖的方式以非常低的水平表达。 众所周知,BDNF在人体循环血小板中积累的水平远高于大脑中的水平。 在血液凝固过程中,BDNF从血小板中释放出来,这使得BDNF作为一种易于获取的生物标记物得到了广泛的应用,其假设是血清水平可能以某种方式反映大脑水平。 为了确定血小板中BDNF的细胞来源,我们建立了巨核细胞(血小板的祖细胞)的原代培养,我们发现人类和大鼠巨核细胞表达BDNF BDNF公司 基因。 令人惊讶的是,mRNA转录物的模式与神经元相似。 在存在thapsigargin和外部钙的情况下,导致有效BDNF翻译的mRNA物种的水平迅速增加。 在这些条件下,生物活性BDNF的必需前体-前BDNF很容易被检测到。 巨核细胞将BDNF储存在α颗粒中,其中80%以上还含有血小板因子4。 相反,在小鼠巨核细胞中检测不到BDNF,这与小鼠血清中不存在BDNF一致。 这些发现表明,抑郁症或体育锻炼研究中报告的人类血清BDNF水平的变化可能主要反映巨核细胞和血小板发生的变化,包括后者保留和释放BDNF的能力。
关键词: 血液、脑源性神经营养因子(BDNF)、神经生物学、神经化学、神经营养素
介绍 BDNF公司 2 是一种调节神经回路发育和功能的分泌蛋白( 1 , 2 ). BDNF在人类中的功能相关性是在发现多态性和缺失等位基因突变后牢固确立的,这些突变与从细微的记忆改变等缺陷相关( 三 )早期出现严重症状( 4 ). 的cDNA序列 BDNF公司 预测,与其他胱氨酸结蛋白一样,BDNF首先被合成为前体蛋白,称为前BDNF,以确保正确形成二硫键和生物活性成熟的神经营养素( 5 , 6 ). 多种人工表达系统的大量实验证实了这一观点,与早期神经生长因子实验的结果一致( 7 ). 到目前为止,只有极少数研究涉及内源性BDNF的生物合成、储存和分泌问题( 8 , 9 ). 由于神经元中蛋白质的缺乏,大多数研究使用了过度表达范式,导致对前BDNF的处理是在神经元内还是在分泌后的细胞外空间发生的不确定性。 在蛋白质基础上比较大脑和血小板时,人类血小板中BDNF的含量是大脑组织的100-1000倍( 10 – 12 ). 由于BDNF的生物合成似乎不太可能发生在血小板中,我们建立了巨核细胞(Mks)的原代培养物,巨核细胞是血小板的祖细胞。 除了与内源性BDNF的生物合成及其基因在非神经元细胞中的高效表达有关的问题外,BDNF在人类血液和血清中的起源问题也引起了广泛关注。 事实上,人类血清中BDNF水平被广泛用作生物标记物,推测其在某种程度上反映了大脑水平。 因此,无数研究报告了情绪障碍(包括抑郁症)患者血清中BDNF水平的降低( 13 ),尽管相比之下,体育锻炼被发现会增加它们( 14 ).
实验程序 试剂 对于重组蛋白,BDNF产生于 大肠杆菌 来自Amgen/Regeneron合作伙伴(纽约州塔里敦)。 在转染了相应cDNA的COS-7细胞中产生了抗裂解的小鼠前BDNF和BDNF前肽( 15 ). 干细胞因子和血小板生成素(TPO)来自R&D Systems(英国阿宾顿)。 白细胞介素-1β(IL1-β)来自Miltenyi Biotec(英国萨里郡比斯利)。 人类重组纤维蛋白原来自EMD-Millipore(Calbiochem;Darmstadt,德国)。 小鼠单克隆抗BDNF 3C11来自Icosagen(爱沙尼亚塔尔图)。 针对成熟BDNF的BDNF抗体以相同的亲和力识别小鼠、大鼠和人类蛋白质,因为相应的氨基酸序列是相同的。 小鼠单克隆抗体pro-BDNF H100G来自GeneCopoeia Inc.(马里兰州Rockville)。 如前所述使用单克隆抗BDNF#9( 15 ). 鸡抗β-肌动蛋白抗体13822、兔抗血小板因子(PF4) Ab129183号 ,山羊抗鸡HRP结合二级抗体Ab97135来自Abcam(英国剑桥)。 驴抗鼠HRP结合二级抗体来自Promega(威斯康星州麦迪逊)。 Alexa Fluor-488驴抗鼠IgG二级抗体、Alexa Fluor-594驴抗兔IgG三级抗体和卵磷脂-TRITC购自Invitrogen。 Hanks’s平衡盐溶液、Iscove’s改良Dulbecco’s培养基、HEPES、胎牛血清(FBS)、, 我 -谷氨酰胺和青霉素/链霉素来自Invitrogen。 Cellgro SCGM培养基来自Cellgenic(德国弗莱堡)。 所有其他试剂,包括塔普西格金和离子霉素,均为分析级试剂,从Sigma(英国多塞特)购买。
细胞培养与分离 大约10周龄的CD1或C57BL/6小鼠和Wistar大鼠因CO升高而死亡 2 随后使用酸性柠檬酸-葡萄糖-B管通过心脏穿刺进行吸入和采血(BD Vacutainer,BD;英国普利茅斯)。 取CD1或C57BL/6小鼠和Wistar大鼠的股骨和胫骨,用含有0.38%柠檬酸钠、1 m 米 腺苷,2米 米 茶碱和5%热灭活FBS。 红细胞溶解后,将悬浮液通过40μm的过滤器,并将颗粒重新悬浮在培养基中(Iscove改良的Dulbecco培养基 我 -谷氨酰胺,25米 米 HEPES、5%热灭活FBS、100单位/ml青霉素和100μg/ml链霉素),含有25 ng/ml干细胞因子和TPO。 培养6-7天后 在体外 成熟的Mks在1.5-3%牛血清白蛋白梯度上纯化,并在Cellgro-SCGM培养基中培养16 h。解剖海马和肺,并在-80°C下冷冻直至使用。 根据国家研究伦理服务局批准的方案,在获得知情同意后,获得了新生儿脐血和成人外周血的人体样本。 采用磁性细胞分选法分离CD34-阳性细胞(≥98%),在含有TPO和IL1-β的Cellgro-SCGM培养基中培养10天,用流式细胞仪检测70-90%的CD41a + 和20-60%CD42a + 分别代表定向祖细胞和成熟Mks的细胞。 通过在200× 克 在前列腺素E1(1μ 米 )和apyrase(1单位/ml)以防止细胞激活。 通过1100×离心从富含血小板的血浆中造粒血小板 克 10分钟后立即溶解。
Western Blot和密度分析 血小板和Mks在含50 m的缓冲液中的冰上溶解30 min 米 三氯化氢,pH 7.4,150 m 米 氯化钠,1米 米 EDTA、1%Triton X-100和0.2%脱氧胆酸钠,补充蛋白酶和磷酸酶抑制剂混合物,10μ 米 1,10-菲罗啉一水合物,10 m 米 6-氨基己酸和10μg/ml抑肽酶。 超声处理(1个脉冲,50%振幅)后,通过离心分离去除不溶性碎片。 蛋白质在含有SDS(Invitrogen)的4–12%NuPAGE梯度凝胶上分离,并使用半干Trans-Blot单元(英国赫特福德郡Bio-Rad)转移至硝化纤维素膜。 允许检测BDNF前肽( 15 )在室温下用2.5%戊二醛转移30分钟后固定膜,然后用封闭溶液(3%封闭试剂(Invitrogen)和TBS-T中的3%BSA)培养2小时,然后用抗BDNF 3C11(1:2000)、抗pro-BDNF H1001G(1:1000)或鸡抗β-肌动蛋白(1:2000。 一级抗体与驴抗鼠HRP结合二级抗体(1:10000)或山羊抗鸡HRP结合二级抗体(1:5000)结合。 使用Lumi-Glo反向蛋白质印迹底物(Cell Signaling Technology,Danvers,MA)开发化学发光。 在所有实验中都很小心,以确保信号在线性范围内,并使用ImageJ软件进行密度测定。
BDNF ELISA测定 如前所述,使用单克隆抗体组合进行BDNF夹心ELISA( 16 ),进行了以下修改。 将10μg/ml小鼠抗BDNF抗体1与生物素(磺化-NHS-LC-生物素化试剂盒EZ-Link,Pierce)结合在涂层缓冲液(25m)中,在室温下将链霉亲和素高结合能力涂层白板(Pierce 米 特里斯,150米 米 氯化钠、0.1%BSA、0.05%吐温20、pH 7.2)。 在隔夜培养后,用0.1%吐温20在PBS(洗涤缓冲液)中洗涤平板,然后用4%BSA在PBS中封闭2小时。 每孔150μl培养缓冲液(0.1 米 千赫 2 人事军官 4 , 0.1 米 纳 2 添加HPO4,pH 7.6),然后添加50μl样品或BDNF标准。 将Mk裂解物或重组BDNF与10μg/ml小鼠抗BDNF抗体9与辣根过氧化物酶(活化过氧化物酶试剂盒,EZ-Link Plus,Pierce)结合,在4°C下培养过夜。 以1:3的比例在0.1%Triton X-100 PBS(PBT)中使用Mk裂解物。 为了测试BDNF从Mks释放到其培养基中的可能性,将纯化的Mks培养在24孔板上,并在37°C和5%CO下培养2天 2 ,在含有10μg/ml辣根过氧化物酶偶联的抗BDNF抗体9的CellGro SCGM培养基中。 使用不同浓度的重组BDNF在无细胞的相同培养基中孵育2天,在平行板中建立标准曲线。 检测限为每口井1.25 pg BDNF。 2天后,收集相应的培养基(Mks和标准曲线),在旋转平台上培养3小时,然后用洗涤缓冲液冲洗。 添加了BM化学发光ELISA底物POD(罗氏应用科学公司,德国曼海姆),并使用微孔板阅读器(FLUOstar Omega,BMG labtech)测量发光。 标准品和样品均为一式三份。
免疫细胞化学和共聚焦分析 Mks在200μg/ml人纤维蛋白原涂层盖玻片上培养6小时(小鼠和大鼠Mks)或36小时(人Mks。 然后用封闭溶液(PBT中10%的驴血清)封闭Mks 1小时。在封闭溶液中以以下最终浓度/稀释度稀释初级抗体:1:500兔抗PF4和10μg/ml鼠抗BDNF抗体9。 在室温下孵育2小时后,用PBT清洗盖玻片三次,并用二级抗体在封闭溶液或指骨苷/TRITC中以1:500的稀释度孵育1小时(封闭溶液中以1:50的稀释度)。 用PBT进一步清洗后,用含DAPI的安装介质将贴有标签的盖玻片安装到玻璃载玻片上。 使用共焦显微镜(LSM 780;卡尔蔡司)在×63放大倍数下采集图像。 使用蔡司联合定位系数软件(ZEN black 2011)确定BDNF和PF4之间的联合定位系数,该软件使用曼德斯重叠系数方程量化重叠像素。 每个样本至少分析15个细胞。
RNA提取、逆转录、常规和实时定量PCR 根据制造商的说明,使用TRIzol试剂(Invitrogen)从动物组织(解剖的海马或肺)和细胞(小鼠、大鼠和人类MKs)中提取总RNA,使用RNeasy试剂盒(加利福尼亚州巴伦西亚的齐亚根),包括DNA酶处理。 来自海马或肺的人类RNA样本来自Clontech。 使用随机六聚体(Promega)和SuperScript III第一链合成系统(Invitrogen)从1250 ng总RNA中制备cDNA。 分析小鼠、大鼠和人类的表达 BDNF公司 外显子特异性转录物,使用57-60°C的退火温度对所有引物组合(引物列于 表1 ). 使用TaqMan探针和引物对小鼠、大鼠和人类的StepOne系统(Applied Biosystems,Invitrogen)进行实时定量PCR BDNF公司 外显子特异性转录物或BDNF编码序列以及看家基因 GAPDH公司 和 rRNA18S (Applied Biosystem,Invitrogen,引物列于 表2 ). 要比较 BDNF公司 物种之间的mRNA编码序列,SYBR®主混合(Applied Biosystems,Invitrogen)与相应的引物一起使用( 表2 ). 相对 BDNF公司 基因表达水平使用2 −ΔΔ 计算机断层扫描 方法和家政基因进行归一化。 如前所述,使用引物分析大鼠Mks中前蛋白转化酶的表达( 17 ).
表1。
常规PCR实验中使用的引物
m是鼠标; r为鼠; h是人类。
寡核苷酸名称 序列(5′-3′) 产品尺寸
先生 BdnfI公司 感觉 GTGTGACCTGAGCAGTGGGCAAGA公司 803基点
先生 BdnfII公司 感觉 GGAAGTGAGAGAACCGTCTAGAGCA公司 469个基点(IIa)
682个基点(IIb) 765个基点(IIc)
米 BdnfIII公司 感觉 GCTTTCTATCCATCCCTCCCCGAGT(通用通信技术公司) 425基点
第页 BdnfIII公司 感觉 CCTTTCTATTTCCCTCCCCGAGAGT公司 427基点
先生 BdnfIV公司 感觉 CTCTGCCTAGATCAATGGAGCTTC公司 553基点
先生 BdnfV公司 感觉 CTCTGTGTAGTTTCATTGTGTTC 364基点
米 BdnfVI公司 感觉 GCTGGCTGTCGCACGGTTCCATT公司 542个基点
第页 BdnfVI公司 感觉 GCTGGCTGTCGCACGGTCCCATT公司 543个基点
先生 Bdnf公司 VII感官 CCTGAAAGGGTCGGAACTCCA公司 420个基点
先生 Bdnf公司 VIII意义 GTGTGTCTCTGCGCCTCAGTGA 362个基点
米 Bdnf公司 IXA感官 CCCAAAGCTGCTAAAGCGAGGAAGAGAGAG
第页 Bdnf公司 IXA感官 CCAGAGCTAAAGTGGGAGAAG公司 525基点
先生 Bdnf公司 反义 GAAGTGTACAAGTCGCGTCCTTA公司
小时 BDNF 感觉 GATGCCAGTTGCTTTGTCTTCTGTAG公司 471个基点
小时 BDNFII公司 感觉 GGGCGAGAGTCCATTCAGCACC公司 311个基点(IIa)
526个基点(IIb) 609基点(IIc)
小时 BDNFIII型 感觉 AGTTTCGGGCGCTGGCTTAGA公司 346个基点
小时 BDNFIV公司 感觉 GCTGCAGAAACAGAGGAGTACA公司 411个基点
小时 BDNFV公司 感觉 TCGCGTTCGCAAGCTCCGTAGTG公司 272个基点(Va)
282个基点(Vb) 565 bp(V-VIII-VIIIh) 682个基点(V-VIII)
小时 BDNFV小时 感觉 GGCTGAACACCCCTCGAA公司 339个基点
小时 BDNFVI公司 感觉 GGCTTAATGAGACACCCCGC公司 368个基点(VIa)
386个基点(VIb) 493个基点(VI-IXb)
小时 BDNFVII公司 感觉 GAACTGAAGGGTCTGCGACACTCT公司 328个基点(VIIa)
428 bp(VIIb)
小时 BDNFIX公司 感觉 TTTCTCGTGACAGCATGAGCAG公司 352个基点(IXabd)
536个基点(IXabcd)
小时 BDNF公司 反义 GTCCTCATCCAACAGCTCTTCTATC公司
嗯 高效放射治疗 感觉 关贸总协定 469个基点
嗯 高效放射治疗 反义 GTCCTTTTCACCAGCAGCTTG公司
表2。
实时定量PCR实验中使用的引物和参考物
m是鼠标; r为鼠; h是人类。
寡核苷酸名称 参考或序列(5′-3′) 产品尺寸
米 Bdnf公司 (编码顺序) Mm04230607_s1 92个基点
米 BdnfI公司 Mm01334047_m1 105 bp
米 BdnfIV公司 00432069立方米 145个基点
米 BdnfVI公司 Mm01334042_m1 108个基点
米 BdnfIXa公司 Mm04230616_s1 77个基点
米 Gapdh公司 Mm99999915_g1 109个基点
米 rRNA18S Mm03928990_g1 61个基点
第页 Bdnf公司 (编码顺序) 02531967_s1卢比 142个基点
第页 BdnfI公司 01484924_m1卢比 106个基点
第页 BdnfIV公司 01484927_m1卢比 120个基点
第页 BdnfVI公司 01484928_m1卢比 109个基点
第页 BdnfIXA公司 04230568_s1卢比 95 bp
第页 Gapdh公司 Rn01775763_g1 174个基点
第页 rRNA18S 03928990_g1卢比 61个基点
小时 BDNF公司 (编码顺序) Hs02718934_s1 74个基点
小时 BDNFI公司 Hs00538277_m1 104个基点
小时 BDNFIV公司 Hs00380947_m1 116个基点
小时 BDNFVIa公司 Hs04188535_m1 119个基点
小时 BDNFVIb公司 Hs00156058_m1 143个基点
小时 BDNFIXabcd公司 Hs00542425_s1 81个基点
小时 GAPDH公司 Hs02758991_g1 93个基点
小时 rRNA18S Hs03003631_g1号 69个基点
mrh先生 BDNF公司 感觉(编码序列) GAGCTGAGTGTGGACAG公司 256个基点
mrh先生 BDNF公司 反义(编码序列) CGCCAGCCAATTCTCTTTGC公司
mrh先生 rRNA18S 感觉 GTCTGTGATGCCTTAGATG公司 176个基点
mrh先生 rRNA18S 反义 AGCTTATGACCCCACTTAC公司
统计分析 所有值均表示为平均值±S.E。所有统计检验均成对进行 t吨 测试,单尾。
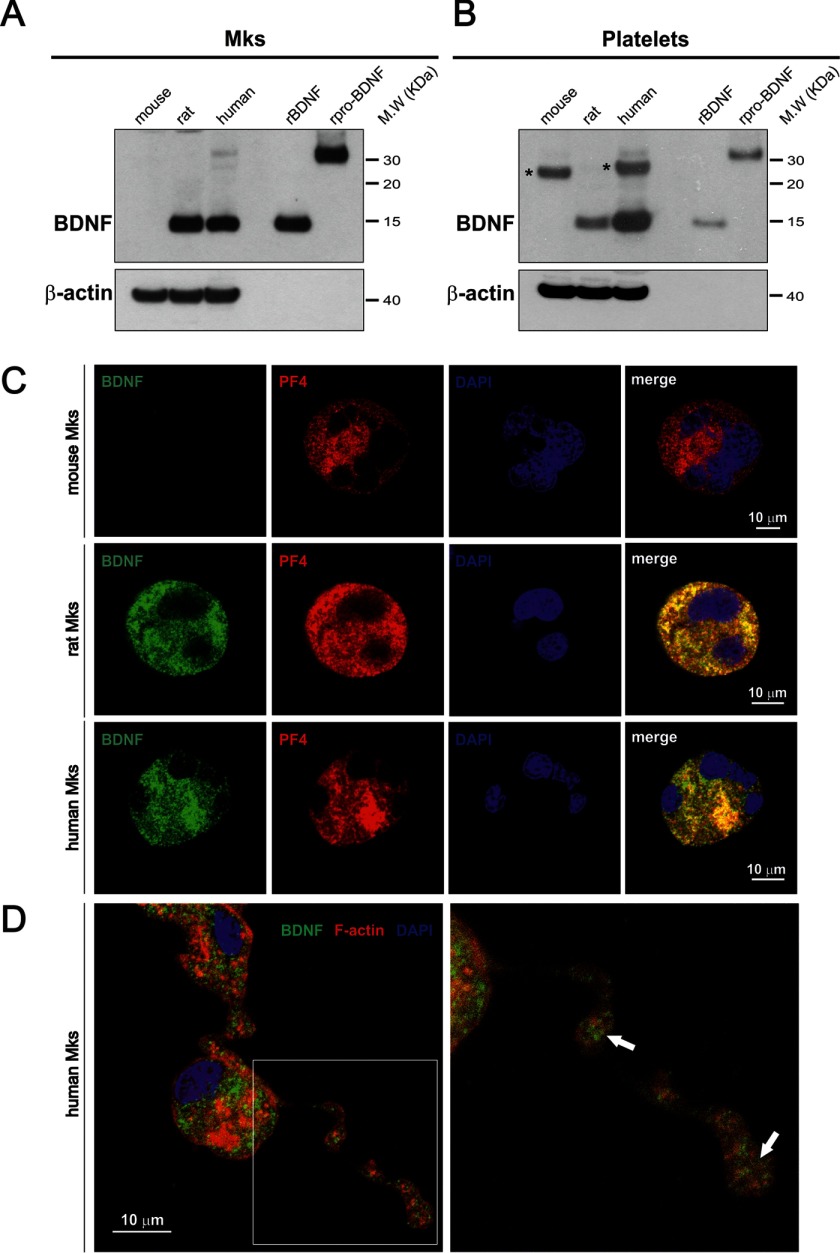
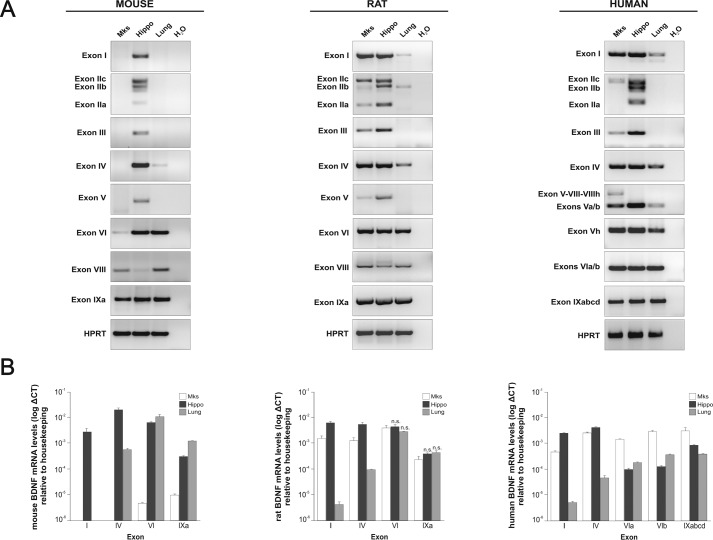
结果 为了确定是否可以在Mks中检测到BDNF,我们建立了小鼠、大鼠和人类Mks的原代培养物,并使用专门识别BDNF而非NGF或NT4的BDNF单克隆抗体通过Western blotting分析了它们的含量,条件是两者都能被相应的抗体识别(数据未显示)。 在大鼠和人中均检测到与成熟BDNF单体预期大小相对应的强信号,但在小鼠Mks中未检测到( 图1 A类 ). 请注意,在这些条件下,pro-BDNF几乎无法检测到,在人类Mk中只检测到一个微弱的带。 作为对照,我们还分析了从相应物种纯化的血小板中BDNF的含量,并证实了人类血小板中存在大量BDNF,在大鼠血小板中也检测到了相当数量的BDNF但在小鼠血小板中没有检测到( 图1 B类 ). 血小板的这一结果与以前用这三种血样制备的血清进行免疫测定得出的结论一致( 18 ). 然后我们探索BDNF是否会定位于α颗粒中,α颗粒是Mk谱系中许多生长因子的储存室。 一种BDNF特异性信号被发现与PF4广泛共定位,也被称为CXCl4,是最丰富的α颗粒蛋白之一( 图1 C类 ). 在前血小板形成的人类Mks的尖端也可以看到明显的BDNF信号( 图1 D类 , 箭头 )与BDNF从Mks转移到血小板的概念一致。 在这些免疫染色实验中,我们使用小鼠Mks作为BDNF信号特异性的对照。 当在与大鼠和人类Mks相同的实验条件下与相应抗体孵育时,检测到PF4,但没有检测到BDNF( 图1 C类 ). 小鼠血小板中缺乏任何可检测到的BDNF并不是我们在大多数实验中使用的CD1小鼠菌株特有的特征,因为C57BL/6菌株在Mks和血小板中均导致相同的阴性结果。 我们注意到,在最近对C57BL/6血小板提取物进行的高灵敏度定量蛋白质组分析中,未检测到BDNF( 19 ). ELISA对大鼠Mks中BDNF水平的定量表明,其裂解物含有1.40±0.13 ng/mg蛋白质(平均值±S.E。, n个 = 6). 我们还试图通过用HRP结合的BDNF单克隆抗体培养细胞来确定前血小板形成Mks是否将BDNF释放到培养基中(参见“实验程序”)。 在与BDNF捕获抗体孵育2天后,我们没有检测到BDNF在Mk条件培养基中的任何释放,这表明BDNF的大部分被转移到血小板中,而没有释放到培养基中。 这一结果与之前的工作一致,即在大鼠和人类中,血清中BDNF的水平远高于血浆中的BDNF水平,这表明血清中大部分BDNF是血小板脱颗粒的结果( 18 ). 为了确定BDNF生物合成机制是否在Mks中表达,我们从成熟的血小板形成小鼠、大鼠和人类Mks分离RNA。 显著水平的 BDNF公司 在大鼠和人类细胞中均检测到mRNA( 图2 A类 ). 在四个单独的实验中,发现与小鼠Mks相比,大鼠和人类中这两种物种的总mRNA水平大约高出200倍。 全部已知 BDNF公司 对从这三个物种的Mks中提取的RNA中的转录物进行分析,并与从海马和肺中提取的作为相应物种的神经元和非神经元参考组织的RNA进行比较( 图2 A类 ). 这些实验的结果揭示了大鼠和人类Mks中mRNA表达的神经元模式,其中包括外显子I和IV转录物。 值得注意的是,包含外显子I的转录本最近被证明显著增加 Bdnf公司 mRNA可翻译性( 20 ). 相比之下,这些典型的神经元转录物在小鼠中无法检测到( 图2 A类 ). 实时PCR还评估了这三个物种中所有主要转录物的水平( 图2 B类 ).
图1。
小鼠、大鼠和人类巨核细胞和血小板中BDNF蛋白的差异水平。 培养Mks的Western blot裂解物( A类 )和血小板( B类 )如图所示。 每条泳道装载80微克蛋白质,将印迹膜与Icosagen(爱沙尼亚塔尔图)开发的小鼠单克隆抗体3C11孵育。 重组BDNF和前BDNF作为分子质量标记物,β-肌动蛋白抗体作为负荷对照。 星号 ( 右上面板 )指向与BDNF无关的条带,可能与小鼠样本中的免疫球蛋白轻链相对应。 注意小鼠Mks和血小板中没有BDNF。 C、, BDNF 9抗体( 绿色 ) ( 15 )和PF4( 红色 )揭示两种抗原在成熟大鼠和人类Mks中的表达。 注意,与PF4不同,BDNF在小鼠Mks中无法检测到。 BDNF与PF4在大鼠和人类Mks中的共同定位使用每个通道特定生成的像素强度进行量化。 在人类中,83%和大鼠中,86%的BDNF阳性颗粒也呈PF4阳性。 蓝色 DAPI染色。 D、, 肌动蛋白的免疫荧光染色( 红色 )和BDNF( 绿色 )在前血小板形成培养的人类Mks中。 箭头 表明BDNF在初生芽中积累。
图2。
转录分析 BDNF公司 在小鼠、大鼠和人类巨核细胞中。 常规( A类 )和实时定量( B类 )用外显子特异性引物和成熟培养的成年海马Mks提取的RNA进行PCR( 河马 )图中显示了、和肺。 请注意,在小鼠中,未检测到神经元特异性转录物,包括外显子I和IV,相反,转录物模式类似于肺组织中观察到的非神经元模式。 相反,从大鼠和人类Mk中提取的RNA具有转录模式,包括外显子I和IV,如海马所示,这是神经元模式的特征。 除非注明为不重要( 不另说明。 ),所有值均为平均值±S.E.,一式三份,基于三个独立实验 第页 <0.001(成对 t吨 测试)。
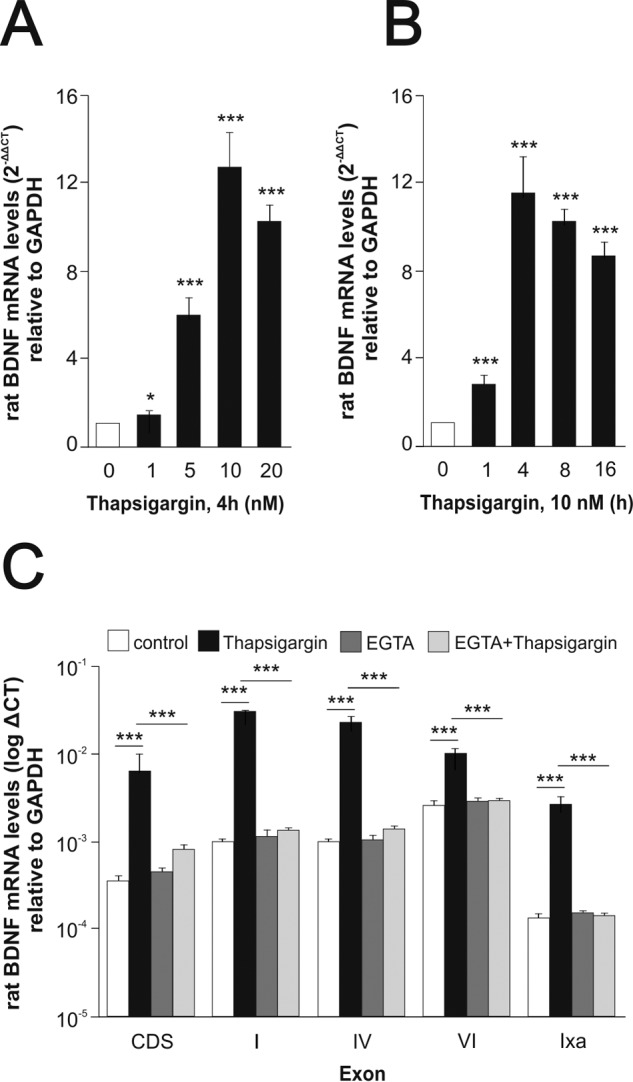
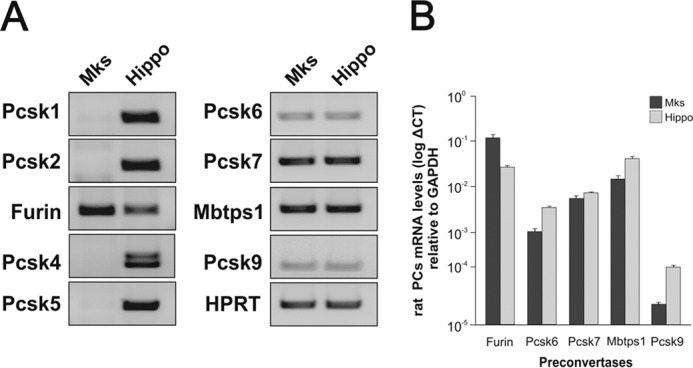
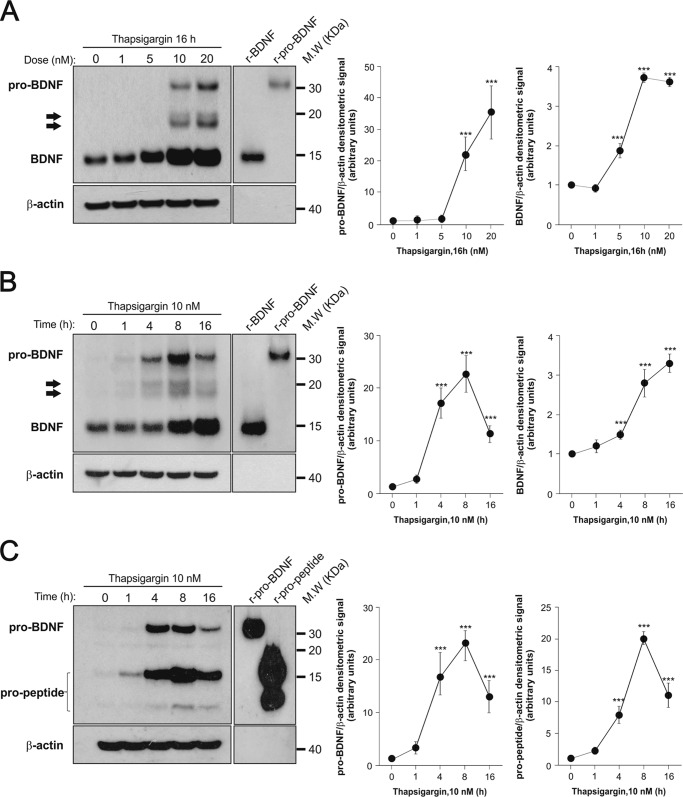
在神经元中,胞浆钙水平的增加早就被认为会激活 Bdnf公司 特别是通过激活启动子I和IV进行转录( 21 ). 由于Mks缺乏电压激活的钙通道,在非电刺激性细胞(如Mks)中添加thapsigargin可以测试相应的 Bdnf公司 启动子对Mks中的钙水平也有反应。 Thapsigargin是肌/内质网钙的选择性抑制剂 2+ -ATP酶,继而导致细胞表面储存操作的钙通道开放,细胞质钙水平增加( 22 ). 我们发现在纳米摩尔浓度下( 图3 A类 ),thapsigargin以时间依赖的方式大量激活转录( 图3 B类 ). 这种增加主要是由于外显子I、IV和IXa的贡献,外显子VI的贡献较小( 图3 C类 ). 然后我们测试了复合细胞外钙是否会降低thapsigargin诱导的 Bdnf公司 发现2.5米 米 通过与蛋白质编码序列对应的引物或外显子特异性引物评估,EGTA完全阻断了thapsigargin的诱导作用( 图3 C类 ). 为了进一步验证细胞内钙水平调节的概念 Bdnf公司 转录后,我们检测了钙离子载体离子霉素的作用。 当添加到成熟的Mk培养基中4小时时,它增加了 Bdnf公司 mRNA增加10.50±1.85倍( n个 =3,平均值±S.E.)。 由于对任何细胞类型内源性BDNF的生物合成知之甚少,我们当时很想知道Mk翻译和处理机制将如何应对 Bdnf公司 thapsigargin引起的mRNA水平。 我们在10n时发现 米 thapsigargin不仅导致加工(或成熟)BDNF的显著增加,而且还导致易于检测到的前BDNF水平,这表明thapsigargin诱导的转录增加可能暂时饱和Mks的前BDNF处理能力( 图4 , A–C ). 3C11 BDNF单克隆抗体不仅可以识别成熟的BDNF,而且还可以识别(如预期的那样)未加工和部分加工的形式,如 图4 , A类 和 B类 在以前使用异源表达系统的实验中,我们注意到,在前BDNF的furin裂解位点用赖氨酸替换位置-1的精氨酸残基导致了 N个 -糖基化中间产物,与 箭头 在里面 图4 , A类 和 B类 该产物的氨基末端测序表明,使用替代裂解位点生成的产物在成熟BDNF的氨基末端添加了15个残基( 23 ). 该产品显示为 N个 -糖基化的( 21 ). 前BDNF单克隆抗体H1001G的使用独立地证实了前BDNF-的身份,并允许检测BDNF裂解的前肽( 图4 C类 ). 我们注意到,在没有thapsigargin刺激的情况下,前BDNF的稳态水平甚至低于神经元中的水平,在神经元中,我们估计它们约代表10个成熟BDNF分子中的1个分子( 8 , 15 ). 我们还测试了最可能参与成熟BDNF生成的蛋白酶候选物的表达,即furin和前蛋白转化酶7,后者最近被证明是神经元中BDNF处理所必需的( 24 ). 常规的结果( 图5 A类 )和实时定量PCR( 图5 B类 )实验表明,这两种酶都存在于大鼠Mks中,其水平与大鼠海马体中的水平相当( 图5 ). 与此相一致,添加转化酶抑制剂癸酰基-Arg-Val-Lys-精-氯甲基酮在很大程度上阻止了原-BDNF的加工(数据未显示)。
图3。
上调 Bdnf公司 thapsigargin的mRNA。 细胞外钙的影响。 剂量反应( A类 )和时间进程( B类 )第页,共页 Bdnf公司 thapsigargin治疗后大鼠Mks的mRNA表达。 纯化的成熟大鼠Mks在有或无thapsigargin或以指定浓度使用的载体(DMSO)的情况下培养( A类 )以及不同的时间长度( B类 ). 提取总mRNA并进行反转录,然后使用特异性引物对编码序列进行实时定量PCR扩增得到的cDNA Bdnf公司。 C, thapsigargin诱导的细胞外钙依赖 Bdnf公司 mRNA增加。 大鼠Mks预孵育2.5 m 米 37°C下EGTA 1.5小时,然后10 n 米 用特异性引物对thapsigargin的编码序列进行实时定量PCR,分析其mRNA表达 Bdnf公司 ( 客户尽职调查 )或外显子特异性引物。 所有值均为平均值±S.E.,一式三份,基于三个独立实验。 除非另有说明,否则所有统计值均与对照组进行比较。 *, 第页 < 0.05; ***, 第页 <0.001(成对 t吨 测试)。
图4。
thapsigargin对大鼠Mks中前BDNF、成熟BDNF和前肽的影响。 剂量反应( A类 )和时间进程( B类 )显示了thapsigargin治疗后大鼠Mks产生的前BDNF和成熟BDNF蛋白。 成熟的Mks在指定剂量的thapsigargin下培养16小时( A类 )或10 n 米 指定时间的thapsigargin( B类 ). 每条泳道装载40微克蛋白质,将印迹膜与Icosagen开发的小鼠单克隆抗体3C11孵育。 箭头 表示前BDNF的中间蛋白水解产物( C类 ). 10n孵育大鼠Mks产生的前BDNF和前肽蛋白的时间进程 米 指定时间段内的thapsigargin。 每条泳道装载80微克蛋白质,将印迹膜与GeneCopeia,Inc.开发的小鼠单克隆抗体H1001G孵育。所示的印迹是具有类似结果的三个独立实验的代表。 图 显示三个单独实验的斑点定量密度值的平均值±S.E。 ***, 第页 <0.001(成对 t吨 测试对比了相应的控制)。 重组BDNF(150–300 pg)、抗劈裂重组原-BDNF(0.5–1 ng)和重组前肽(1–10 ng)用作分子质量标记物,β-肌动蛋白抗体用作负荷对照。
图5。
原代MKs中前蛋白转化酶的差异表达。 常规( A类 )和实时定量( B类 )显示了使用特定引物和从成熟培养大鼠Mks和成年海马提取的RNA进行PCR。 请注意,尽管成绩单,包括 Pcsk1、PcsK2、Pcsk4、, 和 5件 ,在海马组织中表达,在Mks中未检测到( A类 ). 两种组织中表达的前蛋白转化酶的比较表达水平如所示 B类 .所有值均为三份平均值±S.E.,并基于三个独立实验。
讨论 Mks原代培养的结果表明,这些细胞是血小板和血清中BDNF的主要来源。 首先,Mks含有易于检测的BDNF蛋白水平。 其次,BDNF储存在Mks的α颗粒中,长期以来,它也被认为是血小板中各种生长因子和细胞因子的储存室( 25 ). 第三,BDNF可以在proplatelet中可视化( 图1 D类 )这表明血小板在开始与Mks分离时含有BDNF。 第四 BDNF公司 该基因在大鼠和人类Mks中的表达水平相对较高,但相比之下,小鼠的表达水平要低得多。 值得注意的是,小鼠转录物不包括外显子I,这使得BDNF mRNA的高效翻译成为可能( 20 ). 与大鼠和人类血清不同,小鼠Mks的阴性结果是显著的,因为它与小鼠血清中BDNF检测水平的缺乏有关( 18 ). 综上所述,循环血小板似乎是血清中BDNF的唯一重要来源,一旦充满了由Mks遗传的α颗粒包裹的BDNF。 其他来源,如内皮细胞或免疫细胞,确实表达 BDNF公司 低水平基因( 26 , 27 )由于在小鼠血清中检测不到BDNF的水平,因此似乎对BDNF循环水平没有显著影响( 18 ). 此外,在人和大鼠血浆中发现的BDNF水平很低,实际上可能是血小板释放的微粒或外泌体所致( 28 ). 有趣的是,人类血小板和血清中的BDNF水平大约是大鼠的10倍。 目前,这种差异的原因尚不清楚,血小板中BDNF的功能也不清楚。 小鼠血小板中BDNF的缺乏表明,无论血小板源性BDNF的生物学作用如何,它在小鼠中可能是多余的,具有其他血小板源性生长因子的功能。 基于小且普遍存在的细胞碎片循环的信号系统,包括装载有强大神经营养因子的外泌体,具有与人脑功能相关的功能潜力。 由于血液流动受到神经活动的严密调节( 29 )可以想象,在人类外泌体中装载了BDNF( 30 )可能以依赖活动的方式传递到大脑,这可能解释了体育锻炼的有益影响。 尽管目前这只是一个猜测,但BDNF在血小板中发挥功能作用的可能性现在可以通过工程小鼠基因组来测试,以便在人类中复制这种情况。 另外,可以想象,人类血小板中BDNF的功能意义可能与成年雄性小鼠颌下腺中NGF和EGF的功能意义一样神秘( 31 ).
大鼠和人血清中BDNF的细胞来源以前没有被发现,这似乎令人惊讶,特别是考虑到BDNF作为人类血液中的生物标记物的广泛使用( 32 ). 对相应文献的分析表明,在专门解决人类Mks中BDNF表达问题的实验早期,获得了负面结果( 16 ). 这些实验是用巨核细胞系DAMI和Meg-01进行的,并得出结论: BDNF公司 基因在细胞中不表达( 16 ). 尽管我们证实了这些结果,但这些肿瘤细胞系似乎无法如实地复制Mk成熟的晚期,这在容易膨胀的肿瘤细胞中并不罕见。 在这一负面结果之后,血小板中BDNF的存在被推测为来自大脑等来源的假设摄取。 然而,与5-羟色胺不同,这一概念尚未被可信的机制所证实。5-羟色宁是一种神经递质,长期以来被血小板膜上的特定转运体摄取后,积聚在血小板致密颗粒中。
将Mks确定为血小板中BDNF的来源,改变了人们普遍持有的观点,即人的血清BDNF水平反映了其在大脑中的水平。 除了我们的发现外,长期以来已经证实,放射性标记的BDNF注射到外周循环时不会到达大脑( 33 ). 因此,BDNF水平在不同条件下的变化,包括体育锻炼后的增加( 14 )或在抑郁发作期间减少( 13 ),需要其他可信的解释,可以想象这些变化可能反映了不同程度的血小板活化( 34 ). 此外,有新证据表明Mks发育的造血生态位( 35 )受外周神经系统支配,造血细胞可能对神经衍生信号作出反应( 36 ). 然而,目前尚不清楚这些刺激是否会改变Mks中BDNF的表达水平。
关于内源性BDNF的生物合成,我们的结果表明Mks可以代表神经元的另一种细胞模型,面对这些细胞中BDNF水平的极低表达水平,很难对其进行研究。 通过与脑中BDNF水平的比较( 11 )比较大脑提取物和纯化血小板时,人类血小板中BDNF的水平明显更高,是每毫克蛋白质的100–1000倍( 12 ). 特别是,Mks为研究内源性BDNF的生物合成和前BDNF可能的作用提供了一个新的机会。 thapsigargin的转录激活导致可以清楚地检测到前BDNF水平,而无需事先通过免疫沉淀进行富集。 鉴于当前与Val相关的利息 → pro-BDNF中的Met替代( 三 ),相应基因型的人类Mk可能代表了一个有趣的细胞模型,以了解这种氨基酸置换的生化后果。
总之,我们的结果有助于阐明人血液中BDNF的细胞来源; 他们描述了一个易于控制的细胞系统来研究内源性BDNF的生物合成。
作者贡献 P.C.F.设计、执行和分析了 图1 – 5 K.S.也参与其中。 T.M.、M.C.和C.G.参与了与人类、大鼠和小鼠Mks相关的工作的所有方面,并参与了结果的解释。 Y.A.B.帮助启动了项目,设计了实验,并解释了结果。 所有人都阅读了手稿并讨论了其内容。 最终版本得到了所有人的批准。
致谢 我们感谢Mike Greenberg、Michael Frotscher和Hayley Dingsdale的有益讨论。
* 这项工作得到了威尔士生命科学研究网络的支持,该网络是由威尔士政府的Ser Cymru计划资助的一项倡议,以及国家卫生研究院拨款RP-PG-0310-1002(发给C.G.)。
2 使用的缩写如下:
BDNF公司 脑源性神经营养因子
完全用户体验 血小板生成素
TRITC公司 四甲基罗丹明异硫氰酸酯
马克 巨核细胞。
工具书类
1. Park H.和Poo M.M.(2013)神经营养素对神经回路发育和功能的调节。 神经科学自然评论。 14, 7–23 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Zagrebelsky M.和Korte M.(2014)《形式遵循功能:BDNF及其参与塑造突触的功能和结构》。 神经药理学 76, 628–638 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Egan M.F.、Kojima M.、Callicott J.H.、Goldberg T.E.、Kolachana B.S.、Bertolino A.、Zaitsev E.、Gold B.、Goldman D.、Dean M.、Lu B.和Weinberger D.R.(2003)BDNF val66met多态性影响BDNF的活性依赖性分泌、人类记忆和海马功能。 单元格 112, 257–269 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
4 Gray J.、Yeo G.S.、Cox J.、Morton J.、Adlam A.L.、Keogh J.M.、Yanovski J.A.、El Gharbawy A.、Han J.C.、Tung Y.C.、Hodges J.R.、Raymond F.L.、O'rahilly S.和Farooqi I.S.(2006)暴食症、严重肥胖、认知功能受损, 与脑源性神经营养因子(BDNF)基因一个拷贝功能缺失相关的多动症。 糖尿病 55, 3366–3371 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
5 Leibrock J.、Lottspeich F.、Hohn A.、Hofer M.、Hengerer B.、Masiakowski P.、Thoenen H.和Barde Y.A.(1989)脑源性神经营养因子的分子克隆和表达。 自然 341, 149–152 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
6 McDonald N.Q.和Hendrickson W.A.(1993)包含胱氨酸结基序的生长因子结构超家族。 单元格 73, 421–424 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
7 Suter U.、Heymach J.V.Jr.和Shooter E.M.(1991)NGF前肽中的两个保守结构域对于正确加工和生物活性NGF的生物合成是必要的和充分的。 EMBO期刊10,2395–2400 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
8 Matsumoto T.、Rauskolb S.、Polack M.、Klose J.、Kolbeck R.、Korte M.和Barde Y.A.(2008)内源性BDNF的生物合成和处理:中枢神经系统神经元存储和分泌BDNF,而不是前BDNF。 自然神经科学。 11, 131–133 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9. Yang J.、Siao C.J.、Nagappan G.、Marinic T.、Jing D.、McGrath K.、Chen Z.Y.、Mark W.、Tessarollo L.、Lee F.S.、Lu B.和Hempstead B.L.(2009)proBDNF的神经释放。 自然神经科学。 12, 113–115 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
10 Yamamoto H.和Gurney M.E.(1990)人类血小板含有脑源性神经营养因子。 《神经科学杂志》。 10, 3469–3478 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Barde Y.A.、Edgar D.和Thoenen H.(1982)从哺乳动物大脑中纯化一种新的神经营养因子。 EMBO期刊1549–553 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Burnouf T.、Kuo Y.P.、Blum D.、Burnouv S.和Su C.Y.(2012)人类血小板浓缩物:溶剂/洗涤剂处理的高浓缩脑源性神经营养因子的来源。 输血 52, 1721–1728 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
13 Munkholm K.、Vinberg M.和Kessing L.V.(2016)《双相情感障碍中的外周血脑源性神经营养因子:一项综合系统综述和荟萃分析》。 分子精神病学 21, 216–228 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
14 Szuhany K.L.、Bugatti M.和Otto M.W.(2015)运动对脑源性神经营养因子影响的荟萃分析综述。 《精神病学杂志》。 第60、56–64号决议 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
15 Dieni S.、Matsumoto T.、Dekkers M.、Rauskolb S.、Ionescu M.S.、Deogracias R.、Gundelfinger E.D.、Kojima M.、Nestel S.、Frotscher M.和Barde Y.A.(2012)BDNF及其前肽储存在脑神经元突触前致密核心小泡中。 《细胞生物学杂志》。 196, 775–788 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
16 Kolbeck R.、Bartke I.、Eberle W.和Barde Y.A.(1999)野生型和神经营养素基因突变小鼠神经系统中的脑源性神经营养因子水平。 神经化学杂志。 72, 1930–1938 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
17 Kwok S.C.、Chakraborty D.、Soares M.J.和Dai G.(2013)怀孕期间大鼠卵巢中前蛋白转化酶的相对表达。 《卵巢研究杂志》6,91。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
18. Radka S.F.、Holst P.A.、Fritsche M.和Altar C.A.(1996)通过灵敏和特异性免疫分析检测到脑源性神经营养因子在大脑、人和大鼠中的存在,而不是小鼠血清中的存在。 大脑研究709、122–301 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 Zeiler M.、Moser M.和Mann M.(2014)跨越完整丰度范围的小鼠血小板蛋白质组的拷贝数分析。 分子细胞。 蛋白质组学 13, 3435–3445 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
20 Koppel I.、Tuvikene J.、Lekk I.和Timmusk T.(2015)BDNF外显子I.J.神经化学中翻译起始密码子的有效使用。 134, 1015–1025 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
21 West A.E.、Pruunsild P.和Timmusk T.(2014)《神经营养素:转录和翻译》。 把手b。 实验药理学。 220, 67–100 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
22 Cheng K.T.、Ong H.L.、Liu X.和Ambudkar I.S.(2011)TRPC1和Orai1对Ca的贡献 2+ 因存储耗尽而激活的条目。 高级实验医学生物。 704, 435–449 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
23 Kolbeck R.、Jungbluth S.和Barde Y.A.(1994)《神经营养素二聚体和单体的表征》。 欧洲生物化学杂志。 225, 995–1003 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
24 Wetsel W.C.、Rodriguiz R.M.、Guillemot J.、Rousselet E.、Essalmani R.、Kim I.H.、Bryant J.C.、Marcinkiewicz J.、Desjardins R.、Day R.、Constam D.B.、Prat A.和Seidah N.G.(2013)前蛋白转化酶PC7表达的中断会降低BDNF的产生,并影响小鼠的学习和记忆。 Proc。 国家。 阿卡德。 科学。 美国110、17362–17367 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
25 Maynard D.M.、Heijnen H.F.、Horne M.K.、White J.G.和Gahl W.A.(2007)使用质谱法对血小板α颗粒进行蛋白质组学分析。 J.血栓。 止血。 5, 1945–1955 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
26 Kerschensteiner M.、Gallmeier E.、Behrens L.、Leal V.V.、Misgeld T.、Klinkert W.E.、Kolbeck R.、Hoppe E.、Oropeza-Wekerle R.L.、Bartke I.、Stadelmann C.、Lassmann H.、Wekerle H.和Hohlfeld R.(1999)激活的人类T细胞、B细胞和单核细胞产生脑源性神经营养因子 在体外 在炎症性脑损伤中:炎症的神经保护作用? 《实验医学杂志》189、865–870 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
27 Snapyan M.、Lemasson M.、Brill M.S.、Blais M.、Massouh M.、Ninkovic J.、Gravel C.、Berthod F.、Götz M.、Barker P.A.、Parent A.和Saghatelyan A.(2009)《血管学》通过脑源性神经营养因子信号引导成年哺乳动物前脑中迁移的神经元前体。 《神经科学杂志》。 29, 4172–4188 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
28 Heijnen H.F.、Schiel A.E.、Fijnheer R.、Geuze H.J.和Sixma J.J.(1999)活化血小板释放两种类型的膜泡:通过表面脱落的微泡和来自多泡体和α颗粒胞吐的外泌体。 血液 94, 3791–3799 [ 公共医学 ] [ 谷歌学者 ]
29 Hillman E.M.(2014)BOLD信号的耦合机制和意义:状态报告。 每年。 神经科学评论。 37, 161–181 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
30 Aatonen M.T.、Ohman T.、Nyman T.A.、Laitine S.、Gronholm M.和Siljander P.R.(2014)血小板衍生细胞外囊泡的分离和表征。 J.Extracell公司。 囊泡 3,10.3402/jev.v3.24692 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
31 Cohen S.(2008)生长因子的起源:NGF和EGF。 生物学杂志。 化学。 283, 33793–33797 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 Polyakova M.、Stuke K.、Schuemberg K.、Mueller K.、Schoenknecht P.和Schroeter M.L.(2015)BDNF作为成功治疗情绪障碍的生物标志物:一项系统性和定量的荟萃分析。 J.影响。 迪索德。 174, 432–440 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
33 Pardridge W.M.、Kang Y.S.和Buciak J.L.(1994)人类重组脑源性神经营养因子(BDNF)通过大鼠血脑屏障的转运 体内 使用载体介导的肽药物传递。 药学研究11,738–746 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
34 Kestin A.S.、Ellis P.A.、Barnard M.R.、Errichetti A.、Rosner B.A.和Michelson A.D.(1993)剧烈运动对血小板活化状态和反应性的影响。 循环 88, 1502–1511 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35 Day R.B.和Link D.C.(2014),造血干细胞生态位中的巨核细胞。 《国家医学》第20期,第1233–1234页 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
36 Méndez-Ferrer S.、Michrina T.V.、Ferraro F.、Mazloum A.R.、Macarthur B.D.、Lira S.A.、Scadden D.T.、Ma’ayan A.、Enikolopov G.N.和Frenette P.S.(2010)间充质干细胞和造血干细胞形成了独特的骨髓生态位。 自然 466, 829–834 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
《生物化学杂志》的文章由 美国生物化学和分子生物学学会