摘要
反应性星形细胞增多症在包括癫痫在内的许多神经疾病中发生。对星形胶质细胞对病理生理学的贡献知之甚少。检查这一点的研究被反应性星形细胞增多症的合并症所混淆。我们发现,高滴度AAV-eGFP星形胶质细胞转导可诱导反应性星形胶质细胞增多,但不会改变邻近神经元的固有特性或解剖结构。我们使用选择性星形细胞诱导来检测小鼠CA1锥体神经元中突触传递的结果。eGFP标记的反应性星形胶质细胞附近的神经元表现出抑制性突触电流减少,但兴奋性突触流没有减少。这种IPSC侵蚀是由于星形细胞谷氨酸-谷氨酰胺循环的失败所致。反应性星形胶质细胞下调谷氨酰胺合成酶的表达。阻断这种酶通常会导致突触GABA快速耗竭。在星形胶质细胞区域,残留抑制对谷氨酰胺合成酶阻断失去敏感性,而外源性谷氨酰胺给药增强了IPSC。星形胶质细胞介导的抑制缺陷触发了海马回路中谷氨酰胺可逆性超兴奋性。反应性星形细胞增多可能因此产生局部突触紊乱,导致与神经疾病相关的更广泛的功能缺陷。
关键词:腺相关病毒、反应性星形胶质细胞、胶质细胞、突触传递、抑制、谷氨酸-谷氨酰胺循环、海马、斑贴
星形胶质细胞调节整个大脑的突触功能1–三其中一个值得注意的方面是这些细胞在神经递质循环中所起的作用。突触释放后,胶质细胞限制扩散、隔离、灭活和再循环各种小分子神经递质,包括谷氨酸、GABA和儿茶酚胺4–6在谷氨酸和GABA的情况下,调节再循环的关键星形细胞酶是谷氨酰胺合成酶,它在胶质细胞摄取这种神经递质后从谷氨酸中产生谷氨酰胺。谷氨酰胺通过神经胶质和神经元特异性谷氨酰胺转运体被转运回突触前末端,并通过线粒体酶谷氨酰胺酶转化为谷氨酸4,7,可直接或在转化为GABA后在突触功能中重复使用。
这种被称为谷氨酸-谷氨酰胺循环的多细胞酶过程对维持持续的突触功能至关重要。谷氨酰胺循环中断后抑制性突触失效8,9而兴奋性突触有足够的谷氨酸储备来暂时维持功能10在各种中枢神经系统疾病状态下,包括癫痫、帕金森氏病、阿尔茨海默氏病、中风和创伤性脑损伤,越来越多的证据表明谷氨酸-谷氨酰胺循环功能受损11–16所有这些病理条件也与星形细胞病变的发展有关,称为反应性星形细胞增多症。
反应性星形细胞增多症的定义和特征是脑损伤和/或疾病区域的细胞体和星形细胞突起的粗大肥大17伴随着这些解剖变化,胶质细胞骨架蛋白、胶质纤维酸性蛋白(GFAP)和波形蛋白的表达增强17,18因此,这两种蛋白的增强表达在评估反应性胶质增生症的发展中具有诊断价值。反应性星形细胞增多症最受实验关注的疾病是颞叶癫痫(TLE)19TLE的病理特征是内侧颞叶硬化,定义为海马和相关颞叶结构中的节段性神经元丢失和反应性星形细胞增多。
在TLE中,一系列表型变化伴随着反应性星形胶质细胞的细胞肥大。其中值得注意的是对谷氨酰胺循环功能至关重要的蛋白质的表达减少,包括谷氨酰胺合成酶和星形细胞谷氨酸摄取转运体EAAT1和EAAT211–13(但请参见20).认识到这些蛋白质在神经递质吸收和再循环中发挥的关键作用,导致了一种假说,即与反应性星形细胞增多症发展相关的谷氨酰胺循环缺陷可能是癫痫病表型的促成因素8,12,19然而,试图批判性评估这一假设的研究受到了TLE患者海马和癫痫动物模型中明显的结构和功能变化的广泛限制。
在本研究中,我们利用了以下观察结果:星形胶质细胞的高滴度病毒转导导致选择性病毒诱导的反应性星形胶质细胞增生,而相邻神经元和小胶质细胞没有发生改变。利用该模型,我们评估了病毒诱导的反应性星形细胞增多对海马CA1区突触传递的影响。我们发现,星形细胞作用会导致抑制性突触传递的特定缺陷,从而导致电路功能调节的中断,从而增强兴奋性。这可能导致TLE下癫痫发作敏感性升高。
结果
反应性星形细胞增多症的病毒诱导
我们评估了六种腺相关病毒(AAV)假型的转导模式:AAV2/1、2/2、2/5、2/7、2/8和2/9。其中,AAV2/1、AAV2/5、AAV2/7和AAV2/9在诱导CMV启动子驱动的海马eGFP表达方面最有效(图S1).AAV2/9表现出优先的神经元向性,而AAV2/5主要标记星形胶质细胞,显示出eGFP与星形胶质细胞标志物GFAP(85%,图S1、S2).用GFAP启动子(gfa104)替代CMV可将星形胶质细胞特异性表达增加至>99%(图1).我们观察到AAV2/5 eGFP与NG2阳性少突胶质细胞祖细胞、成熟少突胶质胶质细胞或小胶质细胞没有共同定位(图S3)再次表明AAV2/5对星形胶质细胞具有优先向性。AAV2/5转导的星形胶质细胞以病毒滴度依赖性细胞肥大为特征,这与病毒激活星形胶质细胞一致(图1e–g,图2).在星形胶质细胞增生症发展过程中给予溴脱氧尿苷(BrdU)1周,仅标记1%的eGFP/GFAP阳性星形胶质细胞,表明病毒诱导的肥大发生在没有增生的情况下。GFAP和波形蛋白的上调是星形胶质细胞反应性的两个最显著的生化标记17注射高浓度(3×1010基因组拷贝数(GC)/注射),但不低于(1×109GC/注射)AAV2/5-gfa104-eGFP滴度(图2a–h、q、r).在缺乏小胶质细胞反应性的情况下,局部诱导反应性星形细胞增多(图S4).此外,高滴度AAV2/9并没有诱导反应性星形胶质细胞增多,这表明星形胶质细胞活化不是对海马内注射病毒或神经元转导的炎症反应(图S5).
图1。星形胶质细胞特异性eGFP表达。
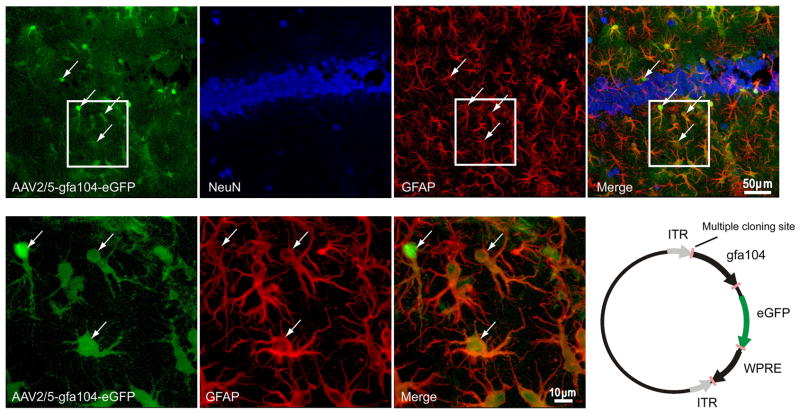
(a–d)共焦图像描绘(一)病毒注射诱导eGFP表达(绿色)(b条)NeuN免疫染色(蓝色),以及(c(c))海马区GFAP(红色)。 (d日)eGFP与GFAP(星形胶质细胞标记物;箭头)共定位,但与NeuN(神经元标记物)不共定位。 (e–g)高倍图像显示eGFP荧光与GFAP染色联合标记。 (小时)AAV2/5-gfa104-eGFP质粒示意图(详见方法)。
图2。AAV2/5-gfa104-eGFP诱导星形胶质细胞的效价依赖性反应。
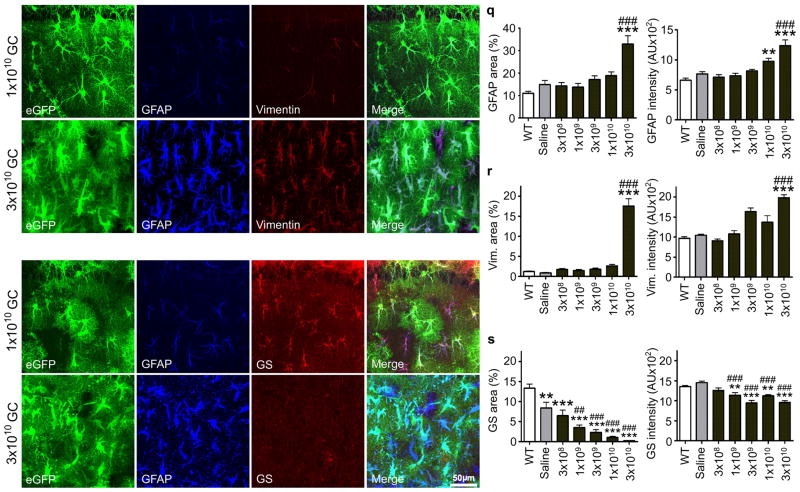
(a–d)注射低病毒滴度(1×109GC/注射),eGFP+细胞表现出正常的星形细胞形态,GFAP和波形蛋白染色水平较低。 (e–h)相反,eGFP+高滴度注射标记细胞(3×1010GC/注射)显示典型的反应性星形胶质细胞肥大形态(e(电子))以及强烈的GFAP和波形蛋白染色(f、 克). (i–l)注射低滴度eGFP后+/GFAP公司+细胞显示正常的星形细胞形态,对谷氨酰胺合成酶(一种星形细胞特异性酶)具有免疫反应性。 (米–第页)高滴度注射导致eGFP中谷氨酰胺合成酶免疫反应性丧失+/GFAP公司+细胞。合并的图像如所示d、 小时,小时和第页. (q–s)辐射层GFAP、波形蛋白和谷氨酰胺合成酶免疫染色的滴度依赖性。表达水平被量化为免疫反应超过背景阈值强度的区域和平均免疫反应强度。**,p<0.01;***,p<0.001,相对于野生型动物。##,p<0.01;###,p<0.001,相对于盐水注射动物。误差线,s.e.m。
几项研究表明,谷氨酰胺合成酶水平降低与癫痫病理生理学中星形细胞增多症的发生有关11,12,21与这些发现一致,我们观察到注射高滴度AAV2/5后谷氨酰胺合成酶表达显著下调(图2i–p,s),但不等于AAV2/9滴度(图S5g).这也与GFAP和波形蛋白表达增强有关(图2,图S6).由于星形胶质细胞谷氨酰胺合成酶是大脑中产生谷氨酰胺的主要酶,这些结果表明,反应性星形细胞增多症的发展将中断神经元谷氨酰胺的供应,并应在位于反应性星形胶质细胞(eGFP)聚居区的神经元中产生抑制性神经传递缺陷+区域)。
星形细胞区IPSC的基础和动态失效
为了评估反应性胶质增生症对突触效能的影响,我们首先记录由局部中间神经元刺激引起的CA1锥体神经元的单突触抑制反应(eIPCS)。eGFP内神经元中的eIPCS+无论是对照动物的神经元还是eGFP中的神经元,其面积都明显小于eIPCS−AAV2/5治疗动物的面积(图3a).eGFP细胞中eIPCS的振幅分布+区域倾向于小幅度事件(偏度=1.15±0.51,p=0.002,K-S检验),与对照细胞群(p=0.013,K-S测试)显著不同,低幅度(<50 pA)成分占所有反应的55%(图3b).幼年动物、注射AAV2/9和eGFP的动物的神经元记录的eIPSC振幅分布−注射AAV2/5的动物的面积没有显著差异(幼年平均eIPSC:91.74±12.62 pA,n=11;AAV2/9:99.9±12 pA,n=8;eGFP−:87±15,n=7),并汇总用于分析(图3b).该复合对照组细胞的eIPSC振幅分布正常(偏斜度=0.46±0.46,p=0.2,K-S检验),大多数eIPCS在51–100 pA范围内。在一系列对照实验中,我们向动物注射低滴度AAV2/5(1×109GC/注射),不诱导反应性星形细胞增多(图2).来自低滴度AAV2/5 eGFP的锥体细胞中低(<50 pA)和高(>50 pA+区域与对照动物细胞中的相应频率没有差异(p=0.37,n=12,二项检验,振幅分布没有总体差异p=0.3,K-S检验,图S7).此外,来自高滴度AAV2/5 eGFP的细胞之间的配对脉冲比率相似+区域和对照细胞,与GABA能突触释放到两组细胞上的类似初始概率一致(对照PPR=0.51±0.02,n=4,AAV2/5 PPR=0.55±0.06,n=5,p=0.56)。
图3。靠近反应性星形胶质细胞的CA1锥体细胞的抑制性神经传递受损。
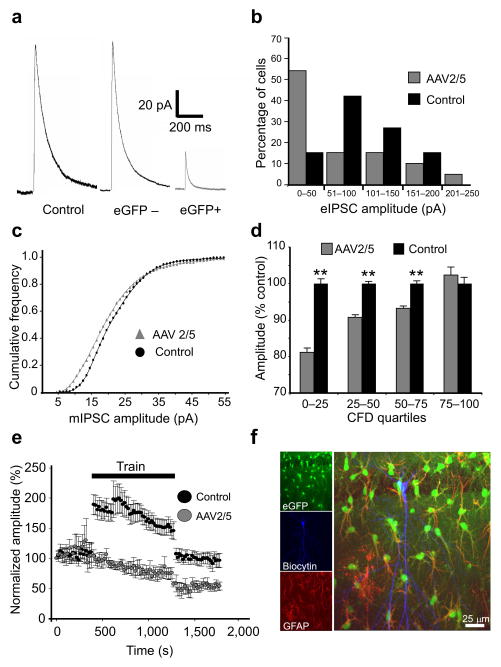
(一)来自远端控制细胞和锥体细胞(eGFP)的eIPCS样本痕迹−)和近端(eGFP+)AAV2/5转导的星形胶质细胞。eIPSCs在邻近反应性星形胶质细胞的神经元中要小得多(b条)对照组和AAV2/5注射动物CA1神经元eIPSC振幅分布直方图。eGFP中的IPSC分布+与对照组相比,神经元倾向于较小的值。 (c(c))4个AAV2/5和6个对照细胞的mIPSC振幅的累积频率分布。注意,与对照组相比,AAV2/5细胞中的振幅分布向左偏移,小振幅mIPSC最大偏移(分布显著不同,p=0.001,K-S检验)。 (d日)AAV2/5和对照细胞中的mIPSC振幅按四分位数分组,归一化为对照组的mIPCC平均值,并进行比较。AAV2/5神经元中mIPSC减少的程度随着人群分布四分位数的增加而逐渐减少(**,p<0.001,K-S检验,误差条,S.e.m.)。 (e(电子))对照组和AAV2/5细胞在训练刺激之前、期间和之后诱发反应的平均时间序列(每20秒以50 Hz频率4次脉冲,持续15分钟),标准化为第一次诱发事件的振幅。火车刺激会引起注射AAV2/5的细胞中eIPCS的长期抑制(至少持续记录8分钟以上),而非对照动物。误差线,s.e.m((f))一个典型的CA1锥体细胞,充满由eGFP(绿色)/GFAP(红色)阳性星形胶质细胞包围的生物细胞素(蓝色)。
接下来,我们通过在河豚毒素和谷氨酸能拮抗剂存在下记录自发的微型IPSC(mIPSC)来研究量子突触后反应。eGFP神经元记录的mIPSC振幅分布+区域相对于对照左移(图3c、d).eGFP神经元的mIPSC频率也减少了35%+区域(AAV2/5:10.3±1.8 Hz;控制:15.8±1.4 Hz,p=0.04),可能是由于AAV2/5细胞中的小事件子集低于噪声阈值。两组之间的mIPSC衰减时间动力学没有差异(AAV2/5:τw个=6.3±1.1毫秒;控制:τw个=6.4±1.1毫秒)。这些数据支持这样的观察,即星形细胞反应性区域内的神经元表现出明显的抑制性神经传递的基础缺陷。此外,小振幅而非大振幅mIPSC的优先损害与该缺陷的突触前起源一致22(见讨论)。
为了评估锥体神经元在类似于体内表现的持续激活条件下的抑制性突触功能,我们记录了长时间刺激序列产生的eIPCS。该序列由4个脉冲的50 Hz脉冲组成,每20秒持续15分钟。在控制单元中,eIPSC振幅在序列中显著增加(204±16%的预处理值,n=10,p=0.004,配对t检验),但在序列刺激后恢复到预处理值(102±8%,图3e).相反,eGFP内神经元的eIPSC振幅+面积(c.f。图3f)在训练期间没有增强(训练前值的96.5±8.7%,n=10),在训练刺激后,降低到训练前值57.5±9.4%(图3e,与对照组相比p=0.003)。
星形胶质细胞释放一些分子来修饰神经元活动,包括ATP2和谷氨酸23为了评估伴随病毒诱导反应的星形胶质细胞释放的改变是否可以解释上述抑制失败,我们阻断了这些胶质递质的神经元受体。在AAV2/5动物的切片中,添加嘌呤(P2)、腺苷(A1)和mGluR II/III拮抗剂(PPADS(50μM)、DCPX(800 nM)和CPPG(300μM),分别)没有显著改变eIPCS或eEPSC相对于在没有这些药物的情况下诱发的反应的振幅或电荷转移(在有拮抗剂的情况下:eIPCS振幅:48.2±9.4,n=6,p=0.121,eIPSC电荷:2.45±0.61,n=5,p=0.174;eEPSC振幅:−154.8±70 pA,n=4,p=0.168,eEPSC电荷:0.54±0.27,n=4,p=0.5)。
兴奋信号未被病毒诱导的星形细胞增多所改变
接下来我们检测了反应性星形细胞增多区域的兴奋性突触后电流(eEPSCs)。在缺乏谷氨酸和GABA的情况下记录到复合突触反应A类受体拮抗剂。在这些条件下,可以看到eIPCS跟随eEPSC,这些eEPSC是由锥体细胞树突上Schaffer侧支突触的激活引起的(图4a).eGFP中细胞的eEPSC振幅和电荷+区域与对照细胞无显著差异(图4b).在相同的EPSC/IPSC复合记录中,AAV2/5 eGFP附近神经元的IPSC振幅和电荷显著降低+单元格与控件的比较(图4c)与eGFP的55%相似+单突触记录中可见具有小eIPCS的神经元(图3b).
图4。靠近反应性星形胶质细胞的CA1锥体神经元中保留的兴奋性神经传递。
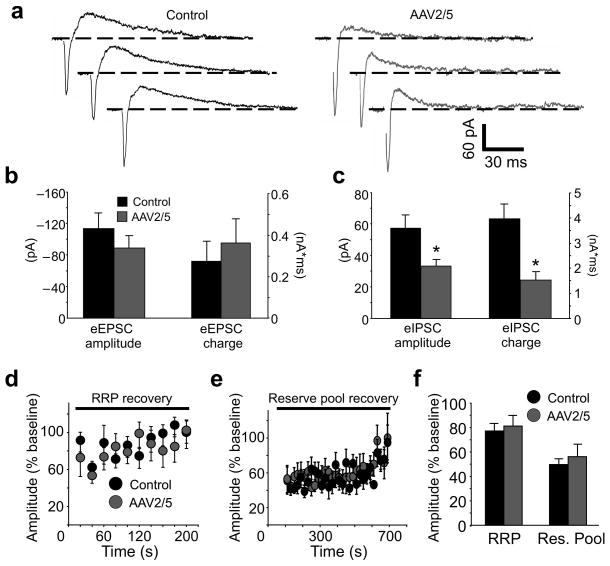
(一)在缺少谷氨酸和GABA的情况下,对照组和AAV2/5切片中CA1锥体细胞的痕迹A类受体拮抗剂(V持有=−40毫伏)。eIPSC在每个跟踪中都跟随eEPSC。请注意,EPSC的振幅相似,而IPSC减小。 (b、 c(c))eEPSC和eIPSC振幅和电荷转移直方图。eEPSC振幅和电荷转移相似(eEPSC幅度:控制n=10,AAV2/5 n=15,p=0.34;eEPSC电荷:控制n=9,AAV2/5 n=12,p=0.59),而eIPSC振幅和荷电转移在AAV2/5电池中都较小(eIPSC幅度:控制n=6,AAV2/5 n=12,*,p=0.014;eIPSC电荷:控制n=6,AAV1/5 n=12,*,p=0.006)。AAV2/5 eIPSC平均值不包括在用于引发兴奋性反应的刺激强度下未能显示eIPSC的两个细胞。 (d、 e(电子))eEPSC从RRP(20 Hz,2 s)和储备池(10 Hz,90 s)刺激中恢复的时间进程。在RRP和储备池刺激之前,在10-15个单脉冲(0.07 Hz)期间,振幅归一化为平均(基线)eEPSC。 ((f))平均eEPSC振幅的直方图。在RRP刺激后5分钟和储备池刺激后12分钟内以0.07 Hz的频率诱发eEPSC(对照组RRP n=9,储备池n=8,AAV2/5 RRP n=8,储备池n=7)。无论是对照组(p=0.1)还是AAV2/5组(p<0.35),在没有和存在苦毒毒素的情况下,基础eEPSC电流振幅没有差异。误差条,s.e.m。
然后,我们使用旨在询问囊泡池释放和恢复动力学的刺激方案来研究eEPSC。两个突触小泡群对电刺激作出反应:一个由可立即释放的对接活性区小泡组成的可释放小泡池(RRP)和一个储备池,代表RRP耗尽时吸取的小泡24。短暂的电刺激可以触发RRP释放,而从储备池释放需要延长刺激方案25使用这些公布的刺激参数,并在苦毒毒素(100μM)和D-AP5(50μM)存在的情况下,我们发现从刺激诱导的RRP耗竭和兴奋性突触小泡储备库的恢复在AAV2/5和对照神经元中发生的时间过程相似(图4d–f).然而,在期间无论是RRP还是储备池刺激,对照神经元中eEPSCs的易化性均强于AAV2/5细胞(图S8),暗示了短期可塑性的差异。
综上所述,这些结果表明,病毒诱导的反应性星形细胞增多导致抑制性神经传递的广泛损害,而非兴奋性神经传递。
星形细胞增多不影响神经元膜特性
eGFP中的CA1锥体神经元+在许多膜属性测量中,这些区域与幼稚动物的神经元无法区分(补充表1,图S9).此外,对照组(n=9)和AAV2/5(n=8)细胞的细胞内标记证实了锥体细胞形态的保存、树突状树枝状结构和贴满标签的胞体和轴突附近星形细胞突起的密集排列(图S10).这些结果表明,CA1锥体神经元在结构和功能上仍然是可行的,它们的内在特性不会因局部星形细胞增多而改变。
eGFP抑制性突触强度的变化+AAV2/5治疗动物的区域可能由局部中间神经元的兴奋性改变产生。以锥体细胞树突为靶点的海马中间神经元有多种亚型。我们检测了转基因小鼠GIN中eGFP选择性标记的含有生长抑素的O-LM中间神经元26通过缺乏动作电位调节,从解剖上(通过GFP和Alexa 594荧光)和生理上验证了中间神经元表型。在eGFP中,我们发现6个控制神经元和5个神经元之间的7个基本电生理参数没有差异+AAV2/5切片的面积(补充表2,图S11)表明中间神经元不太可能导致eGFP中锥体细胞的抑制缺陷+地区。
星形细胞增生诱导的glu/gln循环损害抑制
星形胶质细胞谷氨酰胺维持对CA1锥体细胞的抑制作用,阻断谷氨酰胺合成酶可导致eIPCS活性依赖性失败8在对照细胞中,用蛋氨酸亚砜胺(MSO)阻断谷氨酰胺合成酶活性,使列车刺激期间和之后的eIPSC振幅分别降低到无MSO反应的50±7%和47±6%(n=8,图5a).电子GFP+来自高滴度AAV2/5动物的反应性星形胶质细胞显示出谷氨酰胺合成酶表达的显著下调(图2i–l和图S6),这应该可以阻断MSO对eIPSCs的影响。事实上,MSO治疗对eGFP中CA1神经元记录的eIPCS没有影响+地区。训练期间和训练后,这些细胞的eIPSC振幅分别为无MSO反应的98±12%和107±17%(n=9,比较图5a到图3e).
图5。谷氨酸-谷氨酰胺循环缺陷会降低囊泡GABA的浓度。
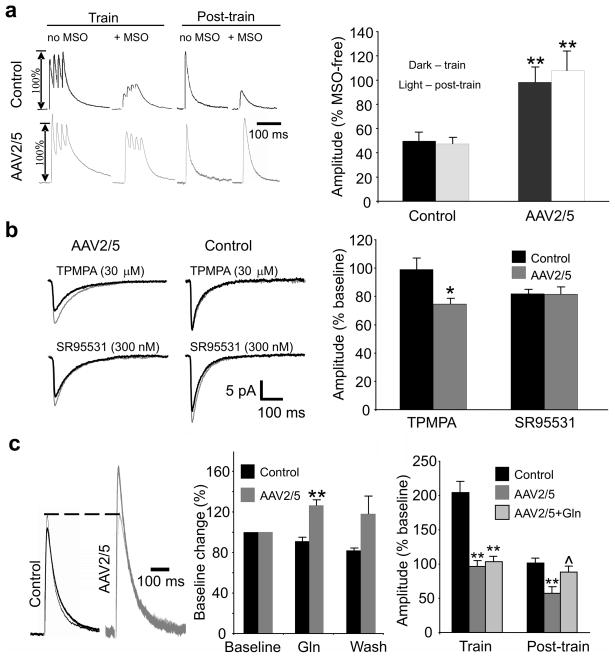
(一)左侧,MSO处理细胞与未暴露于MSO的细胞在列车刺激期间和之后的eIPCS比较。赖特,在MSO(1.5 mM)中孵育后,列车刺激对eIPSC振幅的影响表示为与无MSO时记录的eIPCS相比变化的%(c.f。图3e).MSO会触发对照组eIPSC振幅的活性依赖性降低,但不会触发AAV2/5细胞(**,与对照组相比p<0.001)。 (b条)左侧,mIPSC在TPMPA和SR95531不存在(薄记录道)和存在(厚记录道)时的平均值。赖特,TPMPA显著降低AAV2/5 eGFP神经元的mIPSC振幅+细胞(AAV2/5(+/-TPMPA):9.5±1.2 pA/7.1±0.9 pA,n=6,p=0.005,配对t检验;对照组(+/-TPMPA):12.5±1.6 pA/12.2±2 pA,n=6,p=0.87,配对t检验)。SR95531将两组细胞的mIPSC振幅降低到相似的程度(AAV2/5(+/-SR9553l):12.3±1.4 pA/9.9±1.4 pA,n=5,p=0.033,配对t检验;对照组(+/-SR95531):13.6±2.1 pA/11.1±1.8 pA,p=0.004,配对t检验)。*,p=0.027,与对照组相比。 (c(c))左侧,施用10 mM谷氨酰胺之前(薄迹线)和期间(厚迹线)的电流迹线。中部,补充谷氨酰胺可部分逆转AAV2/5细胞亚群中eIPSC的失败(**,相对于对照组p<0.001;AAV2/5n=5,对照组n=7)。赖特,浴用谷氨酰胺在列车刺激后将eIPSC振幅恢复到控制水平,但未能防止列车期间eIPSC故障(**,p≤0.003,相对于控制,^,p=0.04,相对于AAV2/5)。单元编号(列/列后)如下:控制n=12/10,AAV2/5 n=10/6,AAV2/5+Gln n=6/5。误差线,s.e.m。
谷氨酰胺合成酶活性降低将耗尽可用于神经元摄取的谷氨酰胺。由于谷氨酰胺在抑制性神经末梢转化为谷氨酸,然后转化为GABA,谷氨酰胺缺乏会减少可用于突触释放的GABA库。我们通过在1,2,5,6-四氢吡啶-4-基甲基膦酸(TPMPA)(一种低亲和力GABA)存在下记录mIPSC来证实突触GABA的减少A类具有快速解封率的拮抗剂。较低水平的突触GABA将导致GABA短暂的突触分裂瞬变,以及TPMPA对mIPSC振幅的较大抑制8,22与此预测一致,TPMPA(30μM)对对照切片神经元的影响最小(98.9±8.5%,n=6),但将AAV2/5注射动物神经元的mIPSC振幅降至基线的74.6±4.2%(n=6,p=0.027)。相反,高亲和力的GABAA类拮抗剂SR-95531(300 nM)在AAV2/5组和对照组(AAV2.5:81.5±5.4%,n=5;对照组:81.7±3.3%,n=6,p=0.97,图5b).
如果神经元谷氨酰胺饥饿介导eIPSC失败,则eIPSC应通过外源性谷氨酰胺进行挽救。在eGFP的11个CA1神经元中,有7个神经元在浴中应用谷氨酰胺(10 mM)将eIPSC振幅增加到治疗前水平的126±6%+AAV2/5切片的区域。谷氨酰胺对对照神经元无影响(91±4%,n=7,图5c,组间效果不同,p<0.001)。谷氨酰胺的应用也减弱了eIPCS在列车刺激后的动态失效(图5c
正确的)至训练前基线的88.6±8.6%(n=5,p=0.04,相对于缺乏谷氨酰胺的AAV2/5神经元),但未能逆转训练期间eIPSC振幅的降低(图5c
正确的).后者可能表明,胶质瘤触发的谷氨酰胺循环非依赖性机制的募集调节短期突触可塑性(见讨论)。
这些结果表明,反应性星形细胞增多诱导的谷氨酰胺合成酶减少导致神经元谷氨酰胺供应中断,GABA的神经元生成受损,抑制性神经递质受损。
病毒诱导的星形细胞增多改变网络兴奋性
为了评估在细胞水平上观察到的抑制缺陷是否转化为改变的网络功能,我们使用电压敏感染料(VSD)成像技术检测了由时间共同通路(TAP)刺激触发的CA1电路活动。CA1网络反应的TAP激活受到前馈抑制的强烈调节,前馈抑制将EPSP限制在CA1锥体细胞的远端树突上27,28星形胶质细胞增生诱导后对TAP信号失去抑制性控制应导致更强烈的兴奋,类似于在癫痫动物切片中观察到的兴奋28在TAP刺激后,我们记录到持续的EPSP向放射层和地层orienseGFP的63%(16分之10)+5只动物的切片。在6个对照切片中,有6个EPSP仅向远端扩散放射层并在地层oriens面积CA1(图6a–c).在地层oriens,在星形胶质细胞切片转换为EPSP的对照切片中观察到的IPSP(对照dF/F:-0.024±0.005%,n=6;AAV2/5 dF/F:0.064±0.014%,n=10,p<0.001,图6d).同时,AAV2/5组TAP刺激激活的面积增加了20倍(p<0.002,图6e).来自CA1锥体神经元的全细胞电流灯记录证实,TAP激活在反应性星形胶质细胞附近的神经元中触发EPSP,在对照神经元中触发IPSP(图6c
最下面一排,控制:-2.7±0.8 mV,n=3;AAV2/5:2.1±0.5毫伏,n=6)。
图6。反应性胶质增生症与网络超兴奋性有关。
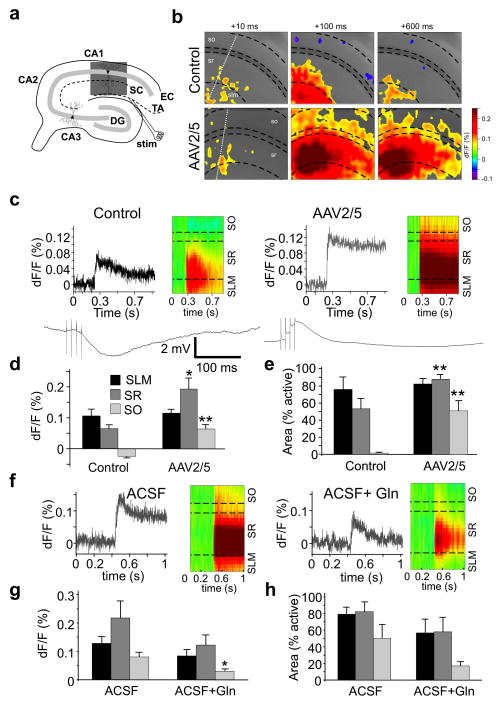
(一)海马准备示意图。阴影框表示(b)中用于快照的区域。DG,齿状回;EC,内嗅皮层;刺激电极。 (b条)TAP刺激开始后指定时间点的VSD信号快照。白色虚线表示(c)SLM中光栅图的采样像素,分子腔隙层、SR、,放射层、SO、,地层oriens. (c(c))顶行,荧光信号的振幅和时间进程以及CA细胞层海马活动的光栅图。注意对照组中EPSP与远端SR的分隔,而不是AAV2/5切片。最下面一行,来自CA1锥体神经元的电流闪烁轨迹。TAP刺激从AAV2/5 eGFP诱导细胞内EPSP+区域和来自对照动物细胞的IPSP。 (d、 e(电子))TAP刺激激活的荧光信号振幅和面积(**p<0.008,*p=0.016;对照n=6,AAV2/5 n=10)。控制片中的SO IPSP从eGFP转换为片中的SO EPSP+AAV2/5片。 ((f))之前TAP激活引发的荧光变化(左侧)和以下内容(赖特)谷氨酰胺在浴缸中15分钟用于eGFP+AAV2/5切片。 (g、 小时)AAV2/5 eGFP中谷氨酰胺应用前后的正常荧光变化和活化面积+切片(*,p=0.04,配对t检验,n=5)。在SO中,AAV2/5组的活动区较小,但与对照组相比未达到显著性(p=0.09,配对t检验)。误差线,s.e.m。
我们研究了外源性谷氨酰胺是否会逆转与反应性胶质增生症相关的回路超兴奋性。在eGFP中+切片,应用10 mM谷氨酰胺可减少放射层和地层oriensEPSP达到前谷氨酰胺水平的64±14%和43±15%(n=5,1片无影响,图6f,g)同样减少了激活区域(放射状的: 68±20%,奥林斯:前谷氨酰胺水平的47±15%(图6h).
因此,与反应性胶质增生相关的抑制缺陷会导致海马神经网络的超兴奋性,外源性谷氨酰胺可以部分改善这一情况。
讨论
病毒诱导的反应性星形细胞增多在海马神经元中触发抑制性突触传递的选择性缺陷。这发生在脑损伤和/或炎症没有潜在的混淆病理生理效应的情况下,而这些通常伴随着星形细胞增多症的发展。抑制性神经传递受损是由于反应性星形胶质细胞中谷氨酰胺合成酶下调介导的星形胶质细胞谷氨酸/谷氨酰胺循环中断所致。这导致神经元摄取谷氨酰胺的可用性降低,同时也降低了突触GABA的可用性。谷氨酸/谷氨酰胺循环功能受损和相关抑制失效导致网络超兴奋性,与TLE动物模型中的情况类似28.
星形细胞增多症与突触缺陷的特异性关联
病毒诱导反应性星形细胞增多的机制尚不清楚。两种可能性包括衣壳与细胞受体的相互作用,导致优先病毒转导或病毒DNA与类收费受体相互作用的结果。无论机制如何,我们的数据与反应性的星形细胞基础一致。当使用选择性转导神经元的AAV2/9时,未检测到反应性星形细胞增多。因此,病毒与星形胶质细胞的相互作用对产生反应性星形胶质细胞增多症很重要。当我们使用AAV2/5和CMV启动子进行实验时,我们从未检测到小胶质细胞中的表达(未发表的观察结果),因此我们可以忽略这种细胞类型对该过程的影响。AAV2/5能转导的少数神经元极有可能导致反应性星形细胞增多。然而,如果是这样的话,我们预计神经元也会影响小胶质细胞。我们没有检测到对小胶质细胞CD45染色的刺激,因此认为这种情况不太可能发生。
使用AAV作为选择性工具来产生与其他病理过程分离的反应性星形胶质细胞病,使我们能够确定突触传递的变化是否特异性地伴随着星形胶质细胞反应。我们观察到星形胶质细胞中谷氨酰胺合成酶的表达减少以及抑制传递的相关减少。在两项因果关系测试中,谷氨酰胺循环拮抗剂对抑制功能的影响在反应性胶质增生区域被阻断,外源性谷氨酰胺导致突触功能部分恢复。由于谷氨酰胺是在星形胶质细胞中选择性合成的,因此这些结果支持我们的结论,即反应性星形胶质细胞增生导致抑制性突触传递受损,这是谷氨酰胺合成酶表达和谷氨酰胺供应减少的结果。此外,我们证明星形细胞增生导致网络兴奋性的改变,而外源性谷氨酰胺可以减弱这种改变(图6).
星形细胞增多引发的IPSC故障
在解释病毒诱导的反应性胶质增生症对抑制的潜在影响时,必须考虑几个变量。首先,在抑制末端有多个囊泡群,包括我们研究中取样的易释放和再循环池。这些不同池中的GABA含量可能来源不同,因此对胶质增生症表现出不同的敏感性。其次,病毒策略激活了许多,但不是所有的星形胶质细胞,因为星形胶质细胞占据了非重叠的突触区域29,一些神经元的抑制性突触可能被反应性星形胶质细胞所投资,而另一些则被未受影响的星形胶质细胞投资。这可能导致小振幅与大振幅IPSC上胶质增生影响程度的差异。
假设突触后受体没有变化,我们假设在非饱和神经递质浓度(即小幅度事件)诱发的IPSC期间,突触前GABA水平的缺陷将主要明显。在这些突触中,神经递质浓度决定了IPSC的振幅,而胶质细胞诱导的突触GABA减少直接转化为较小的反应。相反,在功能处于超饱和状态的突触中,由于胶质增生导致的囊泡GABA的部分减少可能仍足以完全占据突触后受体(即受体可用性,而非神经递质浓度,是速率限制)。因此,大幅度事件往往比小幅度事件受影响较小。我们的数据与这些预测一致,并通过量子突触事件(mIPSC)的检测得到支持。在AAV2/5神经元中,由于小振幅事件的贡献增加,mIPSC振幅分布左移。此外,快速、低亲和力的GABAA类与对照神经元相比,拮抗剂TPMPA对AAV2/5更有效,而高亲和力GABAA类拮抗剂SR95531对两组神经元同样有效。这两种效应都可以从突触群或突触小泡子集中GABA水平的降低中得到预期22,30,31.
病毒诱导的星形细胞增多对EPSCs缺乏影响
谷氨酰胺合成酶下调的反应性星形胶质细胞附近细胞中EPSCs的保存证实了最近的一项研究,该研究表明兴奋性信号不受谷氨酸/谷氨酰胺循环抑制剂的影响10结合我们的结果,这些数据表明,GABA能信号在很大程度上依赖于星形胶质细胞衍生的谷氨酰胺,而谷氨酸能突触可能更依赖于神经元对谷氨酸的直接吸收,和/或与中间神经元相比,这种氨基酸的细胞质基础储备更高。
在刺激RRP和小泡储备池后,我们观察到CA1锥体细胞的兴奋性驱动没有差异。然而,与反应性星形胶质细胞相邻的锥体细胞显示,在RRP和储备池训练早期,eEPSCs的短期易化性降低(图S8)表明含谷氨酸囊泡的初始释放概率较高32有趣的是,IPSC的短期可塑性也发生了类似的变化。eGFP细胞内+切片,列车诱导的eIPSC便利化(图3e)被减少,而这并没有被外源性谷氨酰胺所挽救(图5c正确的).这些发现表明,星形细胞增多症的发展通过不依赖于星形细胞源性谷氨酰胺的机制改变兴奋性和抑制性短期突触可塑性。
通过全身注射细菌内毒素脂多糖(LPS)诱导实验性星形胶质细胞增多症伴脑炎症。这个增加海马的兴奋和抑制驱动33,34与AAV2/5诱导的星形胶质细胞反应性不同,LPS可引发炎症和星形胶质细胞增生,后者在缺乏小胶质细胞活化的情况下产生星形胶质细胞增殖。此外,LPS效应广泛分布于整个大脑,而AAV2/5则相对局限。这强调了区分伴随炎症的全脑病理学引起的神经元缺陷和与局部胶质细胞反应性相关的神经元缺陷的重要性。
结论
反应性星形胶质细胞与许多疾病和损伤状态相关,并与癫痫发作灶的维持有关16,35我们的研究表明,病毒诱导的反应性星形细胞增多症与抑制性而非兴奋性神经传递缺陷有特定的关联。抑制缺陷在空间上局限于星形胶质细胞反应性高的区域,并因星形胶质细胞谷氨酰胺合成减少而沉淀。通过饥饿GABA前体、谷氨酰胺的抑制性突触,反应性星形胶质细胞对GABA能突触的功效进行强有力的控制。鉴于GABA能抑制在神经元回路调节中的关键重要性,反应性星形胶质细胞在调节突触功能中所起作用的改变可能会对与星形细胞增多症相关的中枢神经系统疾病状态产生重大功能后果,可能会侵蚀神经元回路的许多紧急功能,如认知、学习和记忆、动作生成和协调、抗癫痫生成。
致谢
由DAC的P01 NS054900和P20 MH071705支持,由PIO的癫痫基金会奖学金支持,由P01NS054900RO1NS054770和RO1NS037585支持。
脚注
作者贡献
PIO和JD进行并分析了所有实验。AM协助病毒载体生产。CY为VSD数据收集和分析做出了贡献。HT协助共焦数据采集和处理。DJW促成了AAV注射小鼠的第一代。PIO和DAC在PGH和JD的帮助下编写了手稿。DAC和PGH与PIO和JD一起设计实验并监督项目。
工具书类
-
1.Haydon PG,Carmignoto G.星形胶质细胞对突触传递和神经血管耦合的控制。2006年生理学评论;86:1009–31.doi:10.1152/physrev.00049.2005。[内政部] [公共医学] [谷歌学者]
-
2Pascual O、Casper KB、Kubera C、Zhang J、Revilla-Sanchez R、Sul JY、Takano H、Moss SJ、McCarthy K、Haydon PG。星形细胞嘌呤能信号协调突触网络。科学。 2005;310:113–6.doi:10.1126/science.116916。[内政部] [公共医学] [谷歌学者]
-
三。Volterra A,Meldolesi J.星形胶质细胞,从脑胶到通讯元件:革命仍在继续。Nat Rev神经科学。 2005;6:626–40.doi:10.1038/nrn1722。[内政部] [公共医学] [谷歌学者]
-
4Bak LK、Schousboe A、Waagepetersen HS。谷氨酸/GABA-谷氨酰胺循环:运输、神经递质稳态和氨转移方面。神经化学杂志。 2006;98:641–53.doi:10.1111/j.1471-4159.2006.03913.x。[内政部] [公共医学] [谷歌学者]
-
5de Melo Reis RA、Ventura AL、Schitine CS、de Mello MC、de Mello FG。Müller胶质细胞作为调节脊椎动物视网膜神经活动的活性隔室:神经递质和营养因子。神经化学研究2008;33:1466–74.doi:10.1007/s11064-008-9604-1。[内政部] [公共医学] [谷歌学者]
-
6SykováE,Nicholson C.脑细胞外空间的扩散。《生理学评论》2008;88:1277–340.doi:10.1152/physrev.00027.2007。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
7Chaudhry FA、Reimer RJ、Edwards RH。谷氨酰胺通勤:乘坐N线,转往A.J Cell Biol。 2002;157:349–55.doi:10.1083/jcb.200201070。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
8Liang SL,Carlson GC,Coulter DA。海马CA1区谷氨酸-谷氨酰胺循环对突触GABA释放的动态调节。神经科学杂志。 2006;26:8537–48.doi:10.1523/JNEUROSCI.0329-06.2006。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
9Fricke MN、Jones-Davis DM、Mathews GC。系统A转运蛋白摄取谷氨酰胺维持神经递质GABA合成和抑制突触传递。神经化学杂志。 2007;102:1895–904.doi:10.1111/j.1471-4159.2007.04649.x。[内政部] [公共医学] [谷歌学者]
-
10Kam K,Nicoll R.兴奋性突触传递独立于谷氨酸-谷氨酰胺循环。神经科学杂志。 2007;27:9192–200.doi:10.1523/JNEUROSCI.1198-07.2007。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
11Eid T、Thomas MJ、Spencer DD、Runden-Pran E、Lai JC、Malthayar GV、Kim JH、Danbolt NC、Ottersen OP、de Lanerolle NC。人类致痫海马谷氨酰胺合成酶缺失:颞叶内侧癫痫细胞外谷氨酸升高的可能机制。柳叶刀。 2004;363:28–37.doi:10.1016/s0140-6736(03)15166-5。[内政部] [公共医学] [谷歌学者]
-
12Eid T,Williamson A,Lee TS,Petroff OA,de Lanerolle NC。谷氨酸和星形胶质细胞——人类内侧颞叶癫痫的关键因素?癫痫。 2008;49:42–52.doi:10.1111/j.1528-1167.2008.01492.x。[内政部] [公共医学] [谷歌学者]
-
13Sepkuty JP、Cohen AS、Eccles C、Rafiq A、Behar K、Ganel R、Coulter DA、Rothstein JD。神经元谷氨酸转运体参与神经递质GABA合成和癫痫。神经科学杂志。 2002;22:6372–9.doi:10.1523/JNEUROSCI.22-15-06372.2002。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
14Robinson SR.阿尔茨海默病中谷氨酰胺合成酶细胞分布的变化。神经科学研究杂志,2001年;66:972–80.doi:10.1002/jnr.10057。[内政部] [公共医学] [谷歌学者]
-
15.Tilleux S,Hermans E.神经疾病中神经炎症和胶质细胞谷氨酸摄取的调节。神经科学研究杂志2007;85:2059–70.doi:10.1002/jnr.21325。[内政部] [公共医学] [谷歌学者]
-
16Seifert G、Schilling K、Steinhauser C.《神经疾病中的星形胶质细胞功能障碍:分子视角》。Nat Rev神经科学。 2006;7:194–206.doi:10.1038/nrn1870。[内政部] [公共医学] [谷歌学者]
-
17Pekny M,Nilsson M.星形胶质细胞活化和反应性胶质增生。格利亚。 2005;50:427–34.doi:10.1002/glia.20207。[内政部] [公共医学] [谷歌学者]
-
18Wilhelmsson U、Li L、Pekna M、Berthold CH、Blom S、Eliasson C、Renner O、Bushong E、Ellisman M、Morgan TE、Pekny M。缺乏胶质纤维酸性蛋白和波形蛋白可防止星形细胞突起肥大,并改善创伤后再生。神经科学杂志。 2004;26:5016–21.doi:10.1523/JNEUROSCI.0820-04.2004。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
19Wetherington J,Serrano G,Dingledine R.癫痫脑中的星形胶质细胞。神经元。 2008;58:168–78.doi:10.1016/j.neuron.2008.04.002。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
20Steffens M、Huppertz HJ、Zentner J、Chauzit E、Feuerstein TJ。癫痫患者大脑皮层谷氨酰胺合成酶活性不变和NMDA受体密度增加:癫痫病理生理学的意义。神经化学国际,2005年;47:379–84.doi:10.1016/j.neuint.2005.06.001。[内政部] [公共医学] [谷歌学者]
-
21Rosati A、Marconi S、Pollo B、Tomassini A、Lovato L、Maderna E、Maier K、Schwartz A、Rizzuto N、Padovani A、Bonetti B。多形性胶质母细胞瘤癫痫:与谷氨酰胺合成酶水平的相关性。神经瘤杂志。 2009;93:319–24.doi:10.1007/s11060-008-9794-z。[内政部] [公共医学] [谷歌学者]
-
22Barberis A,Petrini EM,Cherubini E.培养中大鼠海马神经元GABA能突触量子大小变异的突触前来源。欧洲神经病学杂志。 2004;20:1803–10.doi:10.1111/j.1460-9568.2004.03624.x。[内政部] [公共医学] [谷歌学者]
-
23Parpura V、Basarsky TA、Liu F、Jeftinija K、Jeftinoja S、Haydon PG。谷氨酸介导的星形胶质细胞-神经元信号传导。自然。 1994;30:744–7.doi:10.1038/369744a0。[内政部] [公共医学] [谷歌学者]
-
24Rizzoli SO、Betz WJ。突触小泡池。Nat Rev神经科学。 2005;6:57–69.doi:10.1038/nrn1583。[内政部] [公共医学] [谷歌学者]
-
25Burrone J,Li Z,Murthy VN。使用基因编码探针Hfluorin研究突触前终末的囊泡循环。Nat Protoc。 2006;1:2970–8.doi:10.1038/nprot.2006.449。[内政部] [公共医学] [谷歌学者]
-
26Oliva AA,Jr、Jiang M、Lam T、Smith KL、Swann JW。使用在GABA能中间神经元中表达绿色荧光蛋白的转基因小鼠鉴定的新海马中间神经元亚型。神经科学杂志。 2000;20:3354–68.doi:10.1523/JNEUROSCI.20-09-03354.2000。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
27Ang CW、Carlson GC、Coulter DA。海马CA1电路在θ频率下优先对直接皮层输入进行动态选通。神经科学杂志。 2005;19:9567–80.doi:10.1523/JNEUROSCI.2992-05.2005。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
28Ang CW,Carlson GC,Coulter DA。颞叶癫痫患者大脑皮层对海马体直接输入的大规模和特异性失调。神经科学杂志。 2006;26:11850–6.doi:10.1523/JNEUROSCI.2354-06.2006。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
29Bushong EA,Marton ME,Jones YZ,Ellisman M.放射状CA1层的原生质星形胶质细胞占据不同的解剖结构域。神经科学杂志。 2002;22:183–92.doi:10.1523/JNEUROSCI.22-01-00183.2002。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
30Mozzymas JW、Wójtowicz T、Piast M、Lebida K、Wyrembek P、Mercik K。GABA瞬变设置大鼠海马神经元中mIPSC对苯二氮卓受体激动剂调节的敏感性。生理学杂志。 2007;585:29–46.doi:10.1113/jphysiol.2007.143602。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
31Cohen AS,Lin DD,Coulter DA。大鼠海马区CA1神经元抑制性突触传递的出生后延长发育。神经生理学杂志。 2000;84:2465–76.doi:10.1152/jn.2000.84.52465。[内政部] [公共医学] [谷歌学者]
-
32Sun HY、Lyons SA、Dobrunz LE。幼年大鼠中间神经元与锥体细胞Schaffer侧支突触靶细胞特异性短期可塑性的机制。生理学杂志。 2005;568:815–40.doi:10.1113/jphysiol.2005.093948。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
33Jakubs K、Bond S、Iosif RE、Ekdahl CT、Kokaia Z、Kokaia-M、Lindvall O。炎症调节成人大脑中神经元的功能整合。神经科学杂志。 2008;28:12477–88.doi:10.1523/JNEUROSCI.3240-08.2008。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
34Galic MA、Riazi K、Heida JG、Mouihate A、Fournier NM、Spencer SJ、Kalynchuk LE、Teskey GC、Pittman QJ。出生后炎症增加成年大鼠的癫痫易感性。神经科学杂志。 2008;28:6904–13.doi:10.1523/JNEUROSCI.1901-08.2008。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
35Binder DK,Steinhauser C.癫痫患者星形胶质细胞的功能变化。格利亚。 2006;54:358–68.doi:10.1002/glia.20394。[内政部] [公共医学] [谷歌学者]
关联数据
本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。








