摘要
背景
DNA-甲基转移酶(DNMT)-3A在胚胎发育和癌变过程中异常甲基化的产生中起着重要作用。本研究的目的是研究DNMT3A启动子遗传变异对其转录活性的作用,并评估DNMT3A基因多态性与中国人群胃癌(GC)和食管癌(EC)易感性之间的关系。
方法
我们在DNMT3A启动子区选择了一个单核苷酸多态性(SNPs)-448A>G,并使用荧光素酶分析评估其对活性的影响。通过聚合酶链反应/限制性片段长度多态性测定DNMT3A的-448A>G多态性,并通过测序确认。在208名GC患者和346名年龄和性别匹配的健康对照中检测到-448A>G多态性的分布。在96名EC患者和241名健康对照组中也检测到-448A>G多态性的分布。根据患者的年龄和性别,通过分层分析评估DNMT3A的-448A>G多态性与GC和EC风险的相关性。
结果
在启动子分析中,与-448G等位基因相比,携带-448A等位基因的启动子活性明显更高(>两倍)(P(P)< 0.001).GC患者和对照组中-448A的等位基因频率分别为32.9%和19.9%。总的来说,我们发现,与GG携带者相比,DNMT3A-448AA纯合子患GC的风险增加了六倍以上。分层分析表明,AA纯合子在GC年龄≤60岁的个体亚群中具有更大的风险。然而,与携带-448GG基因型的个体相比,携带-448AG和-448AA的个体与EC风险的增加没有统计学显著相关。
结论
DNMT3A-448A>G多态性是一种新的功能性SNP,导致其对GC的遗传易感性。-448A>G可以作为一个分层标记物来预测个体对GC的易感性,尤其是在年龄≤60岁的个体亚组中。然而,EC中-448A>G的相对分布不能作为评估个体EC易感性的预测指标。
背景
DNA甲基化异常被认为是肿瘤发生的早期主要事件,其中DNA甲基转移酶(DNMTs)、DNMT1、DNMT3A和DNMT3B已被鉴定为真核细胞中的DNA甲基化功能酶[1,2].DNMT1通常被称为维持甲基转移酶,负责在DNA复制过程中维持预先存在的甲基化模式[三,4].DNMT3A和DNMT3B被视为从头开始DNA甲基转移酶,在胚胎发生和发病过程中的动态DNA甲基化过程中至关重要[5-7].各种肿瘤抑制基因中的异常启动子甲基化也与胃癌和食管癌有关[8-10]表观遗传沉默将这种异常联系在一起从头开始CpG岛甲基化导致DNMT-3家族(DNMT3A和DNMT3B)过度表达。研究表明,DNMT3A和DNMT3B与DNMT1一样,以甲基化依赖的方式抑制转录[11,12].最近,巴赫曼等. [13]表明DNMT3A和DNMT3B抑制其甲基化活性的转录独立性,并且这种抑制部分依赖于组蛋白脱乙酰酶活性。DNMT3A与组蛋白去乙酰化酶HDAC1相关,使用其ATRX同源结构域作为RP58的共同阻遏物[14].
许多研究表明DNMT在多种癌症中过度表达,并可能参与致癌[15,16].对肿瘤细胞中DNMT1和DNMT3B缺失的研究表明,它们在肿瘤发展中起着重要作用。DNMT3A对哺乳动物的发育至关重要,并负责基因组甲基化模式的产生。塞缪尔等使用敲除转基因小鼠研究肠上皮特异性过度表达从头开始DNMT3A型[10].在此之前,尚不清楚DNMT3A表达的哪一部分及其在肿瘤中的生物学功能。研究表明,DNMT3A表达升高与印迹基因SFRP5被抑制一致,并促进了空气污染指数最小老鼠数。胃癌(GC)中DNMT3A的表达仅在蛋白质水平上进行了研究,并显示肿瘤中DNMT3A显著过度表达,而DNMT1和DNMT3B仅适度过度表达[17].DNMT3A在食管癌发生中的表达及其临床意义尚不明确。
许多基因多态性,包括一些表观遗传标记基因,已被报道与肿瘤易感性密切相关。DNMT3B启动子的多态性在从头开始甲基化也被报道与几种肿瘤易感性有关,包括胃癌[18,19].然而,很少有研究报告癌症易感性与DNMT3A(另一种活性物质)的可能关联从头开始哺乳动物中的甲基转移酶。据我们所知,DNMT3A多态性与GC和食管癌(EC)的临床意义之间的关系以前还没有报道。在目前的工作中,我们想确定DNMT3A启动子中的单核苷酸多态性(SNP)是否有助于其表达增加,以及功能性SNP是否与癌症易感性有实质性联系。我们现在表明,与DNMT3B启动子中的一些SNP一样,DNMT3A启动子中SNP可以在转录水平激活其表达。然而,重要的是要知道DNMT3A的SNP转录激活是否与肿瘤发生有关。我们假设负责调节其他基因甲基化状态的DNMT3A基因变体与癌症风险增加有关。在这项基于医院的病例对照研究中,我们对一种功能性DNMT3A多态性进行了基因分型,并研究了该基因变异与胃癌和食管癌风险之间的关系。
方法
研究对象
我们招募了208名GC患者、96名EC患者和346名健康人(对照组)。对56例GC患者的组织样本进行免疫组织化学分析。2006年9月至2008年6月,所有患者均经组织病理学确诊,并获得患者和对照组的知情同意,以及东南大学中大医院和江苏省肿瘤医院机构审查委员会的批准。对照组是从同一家医院定期体检或同期自愿参与流行病学调查的无癌患者中选出的。我们将健康志愿者定义为在健康检查中被发现没有疾病(包括无癌症史)的人。对照组的年龄和性别与患者相匹配(表1和2).所有患者和对照均为华人,居住在中国江苏省或其周边地区。
表1。
| 变量 |
控件(n个= 346) |
GC案例(n个= 208) |
P(P)值† |
| 年龄(岁) |
|
|
0.115 |
| ≤60 |
141 (40.8)* |
99 (47.6) |
|
| >60 |
205 (59.2) |
109 (52.4) |
|
| 性别 |
|
|
0.182 |
| 男性 |
243 (70.2) |
157 (75.5) |
|
| 女性 |
103 (29.8) |
51 (24.5) |
|
表2。
| 变量 |
控件(n个= 241) |
EC案例(n个= 96) |
P(P)值† |
| 年龄(岁) |
|
|
0.395 |
| ≤60 |
141 (58.5)* |
61 (63.5) |
|
| >60 |
100 (41.5) |
35 (36.5) |
|
| 性别 |
|
|
0.177 |
| 男性 |
160 (66.4) |
71 (74.0) |
|
| 女性 |
81 (33.6) |
25 (26.0) |
|
SNP选择和荧光素酶测定
在DNMT3A的候选SNP中,我们重点研究了启动子区域的SNP(启动子中的rs1550117;GenBank登录号。NT_022184.14:g.4381840A/G)。使用携带DNMT3A启动子区域野生型或多态性等位基因的供体基因组DNA,通过聚合酶链反应(PCR)合成DNMT3A-启动子区域的片段(从-1009到+646,外显子1A的转录起始位点计为t1)。用于外显子1A启动子区域的PCR引物为5'-GGAGGACCTGGAGAGCATTG-3’(正向)和5'-TTACCGTGGCGTGG-3’(反向)。将PCR产物插入荧光素酶基因上游的pGL3-基本质粒(Promega,Madison,WI)中,通过DNA测序验证所有克隆的正确序列。启动子活性是使用Lucifierase Reporter Assay System(美国威斯康星州普罗米加)测量的。中国仓鼠卵巢(CHO)细胞在添加10%胎牛血清的最低必需培养基中生长。 5 × 105将细胞铺在六孔板中,并使用Lipofectamine 2000™(Invitrogen,CA,USA)用DNMT3A启动子SNP片段和空载体pGL3-basic转染。转染后48小时收集细胞,然后在细胞裂解液中进行荧光素酶报告试验。实验分三次进行五次,结果报告为平均值±标准偏差(SD)。
DNMT3A基因分型
将样品收集到含有乙二胺四乙酸(EDTA)的血液真空管中,并保存在4°C下。如前所述,在样品采集后1周内通过蛋白酶K消化提取基因组DNA[20].DNMT3A SNP的A>G转变产生了塔阿用PCR-限制性片段长度多态性(RFLP)检测DNMT3A启动子-448A>G(GenBank登录号:。NT_022184.14:g.4381840).DNMT3A-448A>G多态性通过PCR-RFLP分析测定。PCR反应在总共25μL的基因组DNA中进行,其中包含100 ng基因组DNA、0.1 mM dNTPs、2.0 mM MgCl2、10μM引物5’-ACACACCGCTCCACCCCCT-3’(正向)和5’-TCCAGACCCCCTGCCCACAA-3’(反向),以及1.25 U Taq聚合酶(中国上海Biocolor BioScience and Technology Co,Shanghai)。PCR循环条件包括初始熔融步骤95°C 5 min,然后32个95°C循环20 s,66°C循环20s,72°C循环20min,最后延伸步骤72°C 10 min。然后用塔阿I(Takara Biotechnology Co.,Ltd,Dalian,China)在65°C下2 h,在2.0%琼脂糖凝胶上分离消化产物,并用溴化乙锭(EB)染色在紫外光下观察RFLP带。野生型G等位基因包括塔阿I限制性位点产生三条带(153 bp、94 bp和87 bp),而变体A等位基因产生四条带(247 bp、153 bp,94 bp和87bp)。为了进行质量控制,对病例/对照状态进行基因分型分析,并对所有受试者重复两次。基因分型结果100%一致。为了确认基因分型结果,随机选择PCR-扩增DNA样本(n个对每个基因型分别≥3个)进行DNA测序,结果也100%一致。
免疫组织化学
我们对56例患者的福尔马林固定石蜡包埋组织标本的4μm厚切片进行脱蜡和脱水。为了提取抗原,将切片在高压釜中120°C下加热10分钟,并用5%的正常马血清阻断非特异性反应。将所有切片与识别DNMT3A小鼠单克隆抗体稀释度为1:75(Imgenex,IMG-268A)的特异性一级抗体孵育,然后在室温下与生物素化二级抗体(抗羊IgG,抗鼠IgG稀释度为1:200;美国加州齐根实验室)孵育30分钟。然后用Vectastain Elite ABC试剂(Vector Laboratories,CA,USA)处理切片。所有切片均用苏木精进行复染。对于阴性对照制剂,反应序列中省略了一级抗体。
统计分析
使用Student’st吨-连续变量和卡方检验(χ2)分类变量测试。Hardy-Weinberg平衡用良好的fχ检验2测试和1°自由度比较受试者的观察基因型频率和预期基因型频率。利用χ2测试或菲舍尔精确测试。使用STATA 10.0软件(美国德克萨斯州STATA Corp)计算优势比(OR)和95%置信区间(CI)。P(P)<0.05被认为具有统计学意义。
结果
一种新的功能性DNMT3A多态性的鉴定
DNMT3A基因中的几个候选SNP已保存在公共数据库中http://www.ncbi.nlm.nih.gov/SNP网站虽然这些多态性的功能效应尚未阐明,但我们假设其中一些变体可能影响DNA甲基化的DNMT3A活性,尤其是位于基因启动子区域的DNA甲基化。通过荧光素酶分析,我们选择并研究了-448A>G多态性对DNMT3A启动子活性的影响。与-448G等位基因相比,-448A等位基因的启动子活性显著升高(超过两倍)(P(P)<0.001,图1).
图1。
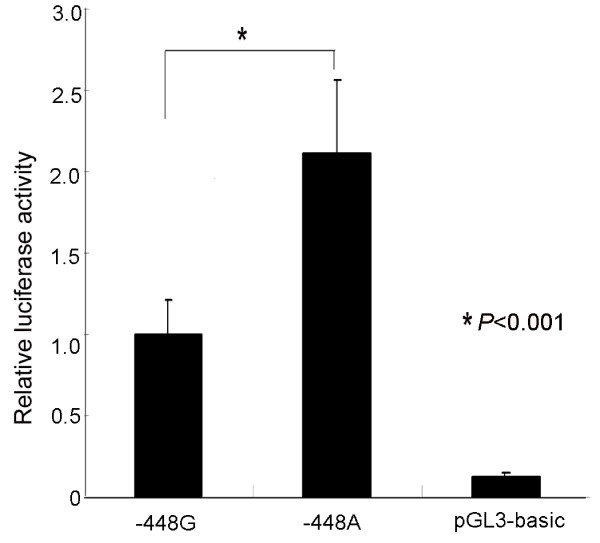
DNMT3A启动子-448G>A多态性的转录活性分析用荧光素酶报告体瞬时转染中国仓鼠卵巢细胞。缺失启动子序列的pGL3-碱性质粒用作阴性对照。数据表示从四个独立实验中计算出的三倍平均标准偏差,并以-448A等位基因活性的百分比表示。-448G和-448A结构之间的差异在P(P)< 0.001 (t吨-测试;n个= 6).
SNP的基因分型
采用PCR-RFLP技术首次在中国健康对照组和GC、EC患者中检测到DNMT3A基因启动子-448A>G多态性。在GC和EC患者及对照组中检测到DNMT3A基因型AA、AG和GG。PCR-RFLP分析的基因分型通过DNA测序分析完全确认(图2).346名健康对照者中-448A>G基因型的分布为GG 63.0%、GA 34.1%、AA 2.9%,A等位基因频率为19.9%,如表所示三在病例对照研究中评估了DNMT3A启动子的-448A>G多态性以及与GC组相关的风险。病例和对照组之间的平均年龄和性别分布没有显著差异,表明基于这两个变量的匹配是足够的(表1).GC患者的平均年龄为65岁(范围34~80岁),对照组为71岁(范围32~80年)。所有患者和对照组均成功进行了DNMT3A多态性基因分型。DNMT3A-448A>G多态性分布在Hardy-Weinberg平衡中。
图2。
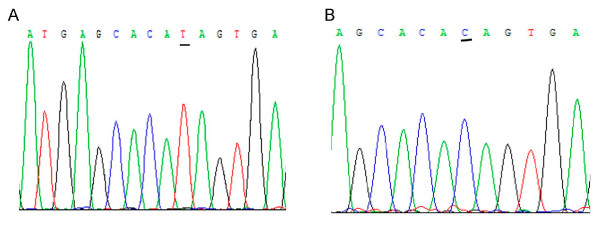
不同-448G>A基因型聚合酶链反应(PCR)产物的测序结果强调了单核苷酸多态性位点。结果与PCR-限制性片段长度多态性基因分型的相应结果完全匹配。A:AA变异体(反链),B:GG野生型(反向链)。
表3。
DNMT3A型-对照组448A>G基因型和等位基因频率
| 组 |
基因型 |
|
|
阿勒 |
|
|
GG(%) |
AG(%) |
AA(%) |
A(%) |
P(P)* |
| 总计 |
218 (63.0) |
118 (34.1) |
10 (2.9) |
19.9 |
|
| 年龄) |
|
|
|
|
0.09†
|
| ≤60 |
80 (23.1) |
57 (16.5) |
4 (1.2) |
9.4 |
|
| >60 |
138 (39.9) |
61 (17.6) |
6 (1.7) |
10.5 |
|
| 性别 |
|
|
|
|
0.521‡
|
| 男性 |
152 (43.9) |
82 (23.7) |
9 (2.6) |
14.5 |
|
| 女性 |
66 (19.1) |
36 (10.4) |
1 (0.3) |
5.5 |
|
与DNMT3A-448A>G基因型相关的胃癌风险如表所示4和5GC患者和对照组中-448A的等位基因频率分别为32.9%和19.9%。GC组-448A>G基因型的分布(GG 49.0%,AG 36.1%,AA 14.9%)与对照组有显著差异(P(P)= 0.000).使用更常见的纯合变异基因型作为参考组(-448个GG基因型)计算OR及其95%CI。与参考组相比,AA纯合子的GC风险增加了6倍以上(OR 6.625;95%CI=3.128-14.034,P(P)= 0.000).当按患者的年龄和性别进行分层分析时,AA基因型与GC风险显著增加相关(OR 9.500,95%CI=3.029-29.796P(P)=0.000)≤60岁时为2.13倍,>60岁时更高(OR 4.452,95%CI=1.598-12.404P(P)= 0.002).AA基因型与GC风险显著增加相关(OR 10.313,95%CI=1.156-91.974P(P)=0.012),并且比男性大1.6倍(OR 6.273,95%CI=2.793-14.089P(P)= 0.000).
表4。
病例患者和对照组患者的DNMT3A-448A>G基因型和等位基因频率及其与胃癌的关系(GC)
| 基因型 |
GC公司
(n个= 208) |
对照组受试者(n个= 346) |
粗赔率
(95%置信区间) |
P(P)价值* |
|
|
|
|
|
|
不. |
(%) |
不. |
(%) |
|
|
| -448A>G |
|
|
|
|
|
|
| GG(参考) |
102 |
(49.0) |
218 |
(63.0) |
1 |
|
| AG公司 |
75 |
(36.1) |
118 |
(34.1) |
1.358 (0.936-1.972) |
0.107一
|
| AA公司 |
31 |
(14.9) |
10 |
(2.9) |
6.625 (3.128-14.034) |
0b条
|
| A等位基因 |
32.9 |
19.9 |
|
|
表5。
胃癌患者中-448A>G DNMT3A基因型的分布及与年龄和性别相关的比值比(OR)
| 基因型 |
GC病例(%) |
控制(%) |
或 |
P(P)价值 |
| 年龄(岁) |
|
|
|
|
| ≤60 |
|
|
|
|
| GG公司 |
40 (19.2) |
80(23.1) |
1 |
|
| AG公司 |
40 (19.2) |
57 (16.5) |
1.404 (0.806-2.444) |
0.230 |
| AA公司 |
19 (9.1) |
4(1.2) |
9.500(3.029-29.796) |
0 |
| >60 |
|
|
|
|
| GG公司 |
62 (29.8) |
138(39.9) |
1 |
|
| AG公司 |
35 (16.8) |
61 (17.6) |
1.277 (0.765-2.132) |
0.349 |
| AA公司 |
12 (5.8) |
6 (1.7) |
4.452(1.598-12.404) |
0.002 |
| 性别 |
|
|
|
|
| 男性 |
|
|
|
|
| GG公司 |
70(33.7) |
152(43.9) |
1 |
|
| AG公司 |
61(29.3) |
82 (23.7) |
1.615(1.045-2.498) |
0.031 |
| AA公司 |
26(12.5) |
9 (2.6) |
6.273(2.793-14.089) |
0 |
| 女性 |
|
|
|
|
| GG公司 |
32(15.4) |
66(19.1) |
1 |
|
| AG公司 |
14(6.7) |
36 (10.4) |
0.802(0.380-1.694) |
0.563 |
| AA公司 |
5(2.4) |
1 (0.3) |
10.313(1.156-91.974) |
0.012 |
随后,为了探讨该SNP是否也与EC相关,我们分析了-448A>G的频率。与DNMT3A-448A>G基因型相关的食管癌风险如表所示6和7EC患者和对照组的-448A等位基因频率分别为21.9%和19.9%。EC组的-448A>G基因型分布(GG 63.5%,AG 29.2%,AA 7.3%)与对照组无显著差异。与参考组相比,AG+AA基因型(OR 0.929,95%CI=0.569-1.517P(P)=0.769)和AA纯合子(OR 2.850,95%CI=0.920-8.825P(P)=0.115)没有更大的EC风险。当按患者的年龄和性别分层分析时,只有AA基因型与EC风险增加相关(OR 7.667,95%CI=1.300-45.230P(P)=0.026)>60年。
表6。
病例患者和对照组患者的DNMT3A-448A>G基因型和等位基因频率及其与食管癌的关系
| 基因型 |
欧盟委员会(n个= 96) |
|
对照组受试者(n个= 241) |
|
粗比值比(95%置信区间) |
P(P)价值* |
|
|
|
|
|
|
不。 |
(%) |
不。 |
(%) |
|
|
| -448A>G |
|
|
|
|
|
|
| GG(参考) |
61 |
(63.5) |
149 |
(61.8) |
1 |
|
| AG公司 |
28 |
(29.2) |
86 |
(35.7) |
0.795 (0.473-1.338) |
0.388c(c)
|
| AA公司 |
7 |
(7.3) |
6 |
(2.5) |
2.850 (0.920-8.825) |
0.115d日
|
| A等位基因 |
21.9 |
19.9 |
|
|
表7。
食管癌患者-448A>G DNMT3A基因型的分布及其与年龄和性别的相关比值比(OR)
| 基因型 |
EC病例(%) |
控制(%) |
或 |
P(P)价值 |
| 年龄(岁) |
|
|
|
|
| ≤60 |
|
|
|
|
| GG公司 |
43 (44.8) |
80 (33.2) |
1 |
|
| AG公司 |
15 (15.6) |
57 (23.7) |
0.490 (0.248-0.965) |
0.037 |
| AA公司 |
3 (3.1) |
4 (1.7) |
1.395 (0.298-6.523) |
0.985 |
| >60 |
|
|
|
|
| GG公司 |
18 (18.7) |
69 (28.6) |
1 |
|
| AG公司 |
13 (13.5) |
29 (12.0) |
1.718 (0.746-3.960) |
0.201 |
| AA公司 |
4 (4.2) |
2 (0.8) |
7.667(1.300-45.230) |
0.026 |
| 性别 |
|
|
|
|
| 男性 |
|
|
|
|
| GG公司 |
46 (47.9) |
96(39.8) |
1 |
|
| AG公司 |
20 (20.8) |
59 (24.5) |
0.707 (0.382-1.311) |
0.271 |
| AA公司 |
5 (5.2) |
5 (2.1) |
2.087 (0.575-7.570) |
0.428 |
| 女性 |
|
|
|
|
| GG公司 |
15 (15.6) |
53(22.0) |
1 |
|
| AG公司 |
8 (8.3) |
27 (11.2) |
1.047 (0.395-2.776) |
0.927 |
| AA公司 |
2 (2.1) |
1 (0.4) |
7.067 (0.599-83.374) |
0.140 |
因此,我们的数据揭示了重要的证据,即-448A的存在表明GC患者发生癌变的可能性很大,但EC患者不发生癌变,至少在中国人群中是如此。DNMT3A启动子的功能多态性改变了GC的易感性,可能是GC的风险预测因子,尤其是在中国主要受影响人群≤60岁组。
胃癌及癌旁组织中DNMT3A的免疫组化分析
DNMT3A的免疫反应性在细胞质中检测到,但在癌细胞的细胞膜中未检测到(图三).为了从背景水平信号泄漏的病例中确定阳性病例,如果组织样本中30%以上的细胞出现细胞质染色,则认为该样本显示阳性免疫反应。DNMT3A免疫反应阳性率为69.64%(39/56)。
图3。
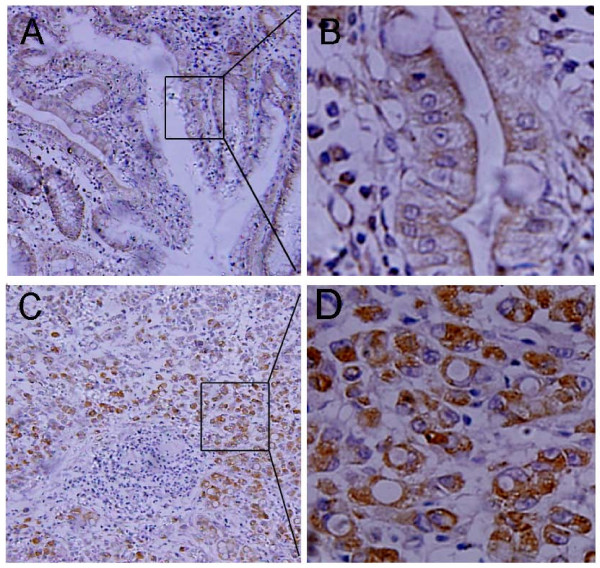
DNMT3A在胃癌及其癌旁组织中的表达DNMT3A呈棕色,在细胞质中分布良好。(A,B)胃癌旁组织(A,×100和B,×400)中DNMT3A的免疫组织化学染色。(C,D)胃癌组织中DNMT3A的免疫组化染色(C,×100;D×400)。
讨论
胃癌和食管癌是两种常见的肿瘤,也是中国人死亡的主要原因之一。在胃癌中,肿瘤抑制基因(TSG)因DNA甲基化异常而失活的频率高于突变[21].TSG的CpG岛庚甲基化与早期食管癌复发相关[22-26].DNMT3A和DNMT3B as的表达增加从头开始DNA甲基转移酶在许多肿瘤中很常见,这意味着DNMT3A和DNMT3B的异常表达与致癌有关。我们的免疫组织化学数据显示,GC组织中DNMT3A表达的阳性率明显高于癌旁组织(这与之前对GC石蜡切片的研究一致[17])因此,表明基因启动子的SNP可能会增加酶的活性,并在生物过程中发挥作用。我们以前的结果表明,DNMT3B启动子-579位的多态性与GC敏感性相关[18]但不是EC[27].据我们所知,到目前为止,DNMT3A多态性与GC和EC发生和发展风险之间的关系尚未见报道。
我们假设DNMT3A启动子的多态性与癌症风险相关。在本病例对照研究中,我们报告了人类DNMT3A启动子的多态性与GC和EC风险之间的关系。在346名健康对照中,-448A的等位基因频率为0.199,-448A>G(AG+AA)的频率为0.370,这意味着它可能具有潜在的SNP来评估疾病的易感性。荧光素酶分析表明,含有5’UTR的DNMT3A片段和448A等位基因的构建物的启动子活性是CHO细胞系中含有448G等位基因构建物的两倍以上,从而支持了该等位基因是功能性SNP的说法。这种关联的潜在机制是G>A转换,它增加了DNMT3A启动子的活性。DNMT3A的两倍以上过表达与肿瘤抑制基因的表达之间的关系尚未得到证实,但DNMT3A的高表达确实与一些肿瘤相关基因一致,包括配对患者活检中SFRP5的高甲基化和转录抑制[28,29].敲除DNMT3A的表达使黑色素瘤细胞中诱导的242个基因增加一倍以上,并在黑色素瘤的发生中发挥重要作用[30].
在我们对来自中国人群的GCs、EC和对照组的DNMT3A基因启动子-448A>G多态性的分析中,发现-448A等位基因和AA基因型分布在所有三个研究组中。我们发现A变异基因型与GC风险显著增加相关。如果参与者是女性,AA基因型在≤60岁时与GC风险显著增加相关。需要进一步研究以阐明DNMT3A变异体在GC患者中的表达水平和DNA甲基化功能中的作用。然而,这种多态性与EC的易感性无关。尽管分析是按患者的年龄和性别分层的,但只有AA基因型与>60岁的EC风险增加相关。
本研究提供证据表明,DNMT3A启动子区的SNP可能改变GC的风险,但不会改变食管癌的风险。为了解释为什么暴露于类似危险因素的个体会发展成不同类型的肿瘤,需要进行遗传学研究。不同的遗传因素,包括肿瘤抑制基因和由从头开始甲基atransferases参与了不同类型肿瘤的发生。尽管有报道称一些肿瘤抑制基因,如p16[31,32],E-钙粘蛋白[9,33]TIMP3公司[34],DLC1[35,36]和RUNX3[37,38]沉默GC和EC,只有MINT25、RORA、GDNF、ADAM23、PRDM5、MLF1在GC中表现出频繁的差异甲基化[39]这意味着不同的遗传和表观遗传机制参与了这两种肿瘤的发展和进展。然后,在GC和EC患者的AA、GA和GG变异基因型携带者中检测到DNMT3A的表达(附加文件1).GA基因型GCs携带者的DNMT3A表达较高,而EC携带者则较低。检测到的病例中没有发现AA纯合子,可能是因为受检组不够大。这些数据表明DNMT3A型可能在胃癌的进展中发挥作用,这一发现需要通过更大的研究来证实。
此外,由于基因多态性在不同种族的组织中经常不同,需要进一步研究以阐明不同种族人群中DNMT3A多态性与GC的关联。为了了解DNMT3A多态性在确定癌症风险中的作用,还需要进一步研究其他DNMT3A序列变体及其生物学功能。目前的研究表明,至少有一些DNMT3A多态性,包括DNMT3A启动子SNP,可能在这两种肿瘤类型的发展和进展中发挥不同的作用。DNMT3A基因在DNA甲基化和基因表达调控中的重要性使其对其他癌症的进一步研究具有吸引力,并可能成为流行病学研究的有用标记物。
结论
总之,我们的研究首次证明了DNMT3A启动子的这种新发现的多态性与该研究人群中GC风险的增加显著相关。与变异相关的更高风险的潜在机制可能是G>A活性的增加。这些结果表明,DNMT3A的多态性可以作为GC遗传易感性的一个重要标志,尽管需要使用更大样本量的额外研究来证实我们的发现。
缩写
CHO:中国仓鼠卵巢;DNMT:DNA-甲基转移酶;EB:溴化乙锭;EC:食管癌;EDTA:乙二胺四乙酸;GC:胃癌;PCR:聚合酶链反应;RFLP:限制性片段长度多态性;SNP:单核苷酸多态性;TSG:肿瘤抑制基因。
作者的贡献
HF设计并进行了部分DNMT3A-448A>G多态性分析并撰写了原稿;DSL对GC患者和对照组进行了DNMT3A-448A>G多态性分析。QXW和ZJZ对GC患者的DNMT3A进行免疫组织化学分析。XMQ和FZ收集患者的临床数据,并在GC和EC患者中执行DNMT3A的mRNA表达(在附加文件中2).FCQ、XWS和YWS在EC研究中进行了DNMT3A-448A>G多态性分析,并对数据进行了分析。WX为论文的设计和编写做出了贡献。HF和DSL为这项工作做出了同等贡献。所有作者阅读并批准了最终手稿。
参与者信息
Hong Fan,电子邮件:fanh@seu.edu.cn。
刘东生,邮箱:lds_16888@tom.com。
邱雪梅,电子邮件:xuemeiqiu@126.com。
Fengchang Qiao,电子邮件:fengchang-qio@163.com。
吴庆祥,电子邮件:suxianwei1985@163.com。
Su Xianwei,电子邮件:wuqingxiang2006@126.com。
Feng Zhang,电子邮件:zhangfeng81868@163.com。
宋云伟,电子邮件:ffaallll5@gmail.com。
Zhao,邮箱:zhujiangzhao@yahoo.com.cn。
Wei Xie,电子邮件:wei.xie@seu.edu.cn。
致谢
本研究得到了国家自然科学基金(30470950)的资助。编号30971605)。我们感谢徐永健博士、王伟文博士、周晓月博士和顾红兵博士在采集血样方面的协助。
工具书类
-
哺乳动物的DNA甲基转移酶。人类分子遗传学。 2000;9:2395–2402.doi:10.1093/hmg/9.16.2395。[内政部] [公共医学] [谷歌学者]
-
Okano M,Xie S,Li E.新型哺乳动物DNA(胞嘧啶-5)甲基转移酶家族的克隆和表征。自然遗传学。 1998;19:219–220.doi:10.1038/890。[内政部] [公共医学] [谷歌学者]
-
Leonhardt H,Page AW,Weier HU,Bestor TH。靶向序列将DNA甲基转移酶导向哺乳动物细胞核中的DNA复制位点。单元格。 1992;71:865–873.doi:10.1016/0092-8674(92)90561-P。[内政部] [公共医学] [谷歌学者]
-
Liu Y,Oakeley EJ,Sun L,Jost JP。小鼠DNA甲基转移酶靶向DNA复制病灶涉及多个域。1998年《核酸研究》;26:1038–1045.doi:10.1093/nar/26.4.1038。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
伯德美联社、沃尔夫美联社。甲基化诱导的阻遏——带、支架和染色质。单元格。 1999;99:451–454.doi:10.1016/S0092-8674(00)81532-9。[内政部] [公共医学] [谷歌学者]
-
Reik W、Dean W、Walter J.哺乳动物发育中的表观遗传重编程。科学。 2001;293:1089–1093.doi:10.1126/science.1063443。[内政部] [公共医学] [谷歌学者]
-
哺乳动物发育中的染色质修饰和表观遗传重编程。Nat Rev基因。 2002;3:662–673.doi:10.1038/nrg887。[内政部] [公共医学] [谷歌学者]
-
Lee EJ、Lee BB、Han J、Cho EY、Shim YM、Park J、Kim DH。E-钙粘蛋白(CDH1)和整合素α4的CpG岛高甲基化与早期食管鳞癌复发相关。国际癌症杂志。 2008;123:2073–2079.doi:10.1002/ijc.23598。[内政部] [公共医学] [谷歌学者]
-
Chan AO、Lam SK、Wong BC、Wong WM、Yuen MF、Yeung YH、Hui WM、Rashid A、Kwong YL。与幽门螺杆菌感染相关的胃粘膜和胃癌中E-cadherin基因启动子甲基化。内脏。 2003;52:502–506.doi:10.1136/gut.52.4.502。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Samuel MS、Suzuki H、Buchert M、Putoczki TL、Tebbutt NC、Lundgren-May T、Christou A、Inglese M、Toyota M、Heath JK、Ward RL、Waring PM、Ernst M。通过放松细胞外对Wnt信号的限制,Dnmt3a活性升高可促进Apc-Min小鼠的息肉病。胃肠病学。 2009;137:902–13.doi:10.1053/j.gastro.2009.05.042。[内政部] [公共医学] [谷歌学者]
-
Shikauchi Y、Saiura A、Kubo T、Niwa Y、Yamamoto J、Murase Y、Yoshikawa H。SALL3与DNMT3A相互作用,并显示出抑制肝细胞癌中CpG岛甲基化的能力。分子细胞生物学。 2009;29:1944–1958.doi:10.1128/MCB.00840-08。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Lorente A、Mueller W、Urdangarín E、Lázcoz P、Lass U、von Deimling A、Castresana JS。胶质瘤和胶质瘤细胞系中RASSF1A、BLU、NORE1A、PTEN和MGMT的表达和启动子甲基化,以及新生DNMT表达被解除管制的证据。脑病理学。 2009;19:279–292.doi:10.1111/j.1750-3639.2008.00185.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Bachman KE,Rountree MR,Baylin SB。Dnmt3a和Dnmt3b是转录抑制因子,对异染色质具有独特的定位特性。生物化学杂志。 2001;276:32282–32287.doi:10.1074/jbc。M104661200。[内政部] [公共医学] [谷歌学者]
-
Fuks F、Burgers WA、Godin N、Kasai M、Kouzarides T.Dnmt3a结合脱乙酰酶,并被序列特异性阻遏物招募以沉默转录。EMBO J.2001;20:2536–2544.doi:10.1093/emboj/20.10.2536。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Robertson KD、Uzvolgyi E、Liang G、Talmadge C、Sumegi J、Gonzales FA、Jones PA。人类DNA甲基转移酶(DNMTs)1、3a和3b:协调正常组织中的mRNA表达和肿瘤中的过度表达。1999年《核酸研究》;27:2291–2298.doi:10.1093/nar/27.11.2291。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Benbrahim-Tallaa L、Waterland RA、Dill AL、Webber MM、Waalkes MP。镉诱导人前列腺细胞恶性转化过程中肿瘤抑制基因失活与从头DNA甲基转移酶的过度表达相关。环境健康展望。 2007;115:1454–1459.doi:10.1289/ehp.10207。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
丁文杰,方JY,陈晓阳,彭毅。DNA甲基转移酶蛋白在胃癌中的表达及临床意义。挖掘与疾病科学。 2008;53:2083–2089.doi:10.1007/s10620-007-0145-2。[内政部] [公共医学] [谷歌学者]
-
胡J,樊H,刘D,张S,张F,徐H。DNMT3B启动子多态性与胃癌风险。挖掘与疾病科学。2009新闻界。[内政部] [公共医学]
-
Aung PP、Matsumura S、Kuraoka K、Kunimitsu K、Yoshida K、Matsusaki K、Nakayama H、Yasui W。在日本人群中,没有证据表明DNMT3B启动子的单核苷酸多态性与胃癌风险相关。Oncol Rep.2005;14:1151–1154.[公共医学] [谷歌学者]
-
Miller SA、Dykes DD、Polesky HF。从人类有核细胞中提取DNA的简单盐析程序。核酸研究1988;16:1215.doi:10.1093/nar/16.1215。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Ushijima T,Sasako M。关注胃癌。癌细胞。 2004;5:121–125.doi:10.1016/S1535-6108(04)00033-9。[内政部] [公共医学] [谷歌学者]
-
Lee EJ、Lee BB、Han J、Cho EY、Shim YM、Park J、Kim DH。E-钙粘蛋白(CDH1)和整合素α4的CpG岛高甲基化与早期食管鳞癌复发相关。国际癌症杂志。 2008;123:2073–2079.doi:10.1002/ijc.23598。[内政部] [公共医学] [谷歌学者]
-
于杰、陶琪、张家富、金浩、潘凤凤、王X、李浩、程瑜、Röcken C、Ebert MP、Chan AT、宋俊杰。泛素羧基末端水解酶L1作为肝细胞癌和其他消化道肿瘤的功能性抑癌剂和生物标记物的表观遗传学鉴定。肝病学。 2008;48:508–518.doi:10.1002/hep.22343。[内政部] [公共医学] [谷歌学者]
-
Peng DF,Razvi M,Chen H,Washington K,Roessner A,Schneider-Stock R,El-Rifai W。DNA超甲基化调节Barrett腺癌中Mu-类谷胱甘肽S-转移酶和谷胱甘苷过氧化物酶成员的表达。内脏。 2009;58:5–15.doi:10.1136/gut.2007.146290。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Park HL、Kim MS、Yamashita K、Westra W、Carvalho AL、Lee J、Jiang WW、Baek JH、Liu J、Osada M、Moon CS、Califano JA、Mori M、Sidransky D.DCC启动子在食管鳞状细胞癌中的超甲基化。国际癌症杂志。 2008;122:2498–2502.doi:10.1002/ijc.23434。[内政部] [公共医学] [谷歌学者]
-
Kim MS、Yamashita K、Chae YK、Tokumaru Y、Chang X、Zahurak M、Osada M、Park HL、Chuang A、Califano JA、Sidransky D。N-甲基-D-天冬氨酸受体2B基因启动子甲基化模式预测食管鳞状细胞癌预后不良。临床癌症研究2007;13:6658–6665.doi:10.1158/1078-0432.CCR-07-1178。[内政部] [公共医学] [谷歌学者]
-
范浩,刘德胜,张珊,胡建军,张飞,赵志杰。DNMT3B 579 G>T启动子多态性与中国人食管癌风险。世界胃肠病杂志。 2008;14:2230–2234.doi:10.3748/wjg.14.2230。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Samuel MS、Suzuki H、Buchert M、Putoczki TL、Tebbutt NC、Lundgren-May T、Christou A、Inglese M、Toyota M、Heath JK、Ward RL、Waring PM、Ernst M。Dnmt3a活性升高通过放松细胞外对Wnt信号的限制,促进Apc(Min)小鼠的息肉病。胃肠病学。 2009;137:902–913.doi:10.1053/j.gastro.2009.05.042。[内政部] [公共医学] [谷歌学者]
-
Bachman KE、Rountree MR、Baylin SB、Dnmt3a和Dnmtt3b是对异染色质具有独特定位特性的转录阻遏物。生物化学杂志。 2001;276:32282–32287.doi:10.1074/jbc。M104661200。[内政部] [公共医学] [谷歌学者]
-
Deng T,Kuang Y,Wang L,Li J,Wang Z,Fei J.DNA甲基转移酶3a在黑色素瘤发生中的重要作用。生物化学与生物物理研究委员会。 2009;387:611–616.doi:10.1016/j.bbrc.2009.07.093。[内政部] [公共医学] [谷歌学者]
-
董CX、邓DJ、潘肯福、张磊、张毅、周杰、游WC。胃癌前病变中与幽门螺杆菌感染相关的p16启动子甲基化:一项基于人群的研究。国际癌症杂志。 2009;124:434–439.doi:10.1002/ijc.23891。[内政部] [公共医学] [谷歌学者]
-
Schulmann K、Sterian A、Berki A、Yin J、Sato F、Xu Y、Olaru A、Wang S、Mori Y、Deacu E、Hamilton J、Kan T、Krasna MJ、Beer DG、Pepe MS、Abraham JM、Feng Z、Schmiegel W、Greenwald BD、Meltzer SJ。在Barrett相关肿瘤进展早期发生p16、RUNX3和HPP1失活,并预测进展风险。致癌物。 2005;24:4138–4148.doi:10.1038/sj.onc.1208598。[内政部] [公共医学] [谷歌学者]
-
Lee EJ、Lee BB、Han J、Cho EY、Shim YM、Park J、Kim DH。E-钙粘蛋白(CDH1)和整合素α4的CpG岛高甲基化与早期食管鳞癌复发相关。国际癌症杂志。 2008;123:2073–2079.doi:10.1002/ijc.23598。[内政部] [公共医学] [谷歌学者]
-
Gu P、Xing X、Tänzer M、Röcken C、Weichert W、Ivanauskas A、Pross M、Peitz U、Malfertheiner P、Schmid RM、Ebert MP。TIMP-3表达在食管癌和胃癌进展中的频繁缺失。肿瘤。 2008;10:563–572.doi:10.1593/neo.08208。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Seng TJ、Low JS、Li H、Cui Y、Goh HK、Wong ML、Srivastava G、Sidransky D、Califano J、Steenbergen RD、Rha SY、Tan J、Hsieh WS、Ambinder RF、Lin X、Chan AT、Tao Q。主要8p22抑癌基因DLC1在地方性和散发性鼻咽癌、食管癌和宫颈癌中常因甲基化而沉默,并抑制肿瘤细胞集落形成。致癌物。 2007;26:934–944.doi:10.1038/sj.onc.1209839。[内政部] [公共医学] [谷歌学者]
-
Kim TY,Jong HS,Song SH.Dimtch胃癌细胞中DLC-1抑癌基因的表观遗传机制转录沉默。致癌物。 2003;22:3943–3951.doi:10.1038/sj.onc.1206573。[内政部] [公共医学] [谷歌学者]
-
Long C,Yin B,Lu Q,Zhou X,Hu J,Yang Y,Yu F,Yuan Y。RUNX3基因在食管鳞癌中的启动子高甲基化。癌症投资。 2007;25:685–690.doi:10.1080/07357900701561131。[内政部] [公共医学] [谷歌学者]
-
李SH,金J,金WH,李YM。胃癌细胞组蛋白修饰对肿瘤抑制因子RUNX3的缺氧沉默。致癌物。 2009;28:184–194.doi:10.1038/onc.2008.377。[内政部] [公共医学] [谷歌学者]
-
Watanabe Y、Kim HS、Castoro RJ、Chung W、Estecio MR、Kondo K、Guo Y、Ahmed SS、Toyota M、Itoh F、Suk KT、Cho MY、Shen L、Jelinek J、Issa JP。通过洗胃液的DNA甲基化分析检测早期胃癌的敏感性和特异性。胃肠病学。 2009;136:2149–2158.doi:10.1053/j.gastro.2009.02.085。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
关联数据
本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。





