摘要
我们最近发现,小鼠妊娠期间需要表达吲哚胺2,3-双加氧酶(IDO),以防止母体T细胞对异基因胎儿的排斥反应。除了在妊娠中的作用外,IDO表达细胞还广泛分布于初级和次级淋巴器官。在这里,我们表明,在巨噬细胞集落刺激因子的影响下分化的单核细胞通过IDO对色氨酸的快速选择性降解,获得了在体外抑制T细胞增殖的能力。通过T细胞衍生信号IFN-γ和CD40配体的协同组合在巨噬细胞中诱导IDO。用色氨酸1-甲基类似物抑制IDO可阻止巨噬细胞介导的抑制。在缺乏色氨酸的条件下激活的纯化T细胞能够合成蛋白质,进入细胞周期,并在G1的初始阶段正常进行,包括上调IL-2受体和合成IL-2。然而,在缺乏色氨酸的情况下,细胞周期进程在G1中期停止。色氨酸对阻滞细胞的恢复不足以允许进一步的细胞周期进展,也不足以通过CD28进行协同刺激。只有在色氨酸存在下提供第二轮T细胞受体信号,T细胞才能退出阻滞状态。这些数据揭示了抗原提呈细胞通过色氨酸分解代谢调节T细胞活化的新机制。我们推测,体内某些抗原提呈细胞表达IDO可以抑制不需要的T细胞反应。
关键词:巨噬细胞;吲哚胺2,3-双加氧酶;T细胞;色氨酸;巨噬细胞集落刺激因子
某些巨噬细胞(Mös)1可能还有其他APC亚群抑制T细胞反应(1,2).免疫抑制APC被假设在维持外周T细胞耐受性中发挥重要作用。我们之前已经证明,在巨噬细胞集落刺激因子(MCSF)的影响下体外分化的Mös获得抑制T细胞增殖的能力(三,4).此属性不是构成性的,而是仅在尝试激活T细胞时调用。抑制活性仅限于特定的Mö表型(例如,MCSF产生的表型),其他表型支持正常T细胞激活(三).综上所述,这些特征表明,MCSF衍生莫氏菌的抑制特性可能反映了调节T细胞活化的生理系统。然而,这种抑制的机制尚不清楚。
在我们的研究过程中,我们发现MCSF衍生的Mös能够快速且选择性地从共培养物中消耗必需的氨基酸色氨酸,并且这种消耗仅在尝试激活T细胞时发生。已知莫氏菌具有诱导色氨酸降解酶吲哚胺2,3-双加氧酶(IDO),该酶催化色氨酸沿尿氨酸途径代谢的初始和速率限制步骤(5–8).据推测,IDO的作用是抑制真核细胞内病原体的增殖(9–13)或肿瘤细胞(14)通过剥夺他们的色氨酸。然而,在进行这项研究时,IDO在调节T细胞反应方面没有发挥作用。最近,我们报道了IDO在胎盘中的表达在防止母体T细胞对异基因胎儿的排斥反应中起着关键作用(15).目前的研究验证了以下假设:通过IDO消耗色氨酸是MCSF衍生的Mös在体外抑制T细胞激活的机制,并确定了T细胞激活期间的色氨酸敏感细胞周期阻滞点。
材料和方法
试剂。
重组人MCSF是马萨诸塞州剑桥遗传研究所的礼物。重组人IFN-γ是基因泰克重组人CD40配体(CD40L)同源三聚体是W.Fanslow的礼物,Immunex公司。华盛顿州西雅图。IDO抑制剂1-甲基-d日,我-色氨酸(16)从购买奥尔德里奇化学公司。6-硝基色氨酸(17)由佐治亚州亚特兰大乔治亚州立大学的D.Boykin使用Moriya等人的改进方法合成(18).抗人干扰素-γ的多克隆抗血清来自生物资源国际。所有其他试剂均来自西格玛化学公司。除非另有规定。
细胞分离和培养。
根据我们的机构审查委员会批准的方案,在适当的知情同意下,通过白细胞分离和逆流离心淘洗从健康志愿者捐赠者中分离出人类外周血单核细胞和淋巴细胞。如前所述,单核细胞(细胞表面标记物纯度>95%)在96个平板中培养(4)使用含10%新生小牛血清(Hyclone)和MCSF(200 U/ml)的RPMI 1640。
如前所述,在共培养中进行T细胞活化研究(4)使用上述介质补充5%的FCS。简言之,莫斯(5×104细胞/孔)在MCSF中分化4-6天,然后自体淋巴细胞(2×105细胞/孔)与丝裂原一起添加。本研究中使用的有丝分裂原为抗CD3单克隆抗体(100 ng/ml,克隆OKT3;美国型培养物收集)和葡萄球菌肠毒素B(5μg/ml;西格玛化学公司。).两者给出了相同的结果;除非另有规定,否则所示数据来自抗CD3。如前所述,通过标准胸腺嘧啶掺入试验评估T细胞增殖(三).当在不使用Mös的情况下研究T细胞激活时,添加新鲜自体单核细胞(1:4)作为非抑制性辅助细胞。
通过在添加T细胞48小时后收获上清液来制备T细胞和Møs共培养的条件培养基。然后使用条件培养基支持第二轮T细胞激活。在无色氨酸缓冲液中制备有丝分裂原和其他添加剂。
一种化学定义的无血清培养基(19)使用无色氨酸RPMI 1640(选择胺试剂盒;GIBCO巴西雷亚尔)补充胰岛素(10μg/ml)、铁饱和转铁蛋白(5μg/ml。初步验证实验证实,该培养基中的T细胞增殖无法检测到,但在添加色氨酸时与基于血清的培养基相当。为了研究没有Mös的T细胞,使用吸附在塑料组织培养孔(0.5μg/cm)上的抗CD3单克隆抗体激活T细胞2在碳酸氢盐缓冲液中,pH值为9)加上可溶性抗CD28单克隆抗体(1μg/ml;法尔敏根).
色氨酸和IDO分析。
莫氏菌的色氨酸降解活性反映了IDO表达、色氨酸进入细胞以及翻译后影响酶活性的细胞内条件的多因素组合(20).因此,当感兴趣的结果是色氨酸缺失时,我们测量了培养上清液中色氨酸随时间的消失率。使用Bloxam和Warren方法测定色氨酸(21).蛋白质用10%TCA沉淀,用甲醛和FeCl转化为去甲骆驼蓬后测定游离色氨酸三用荧光分光光度法测量反应产物(激发360nm,发射460nm),并与色氨酸的标准制剂进行比较。验证研究表明,该分析在0.1-100μM范围内呈线性,估计阈值灵敏度为0.05μM。
如果需要证明培养物中的色氨酸消耗是由于IDO活性所致,则通过HPLC分析培养上清液中是否存在犬尿氨酸。IDO催化色氨酸氧化为N个-甲酰尿氨酸,在莫斯迅速转化为尿氨酸(22)然后到其他下游代谢物(7).除了色氨酸加氧酶(仅在肝细胞中发现)外,IDO是唯一一种能够沿犬尿氨酸途径降解色氨酸的酶(8).因此,培养物中出现的犬尿氨酸是功能性IDO活性的明确证据。然而,由于犬尿氨酸可以转化为其他下游代谢物,因此该分析不是定量的。如果需要定量数据,则使用上述色氨酸消耗试验。
HPLC分析由乔治亚医学院分子生物学核心设施进行。通过用1 ml甲醇提取150μl培养上清液制备样品。沉淀的蛋白质通过离心去除,上清液在真空下干燥。将样品重新悬浮在100μl初始流动相(去离子水)中,并将等分样品注入C-18柱(Phenomenex Luna C-18;250×4.6 mm;5μm)。用乙腈在水中的线性梯度洗脱样品(20分钟内0–80%),并在254 nm处测量吸光度。色氨酸、犬尿氨酸和1-甲基色氨酸的标准品在每一次分析中进行测定,以确定保留时间。在初步验证研究中,每个峰的特性和纯度通过质谱进行了确认。
蛋白质合成和氨基酸分析。
将氚化亮氨酸(4μCi/ml)加入24 h后,测量总蛋白质合成。将TCA不溶性蛋白质沉淀并在5%TCA中洗涤三次,并通过液体闪烁计数分析沉淀。在我们的临床新生儿营养实验室中,用HPLC测定培养上清液中的氨基酸浓度。
RT-PCR。
用EDTA和制备的总RNA收获Mös。样本RNA(1μg)用禽成髓细胞增多症病毒(AMV)-RT逆转录,并用以下引物扩增182-bp片段:正向,发布序列的bp 237–254(23)反向,bp 402-418,跨越外显子3-4。产物形成通过琼脂糖凝胶电泳和溴化乙锭染色进行评估。从凝胶中分离PCR产物,并用内部引物扩增以确认特异性。
流式细胞术。
双色FACS®如前所述,使用直接结合的单克隆抗体进行分析(24).通过对CD3阳性细胞进行门控来识别T淋巴细胞,并在第二种颜色下测量CD69、CD25和CD71的表达。
统计。
所有图形的实验都至少重复了三次,并显示了具有代表性的数据。测量数据点一式三份,并报告平均值。误差条显示标准偏差。当SD小于10%时,为了清晰起见,省略了误差条。通过方差分析对单个实验中的多个组进行比较。
结果
莫氏细胞和T细胞的共培养选择性地耗尽色氨酸。
48小时后,从莫氏细胞和有丝分裂原激活的T细胞共培养物中获得上清液。新鲜淋巴细胞悬浮在条件培养基中,并用额外的有丝分裂素激活。图。1表明条件培养基完全不能支持T细胞增殖(小于新鲜培养基中增殖的1%)。然而,将色氨酸添加到条件培养基中完全恢复了其支持T细胞增殖的能力,这表明色氨酸是唯一被耗尽的成分。与这一发现一致,条件培养基的氨基酸分析表明,存在所有其他必需氨基酸,只有色氨酸无法检测到(数据未显示)。将试剂色氨酸滴定到条件培养基中,T细胞增殖的半最大浓度为0.5–1μM(图。2)与共培养条件培养基中测定的色氨酸浓度<50 nM(我们检测的检测限)相比。仅来自莫氏培养基的对照条件培养基,来自无丝裂原的莫氏+T细胞共培养物,或来自用新鲜单核细胞而非莫氏激活的T细胞的对照条件下培养基,均支持T细胞增殖,与新鲜培养基相比(对照组的90-140%;n个=3–4/组)。
图1。

共培养条件培养基选择性地耗尽色氨酸。允许人单核细胞在MCSF中分化5天。然后,添加T细胞并用抗CD3单克隆抗体激活。48小时后从共培养物中获得条件培养基,然后用新鲜T细胞支持第二轮激活。用单个氨基酸补充复制培养物,使其达到RPMI 1640中的正常浓度。对照组培养物接受新鲜培养基(CTL)或不补充培养基(PBS)。72小时后用胸腺嘧啶掺入法测量增殖。
图2。
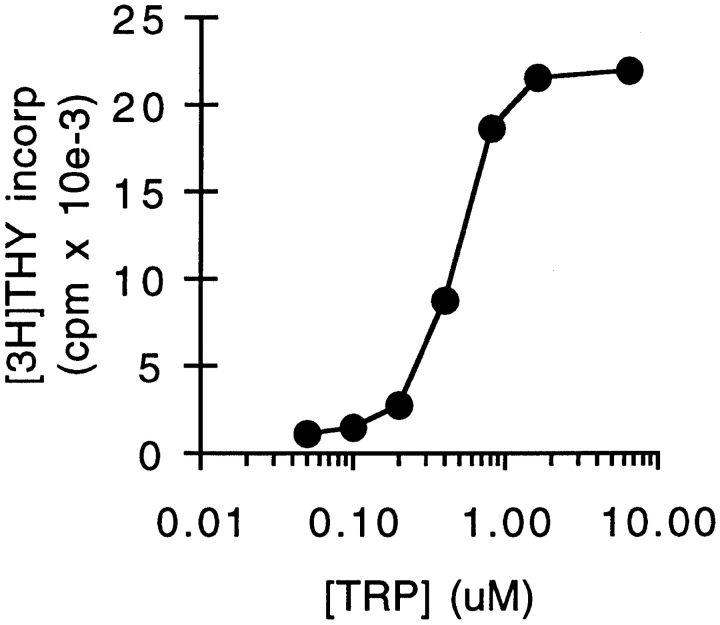
T细胞增殖与色氨酸的剂量-反应关系。在共培养条件培养基(如图所示制备)中滴定色氨酸。1)72小时后测量T细胞的增殖。
用MCSF衍生Mös表达IDO。
通过将Mös和T细胞与有丝分裂原共培养24小时,以上调色氨酸消耗途径,然后添加新鲜色氨酸并在其消失后,测量色氨酸消除的动力学。如图所示。三A、 色氨酸通过半衰期为2–3小时的一级动力学消除。当色氨酸不受限制时,初始消除速率高达20000 pmol/106细胞/h。这远远超过了细胞代谢产生的消耗量(参见对照,图。三A) ,因为没有活化T细胞的Mös以300±130 pmol/10的速率耗尽色氨酸6细胞/小时(7天内获得的累积测量值;未显示数据)。这意味着被激活的莫氏菌消耗色氨酸的大部分是由于一个诱导系统,我们怀疑这是IDO。
图3。


共培养物中色氨酸的消除动力学和MCSF衍生Mös表达IDO。(A)将MCSF衍生的Mös与自体T细胞培养24 h,无论是否有(•)(▪) 抗CD3单克隆抗体。然后用新鲜培养基和在所示时间采集的复制培养物上清液替换培养基。色氨酸浓度按材料和方法中所述的分光光度法测定。(B)MCSF衍生Mös中IFN-γ诱导的IDO mRNA。RT-PCR显示重组IFN-γ激活24小时之前(第4道)和之后(第1-3道)MCSF-衍生Mös中IDO的表达。1–3道中逆转录酶反应的起始RNA分别来自20000、2000和200个激活的摩尔,以及4道中20000个未激活的摩尔。第5栏显示了人类IDO质粒模板的扩增,得到预期的182-bp产物。(C)莫氏培养上清液的HPLC分析,显示色氨酸降解和犬尿氨酸生成。用IFN-γ预激活MCSF衍生的Mös 24h以诱导IDO表达,然后用新鲜培养基替换90:10的废培养基。微量1显示添加新鲜培养基后立即对上清液的分析(时间0);迹线2显示24小时后的条件培养基。这些实验中的摩尔数保持在较低水平,以便在实验结束时可以检测到一些色氨酸。所示痕量代表洗脱梯度在28%至42%乙腈(7.00–10.50分钟)之间的部分,在此期间出现了犬尿氨酸(K)和色氨酸(T)。峰标签位于纯化标准洗脱点处,洗脱点位于相应样品峰的±3 s范围内。培养基中的化合物在OD时也被吸收254(未标记的峰)很容易从色氨酸和犬尿氨酸中分离出来,T和K峰通过质谱得到确认(见材料和方法)。实验表明,所用的纯化莫氏液经重组配体活化;在与T细胞和丝裂原共培养中激活Mös时,获得了相同的结果。显示了四个实验中的一个。
与这一发现一致,激活后通过RT-PCR在莫氏中检测到丰富的IDO mRNA,而激活前,IDO信息无法检测到(图。三B) ●●●●。为了确认IDO活性的存在,对培养上清液中的犬尿氨酸进行了检测。如图所示。三C、 色氨酸的消耗伴随着尿氨酸生成的相应增加,证实了功能性IDO活性的存在。
抑制IDO可防止Mö介导的T细胞抑制。
接下来,我们询问IDO的药物抑制是否可以阻止共培养中T细胞的抑制。据报道,当使用纯化酶进行体外测试时,化合物1-甲基色氨酸是一种有效的IDO活性竞争抑制剂(16,17).为了确定该试剂是否可以抑制完整莫氏菌中的IDO活性,我们向活化莫氏菌添加了1-甲基色氨酸。如图所示。4A、 1-甲基色氨酸的存在显著降低了莫氏菌对色氨酸降解,这伴随着对犬尿氨酸生成的相应抑制(例如,在图中比较24小时后色氨酸与犬尿氨素的比率)。三C) ,证实抑制剂的靶点是IDO。
图4。



抑制IDO活性可防止莫介导的抑制。(A)1-甲基色氨酸抑制MöIDO酶活性。用IFN-γ激活MCSF衍生的Mös 24小时以诱导IDO表达,然后按照图所示添加新鲜培养基。三以及1-甲基色氨酸(1 mM)。在添加新鲜培养基(微量1)和24 h后(微量2),用HPLC分析上清液中的色氨酸(T)和犬尿氨酸(K)。在使用的设置下,1-甲基色氨酸峰(M)超出范围。这些实验的对照培养物(含IFN-γ但不含1-甲基色氨酸的莫氏菌)在24小时时色氨酸均匀减少>90%,而尿氨酸相应增加,如图所示。三实验表明,所用的纯化莫氏液经重组配体活化;在与T细胞和丝裂原共培养中激活Mös时,获得了相同的结果。(B)1-甲基色氨酸防止共培养中的T细胞抑制。将T细胞添加到MCSF衍生的Mös中,并用抗CD3单克隆抗体激活。用不同浓度的1-甲基色氨酸处理复制培养物。72小时后通过胸腺嘧啶掺入法测量增殖。对照组(○)显示,在所用抑制剂的最高浓度下,不含Mös的T细胞增殖(在所示浓度范围内,仅抑制剂对T细胞没有影响)。(C)IDO活性的第二个抑制剂,6-硝基色氨酸,表现出与莫介导的T细胞抑制作用类似的逆转。实验设计如B.(D)中所示,补充高浓度色氨酸可防止莫介导的抑制。在低密度(CC-lo;5×104细胞/孔)和高密度(CC-hi;2×105细胞/孔)和添加5倍正常色氨酸浓度的培养基。在第72小时测量扩散。对照组显示仅由莫氏细胞(M)和T细胞(T)增殖。
从功能上讲,向共培养物中添加1-甲基色氨酸会以剂量依赖的方式消除莫氏抑制T细胞增殖的能力(图。4B) 。虽然这一发现与IDO在莫介导抑制中的拟议作用一致,但理论上可能表明1-甲基色氨酸本身具有意料之外的免疫刺激作用。为了排除这种可能性,我们合成了第二种色氨酸类似物,6-硝基色氨酸,也有报道称其在体外抑制纯化的IDO酶(17).如图所示。4C、 6-硝基色氨酸还以剂量依赖的方式阻止了莫介导的抑制(图。4C) ●●●●。最后,我们测试了补充色氨酸对抑制作用的影响。如图所示。4D、 高水平的色氨酸确实阻止了T细胞的抑制,前提是共培养物中的莫氏菌数量保持较低。在我们通常的莫氏浓度下,事实证明不可能补充足够的色氨酸来克服其快速降解。因此,通过使用两种IDO药物抑制剂和补充色氨酸,我们系统中的T细胞抑制机制似乎是IDO耗尽色氨酸。
T细胞活化的早期信号协同诱导色氨酸降解活性。
莫斯不会仅仅因为接触T细胞而降解色氨酸。相反,有一个强制性要求,即T细胞试图激活(图。三A) ●●●●。根据现有研究表明干扰素-γ是IDO的诱导剂(25–27),我们怀疑来自活化T细胞的IFN-γ可能是IDO诱导的信号。与这一想法一致,在T细胞激活的4-6小时内,共培养物中存在低水平但可检测到的IFN-γ,这与色氨酸降解开始的时间一致(图。5A) ●●●●。针对IFN-γ的中和抗体降低了色氨酸降解活性的诱导(图。5B) 并减少莫氏对T细胞的抑制(图。5C) ,支持IFN-γ在信号通路中的作用。然而,使用重组IFN-γ的剂量-反应关系表明,完全诱导色氨酸降解活性需要相对较高浓度的IFN-γ(图。5D) ●●●●。因此,我们询问是否存在与IFN-γ协同作用的额外信号。CD40L在T细胞激活早期上调,已知与IFN-γ协同作用以激活其他Mö功能(28).图。5D显示,CD40L与IFN-γ发挥了显著的协同作用,将IFN-γ的剂量-反应曲线移动了一到两个数量级,因此在IFN-γ浓度<1 U/ml时开始出现明显的色氨酸消耗。
图5。
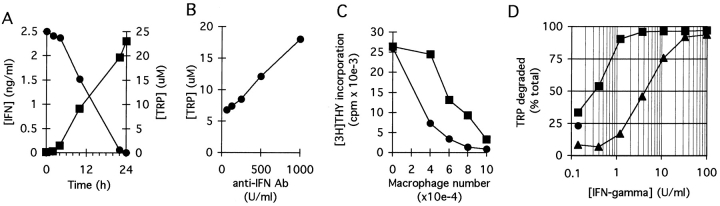
IFN-γ和CD40L协同诱导IDO。(A)MCSF衍生的Mös与T细胞和抗CD3单克隆抗体共培养。添加淋巴细胞后,在所示时间采集培养上清液并检测IFN-γ(▪, 左轴)和色氨酸浓度(•,右轴)。(B)Mös和T细胞与有丝分裂原在不同浓度的中和抗IFN-γ抗血清存在下共同培养。18小时后测定培养上清液中的色氨酸浓度。这些实验使用低密度的Møs,以免掩盖IFN-γ的作用。(C)如图所示,在一定的播种密度下培养莫氏菌,然后添加T细胞和抗CD3单克隆抗体(▪) 或没有(•)IFN-γ的中和抗体(100中和U/ml)。干扰素-γ抗体降低了莫氏菌抑制T细胞的有效性,尤其是莫氏菌数量有限时。(D)用不同浓度的重组干扰素-γ培养MCSF衍生的莫氏菌24小时(▪) 或缺乏重组CD40L(500 ng/ml)。在激活期结束时,对培养上清液进行色氨酸残留浓度分析。单圆点显示色氨酸降解是对CD40L的单独反应。
脱色氨酸对T细胞蛋白质和DNA合成的影响。
我们之前已经证明,在与MCSF衍生Mös共培养中激活的T细胞最初进入细胞周期,但在第一次G1/s转变之前停止(4).因此,我们询问当T细胞在缺乏色氨酸的情况下被激活时,是否会出现类似的现象。纯化的T细胞(不含单核细胞或Mös)在无色氨酸的培养基中培养,使用固定化抗CD3抗体和抗CD28单克隆抗体作为激活刺激物。在这个系统中,在色氨酸存在下刺激的T细胞正常激活,而在没有色氨酸的刺激下,T细胞在进入第一个S期之前被阻止,如DNA合成完全缺失所示(图。6).这种阻滞不是由于缺乏蛋白质合成,因为没有色氨酸的T细胞成功上调了CD69、CD25(高亲和力IL-2受体)和CD71(转铁蛋白受体)(图。7)分泌IL-2和IFN-γ(图。8)所有这些都需要新的蛋白质合成(29).总蛋白合成,以放射性标记亮氨酸在激活的前24小时内的掺入量进行测量,以40–55%的对照组速率继续进行(n个= 3;见材料和方法),尽管缺乏外源色氨酸。然而,没有进入S阶段。因此,在缺乏外源色氨酸的情况下,T细胞被激活,并以类似于我们之前在共培养中观察到的方式被阻止。
图6。

在缺乏色氨酸的情况下,T细胞不会进入S期。用固定化抗CD3单克隆抗体和抗CD28在化学定义的无色氨酸介质中激活T细胞(▪) 或在添加25μM色氨酸(•)的相同培养基中。在所示时间,通过胸腺嘧啶掺入分析DNA合成。
图7。
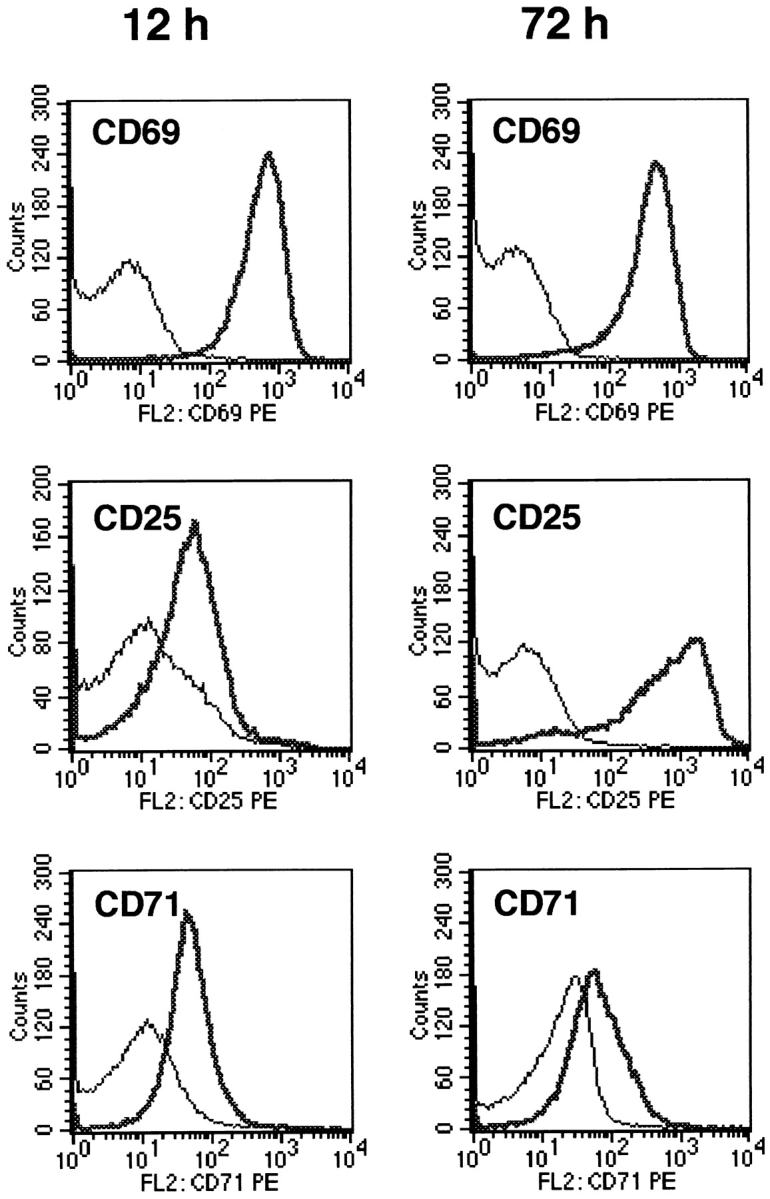
在缺乏色氨酸的T细胞上表达激活标记物。使用固定化抗CD3/CD28(重示踪)在无色氨酸的培养基中激活T细胞,或在相同条件下培养,但不使用抗CD3/CD28(轻示踪)。在所示的时间,两组均被采集并染色,以表达材料和方法中所述的激活标记。
图8。

缺乏色氨酸的T细胞产生IFN-γ和IL-2。在无色氨酸培养基中用抗CD3单克隆抗体激活T细胞(▪) 或在补充了25μM色氨酸(•)的相同培养基中,在所示时间测定培养上清液中IFN-γ(A)和IL-2(B)的浓度。
在Mid-G1中鉴定一个色氨酸敏感的停搏点。
早期G1标记的上调表明G1的某些部分是色氨酸非依赖性的。为了验证这一假设,在没有色氨酸的情况下激活T细胞不同时间,然后添加色氨酸并确定进入S期的时间。用色氨酸培养的对照细胞在初次TCR作用后28–32小时可重复进入S期(时间报告为4小时范围,以反映分析的精确度极限)。相比之下,在无色氨酸条件下预激活的T细胞在添加色氨酸后仅需12–16小时即可进入S期(图。9A) ,表明在缺乏色氨酸的情况下,通过G1发生了显著进展。色氨酸敏感的停搏点是稳定的,T细胞在没有色氨酸的情况下存活>72小时,没有丧失活力。当将色氨酸添加到滞留细胞中时,进入S期的时间始终为12–16小时,无论细胞是否在没有色氨酸的情况下预激活了36、48或72小时。这表明阻滞发生在G1的特定点,并且在色氨酸恢复之前,细胞周期中的这个位置一直保持不变。
图9。

进入色氨酸敏感阻滞状态的T细胞保持在G1中期。(A)使用固定化抗CD3/CD28(•)在无色氨酸的培养基中激活T细胞。在一段时间的预激活后(24–72小时,结果相似;在所示实验中为48小时),添加色氨酸,并确定进入S相的时间(定义为胸腺嘧啶掺入的起始时间)。在含有色氨酸的培养基中激活复制的小份细胞,无需48小时的预孵育期(▪). 每种情况下的延迟时间定义为从细胞同时看到色氨酸和抗CD3的点开始S期的时间。箭头显示,由于在缺乏色氨酸的情况下预激活,到S期的延迟时间缩短了12–16小时,这表明G1的这一部分在细胞停止之前完成。的代表 在36、48和72小时的七个实验中,都显示了相同的S相滞后时间。(B)T细胞被抗CD3/CD28激活(▪) 或缺乏色氨酸。14小时后(根据A估计的假定停止点时间),将色氨酸添加到缺乏色氨酸的培养物中,并确定进入S期。与对照组相比,第14小时获救的T细胞没有延迟。
根据前面的实验,我们估计G1的色氨酸依赖部分为~14小时(计算为静止T细胞到S期的平均时间与预激活细胞到S阶段的时间之差)。为了验证这一估计,我们在激活的最初14小时内剥夺了T细胞的色氨酸,然后在假定的停止点之前添加色氨酸。如图所示。9B、 培养物在最初14小时内缺乏色氨酸,进入S期的过程与T细胞始终供应色氨酸的过程相同,支持了G1的初始部分不依赖色氨酸这一假设。在其他实验(未显示)中,延迟添加色氨酸超过14小时会导致进入S期的相应延迟,支持在接近14小时时定位所提议的停止点。
T细胞可以在没有色氨酸的情况下进行细胞分裂。
静止(G0)T细胞需要TCR信号才能进入G1,但随后的细胞周期进展迅速变得与TCR无关(综述见参考文献29).在我们的系统中,TCR参与后6小时内首次检测到TCR非依赖性细胞分裂,大多数细胞在12小时前发生分裂。如图所示。10在相关时间段内,无论色氨酸是否存在,这种承诺都是一致的。只要不允许细胞停滞(即在色氨酸敏感检查点之前提供色氨酸),细胞分裂的承诺就会正常进行。
图10。
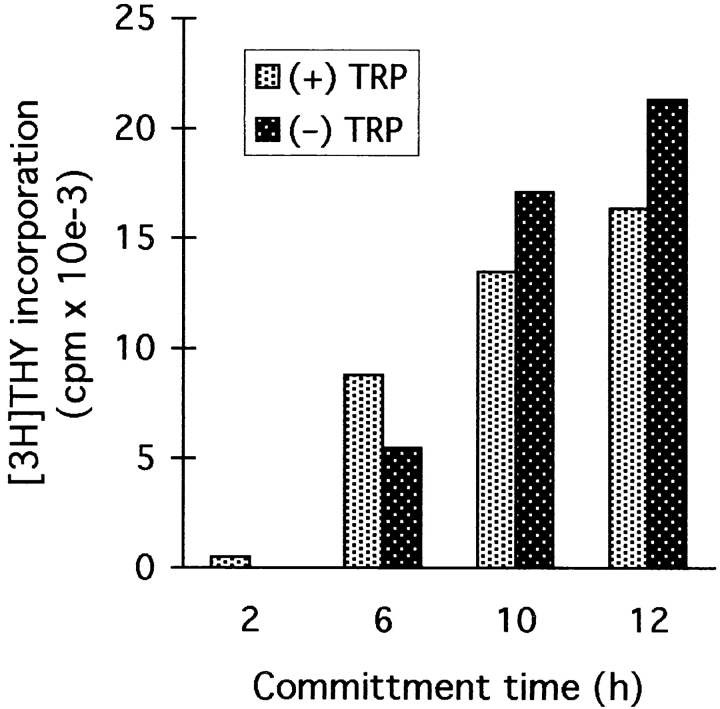
在缺乏色氨酸的情况下,T细胞会进行正常的TCR非依赖性激活。将T细胞暴露于固定化的抗CD3/CD28抗体中2–12 h,其中色氨酸的存在(亮条)或不存在(暗条)。在显示的时间,细胞被从抗CD3接触中移除。转移后,将色氨酸添加到色氨酸缺乏的培养物中,所有组继续培养至48小时。将细胞转移到其自身的条件培养基中,无需清洗,并始终接受抗CD28抗体。48小时时,通过胸腺嘧啶掺入法对所有组的增殖进行分析。将2小时的时间点(转移后无增殖)作为对照,以确认新培养物中没有携带抗CD3抗体。
T细胞在进入被捕状态时逆转其对细胞周期进程的承诺。
与图中所示的实验相反。10然而,一旦T细胞进入停滞状态,仅仅恢复色氨酸就不足以促进细胞周期的进展。使用固定化抗CD3/CD28在色氨酸缺乏的培养基中激活T细胞48小时。然后将被截留的细胞从与抗CD3的接触中取出,洗去抗CD28,并转移到含有正常水平色氨酸的培养基中。如图所示。11尽管他们之前48小时暴露于抗CD3抗体,但被捕的T细胞仍然需要额外的TCR信号和色氨酸的存在才能退出被捕状态。在缺乏TCR参与的情况下,即使通过CD28进行共刺激也不足以促进细胞周期进展。
图11。

T细胞需要TCR信号来退出阻滞状态。使用固定化抗CD3/CD28抗体在不含色氨酸的情况下激活T细胞48小时。为了模拟与APC的接触损失,将T细胞从固定化抗CD3中取出,清洗,然后返回到含有25μm色氨酸的培养基中培养。在重放后,复制培养物接受固定化抗CD3、抗CD28或两者。
讨论
在本研究中,我们表明,通过IDO的色氨酸分解代谢是MCSF衍生的Mös体外抑制T细胞增殖的机制。我们最近利用异基因妊娠模型在体内测试了IDO介导的T细胞抑制假说。之所以选择这种模型,是因为长期以来人们一直认为,母体免疫系统在整个妊娠期都能耐受基因外来的胎儿,这是自相矛盾的(30).IDO已知在人类胎盘中表达,并且据报道局限于胎儿组织和母亲免疫系统之间的接触区(31).使用1-甲基色氨酸(如图。4)作为IDO的药物抑制剂,我们已经证明IDO是异基因胎儿保护自己免受母体免疫系统排斥的机制的必要组成部分,并且抑制IDO会破坏母体对异基因胎儿的耐受性(15).在同一份报告中,我们还发现药物抑制IDO可以增强自身反应性T细胞的活化。因此,通过打破耐受性和增强自身反应性这两项措施,这些数据支持IDO在调节体内T细胞反应中的作用。
IDO以前主要被视为宿主防御机制,抑制细胞内病原体的增殖(6,9–13)或癌细胞系(14)通过剥夺它们的色氨酸(有关综述,请参阅参考文献8).在这些情况下,IDO的拟议作用是消除细胞自身储存的色氨酸。据我们所知,IDO在调节邻近细胞增殖方面没有任何作用。然而,直接和间接证据都表明IDO在整个免疫系统中广泛表达(32,33)特别是,它定位于具有Mö或树突状细胞形态的细胞子集(33–35).这些IDO表达细胞存在于免疫耐受或特权的几个假定部位,包括胸腺、肠道粘膜、附睾、胎盘和眼前房(32,33,36,37).这种在整个免疫系统中广泛表达的模式很难与宿主防御的简单机制相协调。我们假设APCs的IDO表达可抑制不良T细胞激活,从而有助于维持外周耐受。
IDO可以通过两种模型抑制体内T细胞:它可以催化色氨酸抑制代谢物的产生,或者它可以将局部色氨酸消耗到T细胞激活所需的阈值水平以下。在重复的实验中,我们无法在共培养上清液中检测到任何免疫抑制代谢物的证据(图。1和2) (4).此外,我们对分离的T细胞进行的实验表明,早期T细胞激活存在一个特定的检查点,该检查点对低浓度色氨酸敏感。基于这些原因,我们支持色氨酸耗竭假说。
这一假设隐含着这样一个假设,即尽管其他地方有充足的色氨酸,但体内表达IDO的细胞可以创造一个局部的微环境,其中色氨酸含量较低。在这方面,众所周知,基质向局部微环境的传递受到扩散速度的急剧限制(K(K)
d日)通过间隙(38,39).即使面对正常的代谢需求,底物浓度也会在输送源的几个细胞直径内迅速降至无法检测的水平(39).由于表达IDO的莫氏菌的色氨酸消耗率比正常代谢需求高出几个数量级,因此这种莫氏菌可能会造成当地色氨酸浓度极低的情况。虽然这个假设现在是关于色氨酸的推测,但这一现象在例如运动期间肌肉组织内产生的局部缺氧状态方面有很好的记录。
因为IDO对色氨酸的降解远远大于代谢需求的消耗(图。三),IDO很可能是活性Mös消耗色氨酸的主要途径。然而,IDO可以与其他途径联合作用。莫氏菌有很高的蛋白质合成速率,将游离色氨酸并入蛋白质中可能会导致局部色氨酸消耗。事实上,色氨酸的tRNA合成酶(WRS基因)在tRNA合合酶中是独一无二的,因为它在M系细胞系(但不是淋巴系)中由诱导IDO的相同信号大量诱导(40).有人提出,当底物浓度较低时,这种诱导使莫氏菌优先竞争色氨酸。同样,任何将色氨酸运输到莫斯的途径,无论是用于蛋白质合成、IDO降解还是并入其他生物合成途径,都会消耗当地的色氨酸。因此,IDO可以与其他分解代谢途径协同作用,使莫氏成为色氨酸的有效局部“汇”。
色氨酸耗竭模型得到了对色氨酸浓度敏感的细胞周期阻滞点的支持。虽然从定义上讲,缺乏任何必需营养素与长期增殖是不相容的,但我们描述的停止点似乎比单纯的蛋白质饥饿更具体。首先,虽然在缺乏外源色氨酸的情况下蛋白质合成减少,但仍以显著的速度发生,可能反映了内源性色氨酸储存和内源性和外源性蛋白质分解代谢中色氨酸再循环的结合(41).然而,尽管正在进行蛋白质合成,细胞周期的进展并不是简单地被延迟,而是完全被阻止。第二,色氨酸剥夺诱导的阻滞发生在细胞周期中的一个可复制点,一旦进入该点就保持稳定,表明这是一个受调控的过程。综上所述,这些特征表明存在一个特定的、对色氨酸敏感的细胞周期阻滞点。
一些研究小组已经注意到,剥夺某些氨基酸,特别是色氨酸,会对细胞周期进程产生抑制作用,而这种抑制作用无法用对蛋白质合成的影响来解释(42–45).因此,有人建议,这些氨基酸的水平可能作为调节细胞周期进展的特定检查点。然而,这种氨基酸特异性检查点的生物学意义以及操纵氨基酸水平以调节T细胞活化的机制仍然不清楚。我们现在提出了一种系统,在该系统中,局部色氨酸浓度的调节是APC和T细胞之间通信的一种手段,APC通过IDO调节色氨酸水平,T细胞根据检测到的水平对其进行激活或停止反应。
作为抑制T细胞活化的策略,阻止细胞周期的进展并不是色氨酸代谢所独有的。免疫抑制药物霉酚酸酯、雷帕霉素和来氟米特均可诱导激活T细胞的G1中期停滞,这被认为是其免疫抑制作用的全部或部分原因(46–48).最近的证据表明,T细胞需要一轮或多轮细胞分裂才能获得多种效应器功能(49–51),因此抑制增殖也可能抑制功能活动。在我们的系统中,目前尚不清楚T细胞如何感知色氨酸水平并触发细胞周期阻滞。细菌中的色氨酸传感系统已被很好地描述(52),但真核生物中的可比系统尚未确定。然而,已知哺乳动物的基因,如色氨酸加氧酶,受色氨酸水平变化的调节(53),因此可以推断存在此类传感系统。
根据我们提出的生物模型,需要TCR发出第二个信号以退出被捕状态是一个重要发现。在这种模型下,当与表达IDO的APC接触时,试图激活的T细胞受到局部缺乏色氨酸的抑制。然而,理论上,一旦这些T细胞进行细胞分裂,它们就可以迁移到其他地方,并在色氨酸充足的条件下完成活化过程。图中所示的数据。11研究表明,一旦T细胞被抑制,仅仅恢复色氨酸就不足以继续激活。尽管T细胞在色氨酸敏感检查点之前通常会独立于TCR信号(图。10)一旦他们进入被捕状态,他们显然会推翻这一承诺,重新要求自己发出第二轮TCR信号。从生物学的角度来看,这意味着被IDO表达的APC捕获的T细胞必须找到第二个呈现相同抗原的非抑制性APC,以退出捕获状态。
如果找不到这样的支持性APC,一个被捕的T细胞的命运会怎样?在体外,我们发现,如果不通过TCR的参与来挽救,被阻滞的细胞在几天后会发生渐进性凋亡(4).这是否意味着它们也会在体内死亡,进入某种形式的无能,或返回到休息状态,尚待确定。然而,我们描述的被捕状态不同于经典的无能(54)在几个有趣的方面。首先,细胞保持对TCR参与的响应(图。11).其次,通过CD28的协同刺激不足以在细胞被捕后拯救细胞。第三,如果在相对较短的时间内没有获救,被捕的牢房就会死亡。综上所述,这些属性表明,被色氨酸剥夺所捕获的T细胞并不会立即从储备中删除,但它们必须找到一个允许的APC并完成激活过程,才能存活下来。
总之,我们关于IDO表达APC生物学作用的假设是,它们参与维持外周对自身抗原的耐受性。我们的体外模型将MCSF衍生的Mös作为免疫抑制性APC的一个例子,但具有可诱导IDO的树突状细胞或其他APC也可能具有免疫抑制性。我们推测,色氨酸分解代谢可能是一种以前未被怀疑的机制,有助于调节外周T细胞的活化。
致谢
作者感谢蔡俊晖(J.-F.Tsai)提供的专家技术援助、T.Stoming(T.Stomin)开发和执行的HPLC分析,以及C.Rossignol和J.Bhatia(J.Bhatia)提供的氨基酸分析。
这项工作得到了美国国立卫生研究院(向D.H.Munn授予K08 HL03395、R21 AI44759和R01 HL60137)的支持,以及卡洛斯和玛格丽特·梅森信托基金的慷慨支持。
本文中使用的缩写词
- CD40升
CD40配体
- IDO公司
吲哚胺2,3-双加氧酶
- 莫
巨噬细胞
- MCSF公司
巨噬细胞集落刺激因子
工具书类
-
1.Fazekas de St.Groth B.自我容忍的进化:一个新的细胞出现以迎接自我活动的挑战。今日免疫学。 1998;19:448–454.doi:10.1016/s0167-5699(98)01328-0。[内政部] [公共医学] [谷歌学者]
-
2Banchereau J,Steinman RM。树突状细胞和免疫控制。自然。 1998;392:245–252.doi:10.1038/32588。[内政部] [公共医学] [谷歌学者]
-
三。Munn DH,Armstrong E.细胞因子对体外人单核细胞分化的调节:巨噬细胞集落刺激因子诱导的肿瘤细胞毒表型受干扰素γ的发育调节。1993年癌症研究;53:2603–2613.[公共医学] [谷歌学者]
-
4Munn DH,Pressey J,Beall AC,Hudes R,Alderson MR。巨噬细胞对外周T细胞的选择性激活诱导凋亡:抗原特异性外周淋巴细胞缺失的潜在机制。免疫学杂志。 1996;156:523–532.[公共医学] [谷歌学者]
-
5Shimizu T、Nomiyama S、Hirata F、Hayaishi O。吲哚胺2,3-双加氧酶:纯化和一些性质。生物化学杂志。 1978;253:4700–4706.[公共医学] [谷歌学者]
-
6Carlin JM、Borden EC、Sondel PM、Byrne GI。人类单核吞噬细胞中干扰素诱导的吲哚胺2,3-双加氧酶活性。白细胞生物学杂志。 1989;45:29–34.doi:10.1002/jlb.45.1.29。[内政部] [公共医学] [谷歌学者]
-
7Werner ER、Bitterlich B、Fuchs D、Hausen A、Reibnegger G、Szabo G、Dierich MP、Wachter H。人巨噬细胞在干扰素-γ诱导下降解色氨酸。生命科学。 1987;41:273–280.doi:10.1016/0024-3205(87)90149-4。[内政部] [公共医学] [谷歌学者]
-
8Taylor MW,Feng G.干扰素-γ、吲哚胺2,3-双加氧酶和色氨酸分解代谢之间的关系。FASEB J.1991;5:2516–2522.[公共医学] [谷歌学者]
-
9Pfefferkorn ER。γ干扰素通过诱导宿主细胞降解色氨酸来阻止弓形虫人成纤维细胞的生长。美国国家科学院院刊,1984年;81:908–912.doi:10.1073/pnas.81.3.908。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
10Gupta SL、Carlin JM、Pyati P、Dai W、Pfefferkorn ER、Murphy MJ。人成纤维细胞中吲哚胺2,3-双加氧酶表达的抗寄生虫和抗增殖作用。感染免疫。 1994;62:2277–2284.doi:10.1128/iai.62.6.2277-2284.1994。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
11Daubener W,Mackenzie C,Hadding U。建立类人弓形虫抗原特异性T细胞克隆的T-helper 1型和T-helper 2型。免疫学。 1995;86:79–84.[PMC免费文章] [公共医学] [谷歌学者]
-
12Daubener W,Remscheid C,Nockemann S,Pilz K,Seghrouchni S,Mackenzie C,Hadding U。人脑肿瘤细胞中的抗帕金森病效应器机制:干扰素-γ和肿瘤坏死因子-α的作用。欧洲免疫学杂志。 1996;26:487–492.doi:10.1002/eji.1830260231。[内政部] [公共医学] [谷歌学者]
-
13Nagineni CN、Pardhasaradhi K、Martins MC、Detrick B、Hooks JJ。干扰素诱导人视网膜色素上皮细胞弓形虫复制抑制的机制。感染免疫。 1996;64:4188–4196.doi:10.1128/iai.64.104188-4196.1996。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
14Aune TM,Pogue SL。干扰素-γ抑制肿瘤细胞生长由依赖于氧张力的两种不同机制介导:诱导色氨酸降解和细胞内烟酰胺腺嘌呤二核苷酸的耗尽。临床投资杂志。 1989;84:863–875.doi:10.1172/JCI114247。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
15.Munn DH,Zhou M,Attwood JT,Bondarev I,Conway SJ,Marshall B,Brown C,Mellor AL.通过色氨酸分解代谢预防异基因胎儿排斥反应。科学。 1998;281:1191–1193.doi:10.1126/science.281.5380.1191。[内政部] [公共医学] [谷歌学者]
-
16Cady SG、Sono M.1-甲基-d、l-色氨酸、β-(3-苯并呋喃基)-d、l-丙氨酸(色氨酸的氧类似物)和β-[3-苯并(b)噻吩基]-d、1-丙氨酸(色氨酸的硫类似物)是吲哚胺2,3-双加氧酶的竞争抑制剂。生物化学与生物物理学Arch Biochem Biophys。 1991;291:326–333.doi:10.1016/0003-9861(91)90142-6。[内政部] [公共医学] [谷歌学者]
-
17Southan MD、Truscott RJ、Jamie JF、Pelosi L、Walker MJ、Maeda H、Iwamoto Y、Tone S.重组人吲哚胺2,3-双加氧酶竞争结合位点的结构要求。1996年《药物化学研究》;1996:343–352.[谷歌学者]
-
18Moriya T,Hagio K,Yoneda N.6-氯-d-色氨酸的简易合成。Bull Chem Soc日本。 1975;48:2217–2218.[谷歌学者]
-
19Munn DH,Cheung NK。白细胞介素-2增强单克隆抗体介导的细胞对人类黑色素瘤的细胞毒性。1987年癌症研究;47:6600–6605.[公共医学] [谷歌学者]
-
20Sono M,Taniguchi T,Watanabe Y,Hayaishi O。吲哚胺2,3-双加氧酶:色氨酸与铁、亚铁和共结合酶结合的平衡研究。生物化学杂志。 1980;255:1339–1345.[公共医学] [谷歌学者]
-
21Bloxam DL、Warren WH。Denckla和Dewey法测定色氨酸的误差。修订后的程序。分析生物化学。 1974;60:621–625.doi:10.1016/0003-2697(74)90275-9。[内政部] [公共医学] [谷歌学者]
-
22Yamamoto S,Hayaishi O。兔肠的色氨酸吡咯酶:d-和l-色氨酸离解酶或酶。生物化学杂志。 1967;242:5260–5266.[公共医学] [谷歌学者]
-
23Dai W,Gupta S.人干扰素-γ-诱导吲哚胺2,3-双加氧酶cDNA的分子克隆、测序和表达。生物化学与生物物理研究委员会。 1990;168:1–8.doi:10.1016/0006-291x(90)91666-g。[内政部] [公共医学] [谷歌学者]
-
24Munn DH、Bree AG、Beall AC、Kaviani MD、Sabio H、Schaub RG、Alpaugh RK、Weiner LM、Goldman SJ。非人灵长类中重组人巨噬细胞集落刺激因子:与灵长类自然杀伤细胞表型相似的CD16+单核细胞亚群的选择性扩增。鲜血。 1996;88:1215–1224.[公共医学] [谷歌学者]
-
25Koide Y,Yoshida A.γ-干扰素诱导吲哚胺2,3-双加氧酶基因表达的信号转导机制。感染免疫。 1994;62:948–955.doi:10.1128/iai.62.3948-955.1994。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
26Dai W,Gupta SL.干扰素-γ对人成纤维细胞吲哚胺2,3-双加氧酶基因表达的调节。生物化学杂志。 1990;265:19871–19877.[公共医学] [谷歌学者]
-
27Chon SY,Hassanain HH,Gupta SL.干扰素调节因子1和p91(STAT1)反应元件在干扰素-γ诱导人吲哚胺2,3-双加氧酶基因表达中的协同作用。生物化学杂志。 1996;271:17247–17252.doi:10.1074/jbc.271.29.17247。[内政部] [公共医学] [谷歌学者]
-
28Stout RD,Suttles J.CD40在细胞介导炎症反应中的多种作用。今日免疫学。 1996;17:487–492.doi:10.1016/0167-5699(96)10060-i。[内政部] [公共医学] [谷歌学者]
-
29Crabtree GR.T淋巴细胞活化中的偶然遗传调控事件。科学。 1989;243:355–361.doi:10.1126/science.2783497。[内政部] [公共医学] [谷歌学者]
-
30Medawar PB公司。脊椎动物胎生进化引起的一些免疫学和内分泌学问题。Symp-Soc实验生物。 1953;7:320–328.[谷歌学者]
-
31Kamimura S,Eguchi K,Yonezawa M,Sekiba K。人类胎盘中吲哚胺2,3-双加氧酶活性的定位和发育变化。冈山医学学报。 1991;45:135–139.doi:10.18926/AMO/32206。[内政部] [公共医学] [谷歌学者]
-
32Yoshida R、Nukiwa T、Watanabe Y、Fujiwara M、Hirata F、Hayaishi O。小鼠小肠和附睾中吲哚胺2,3-双加氧酶活性的调节。生物化学与生物物理学Arch Biochem Biophys。 1980;203:343–351.doi:10.1016/0003-9861(80)90185-x。[内政部] [公共医学] [谷歌学者]
-
33Moffett J,Espey M,Namboodiri M。喹啉酸抗体及其在大鼠免疫系统中细胞分布的测定。细胞组织研究,1994年;278:461–469.doi:10.1007/BF00331364。[内政部] [公共医学] [谷歌学者]
-
34Espey M,Tang Y,Morse H,Moffett J,Namboodiri M。喹啉酸在逆转录病毒诱导免疫缺陷小鼠艾滋病模型中的定位:神经毒性和树突状细胞免疫发病机制的意义。艾滋病。 1996;10:151–158.doi:10.1097/00002030-199602000-00004。[内政部] [公共医学] [谷歌学者]
-
35Espey M,Moffett J,Namboodiri M。脂多糖刺激小鼠免疫系统中喹啉酸免疫反应性的时空变化。白细胞生物学杂志。 1995;57:199–206.doi:10.1002/jlb.57.2.199。[内政部] [公共医学] [谷歌学者]
-
36Yoshida R、Urade Y、Nakata K、Watanabe Y、Hayashi O。细菌内毒素对小鼠肺中吲哚胺2,3-双加氧酶的特异性诱导。生物化学与生物物理学Arch Biochem Biophys。 1981;212:629–637.doi:10.1016/0003-9861(81)90406-9。[内政部] [公共医学] [谷歌学者]
-
37Malina HZ,Martin XD。吲哚胺2,3-双加氧酶:人眼中的抗氧化酶。格雷夫临床实验眼科学Arch。 1996;234:457–462.doi:10.1007/BF02539413。[内政部] [公共医学] [谷歌学者]
-
38Casciari JJ,Sotirchos SV,Sutherland RM。多细胞肿瘤球体中的葡萄糖扩散率。1988年癌症研究;48:3905–3909.[公共医学] [谷歌学者]
-
39Li CK。9L大鼠脑多细胞瘤球中的葡萄糖分布及其对细胞坏死的影响。癌症。 1982;50:2066–2073.doi:10.1002/1097-0142(19821115)50:10<2066::aid-cncr2820501017>3.0.co;2-x。[内政部] [公共医学] [谷歌学者]
-
40Fleckner J、Martensen PM、Tolstrup AB、Kjeldgaard NO、Justesen J.细胞系中各种细胞因子对人干扰素诱导色氨酸-tRNA合成酶的差异调节。细胞因子。 1995;7:70–77.doi:10.1006/cyto.1995.1009。[内政部] [公共医学] [谷歌学者]
-
41Smith CB、Deibler GE、Eng N、Schmidt K、Sokoloff L。体内局部脑蛋白质合成的测量:蛋白质降解产生的氨基酸再循环的影响。美国国家科学院院刊1988;85:9341–9345.doi:10.1073/pnas.85.23.9341。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
42Dauphinais C,Waithe W.氨基酸剥夺期间PHA对人类淋巴细胞的刺激:蛋白质、RNA和DNA合成。细胞生理学杂志。 1977;91:357–368.doi:10.1002/jcp.1040910305。[内政部] [公共医学] [谷歌学者]
-
43Woolley PV,Dion RL,Bono VH.色氨酸剥夺对培养中L1210细胞的影响。1974年癌症研究;34:1010–1014.[公共医学] [谷歌学者]
-
44Brunner M.通过氨基酸限制调节DNA合成。癌症研究1973;33:29–32.[公共医学] [谷歌学者]
-
45Tobey R,Ley K.异亮氨酸介导的各种哺乳动物细胞系基因组复制调控。1971年癌症研究;31:46–51.[公共医学] [谷歌学者]
-
46Cherwinski HM、Cohn RG、Cheung P、Webster DJ、Xu Y-Z、Caulfield JP、Young JM、Nakano G、Ransom JT。免疫抑制剂来氟米特通过抑制嘧啶生物合成来抑制淋巴细胞增殖。药理学实验与治疗杂志。 1995;275:1043–1049.[公共医学] [谷歌学者]
-
47.Terada N、Takase K、Papst P、Nairn AC、Gelfand EW。雷帕霉素抑制核糖体蛋白合成并诱导有丝分裂原激活的T淋巴细胞G1延长。免疫学杂志。 1995;155:3418–3426.[公共医学] [谷歌学者]
-
48Laliberte J,Yee A,Xiong Y,Mitchell BS。鸟嘌呤核苷酸耗竭对人类T淋巴细胞细胞周期进展的影响。鲜血。 1998;91:2896–2904.[公共医学] [谷歌学者]
-
49DeSilva DR、Urdahl KB、Jenkins MK。在没有增殖的情况下,T细胞受体的占据在体外诱导克隆无能。免疫学杂志。 1991;147:3261–3267.[公共医学] [谷歌学者]
-
50Bird JJ、Brown DR、Mullen AC、Moskowitz NH、Mahowald MA、Sider JR、Gajewski TF、Wang CR、Reiner SL。Helper T细胞分化受细胞周期控制。免疫。 1998;9:229–237.doi:10.1016/s1074-7613(00)80605-6。[内政部] [公共医学] [谷歌学者]
-
51Ohen S,Brduscha-Riem K。将原始CTL分化为效应器和记忆CTL:效应器功能与表型和细胞分裂的相关性。免疫学杂志。 1998;161:5338–5346.[公共医学] [谷歌学者]
-
52Babitzke P.色氨酸生物合成的调节:试验TRAP或枯草芽孢杆菌如何重新发明轮子。摩尔微生物。 1997;26:1–9.doi:10.1046/j.1365-2958.1997.5541915.x。[内政部] [公共医学] [谷歌学者]
-
53诺克斯WE,梅勒AH。肝脏色氨酸过氧化物酶氧化酶系统的适应性增加。科学。 1951;113:237–238.doi:10.1126/science.113.2931.237。[内政部] [公共医学] [谷歌学者]
-
54Schwartz RH。T细胞无能模型:是否存在共同的分子机制? .《实验医学杂志》,1996年;184:1–8.doi:10.1084/jem.184.1.1。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
















