图1。甲基乙二醛(MGO)对胰岛素信号介质的miR-214和miR-126靶磷酸酶的影响。用500μmol/L MGO处理小鼠主动脉内皮细胞(MAECs)16 h。用抗PTEN蛋白印迹分析从这些细胞中获得的蛋白裂解物(一)抗PTP1B(b条)抗PHLPP1(c(c))和抗PHLPP2抗体(天). 使用α-微管蛋白抗体进行蛋白质归一化。面板上的污点暴露时间为1分钟(一,c(c),天)面板上有污渍时为2分钟(b条). 蛋白质水平通过至少三个独立实验的密度分析进行量化。图中的条形代表控制(−MGO)百分比(%)的平均值±SD。使用学生的吨-测试***第页≤ 0.001.
图1。甲基乙二醛(MGO)对胰岛素信号介质的miR-214和miR-126靶磷酸酶的影响。用500μmol/L MGO处理小鼠主动脉内皮细胞(MAECs)16 h。用抗PTEN蛋白印迹分析从这些细胞中获得的蛋白裂解物(一)抗PTP1B(b条)抗PHLPP1(c(c))和抗PHLPP2抗体(天). 使用α-微管蛋白抗体进行蛋白质归一化。面板上的污点暴露时间为1分钟(一,c(c),天)面板上有污渍时为2分钟(b条). 蛋白质水平通过至少三个独立实验的密度分析进行量化。图中的条形代表控制(−MGO)百分比(%)的平均值±SD。使用学生的吨-测试***第页≤ 0.001.
图2。miR-214和miR-126调节对MAEC中PHLPP2蛋白水平的影响。用不同浓度(0.5、5和50 nmol/L)的miR-214转染MAEC(一)和miR-126(b条)抑制剂(miR-214-In和miR-126-In),或miR-214和miR-26模拟物(miR-244 M和miR-26M)(c(c)). 用非靶向反义抑制剂(Ctr-In(一,b条))和非靶向对照寡核苷酸(Ctr M(c(c)))作为阴性对照。转染后48小时,收集细胞,用抗PHLPP2和抗α-微管蛋白抗体进行蛋白质印迹分析。面板中斑点的暴露时间为4分钟(一)面板上有污渍时为2分钟(b条)面板上有污渍时为20分钟(c(c)). 蛋白质水平通过至少三个独立实验的密度分析进行量化。图中的横线表示对照组(Ctr-in或Ctr-M)0.5 nmol/L的百分比(%)的平均值±SD。使用Student’s吨-测试**第页≤ 0.01; ***第页≤ 0.001.
图2。miR-214和miR-126调节对MAEC中PHLPP2蛋白水平的影响。用不同浓度(0.5、5和50 nmol/L)的miR-214转染MAEC(一)和miR-126(b条)抑制剂(miR-214-In和miR-126-In),或miR-214和miR-26模拟物(miR-244 M和miR-26M)(c(c)). 用非靶向反义抑制剂(Ctr-In(一,b条))和非靶向对照寡核苷酸(Ctr M(c(c)))作为阴性对照。转染后48小时,收集细胞,用抗PHLPP2和抗α-微管蛋白抗体进行蛋白质印迹分析。面板上的斑点暴露时间为4分钟(一)面板上有污渍时为2分钟(b条)面板上有污渍时为20分钟(c(c)). 蛋白质水平通过至少三个独立实验的密度分析进行量化。图中的横线表示对照组(Ctr-in或Ctr-M)0.5 nmol/L的百分比(%)的平均值±SD。使用Student’s吨-测试**第页≤ 0.01; ***第页≤ 0.001.
图3。miR-214模拟物和miR-214inhibitor对伴有或不伴有MGO的MAEC中PHLPP2水平的影响。用非靶向反义抑制剂(Ctr-In 0.5 nmol/L(一))和非靶向对照寡核苷酸(Ctr M 50 nmol/L(b条))(白色和黑色条),含有miR-214抑制剂(miR-214-In 0.5 nmol/L(一))或miR-214模拟物(miR-214M 50 nmol/L(b条))(灰色条)。如有指示,用500μmol/L MGO处理MAEC 16 h。转染48 h后从这些细胞获得的蛋白裂解物用抗PHLPP2和抗α-微管蛋白抗体进行Western blot分析。PHLPP2印迹和α-微管蛋白印迹的暴露时间分别为2分钟和10分钟。蛋白质水平通过至少三个独立实验的密度分析进行量化。图中的条形图表示控制(Ctr M和Ctr in)百分比(%)的平均值±SD。使用学生的吨-测试**第页≤0.01***第页≤ 0.001.
图3。miR-214模拟物和miR-214inhibitor对伴有或不伴有MGO的MAEC中PHLPP2水平的影响。用非靶向反义抑制剂(Ctr-In 0.5 nmol/L(一))和非靶向对照寡核苷酸(Ctr M 50 nmol/L(b条))(白色和黑色条),带有miR-214抑制剂(miR-214In 0.5 nmol/L(一))或miR-214模拟物(miR-214M 50 nmol/L(b条))(灰色条)。如有指示,用500μmol/L MGO处理MAEC 16 h。转染48 h后从这些细胞获得的蛋白裂解物用抗PHLPP2和抗α-微管蛋白抗体进行Western blot分析。PHLPP2印迹和α-微管蛋白印迹的暴露时间分别为2分钟和10分钟。蛋白质水平通过至少三个独立实验的密度分析进行量化。图中的条形图表示控制(Ctr M和Ctr in)百分比(%)的平均值±SD。使用学生的吨-测试**第页≤ 0.01; ***第页≤ 0.001.
图4。miR-214对PHLPP2调节的影响。(一)用非靶向对照寡核苷酸(Ctr M;白色条)或miR-214模拟物(miR-214M 50 nmol/L;黑色条)转染MAEC。如有指示,MAEC与miScript miR-214靶向保护剂(miR-214TP 0.1 nmol/L)共转染。用抗PHLPP2和抗α-微管蛋白抗体对48小时转染的MAEC获得的蛋白裂解物进行Western blot分析。印迹的暴露时间为2分钟。蛋白质水平通过至少三个独立实验的密度分析进行量化。图中的条形代表控制(Ctr M)百分比(%)的平均值±SD。(b条)在pEZX-MT06对照报告载体或pEZX-MT06/PHLPP2-3′UTR报告载体存在的情况下,用非靶向对照寡核苷酸(Ctr M 50 nmol/L;白色条)或miR-214模拟物(miR-214M 50 nmol/L;黑色条)转染MAEC 24小时。在每种实验条件下,在细胞裂解物中测定萤火虫和雷尼拉萤光素酶的活性。结果被归一化为Renilla活动。图中的条表示折叠控制(Ctr M)的平均值±SD。使用Student’s吨-测试***第页≤ 0.001.
图4。miR-214对PHLPP2调节的影响。(一)用非靶向对照寡核苷酸(Ctr M;白色条)或miR-214模拟物(miR-214M 50 nmol/L;黑色条)转染MAEC。如有指示,MAEC与miScript miR-214靶向保护剂(miR-214TP 0.1 nmol/L)共转染。用抗PHLPP2和抗α-微管蛋白抗体对48小时转染的MAEC获得的蛋白裂解物进行Western blot分析。印迹的暴露时间为2分钟。蛋白质水平通过至少三个独立实验的密度分析进行量化。图中的条形代表控制(Ctr M)百分比(%)的平均值±SD。(b条)在pEZX-MT06对照报告载体或pEZX-MT06/PHLPP2-3′UTR报告载体存在的情况下,用非靶向对照寡核苷酸(Ctr M 50 nmol/L;白色条)或miR-214模拟物(miR-214M 50 nmol/L;黑色条)转染MAEC 24小时。在每种实验条件下,在细胞裂解物中测定萤火虫和雷尼拉萤光素酶的活性。结果被归一化为Renilla活动。图中的条表示折叠控制(Ctr M)的平均值±SD。使用Student’s吨-测试***第页≤ 0.001.
图5。miR-214调制对MAEC中胰岛素依赖性Akt激活的影响。用非靶向反义抑制剂(Ctr-In 0.5 nmol/L(一))或非靶向对照寡核苷酸(Ctr M 50 nmol/L(b条))(白色和黑色条),带有miR-214抑制剂(一)或miR-214模拟(b条)(miR-214 In 0.5 nmol/L或miR-214M 50 nmol/L.;灰色条)。如有指示,MAEC在收获前用500μmol/L MGO(黑条)处理16小时。转染48小时后,用100 nmol/L胰岛素刺激或不刺激细胞10分钟。蛋白裂解产物用p-ser473-Akt和Akt抗体进行Western blot分析。曝光时间为30秒。蛋白质水平通过至少三个独立实验的密度分析进行量化。p-ser473-Akt水平归一化为Akt总水平。图中的条形图表示控制(Ctr-in和Ctr-M)百分比(%)的平均值±SD。使用学生的吨-测试*第页≤ 0.05; **第页≤ 0.01; ***第页≤ 0.001.
图5。miR-214调节对MAEC中胰岛素依赖性Akt激活的影响。用非靶向反义抑制剂(Ctr-In 0.5 nmol/L(一))或非靶向对照寡核苷酸(Ctr M 50 nmol/L(b条))(白色和黑色条),带有miR-214抑制剂(一)或miR-214模拟物(b条)(miR-214 In 0.5 nmol/L或miR-214M 50 nmol/L.;灰色条)。如有指示,MAEC在收获前用500μmol/L MGO(黑条)处理16小时。转染48小时后,用100 nmol/L胰岛素刺激或不刺激细胞10分钟。蛋白裂解产物用p-ser473-Akt和Akt抗体进行Western blot分析。曝光时间为30秒。蛋白质水平通过至少三个独立实验的密度分析进行量化。p-ser473-Akt水平归一化为Akt总水平。图中的条形图表示控制(Ctr-in和Ctr-M)百分比(%)的平均值±SD。使用学生的吨-测试*第页≤ 0.05; **第页≤ 0.01; ***第页≤ 0.001.
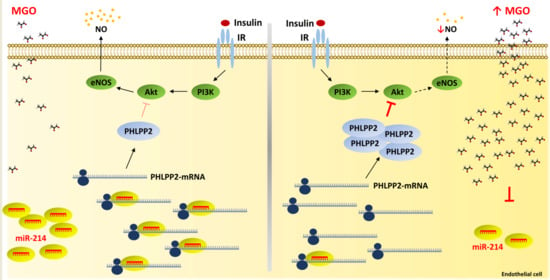
图6。MGO对小鼠主动脉组织中miR-214水平的影响。采用实时PCR方法评估从Glo1KD分离的主动脉中miR-214的水平(n个=5)和重量(n个=8)小鼠。图中的横线表示表达单位相对于U6 snRNA水平的平均值±SD,用作管家小RNA。使用Student’s吨-测试***第页≤ 0.001.