MicroRNA-331-3p靶向NRP2抑制宫颈癌细胞增殖和E6/E7表达
摘要
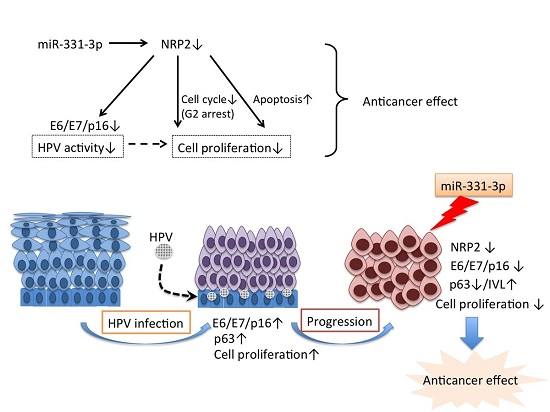
1.简介
2.结果
2.1. miR-331-3p过度表达抑制宫颈癌细胞增殖
2.2。 miR-331-3p显著降低HPV相关蛋白E6和E7的表达
2.3. NRP2在SKG-II细胞中的表达直接介导miR-331-3p抑制细胞增殖
2.4. miR-331-3p抑制NRP2诱导G2/M期细胞周期阻滞
3.讨论
4.材料和方法
4.1、。 单元格行
4.2. 宫颈细胞系中的miRNA前体和siRNA转染
4.3. miRNA和mRNA的qRT-PCR分析
4.4. 细胞增殖试验
4.5. 荧光素酶报告分析
4.6. 细胞活性和细胞周期分析
4.7. Western Blot和免疫细胞化学分析
4.8. TdT介导的dUTP Nick End标记(TUNEL)分析
4.9. 统计分析
5.结论
补充资料
致谢
作者贡献
利益冲突
工具书类
穆尼奥斯,N。; 卡斯特尔萨圭,X。; de González,A.B。; Gissmann,L.第1章:人类癌症病因学中的HPV。 疫苗 2006 , 24 , 1–10. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 豪森,H.Papillomavirus causing cancer:在致癌的早期事件中逃避宿主-细胞控制。 J.国家。 癌症研究所。 2000 , 92 , 690–698. [ 谷歌学者 ][ 交叉参考 ] Ganguly,N.人乳头瘤病毒-16 E5蛋白:致癌作用和治疗价值。 单元格。 昂科尔。 2012 , 35 , 67–76. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Liao,S。; 邓,D。; 张伟。; 胡,X。; Wang,W。; Wang,H。; 卢,Y。; 王,S。; 孟,L。; Ma,D.人乳头瘤病毒16/18 E5在体外促进宫颈癌细胞增殖、迁移和侵袭,并在体内加速肿瘤生长。 昂科尔。 代表。 2013 , 29 , 95–102. [ 谷歌学者 ] [ 公共医学 ] Narisawa-Saito,M。; Kiyono,T.高危人乳头瘤病毒诱导致癌的基本机制:E6和E7蛋白的作用。 癌症科学。 2007 , 98 ,1505年至1511年。 [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Longworth,M.S。; Laimins,L.A.人乳头瘤病毒在分化上皮中的发病机制。 微生物。 分子生物学。 版次。 2004 , 68 , 362–372. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Jung,H.S。; 拉贾塞卡兰,N。; Song,S.Y。; Kim,Y.D。; 洪,S。; Choi,H.J。; Kim,Y.S。; Choi,J.S。; Choi,Y.L.公司。; Shin,Y.K.人乳头瘤病毒E6/E7特异性siRNA在体内外增强了宫颈癌放射治疗的效果。 国际分子科学杂志。 2015 , 16 , 12243–12260. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 刘易斯,B.P。; 施,I。; Jones-Rhoades,M.W。; 巴特尔,D.P。; Burge,C.B.对哺乳动物microRNA靶点的预测。 单元格 2003 , 115 , 787–798. [ 谷歌学者 ][ 交叉参考 ] Bartel,D.P.MicroRNAs:基因组学、生物发生、机制和功能。 单元格 2004 , 116 , 281–297. [ 谷歌学者 ][ 交叉参考 ] 加森,R。; 法布里,M。; Cimmino,A。; Calin,G.A。; Croce,C.M.MicroRNA在癌症中的表达和功能。 摩尔医学趋势。 2006 , 12 , 580–587. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Fujii,T。; 岛田,K。; Tatsumi,Y。; 藤本,K。; Konishi,N.Syndecan-1反应性microRNA-126和149调节前列腺癌细胞增殖。 生物化学。 生物物理学。 Res.Commun公司。 2015 , 456 , 183–189. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Fujii,T。; 岛田,K。; Tatsumi,Y。; Hatakeyama,K。; Obayashi,C。; 藤本,K。; Konishi,N.MicroRNA-145通过下调syndecan-1促进人类尿路上皮癌的分化。 BMC癌症 2015 , 15 , 818. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Fujii,T。; 岛田,K。; Tatsumi,Y。; 田中,N。; 藤本,K。; Konishi,N.Syndecan-1上调microRNA-331–3p并介导前列腺癌中的上皮-间充质转化。 摩尔致癌物。 2016 , 55 , 1378–1386. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Fkih Mhamed,I。; Privat,M。; 波内尔,F。; Penault-Llorca,F。; Kenani,A。; Bignon,Y.J.将miR-10b、miR-26a、miR-146a和miR-153鉴定为潜在的三阴性乳腺癌生物标记物。 单元格。 昂科尔。 2015 , 38 , 433–442. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Yu,C。; 王,M。; 李,Z。; 肖,J。; 彭,F。; 郭,X。; 邓,Y。; 姜杰。; Sun,C.MicroRNA-138-5p通过靶向FOXC1调节胰腺癌细胞生长。 单元格。 昂科尔。 2015 , 38 , 173–181. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 里克尔梅,I。; 俄勒冈州塔皮亚。; 利尔,P。; 桑多瓦尔,A。; 瓦尔加,M.G。; Letelier,P。; Buchegger,K。; 比扎马,C。; 埃斯皮诺扎,J.A。; Peek,R.M。; 等。miR-101-2、miR-125b-2和miR-451a通过调节PI3K/AKT/mTOR通路在胃癌中发挥潜在的抑癌作用。 单元格。 昂科尔。 2016 , 39 , 23–33. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 曾,K。; 郑伟。; 莫,X。; 刘,F。; Li,M。; 刘,Z。; 张伟。; Hu,X.失调的microRNA参与宫颈肿瘤的进展。 架构(architecture)。 妇科。 障碍物。 2015 , 292 , 905–913. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 刘杰。; Sun,H。; 王,X。; 于清。; 李,S。; Yu,X。; Gong,W.在宫颈癌患者的颈阴道灌洗标本中,外体microRNA-21和microRNA146a水平增加。 国际分子科学杂志。 2014 , 15 , 758–773. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 张杰。; 李,S。; 严奇。; 陈,X。; Yang,Y。; 刘,X。; Wan,X.干扰素β诱导的microRNA-129-5p通过靶向宫颈癌细胞中的SP1下调HPV-18 E6和E7病毒基因表达。 公共科学图书馆 2013 , 8 ,e81366。 [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Dong,J。; 隋,L。; 王,Q。; 陈,M。; Sun,H.MicroRNA-26a通过靶向蛋白酪氨酸磷酸酶IVA 1型抑制宫颈癌细胞的增殖和侵袭。 摩尔医学代表。 2014 , 10 ,1426年-1432年。 [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 李,X。; Chu,H。; 吕,T。; Wang,L。; 孔,S。; Dai,S.MiR-342–3p通过靶向人类宫颈癌中的FOXM1抑制增殖、迁移和侵袭。 FEBS信函。 2014 , 588 , 3298–3307. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] X·梁。; 刘,Y。; 曾磊。; Yu,C。; 胡,Z。; 周,Q。; Yang,Z.MiR-101通过靶向Fos抑制宫颈癌细胞的G1-S期转变。 国际妇科杂志。 癌症 2014 , 24 , 1165–1172. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Hou,T。; 欧,J。; X.赵。; 黄,X。; 黄,Y。; Zhang,Y.MicroRNA-196a通过调节FOXO1和p27Kip1促进宫颈癌增殖。 英国癌症杂志 2014 , 110 , 1260–1268. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Yang,L。; Wang,Y.L。; 刘,S。; 张,P.P。; 陈,Z。; 刘,M。; Tang,H.MiR-181b通过抑制宫颈癌细胞中腺苷酸环化酶9(AC9)的表达,促进细胞增殖并减少凋亡。 FEBS信函。 2014 , 588 , 124–130. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 埃皮斯,M.R。; 吉尔斯,K.M。; 坎迪,P.A。; R.J.韦伯斯特。; Leedman,P.J.MiR-331–3p调节胶质母细胞瘤中神经纤维蛋白-2的表达。 神经瘤杂志。 2014 , 116 , 67–75. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 埃皮斯,M.R。; 吉尔斯,K.M。; Kalinowski,F.C。; 巴克,A。; 科恩,R.J。; Leedman,P.J.前列腺癌细胞中miR-331–3p和miR-642–5p催化eIF5A活化的酶脱氧胆碱酯酶(DOHH)表达的调节。 生物学杂志。 化学。 2012 , 287 , 35251–35259. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 刘,X.H。; 孙,M。; 聂,F.Q。; Ge,Y.B。; 张,E.B。; Yin,D.D。; R.孔。; 夏,R。; 卢,K.H。; Li,J.H。; 等。Lnc RNA HOTAIR作为一种竞争性内源性RNA,通过海绵miR-331–3p在胃癌中调节HER2的表达。 摩尔癌症 2014 , 13 , 92. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 麦肯纳,D.J。; McDade,S.S.公司。; 帕特尔,D。; McCance,D.J.MicroRNA 203在角质形成细胞中的表达依赖于E6对p53水平的调节。 J.维罗尔。 2010 , 84 ,10644–10652。 [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] O.霍顿。; McClaugh,W.G.女性生殖道中p63的表达和诊断效用。 高级Anat。 病态。 2009 , 16 , 316–321. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Martens,J.E。; 阿伦兹,J。; 范德林登,P.J。; de Boer,文学学士。; Helmerhorst,T.J.细胞角蛋白17和p63是HPV靶细胞,即宫颈干细胞的标记物。 抗癌研究。 2004 , 24 , 771–775. [ 谷歌学者 ] [ 公共医学 ] 塞尔维,K。; 巴德,文学学士。; D.爸爸。; Ganesh,R.N.。p16、CK17、p63和人乳头瘤病毒在宫颈上皮内瘤变诊断中的作用及其与模拟物的区别。 国际外科病理学杂志。 2014 , 22 , 221–230. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Gyöngyösi,E。; Szalmás,A。; Ferenczi,A。; 科尼亚,J。; Gergely,L。; Veress,G.人乳头瘤病毒(HPV)16型癌蛋白对人角质形成细胞中总苞素表达的影响。 维罗尔。 J。 2012 , 9 , 36. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 基廷,J.T。; Cviko,A。; 里斯多夫,S。; 里斯多夫。; 奎德,B.J。; Sun,D。; Duensing,S。; 板材,E.E。; 芒格,K。; Crum、C.P.Ki-67、cyclin E和p16INK4是人类乳头状瘤病毒相关宫颈肿瘤的补充替代生物标记物。 美国外科病理学杂志。 2001 , 25 , 884–891. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] McLaughlin-Drubin,医学博士。; 帕克·D。; Munger,K.肿瘤抑制因子p16INK4A对宫颈癌细胞系的生存是必需的。 程序。 国家。 阿卡德。 科学。 美国 2013 , 110 , 16175–16180. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 王S.S。; 树干,M。; 希夫曼,M。; Herrero,R。; 谢尔曼,M.E。; R.D.伯克。; Hildesheim,A。; M.C.布拉蒂。; 赖特,T。; 公元前罗德里格斯。; 等。哥斯达黎加人群队列宫颈活检中p16INK4a作为致癌人乳头瘤病毒感染标记物的验证。 癌症流行病学生物标记。 2004 , 13 , 1355–1360. [ 谷歌学者 ] 萨诺,T。; Oyama,T。; Kashiwabara,K。; 福田,T。; Nakajima,T.宫颈癌和宫颈上皮内瘤变中p16蛋白的免疫组织化学过度表达与完整的视网膜母细胞瘤蛋白表达相关。 病态。 国际。 1998 , 48 , 580–585. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Andersson,S。; Hansson,B。; 诺曼,I。; 加贝里,V。; 薄荷,M。; Hjerpe,A。; 卡尔森,F。; Johansson,B.O.“高危”人乳头瘤病毒E6/E7 mRNA的表达与CIN分级、病毒载量和p16INK4a的关系。 国际期刊Oncol。 2006 , 29 , 705–711. [ 谷歌学者 ][ 交叉参考 ] 萨奇,A。; 帕夏,T.L。; McGrath,C.M。; Yu,G.H。; 张,P。; Gupta,P.液体标本中p16INK4A的过度表达(SurePath)作为宫颈发育不良和肿瘤的标志物。 诊断。 细胞病理学。 2002 , 27 , 365–370. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Gustinucci,D。; 罗西,P.G。; Cesarini,E。; 布罗科里尼,M。; Bulletti,S。; Carlani,A。; D′angelo,V。; D′amico,M.R。; di Dato,E。; Galeazzi,P。; 等。使用细胞学、E6/E7 mRNA和p16INK4a-Ki-67确定宫颈癌筛查中人类乳头瘤病毒(HPV)阳性女性的管理。 美国临床医学杂志。 病态。 2016 , 145 , 35–45. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 库奇埃里,K。; Wentzensen,N.人乳头瘤病毒mRNA和p16检测作为改善宫颈肿瘤诊断的生物标记物。 癌症流行。 生物标记前。 2008 , 17 , 2536–2545. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Klaes,R。; 弗里德里希,T。; 斯皮特科夫斯基,D。; Ridder,R。; 鲁迪,W。; 彼得里,美国。; Dallenbach-Hellweg,G。; 施密特,D。; von Knebel Doeberitz,M.过度表达p16(INK4A)作为子宫颈发育不良和肿瘤上皮细胞的特异性标记物。 国际癌症杂志 2001 , 92 , 276–284. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 赵,D。; 隋,Y。; Zheng,X.miR-331–3p通过PI3K/Akt和ERK1/2通路靶向HER2,抑制结直肠癌细胞增殖并促进细胞凋亡。 昂科尔。 代表。 2016 , 35 , 1075–1082. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 郭,X。; 郭,L。; 季军(Ji,J.)。; 张杰。; 张杰。; 陈,X。; 蔡,Q。; 李,J。; 顾奇。; 刘,B。; 等。miRNA-331–3p直接靶向E2F1并诱导人胃癌生长停滞。 生物化学。 生物物理学。 Res.Commun公司。 2010 , 398 , 1–6. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 白色,N.M。; 优素福,Y.M。; Fendler,A。; 斯蒂芬,C。; Jung,K。; Yousef,G.M.《miRNA-激肽释放酶相互作用轴:前列腺癌发病机制的新维度》。 生物化学。 2012 , 393 , 379–389. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] R.M.Chang。; Yang,H。; 方,F。; Xu,J.F。; Yang,L.Y.MicroRNA-331-3p通过靶向pH结构域和富含亮氨酸的重复蛋白磷酸酶,促进肝细胞癌的增殖和转移。 肝病学 2014 , 60 , 1251–1263. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Nasarre,P。; Gemmill,R.M。; Potiron,V.A。; 罗氏,J。; Lu,X。; 巴隆,A.E。; 科赫,C。; Garrett-Mayer,E。; 拉加纳,A。; Howe,P.H。; 等。在TGF-β1诱导的上皮-间充质转化过程中,肺癌细胞中的Neuropilin-2上调。 癌症研究。 2013 , 73 , 7111–7121. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Staton,C.A.公司。; 科伊,I。; Wu,J.M。; Hoh,L。; 里德,M.W.R。; Brown,N.J.Neuropilin-1和Neuropolin-2在结直肠癌腺瘤-癌序列中的表达。 组织病理学 2013 , 62 , 908–915. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Fukahi,K。; Fukasawa,M。; Neufeld,G。; Itakura,J。; Korc,M.人胰腺癌细胞中神经纤维蛋白-1和-2的异常表达。 临床。 癌症研究。 2004 , 10 , 581–590. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Shi,S。; 卢,Y。; 秦,Y。; 李伟(Li,W.)。; Cheng,H。; Xu,Y。; 徐,J。; Long,J。; 刘,L。; 刘,C。; 等。miR-1247与胰腺癌的预后相关,并通过靶向神经胶质抑制细胞增殖。 货币。 分子医学。 2014 , 14 ,316–327。 [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] Futamura,M。; 卡米诺,H。; 宫本茂,Y。; 北村。; Y.中村。; Ohnishi,S。; Y.Masuda。; Arakawa,H.信号蛋白3F(3p2l1.3的候选抑癌基因)在p53调节的肿瘤血管生成抑制中的可能作用。 癌症研究。 2007 , 67 , 1451–1460. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ] 岛田,K。; Nakamura,M。; de Velasco,文学硕士。; 田中,M。; Ouji,Y。; Konishi,N.Syndecan-1,一种参与雄激素依赖性前列腺癌进展的新靶分子。 癌症科学。 2009 , 100 , 1248–1254. [ 谷歌学者 ][ 交叉参考 ][ 公共医学 ]