锌在感染和炎症中的作用
摘要
1.简介
2.锌与营养
3.锌平衡
3.1. 锌运输车
3.2、。 金属硫蛋白和其他锌结合蛋白
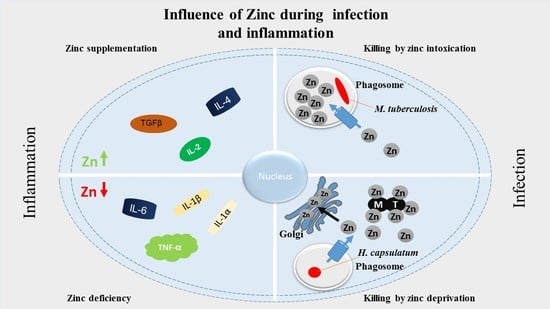
4.锌与免疫
5.炎症中的锌
5.1. NF-κB和其他信号通路
5.2. 氧化应激
5.3. 锌状态与炎症细胞因子
6.感染中的锌
6.1. 营养免疫
6.2. 锌是膜屏障的关键成分
6.3. 肽聚糖调节蛋白质(PGLYRP)
7.结论
致谢
作者贡献
利益冲突
工具书类
普拉萨德,A.S。; Miale,A.,Jr。; 法里德,Z。; Sandstead,H.H。; Schulert,A.R.缺铁性贫血、肝脾肿大、侏儒症和性腺机能减退综合征患者的锌代谢。 临床实验室J。 医学。 1963 , 61 , 537–549. [ 谷歌学者 ] [ 公共医学 ] 林克,L。; Gabriel,P.Zinch和免疫系统。 程序。 螺母。 Soc公司。 2000 , 59 , 541–552. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 瓦利,B.L。; Falchuk,K.H.锌生理学的生化基础。 生理学。 版次。 1993 , 73 ,79–118。 [ 谷歌学者 ] [ 公共医学 ] 马雷特,W。; Li,Y.蛋白质中锌的配位动力学。 化学。 版次。 2009 , 109 , 4682–4707. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Haase,H。; Rink,L.锌对免疫功能的多重影响。 金属。 集成。 生物识别。 科学。 2014 , 6 , 1175–1180. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Maret,W.锌与人类疾病。 在 必需金属离子与人类疾病的相互关系 ; 西格尔A.、西格尔H.、西格尔R.K.编辑。; 施普林格出版社:荷兰多德雷赫特出版社,2013年; 第389–414页。 [ 谷歌学者 ] Mills,C.F.(编辑)《人体生物学中的锌》。 在 锌的生理学:概述 ; 施普林格:英国伦敦,1989年。 [ 谷歌学者 ] [ 交叉参考 ] Favier,A。; Favier,M.,妊娠期缺锌对母亲和新生儿的影响。 女祭司(Rev.Fr.Gynecol)。 障碍物。 1990 , 85 ,13-27。 [ 谷歌学者 ] [ 公共医学 ] Otten,J.J。; Pitzi Hellwig,J。; Meyers,L.D.(编辑) 膳食参考摄入量:营养需求基本指南 ; 国家学院出版社:华盛顿特区,美国,2006年; 在线可用: https://doi.org/10.17226/11537 (2017年7月7日访问)。 德国Gesellschaft für Ernährung。 厄尔·厄纳赫隆(Ernährung) ; 施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施·施韦泽里施; Schweizerische Vereinigung für Ernährung; Referencewerte für die Nährstoffzufuhr:德国波恩,2016年。 (德语)[ 谷歌学者 ] 世界卫生组织(WHO)。 人体营养与健康中的微量元素 ; 世界卫生组织:瑞士日内瓦,1996年。 [ 谷歌学者 ] 欧洲食品安全局饮食产品营养和过敏问题小组。 锌膳食参考值的科学意见。 欧洲食品安全局J。 2014 , 12 . [ 谷歌学者 ] [ 交叉参考 ] King,J.C。; 布朗,K.H。; 吉布森,R.S。; Krebs,N.F。; 新墨西哥州洛韦。; 希克曼,J.H。; Raiten,D.J.营养促进发展生物标记物(BOND)-锌评论。 《营养学杂志》。 2016 , 146 ,858S–885S。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Brieger,A。; Rink,L.Zink和Immunfunktionen。 埃尔纳·赫伦·梅迪赞 2010 , 25 , 156–160. [ 谷歌学者 ] [ 交叉参考 ] Sandstead,H.H.缺锌。 美国疾病杂志。 儿童。 1991 , 145 , 853–859. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 世界卫生组织。 世界卫生报告 ; 世界卫生组织:瑞士日内瓦,2002年。 [ 谷歌学者 ] Wellenreuther,G。; Cianci,M。; 图库鲁,R。; 梅耶·克劳克,W。; Haase,H。储存在囊泡中的锌的配体环境。 生物化学。 生物物理学。 Res.Commun公司。 2009 , 380 , 198–203. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Kambe,T。; 桥本,A。; Fujimoto,S.目前对ZIP和ZnT锌转运蛋白在人类健康和疾病中的认识。 单元格。 分子生命科学。 2014 , 71 ,3281–3295。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Haase,H。; Rink,L.免疫细胞中锌相关信号通路的功能意义。 每年。 修订版螺母。 2009 , 29 , 133–152. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 木村,T。; Kambe,T.《金属硫蛋白、ZIP和ZnT转运蛋白的功能:综述和展望》。 国际分子科学杂志。 2016 , 17 . [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Prasad,A.S.人类缺锌的发现:其对人类健康和疾病的影响。 高级螺母。 2013 , 4 ,176–190。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Jeong,J。; Eide,D.J.锌转运蛋白SLC39家族。 分子天冬氨酸。 医学。 2013 , 34 , 612–619. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 黄,L。; Tepaamondech,S.锌转运蛋白SLC30家族——对其生物学和病理生理作用的当前认识的综述。 分子天冬氨酸。 医学。 2013 , 34 , 548–560. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Lang,C。; Murgia,C。; Leong,M。; Tan,L.-W。; 佩罗齐,G。; 奈特·D·。; Ruffin,R。; Zalewski,P.过敏性炎症小鼠模型中锌的抗炎作用和锌转运蛋白mRNA的改变。 美国生理学杂志。 肺细胞。 摩尔生理学。 2007 , 292 ,L577–L584。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Subramanian Vignesh,K。; Landero Figueroa,J.A。; Porollo,A。; Caruso,J.A。; Deepe,G.S.,Jr.粒细胞-巨噬细胞集落刺激因子诱导的锌螯合增强巨噬细胞超氧化物并限制细胞内病原体存活。 免疫 2013 , 39 ,697–710。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Maret,W.锌金属硫蛋白的功能:细胞锌与氧化还原状态之间的联系。 《营养学杂志》。 2000 , 130 ,1455S–1458S。 [ 谷歌学者 ] [ 公共医学 ] King,J.C.锌:一种基本但难以捉摸的营养素。 美国临床医学杂志。 螺母。 2011 , 94 , 679–684. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Lu,J。; A.J.斯图尔特。; 萨德勒,P.J。; T.J.皮涅罗。; Blindauer,C.A.白蛋白作为锌载体:其高亲和力锌结合位点的特性。 生物化学。 社会事务处理。 2008 , 36 , 1317–1321. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 海兹曼,C.W。; Cox,J.A.关于S100蛋白的新观点:一个多功能钙(2+)、锌(2+)和铜(2+)结合蛋白家族。 生物金属 1998 , 11 , 383–397. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Gilston,文学学士。; 斯卡尔,E.P。; Chazin,W.J.过渡金属与S100蛋白质的结合。 科学。 中国生命科学。 2016 , 59 ,792–801。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Mocchegiani,E。; 科斯塔雷利。; 贾科尼(Giacconi,R.)。; Cipriano,C。; Muti,E。; Malavolta,M.锌结合蛋白(金属硫蛋白和α-2巨球蛋白)和免疫衰老。 老年病学扩展。 2006 , 41 , 1094–1107. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Nuttall,J.R。; Oteiza,P.I.锌与大脑老化。 基因营养。 2014 , 9 . [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 德库西,T.E。; 摩根·D·。; Cherny,V.V.NADPH氧化酶的电压依赖性揭示了吞噬细胞需要质子通道的原因。 自然 2003 , 422 , 531–534. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 长谷川,H。; 铃木,K。; Nakaji,S。; Sugawara,K.锌对人类中性粒细胞活性氧生成能力和体外血清调理活性的影响。 发光 2000 , 15 ,321–327。 [ 谷歌学者 ] [ 交叉参考 ] 布林克曼,V。; 美国莱查德。; 古斯曼,C。; Fauler,B。; 尤勒曼,Y。; 维斯,D.S。; Y.Weinrauch。; Zychlinsky,A.中性粒细胞外陷阱杀死细菌。 科学 2004 , 303 , 1532–1535. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Haase,H。; Rink,L.锌信号和免疫功能。 生物因素 2014 , 40 , 27–40. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 盖特克,L.M。; R.C.弗雷德里希。; 奥兹,H.S。; McClain,C.J.食物摄入减少而非缺锌与缺锌大鼠血浆瘦素、代谢率和活动水平的变化有关。 《营养学杂志》。 生物化学。 2002 , 13 , 237–244. [ 谷歌学者 ] [ 交叉参考 ] 内森,C。; 丁,A.非消炎。 单元格 2010 , 140 , 871–882. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Jarosz,M。; 奥尔伯特,M。; Wyszogrodzka,G。; Młyniec,K。; 利伯夫斯基,T.锌的抗氧化和抗炎作用。 锌依赖性NF-κB信号传导。 炎症药理学 2017 , 25 , 11–24. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Perkins,N.D.将细胞吞噬途径与NF-κB和IKK功能整合。 自然修订版分子细胞生物学。 2007 , 8 , 49–62. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 福斯特,M。; Samman,S.锌与炎症细胞因子的调节:对心脏代谢疾病的影响。 营养物 2012 , 4 , 676–694. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Haase,H。; Ober-Blöbaum,J.L。; Engelhardt,G。; 赫贝尔,S。; 海特,A。; Heine,H。; Rink,L.锌信号对单核细胞中的脂多糖诱导信号转导至关重要。 免疫学杂志。 2008 , 181 , 6491–6502. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 普拉萨德,A.S。; Bao,B。; 贝克,F.W。; Sarkar,F.H.锌通过诱导A20介导的核因子-κB抑制抑制炎症细胞因子。 营养 2011 , 27 , 816–823. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 普拉萨德,A.S。; Bao,B。; 贝克,F.W。; 库库克,O。; Sarkar,F.H.锌对人体的抗氧化作用。 自由基。 生物医学。 2004 , 37 , 1182–1190. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 布里格,A。; 林克,L。; Haase,H.游离锌离子对TLR-依赖性MyD88和TRIF信号通路的差异调节。 免疫学杂志。 2013 , 191 , 1808–1817. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] C.I.摩根。; Ledford,J.R。; 周,P。; Page,K。补充锌可以改变气道炎症和对常见过敏原的气道高反应性。 J.燃烧。 2011 , 8 , 36. [ 谷歌学者 ] [ 交叉参考 ] Yan,Y.-W。; 范,J。; Bai,S.-L。; 侯伟杰。; 李,X。; Tong,H.锌通过诱导A20介导的NF-κB通路抑制来预防腹主动脉瘤的形成。 公共科学图书馆 2016 , 11 ,e0148536。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 李,C。; 郭,S。; 高杰。; 郭毅。; 杜,E。; Lv,Z。; Zhang,B.母体高锌饮食通过降低后代雏鸡A20启动子中的DNA甲基化和提高H3K9乙酰化来减轻肠道炎症。 《营养学杂志》。 生物化学。 2015 , 26 , 173–183. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Bao,B。; 普拉萨德,A.S。; F.W.J.贝克。; 菲茨杰拉德,J.T。; 斯内尔,D。; 鲍国伟(Bao,G.W.)。; 辛格,T。; Cardozo,L.J.锌可降低老年受试者的C反应蛋白、脂质过氧化和炎性细胞因子:锌作为动脉粥样硬化保护剂的潜在意义。 美国临床医学杂志。 螺母。 2010 , 91 , 1634–1641. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 冯·布洛,V。; Dubben,S。; Engelhardt,G。; Hebel,S。; 管道工,B。; Heine,H。; 林克,L。; Haase,H.锌对TNF-α生成的依赖性抑制由蛋白激酶A诱导的Raf-1、IκB激酶β和NF-κB的抑制介导。 免疫学杂志。 2007 , 179 , 4180–4186. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 西田,K。; 长谷川,A。; Nakae,S。; Oboki,K。; 齐藤,H。; 山崎,S。; Hirano,T.锌转运蛋白Znt5/Slc30a5是肥大细胞介导的延迟型过敏反应所必需的,但不是立即型过敏反应。 实验医学学报 2009 , 206 , 1351–1364. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Truong-Tran,A.Q。; Carter,J。; 鲁芬,R.E。; Zalewski,P.D.《锌在半胱氨酸蛋白酶激活和凋亡细胞死亡中的作用》。 生物金属 2001 , 14 , 315–330. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 梅花,L.M。; Rink,L.公司。; Haase,H.基本毒素:锌对人类健康的影响。 国际环境杂志。 Res.公共卫生 2010 , 7 , 1342–1365. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 斯坦尼克,H.R。; Salvesen,G.S.半胱天冬酶-3、-6、-7和-8的生化特性。 生物学杂志。 化学。 1997 , 272 , 25719–25723. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Huber,K.L。; Hardy,J.A.锌介导的caspase-9抑制机制。 蛋白质科学。 2012 , 21 , 1056–1065. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 贝拉斯克斯·德尔加多,E.M。; Hardy,J.A.锌介导的caspase-6变构抑制。 生物学杂志。 化学。 2012 , 287 , 36000–36011. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 马雷特,W。; 雅各布,C。; 瓦利,B.L。; Fischer,E.H.酶中的抑制位点:锌的去除和硫蛋白的活化。 程序。 国家。 阿卡德。 科学。 美国 1999 , 96 1936年至1940年。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Muroi,M。; Tanamoto,K.-I.锌和氧化特性依赖于锆在小鼠巨噬细胞中对前caspase-1和NLRP3的降解。 毒物。 莱特。 2015 , 235 , 199–205. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Ting,J.P.-Y。; Willingham,S.B.公司。; Bergstralh,D.T.《细胞死亡与免疫交叉点的NLR》。 《自然免疫学评论》。 2008 , 8 , 372–379. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 刘明杰。; Bao,S。; Galvez-Peralta,M。; Pyle,C.J。; 鲁道夫斯基,A.C。; 巴甫洛维奇,R.E。; 基里莱,D.W。; 李,C。; 内伯特·D.W。; Wewers,医学博士。; 等。ZIP8通过锌介导的NF-kappaB抑制调节宿主防御。 单元格代表。 2013 , 三 ,386–400。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 马雷罗,D.D.N。; 克鲁兹,K.J.C。; Morais,J.B.S。; 贝塞拉,J.B。; Severo,J.S。; de Oliveira,A.R.S.《锌与氧化应激:当前机制》。 抗氧化剂 2017 , 6 , 24. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 瓦尔科,M。; Leibfritz,D。; 蒙科尔,J。; 克罗宁,麻省理工学院。; Mazur,M。; Telser,J.正常生理功能和人类疾病中的自由基和抗氧化剂。 国际生物化学杂志。 细胞生物学。 2007 , 39 , 44–84. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 巴塔查里亚,A。; Chattopadhyay,R。; 密特拉,S。; 氧化应激:胃肠道粘膜疾病发病机制中的一个重要因素。 生理学。 版次。 2014 , 94 , 329–354. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 夏尔马,B。; 辛格,S。; 新泽西州Siddiqi,《重金属诱导氧化还原系统失衡的生物医学意义》。 生物医药研究国际。 2014 , 2014 . [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Rahman,K.关于自由基、抗氧化剂和协同因子的研究。 临床。 Interv公司。 老化 2007 , 2 , 219–236. [ 谷歌学者 ] [ 公共医学 ] Prasad,A.S.锌:一种抗氧化剂和抗炎剂:锌在衰老退行性疾病中的作用。 J.微量元素。 医学生物学。 2014 , 28 , 364–371. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 吉布斯,P.N。; 戈尔,M.G。; Jordan,P.M.《金属离子对人体5-氨基乙酰丙酸脱水酶中硫醇基团反应性影响的研究》。 生物化学。 J。 1985 , 225 , 573–580. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Powell,S.R.锌的抗氧化性能。 《营养学杂志》。 2000 , 130 ,1447S–1454S。 [ 谷歌学者 ] [ 公共医学 ] 普拉萨德,A.S。; F.W.J.贝克。; Bao,B。; 菲茨杰拉德,J.T。; 斯内尔特区。; 斯坦伯格,J.D。; Cardozo,L.J.补充锌可降低老年人感染的发生率:锌对细胞因子生成和氧化应激的影响。 美国临床医学杂志。 螺母。 2007 , 85 , 837–844. [ 谷歌学者 ] [ 公共医学 ] Kloubert,V。; Rink,L.锌作为一种微量营养素及其对细胞氧化损伤的预防作用。 食物功能。 2015 , 6 , 3195–3204. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Young,B。; 奥特·L。; Kasarskis,E。; 拉普,R。; 摩尔,K。; 邓普西,R.J。; 蒂布斯,P.A。; Kryscio,R。; McClain,C.补充锌与改善严重闭合性头部损伤患者的神经恢复率和内脏蛋白质水平有关。 J.神经创伤 1996 , 13 , 25–34. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 英国Besecker。; 埃克斯林,M.C。; 霍利菲尔德,J。; 菲利普斯,G。; 迪西尔维斯特罗,R.A。; Wewers,医学博士。; Knoell,D.L.,重症监护病房入院后早期重症感染和非感染成人锌代谢、炎症和疾病严重程度的比较。 美国临床医学杂志。 螺母。 2011 , 93 , 1356–1364. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 科斯塔雷利。; Muti,E。; 马拉沃尔塔,M。; Cipriano,C。; 贾科尼(Giacconi,R.)。; Tesei,S。; 皮亚琴察,F。; Pierpaoli,S。; Gasparini,N。; Faloia,E。; 等。与成人超重/肥胖受试者锌营养状态相关的炎症和代谢参数的独特调节。 《营养学杂志》。 生物化学。 2010 , 21 ,432–437页。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Chang,K.-L。; 洪,T.-C。; 谢国忠,B.-S。; Chen,Y.-H。; Chen,T.-F。; Cheng,H.-L.锌在药物浓度下影响细胞因子表达并诱导人类外周血单个核细胞凋亡。 营养 2006 , 22 , 465–474. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Tsou,T.-C。; Chao,H.-R。; Yeh,南卡罗来纳州。; 蔡富英(Tsai,F.-Y.)。; Lin,H.-J.锌诱导人类前体细胞释放趋化因子和炎性细胞因子。 J.危险。 马特。 2011 , 196 , 335–341. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] F.W.J.贝克。; 李毅。; Bao,B。; 普拉萨德,A.S。; Sarkar,F.H.HUT-78细胞系缺锌期间重新编程全球基因表达的证据。 营养 2006 , 22 , 1045–1056. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 韦塞尔斯,I。; Haase,H。; Engelhardt,G。; 林克,L。; Uciechowski,P.缺锌通过表观遗传和氧化还原依赖机制诱导早幼粒细胞产生促炎细胞因子IL-1β和TNFalpha。 《营养学杂志》。 生物化学。 2013 , 24 , 289–297. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 普拉萨德,A.S。; 贝克,F.W。; Grabowski,S.M.公司。; 卡普兰,J。; Mathog,R.H.缺锌:头颈癌患者和非癌受试者细胞因子生成和T细胞亚群的变化。 程序。 美国医师协会 1997 , 109 , 68–77. [ 谷歌学者 ] [ 公共医学 ] 普拉萨德,A.S。; Bao,B。; F.W.J.贝克。; Sarkar,F.H.通过体外向缺锌的人类受试者的单核细胞添加锌来校正白细胞介素2基因表达:人类缺锌的特异性测试。 Transl.公司。 临床实验室研究。 医学。 2006 , 148 , 325–333. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Pinna,K。; 凯利,D.S。; P.C.泰勒。; King,J.C.锌摄入量低的健康男性保持免疫功能。 《营养学杂志》。 2002 , 132 , 2033–2036. [ 谷歌学者 ] [ 公共医学 ] Kahmann,L。; Uciechowski,P。; Warmuth,S。; 管道工,B。; 格雷斯纳,A.M。; 马拉沃尔塔,M。; Mocchegiani,E。; Rink,L.老年人补锌可减少自发性炎症细胞因子释放并恢复T细胞功能。 复兴研究。 2008 , 11 , 227–237. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Wong,C.P。; 北卡罗来纳州里纳尔迪。; 缺锌通过增加免疫细胞活化和诱导IL6启动子去甲基化增强炎症反应。 分子螺母。 食品研究。 2015 , 59 , 991–999. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Prasad,A.S.Zinch:宿主防御机制。 《营养学杂志》。 2007 , 137 , 1345–1349. [ 谷歌学者 ] [ 公共医学 ] 贝克,F.W。; 普拉萨德,A.S。; 卡普兰,J。; 菲茨杰拉德,J.T。; Brewer,G.J.在实验诱导的缺锌人类中细胞因子产生和T细胞亚群的变化。 美国生理学杂志。 1997 , 272 ,E1002–E1007。 [ 谷歌学者 ] [ 公共医学 ] Tapazoglou,E。; 普拉萨德,A.S。; 希尔·G。; G.J.布鲁尔。; Kaplan,J.镰状细胞病缺锌患者的自然杀伤细胞活性降低。 临床实验室杂志。 医学。 1985 , 105 , 19–22. [ 谷歌学者 ] [ 公共医学 ] Honscheid,A。; 林克,L。; Haase,H.T淋巴细胞:锌离子刺激和抑制作用的靶点。 恩多克。 代谢产物。 免疫失调。 药物靶点 2009 , 9 , 132–144. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 韦林豪森,N。; Martin,M。; Rink,L.锌抑制白细胞介素-1依赖性T细胞刺激。 欧洲免疫学杂志。 1997 , 27 , 2529–2535. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Rosenkranz,E。; 希格斯,R.-D。; Uciechowski,P。; 彼得森,A。; 水管工,B。; Rink,L.锌可增加过敏性受试者过敏原刺激细胞中调节性T细胞的数量。 欧洲营养学杂志。 2017 , 56 , 557–567. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Rosenkranz,E。; 梅瓦尔德,M。; 希格斯,R.-D。; Brieger,A。; Clarner,T。; Kipp先生。; 普吕梅克斯,B。; 梅耶,S。; Schwerdtle,T。; Rink,L.锌对Th1-/Th17驱动的实验性自身免疫性脑脊髓炎中调节性T细胞的诱导作用。 《营养学杂志》。 生物化学。 2016 , 29 , 116–123. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 梅瓦尔德,M。; Meurer,S.K.公司。; 魏基尔琴,R。; Rink,L.补充锌可增强TGF-β1依赖性调节性T细胞的诱导。 分子螺母。 食品研究。 2017 , 61 . [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Rosenkranz,E。; 梅茨,C.H。; 梅瓦尔德,M。; Hilgers,R。; 我们,我。; 森夫,T。; Haase,H。; Jäger,M。; 奥特,M。; 阿斯皮纳尔,R。; 等。补锌通过抑制混合淋巴细胞培养中的Sirt-1脱乙酰酶诱导调节性T细胞。 分子螺母。 食品研究。 2016 , 60 . [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Hennigar,S.R。; McClung,J.P.营养免疫。 美国生活方式医学杂志。 2016 , 10 ,170–173。 [ 谷歌学者 ] [ 交叉参考 ] 艾德米尔,T.B。; Chang,S.-M。; Guthrie,G.J。; Maki,A.B。; Ryu,M.-S。; 卡拉比伊克,A。; Cousins,R.J.锌转运蛋白ZIP14在先天性免疫反应(内毒素血症)期间的肝脏锌、铁和葡萄糖稳态中发挥作用。 公共科学图书馆 2012 , 7 ,e48679。 [ 谷歌学者 ] [ 交叉参考 ] 格拉泽,R。; Harder,J。; 兰格,H。; Bartels,J。; Christophers,E。; Schroder,J.-M.抗菌牛皮癣素(S100A7)保护人类皮肤免受 大肠杆菌 感染。 自然免疫学。 2005 , 6 , 57–64. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 科尔宾,B.D。; Seeley,E.H。; Raab,A。; 费尔德曼,J。; 米勒,M.R。; V.J.托雷斯。; 安德森,K.L。; 达蒂洛,B.M。; 邓曼,P.M。; Gerads,R。; 等。金属螯合和抑制组织脓肿中的细菌生长。 科学 2008 , 319 , 962–965. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 肉毒杆菌,H。; 斯塔德赫恩,G。; Lugo-Villarino,G。; Chastellier,C。; de Neyrolles,O。《宿主与肿瘤相互作用的金属生物学:令人陶醉的新见解》。 微生物趋势。 2012 , 20 ,106–112。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 拉潘恩,M。; 丹霍夫,S。; Guenther,F。; Olivares-Florez,S。; 莫德霍斯特,I.L。; Vogel,U。脑膜炎奈瑟菌对中性粒细胞胞外陷阱的体外耐药机制。 摩尔微生物。 2013 , 89 , 433–449. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 斯托克,M。; 格里杰普斯特拉,J。; 博斯,医学博士。; 马纳斯·托雷斯,C。; 北卡罗来纳州德沃斯。; Poolman,J.T。; 查赞,W.J。; Tommassen,J.盗用锌作为脑膜炎奈瑟菌逃避营养免疫的机制。 《公共科学图书馆·病理学》。 2013 , 9 ,e1003733。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 博布罗夫,A.G。; 基里利娜,O。; 费瑟斯顿,J.D。; M.C.米勒。; Burlison,J.A。; Perry,R.D.鼠疫耶尔森菌铁载体、耶尔森氏菌素和ZnuABC系统都有助于锌的获取和小鼠致命性败血性鼠疫的发展。 摩尔微生物。 2014 , 93 , 759–775. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 刘建中。; 杰尔鲍尔,S。; 爱伦·爱伦·坡。; 吨,V。; 佩西拉里,M。; Kehl-Fie,T.E。; Restrepo,N.A。; 霍斯金,医学博士。; 爱德华兹,R.A。; 巴蒂斯托尼,A。; 等。中性粒细胞蛋白钙保护素对锌的隔离促进了炎症肠道中沙门氏菌的生长。 宿主与微生物 2012 , 11 , 227–239. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Nowak,J.E。; 哈蒙,K。; 加利福尼亚州考德威尔。; Wong,H.R.在败血症小鼠模型中,预防性补锌可减少细菌负荷并提高存活率。 儿科。 批评。 护理医学。 2012 , 13 ,e323–e329。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 辛格,M。; Das,R.R.普通感冒用锌。 Cochrane数据库系统。 版次。 2013 ,CD001364。 [ 谷歌学者 ] [ 交叉参考 ] Mezzetti,A。; Pierdomenico,S.D.公司。; 科斯坦蒂尼,F。; 罗曼诺,F。; de Cesare,D。; Cuccurullo,F。; 英巴斯塔罗,T。; Riario-Sforza,G。; Di Giacomo,F。; 祖利安尼,G。; 等。铜/锌比率和全身氧化负荷:衰老和衰老相关退行性疾病的影响。 自由基。 生物医学。 1998 , 25 , 676–681. [ 谷歌学者 ] [ 交叉参考 ] 科兹洛夫斯基,H。; Luczkowski,M。; 雷梅利,M。; Valensin,D.铜、锌和铁在神经退行性疾病(阿尔茨海默病、帕金森病和朊病毒病)中的作用。 协调。 化学。 版次。 2012 , 256 , 2129–2141. [ 谷歌学者 ] [ 交叉参考 ] 马拉沃尔塔,M。; 贾科尼(Giacconi,R.)。; 皮亚琴察,F。; 桑塔雷利。; Cipriano,C。; 科斯塔雷利。; Tesei,S。; Pierpaoli,S。; 巴索,A。; 加莱亚齐,R。; 等。血浆铜/锌比率:一种炎症/营养生物标志物,作为老年人全因死亡率的预测因子。 生物老年学 2010 , 11 , 309–319. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Overbeck,S。; 林克,L。; Haase,H.通过口服补锌调节免疫反应:一种治疗多种疾病的单一方法。 架构(architecture)。 免疫学。 疗法。 支出。 2008 , 56 , 15–30. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Hulisz,D.锌对常见感冒病毒的疗效:综述。 美国药学协会杂志。 2004 , 44 , 594–603. [ 谷歌学者 ] [ 交叉参考 ] Z.库鲁戈。; 阿基利,M。; Bayram,N。; Koturoglu,G.硫酸锌对儿童普通感冒的预防和治疗效果。 儿科学报。 2006 , 95 , 1175–1181. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 鲍姆,M.K。; Lai,S。; 销售额,S。; Page,J.B。; Campa,A.补充锌预防艾滋病毒阳性成人免疫功能衰竭的随机对照临床试验1,2。 临床。 感染。 数字化信息系统。 2010 , 50 , 1653–1660. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Asdamongkol,N。; Phanachet等人。; Sungkanuparph,S.抗逆转录病毒治疗后免疫学不一致的HIV感染患者的低血浆锌水平和对补锌的免疫反应。 日本。 J.感染。 数字化信息系统。 2013 , 66 , 469–474. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 罗达·R。; 沙阿,N。; 莫哈里,N。; 穆克吉,A。; 瓦杰帕伊,M。; 辛格,R。; Singla,M。; Saini,S。; 巴特纳加,S。; Kabra,S.K.补充锌对接受高效抗逆转录病毒治疗的艾滋病毒感染儿童的免疫效果:一项随机、双盲、安慰剂对照试验。 J.收购人。 免疫防御。 综合。 2014 , 66 , 386–392. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Mocchegiani,E。; Veccia,S。; Ancarani,F。; 比例尺,G。; Fabris,N.口服补锌作为齐多夫定(AZT)治疗艾滋病机会性感染的辅助药物的益处。 国际免疫药理学杂志。 1995 , 17 ,719–727页。 [ 谷歌学者 ] [ 交叉参考 ] 扎佐,J.F。; Rouveix,B。; Rajagopalon,P。; 勒瓦彻,M。; Girard,P.M.锌对缺锌艾滋病相关综合征患者免疫状态的影响。 临床。 螺母。 1989 , 8 , 259–261. [ 谷歌学者 ] [ 交叉参考 ] 博巴特,R。; 库瓦迪亚,H。; 斯蒂芬,C。; Naidoo,K.L。; 北卡罗来纳州麦克罗。; 黑色,R.E。; Moss,W.J.,南非HIV-1感染儿童补锌的安全性和有效性:一项随机双盲安慰剂对照试验。 柳叶刀 2005 , 366 , 1862–1867. [ 谷歌学者 ] [ 交叉参考 ] Green,J.A。; 勒温,S.R。; Wightman,F。; Lee,M。; 拉文德兰,T.S。; Paton,N.I.一项口服锌对HIV感染患者结核病免疫反应的随机对照试验。 国际癌症杂志。 肺部疾病。 2005 , 9 , 1378–1384. [ 谷歌学者 ] [ 公共医学 ] 法齐,W.W。; 维拉莫尔,E。; 穆萨曼加,G.I。; Antelman,G。; Aboud,S。; 乌拉萨,W。; Hunter,D.补锌与坦桑尼亚HIV-1感染妇女妊娠结局、血液学指标和T细胞计数的关系试验。 美国临床医学杂志。 螺母。 2005 , 81 , 161–167. [ 谷歌学者 ] [ 公共医学 ] 维拉莫尔,E。; Aboud,S。; 库林斯卡,I.N。; 库普卡,R。; 乌拉萨,W。; 卓别林,B。; Msamanga,G。; Fawzi,W.W.《向感染HIV-1的孕妇补充锌:对产妇人体测量、病毒载量和早期母婴传播的影响》。 欧洲临床杂志。 螺母。 2006 , 60 , 862–869. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Deloria-Knoll,M。; 斯坦霍夫,M。; 塞姆巴,R.D。; Nelson,K。; 维拉霍夫,D。; Meinert,C.L.补充锌和维生素A对HIV阳性注射吸毒者肺炎球菌结合疫苗抗体反应的影响:一项随机试验。 疫苗 2006 , 24 , 1670–1679. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 川口,T。; 永高,Y。; Abe,K。; Imazeki,F。; 本田,K。; 山崎,K。; 宫崎骏,K。; Taniguchi,E。; Kakuma,T。; 加藤,J。; 等。支链氨基酸和富锌营养素对HCV感染患者预后的影响:一项多中心随机对照试验。 摩尔医学代表。 2015 , 11 , 2159–2166. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 村上,Y。; Koyabu,T。; 川岛,A。; Kakibuchi,N。; 川崎,T。; 高口,K。; Kita,K。; Okita,M.在聚乙二醇干扰素α-2b和利巴韦林联合治疗期间,补锌可防止慢性丙型肝炎患者转氨酶升高。 《营养学杂志》。 科学。 维生素。 2007 , 53 , 213–218. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 高木,H。; Nagamine,T。; Abe,T。; Takayama,H。; 佐藤,K。; 大冢,T。; 川崎,S。; Y.桥本。; 松本,T。; 小岛,A。; 等。补充锌可以提高慢性丙型肝炎患者对干扰素治疗的反应。 J.病毒性肝炎。 2001 , 8 , 367–371. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Ko、W.-S。; 郭春华。; 徐,G.-S.W。; Chiou,Y.-L。; 叶,M.-S。; Yaun,S.-R.补充锌对干扰素和利巴韦林治疗慢性丙型肝炎患者的影响。 临床。 生物化学。 2005 , 38 , 614–620. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 霍克,K.M。; Binder,H.J.锌治疗急性腹泻:现状和评估。 胃肠病学 2006 , 130 , 2201–2205. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 杜塔,P。; 密特拉,美国。; 杜塔,S。; Naik,T.N。; Rajendran,K。; Chatterjee,M.K.,《腹泻儿童锌、维生素A和微量营养素补充剂:联合治疗与单一治疗的随机对照临床试验》。 《儿科杂志》。 2011 , 159 , 633–637. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 马利克,A。; Taneja,D.K。; Devasenapathy,N。; Rajeshwari,K.补充锌预防婴儿急性呼吸道感染:一项随机对照试验。 印度儿科。 2014 , 51 , 780–784. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 阿联酋沙阿。; 阿布沙欣,A.K。; Malik,文学硕士。; Alam,S。; Riaz,M。; AL-Tanner,M.A.补锌对患有急性下呼吸道感染的幼儿的疗效:一项随机双盲对照试验。 临床。 螺母。 2013 , 32 , 193–199. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Martinez-Estevez,N.S。; 阿尔瓦雷斯·格瓦拉,A.N。; Rodriguez-Martinez,C.E.补充锌对哥伦比亚儿童呼吸道感染和腹泻病的预防作用:一项为期12个月的随机对照试验。 过敏原。 免疫病理学。 2016 , 44 , 368–375. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Sazawal,S。; 黑色,R.E。; 贾拉,S。; Mazumdar,S。; 辛哈,A。; Bhan,M.K.补充锌可降低婴儿和学龄前儿童急性下呼吸道感染的发病率:一项双盲对照试验。 儿科 1998 , 102 , 1–5. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Mahalanabis,D。; 拉希里,M。; Paul博士。; 古普塔,S。; 古普塔,A。; Wahed,文学硕士。; Khaled,M.A.,锌或维生素A治疗婴幼儿严重急性下呼吸道感染疗效的随机、双盲、安慰剂对照临床试验。 美国临床医学杂志。 螺母。 2004 , 79 , 430–436. [ 谷歌学者 ] [ 公共医学 ] Karyadi,E。; 西,C.E。; Schultink,W。; 内尔万,R.H.H。; 毛重,R。; 阿明,Z。; W.M.V.多尔曼斯。; Schlebusch,H。; van der Meer,J.W.M.,《印度尼西亚结核病患者补充维生素A和锌的双盲安慰剂对照研究:对临床反应和营养状况的影响》。 美国临床医学杂志。 螺母。 2002 , 75 , 720–727. [ 谷歌学者 ] [ 公共医学 ] 新泽西州马图尔。; Bumb,R.A。; Mangal,H.N.口服锌治疗复发性结节性红斑-麻风反应。 勒普。 印度 1983 , 55 , 547–552. [ 谷歌学者 ] [ 公共医学 ] 新泽西州马图尔。; Bumb,R.A。; Mangal,H.N。; Sharma,M.L.口服锌作为氨苯砜治疗麻风的辅助药物。 国际法学杂志。 其他分枝杆菌。 数字化信息系统。 组织外利息。 协会。 1984 , 52 , 331–338. [ 谷歌学者 ] El-Shafei,医学硕士。; 卡马尔,A.A。; 索利曼,H。; el-Shayeb,F。; Abdel Baqui,医学硕士。; Faragalla,S。; Sabry,M.K.口服锌补充剂对麻风细胞介导的免疫的影响。 J.埃及。 公共卫生协会。 1988 , 63 , 311–336. [ 谷歌学者 ] [ 公共医学 ] Mahajan,P.M。; 贾达夫,V.H。; Patki,A.H。; 乔盖卡尔,D.G。; Mehta,J.M.口服锌治疗复发性麻风结节性红斑:一项临床研究。 印度J.Lepr。 1994 , 66 , 51–57. [ 谷歌学者 ] [ 公共医学 ] Alam,A.N。; Sarker公司。; Wahed,文学硕士。; Khatun,M。; Rahaman,M.M.,急性志贺氏菌病期间和恢复后儿童的肠蛋白损失和肠通透性变化:补锌的影响。 肠子 1994 , 35 , 1707–1711. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Raqib,R。; 罗伊,S.K。; M.J.拉赫曼。; 阿齐姆,T。; Ameer,S.S.公司。; Chisti,J。; Andersson,J.补锌对志贺氏菌病患儿免疫和炎症反应的影响。 美国临床医学杂志。 螺母。 2004 , 79 , 444–450. [ 谷歌学者 ] [ 公共医学 ] M.J.拉赫曼。; 萨克,P。; 罗伊,S.K。; 艾哈迈德,S.M。; Chisti,J。; 阿齐姆,T。; 马坦,M。; 萨克,D。; 安德森,J。; Raqib,R.补锌作为辅助治疗对志贺氏菌病患者全身免疫反应的影响。 美国临床医学杂志。 螺母。 2005 , 81 , 495–502. [ 谷歌学者 ] [ 公共医学 ] 罗伊,S.K。; 拉奇布,R。; 西卡顿。; 阿齐姆,T。; 乔杜里,R。; G.J.Fuchs。; Sack,D.A.补锌在孟加拉国营养不良儿童志贺氏菌病治疗中的应用。 欧洲临床杂志。 螺母。 2008 , 62 ,849–855页。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 鹿村,H。; 铃木,K。; 哈桑,M。; 池泽一郎,K。; Sawahata,T。; 渡边,T。; Nakahara,A。; 穆托,H。; 粘膜保护剂Tanaka,N.Polaprezin与兰索拉唑、阿莫西林和克拉霉素联合使用可提高幽门螺杆菌感染的治愈率。 Aliment公司。 药理学。 疗法。 1999 , 13 , 483–487. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] Zeba,A.N。; Sorgho,H。; Rouamba,N。; Zongo,I。; Rouamba,J。; R.T.Guiguemdé。; 哈默,D.H。; 莫赫塔,N。; Ouedraogo,J.-B.联合补充维生素A和锌可显著降低布基纳法索幼儿的疟疾发病率:一项随机双盲试验。 螺母。 J。 2008 , 7 , 7. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] A.H.Shankar。; Genton,B。; Baisor,M。; 佩诺,J。; Tamja,S。; Adiguma,T。; Wu,L。; 稀有,L。; Bannon,D。; 蒂尔施,J.M。; 等。补锌对因缺锌引起的发病率的影响 恶性疟原虫 巴布亚新几内亚学龄前儿童的随机试验。 美国J.特罗普。 医学Hyg。 2000 , 62 , 663–669. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] C.J.贝茨。; Evans,P.H.公司。; 达登,M。; 普伦蒂斯,A。; Lunn,P.G。; 科罗拉多州诺斯罗普·克鲁斯。; 霍尔,S。; 科尔,T.J。; 霍兰,S.J。; Longman,S.C.冈比亚农村儿童补锌试验。 英国营养学杂志。 1993 , 69 , 243–255. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] O.穆勒。; Becher,H。; van Zweeden,A.B。; Ye,Y。; 迪亚洛,D.A。; 科纳特,A.T。; 巴古,A。; 库亚特,B。; Garenne,M.补锌对西非儿童疟疾和其他发病原因的影响:随机双盲安慰剂对照试验。 英国医学杂志临床。 物件。 2001 , 322 , 1567. [ 谷歌学者 ] [ 交叉参考 ] 锌抗疟原虫研究小组。 锌对 恶性疟原虫 儿童疟疾:一项随机对照试验。 美国临床医学杂志。 螺母。 2002 , 76 , 805–812. [ 谷歌学者 ] 理查德,S.A。; 北卡罗来纳州萨瓦莱塔。; 考尔菲尔德,L.E。; 黑色,R.E。; Witzig,R.S。; Shankar,A.H.锌和铁补充剂与秘鲁亚马逊地区儿童的疟疾、腹泻和呼吸道感染。 美国J.特罗普。 医学Hyg。 2006 , 75 , 126–132. [ 谷歌学者 ] [ 公共医学 ] 拉泽里尼,M。; Wanzira,H.口服锌治疗儿童腹泻。 Cochrane数据库系统。 版次。 2016年[ 交叉参考 ] 世界卫生组织。 补锌治疗腹泻 ; 世界卫生组织:瑞士日内瓦,2017年。 [ 谷歌学者 ] Finamore,A。; 马西米,M。; Conti Devirgiliis,L。; Mengheri,E.缺锌导致Caco-2细胞膜屏障损伤并增加中性粒细胞迁移。 《营养学杂志》。 2008 , 138 , 1664–1670. [ 谷歌学者 ] [ 公共医学 ] Bao,S。; Knoell,D.L.锌调节细胞因子诱导的肺上皮细胞屏障通透性。 美国生理学杂志。 肺细胞。 摩尔生理学。 2006 , 291 ,L1132-41。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 兰斯敦,A.B.G。; Mirastschijski,美国。; 斯塔布斯,N。; Scanlon,E。; Agren,M.S.《伤口愈合中的锌:理论、实验和临床方面》。 伤口修复再生。 2007 , 15 , 2–16. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 戈桑,A。; 洛杉矶DiPietro衰老与伤口愈合。 世界外科杂志。 2004 , 28 ,321–326。 [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 卢,X。; 王,M。; 齐,J。; Wang,H。; 李,X。; 古普塔,D。; Dziarski,R.肽聚糖识别蛋白质是一类新的人类杀菌蛋白质。 生物学杂志。 化学。 2006 , 281 , 5895–5907. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ] 王,M。; 刘,L.-H。; 王,S。; 李,X。; 卢,X。; Gupta博士。; Dziarski,R.人类肽聚糖识别蛋白质需要锌来杀死革兰氏阳性和革兰氏阴性细菌,并且与抗菌肽具有协同作用。 免疫学杂志。 2007 , 178 , 3116–3125. [ 谷歌学者 ] [ 交叉参考 ] [ 公共医学 ]