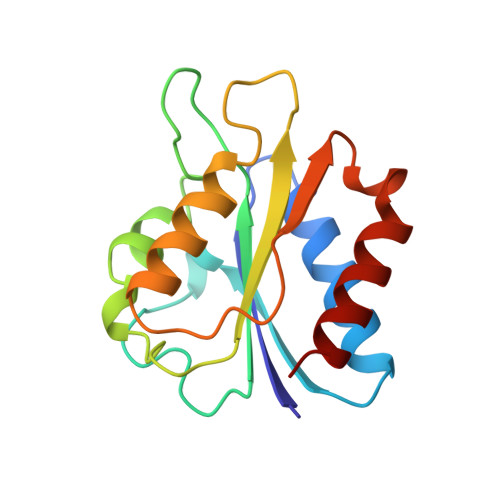
天冬氨酸95在调节普通脱硫弧菌黄曲霉毒素氧化还原电位中作用的结晶研究。
A.A.麦卡锡。, Walsh,文学硕士。, C.S.维尔玛。, D.P.奥康奈尔。, Reinhold,M。, G.N.亚洛韦。, D’Arcy,D。, 希金斯,T.M。, G·伏尔都夫。, S.G.梅休。(2002)生物化学41: 10950-10962
- 公共医学: 12206666 在PubMed上搜索
- 内政部:https://doi.org/10.1021/bi020225h
- 相关结构的主要引文:
1AKQ公司,1AKU公司,1千伏,1C7E公司,1C7F型
- PubMed摘要:
普通脱硫弧菌黄曲霉毒素中天冬氨酸95的侧链提供了与蛋白中结合FMN的N(1)最近的负电荷。用定点突变取代丙氨酸、天冬酰胺或谷氨酸来替代该氨基酸,以评估该电荷对FMN辅因子的半醌/对苯二酚氧化还原电位(E(1))的影响。D95A突变使E(1)氧化还原电位正移16 mV,而氧化/半醌中点氧化还原电位负移23 mV(E(2))。该突变体的氧化型和半醌型的晶体结构与野生型蛋白质的相应状态相似。与野生型蛋白质相比,氢醌型D95A突变体的结构发生了进一步的变化。Y98的侧链与结合的FMN发生了能量上更有利的边-面相互作用。考虑到FMN结合位点的静电相互作用,对D95A突变体的结构变化进行分析表明,当FMN辅因子与脱黄素毒素结合时,pi-pi静电斥力对其极低的E(1)氧化还原电位的贡献很小。用谷氨酸取代D95只引起FMN辅因子的两个单电子氧化还原电位的轻微扰动。D95E突变体的结构显示60环(残基60-64)在氧化结构中远离黄素的大量运动。将该突变体还原为对苯二酚会导致60-环的构象回复到野生型蛋白质结构中的构象。D95E突变体的晶体结构表明,位置95处侧链上的羧酸盐与Y98的酚环之间的静电排斥阻止了Y98侧链旋转到更有利的构象,就像D95A突变体中发生的那样。用天冬酰胺取代D95对E(2)没有影响,但使E(1)改变45 mV。D95N突变体未能结晶。蛋白FMN复合物在所有三种氧化还原状态下的K(d)值与野生型复合物不同。分子模拟表明,蛋白质的构象能量随氧化还原状态而变化,与观察到的K(d)变化在定性上一致,并允许定量FMN与蛋白质上周围基团之间的静电相互作用。
组织附属关系: 爱尔兰戈尔韦爱尔兰国立大学化学系。