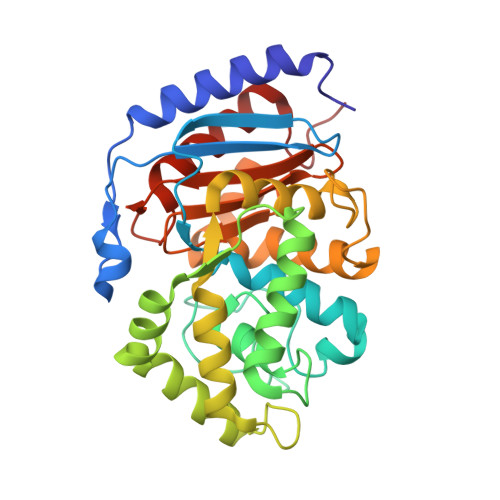
人肾型谷氨酰胺酶(KGA)变构抑制机制及其Raf-Mek-Erk信号在癌细胞代谢中的调节的结构基础。
肯塔基州坦加维鲁。, C.Q.潘。, 卡尔伯格,T。, 巴拉吉(G.Balaji)。, 乌塔姆昌达尼,M。, V.苏雷什。, H.舒勒。, 不列颠哥伦比亚省洛市。, J.西瓦拉曼。(2012)美国国家科学院院刊109: 7705-7710
- 公共医学: 22538822 在PubMed上搜索在PubMed Central上搜索
- 内政部:https://doi.org/10.1073/pnas.1116573109
- 相关结构的主要引文:
3CZD公司,三人行,3VOZ公司,第3页第0页,第三视频处理1,第三视频处理2,第三副总裁,第三视频处理4
- PubMed摘要:
癌症细胞除了靠葡萄糖代谢的改变而茁壮成长外,还需要进行谷氨酰胺水解以满足其能量需求。作为第一种催化谷氨酰胺分解的酶,人肾素型谷氨酰胺酶亚型(KGA)正成为小分子如BPTES(双-2-(5苯基乙酰氨基-1,2,4-噻二唑-2-基)乙基硫醚)的诱人靶点,尽管KGA的调控机制尚不清楚。根据晶体结构,我们发现BPTES与KGA二聚体界面的变构口袋结合,触发了催化位点附近关键环(Glu312-Pro329)的剧烈构象变化,并使其失去活性。BPTES在疏水囊上的结合方式解释了其对KGA的特异性。有趣的是,细胞中的KGA活性受到EGF的刺激,KGA与Raf-1/Mek2/Erk信号模块的所有三个激酶组分相关。然而,增强的活性被激酶死亡、Raf-1(Raf-1-K375M)和Mek2(Mek2-K101A)的显性阴性突变体、蛋白磷酸酶PP2A和Mek抑制剂U0126所抵消,表明磷酸化依赖性调节。此外,用次优水平的BPTES处理Mek2-K101A和KGA共存的细胞会导致协同抑制细胞增殖。因此,尽管构成活性Mek2-S222/226D结合,但该关键环上关键疏水残基的突变会抑制KGA活性和细胞增殖。因此,这些研究为(i)BPTES对KGA的变构抑制,揭示KGA活性和抑制位点的动态性质,以及(ii)EGF-介导的Raf-Mek-Erk信号传导对KGA活性的串扰和调节提供了见解。这些发现将有助于设计更好的抑制剂和治疗谷氨酰胺代谢成瘾癌症的策略。
组织隶属关系: 新加坡国立大学生物科学系,新加坡117543。