摘要
介绍
蛋白质-蛋白质相互作用“下拉”测定
结构研究标签
图1。
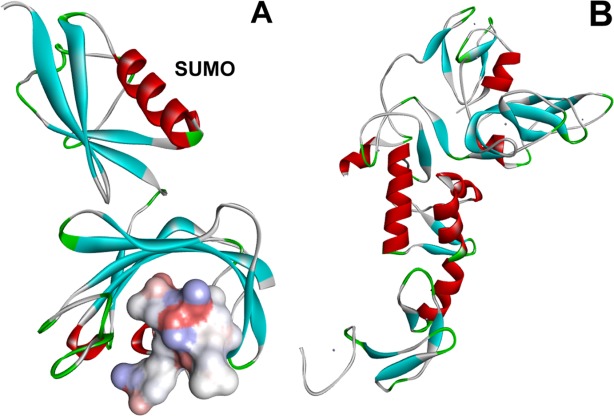
功能活动标签
自我分裂亲和力标签
大规模制造
致谢
工具书类
-
1 Arnau J、Lauritzen C、Petersen GE、Pedersen J。使用亲和标记和去除标记纯化重组蛋白的当前策略。 蛋白质实验纯化2006; 48:1–13. doi:10.1016/j.pep.2005.12.002。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
2 Young CL,Britton ZT,Robinson AS。重组蛋白表达和纯化:亲和标签和微生物应用的综合评述。 生物技术杂志2012; 7:620–634. doi:10.1002/biot.201100155。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
三。 Smyth DR、Mrozkiewicz MK、McGrath WJ、Listwan P、Kobe B。具有大亲和力标签的融合蛋白的晶体结构。 蛋白质科学。 2003; 12:1313–1322. doi:10.1110页/第0243403页。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
4 Ron D,Dressler H.pGSTag——用于酶标记重组蛋白的多功能细菌表达质粒。 生物技术。 1992; 13:866–869. [ 公共医学 ] [ 谷歌学者 ] -
5 Malhotra A.蛋白质表达标记。 方法酶制剂。 2009; 463:239–258. doi:10.1016/S0076-6879(09)63016-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
6 史密斯DB,约翰逊KS。 大肠杆菌中表达的多肽与谷胱甘肽S-转移酶融合物的单步纯化。 基因。 1988; 67:31–40. doi:10.1016/0378-1119(88)90005-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
7 Waugh DS。充分利用亲和标记。 生物技术趋势。 2005; 23:316–320. doi:10.1016/j.tibtech.2005.03.012。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
8 Frangioni JV,Neel BG。酶活性谷胱甘肽S-转移酶(pGEX)融合蛋白的溶解和纯化。 分析生物化学。 1993; 210:179–187. doi:10.1006/abio.1993.1170。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
9 Schrodel A,de Marco A.细菌中重组蛋白表达过程中形成的聚集体的表征。BMC生物化学。 2005; 6:10. doi:10.1186/1471-2091-6-10。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
10 Fang M,Wang W,Wang Y,Ru B.具有生物活性的人TFF3的细菌表达和纯化。 肽。 2004; 25:785–792. doi:10.1016/j.peptides.2004.01.025。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
11 Mitchell DA,Marshall TK,Deschenes RJ。酵母中谷胱甘肽S-转移酶融合蛋白诱导过度表达的载体。 酵母。 1993; 9:715–722. doi:10.1002/年320090705。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
12 Rodal AA,Duncan M,Drubin D.酵母谷胱甘肽S-转移酶融合蛋白的纯化。 方法酶制剂。 2002; 351:168–172. doi:10.1016/s0076-6879(02)51846-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
13. Zhang N,Qiao Z,Liang Z,Mei B,Xu Z,Song R.玉米Taxilin蛋白通过改变其亚细胞分布负调控opaque-2转录活性。 公共科学图书馆一号。 2012; 7:e43822。 doi:10.1371/journal.pone.0043822。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
14 Song CP,加尔布雷思德国之声。 AtSAP18是人类SAP18的直系同源物,参与盐胁迫的调节并介导拟南芥的转录抑制。 植物分子生物学。 2006; 60:241–257. doi:10.1007/s11103-005-3880-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
15 Wong A,Albright SN,Wolfner MF。胚珠蛋白(一种快速进化的果蝇精蛋白)的结构限制证据。 美国国家科学院院刊2006; 103:18644–18649. doi:10.1073/pnas.0601849103。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
16 Bao X,Zhang W,Krencik R,Deng H,Wang Y,Girton J,Johansen J,Johnsen KM。JIL-1激酶与层粘连Dm0相互作用并调节果蝇滋养细胞的核膜形态。 细胞科学杂志。 2005; 118:5079–5087. doi:10.1242/jcs.02611。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
17 Thomson RB,Wang T,Thomson BR,Tarrats L,Girardi A,Mentone S,Soleimani M,Kocher O,Aronson PS。PDZK1在肾刷边界离子交换器膜表达中的作用。 美国国家科学院院刊2005; 102:13331–13336. doi:10.1073/pnas.0506578102。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
18 Rudert F、Visser E、Gradl G、Grandison P、Shemshedini L、Wang Y、Grierson A、Watson J.pLEF,一种在哺乳动物细胞中表达谷胱甘肽S-转移酶融合蛋白的新型载体。 基因。 1996; 169:281–282. doi:10.1016/0378-1119(95)00820-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
19 Harper S,Speicher DW公司。 谷胱甘肽S-转移酶融合蛋白的纯化。 方法分子生物学。 2011; 681:259–280. doi:10.1007/978-1-60761-913-0_14。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
20 Deceglie S、Lionetti C、Roberti M、Cantatore P、Loguercio Polosa P。使用谷胱甘肽S-转移酶表达系统纯化活性大酶的改良方法。 分析生物化学。 2012; 421:805–807. doi:10.1016/j.ab.2011.12.015。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
21 Maru Y,Afar DE,Witte ON,Shibuya M.谷胱甘肽S-转移酶的二聚化特性部分激活了缺乏寡聚结构域的Bcr-Abl。 生物化学杂志。 1996; 271:15353–15357. doi:10.1074/jbc.271.26.15353。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
22 Vinckier NK,Chworos A,Parsons SM。谷胱甘肽S-转移酶标记蛋白质的改良分离。 蛋白质实验纯化2011; 75:161–164. doi:10.1016/j.ep.2010.09.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
23 Tolia NH,Joshua-Tor L.大肠杆菌蛋白质共表达策略。 自然方法。 2006; 3:55–64. doi:10.1038/nmeth0106-55。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
24 Hochuli E,Dobeli H,Schacher A.新型金属螯合吸附剂,对含有相邻组氨酸残基的蛋白质和肽具有选择性。 J色谱法。 1987; 411:177–184. doi:10.1016/s0021-9673(00)93969-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
25 Hefti MH,Van Vugt-Van der Toorn CJ,Dixon R,Vervoort J.含有凝血酶裂解位点的组氨酸标记蛋白质的新纯化方法。 分析生物化学。 2001; 295:180–185. doi:10.1006/abio.2001.5214。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
26. Huang A,de Jong RN,Folkers GE,Boelens R.E3环结构域生成折叠性的核磁共振表征。 结构生物学杂志。 2010; 172:120–127. doi:10.1016/j.jsb.2010.07.014。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
27 Lamberti A、Sanges C、Chambery A、Migliaccio N、Rosso F、Di Maro A、Papale F、Marra M、Parente A、Caraglia M、Abbruzzese A、Arcari P。通过功能蛋白质组学分析真核生物翻译延伸因子1A M域的相互作用伙伴。 生物化学。 2011; 93:1738–1746. doi:10.1016/j.biochi.2011.06.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
28 Noberini R、Rubio de la Torre E、Pasquale EB。 分析细胞和组织中Eph受体的表达:靶向质谱法。 细胞Adh Migr。 2012; 6:102–112. doi:10.4161/cam.19620。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
29 Uhlen M、Forsberg G、Moks T、Hartmanis M、Nilsson B。生物技术中的融合蛋白。 Curr Opin生物技术。 1992; 3:363–369. doi:10.1016/0958-1669(92)90164-e。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
30 德雷温达ZS。 重组方法和分子工程在蛋白质结晶中的应用。 方法。 2004; 34:354–363. doi:10.1016/j.meth.2004.03.024。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
31 Bucher MH,Evdokimov AG,Waugh DS。短亲和标记对糠秕球菌麦芽糊精结合蛋白结晶的差异效应。 《水晶学报》。 2002; D58:392–397。 doi:10.1107/s0907444901021187。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
32 Geoghegan KF、Dixon HB、Rosner PJ、Hoth LR、Lanzetti AJ、Borzilleri KA、Marr ES、Pezzullo LH、Martin LB、LeMotte PK、McColl AS、Kamath AV、Stroh JG。 大肠杆菌中“His标签”的自发α-N-6-磷酸葡萄糖基化:融合蛋白中258或178 Da额外质量的原因。 分析生物化学。 1999; 267:169–184. doi:10.1006/abio.1998.2990。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
33. 史蒂文斯RC。 为结构生物学设计高通量蛋白质生产方法。 结构。 2000; 8:R177–185。 doi:10.1016/s0969-2126(00)00193-3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
34 Edwards AM、Arrowsmith CH、Christendat D、Dharamsi A、Friesen JD、Greenblatt JF、Vedadi M.蛋白质生产:给晶体学家和核磁共振波谱学家喂食。 自然结构生物。 2000; 7:970–972. doi:10.1038/80751。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
35 Shih YP,Kung WM,Chen JC,Yeh CH,Wang AH,Wang TF.可溶性重组蛋白的高通量筛选。 蛋白质科学。 2002; 11:1714–1719. doi:10.1110/ps.0205202。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
36 Hammarstrom M、Hellgren N、van Den Berg S、Berglund H、Hard T。快速筛选作为融合蛋白产生的人类小蛋白在大肠杆菌中的溶解度。 蛋白质科学。 2002; 11:313–321. doi:10.1110/ps.22102。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
37 Braun P,Hu Y,Shen B,Halleck A,Koundinya M,Harlow E,LaBaer J.从细菌中提取人类蛋白质的蛋白质组规模纯化。美国国家科学院学报,2002年; 99:2654–2659. doi:10.1073/pnas.042684199。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
38 di Guan C,Li P,Riggs PD,Inouye H.通过与麦芽糖结合蛋白融合促进外源肽在大肠杆菌中表达和纯化的载体。 基因。 1988; 67:21–30. doi:10.1016/0378-1119(88)90004-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
39 Johnson KS,Smith DB。 大肠杆菌中表达的多肽与谷胱甘肽S-转移酶融合物的单步纯化。 基因。 1988; 67:31–40. doi:10.1016/0378-1119(88)90005-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
40 LaVallie ER、DiBlasio EA、Kovacic S、Grant KL、Schendel PF、McCoy JM。一种绕过大肠杆菌细胞质中包涵体形成的硫氧还蛋白基因融合表达系统。 生物技术(NY)1993; 11:187–193. doi:10.1038/nbt0293-187。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
41 Panavas T、Sanders C、Butt TR。SUMO融合技术用于增强原核和真核表达系统中的蛋白质生产。 方法分子生物学。 2009; 497:303–317. doi:10.1007/978-1-59745-566-4-20。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
42 Riley BE、Lougheed JC、Callaway K、Velasquez M、Brecht E、Nguyen L、Shaler T、Walker D、Yang Y、Regnstrom K、Diep L、Zhang Z、Chiou S、Bova M、Artis DR、Yao N、Baker J、Yednock T、Johnston JA。 Parkin E3泛素连接酶的结构和功能揭示了RING和HECT连接酶。 国家公社。 2013; 4个doi:10.1038/ncomms2982。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
43 Waugh DS。去除亲和标记的酶试剂概述。 蛋白质实验纯化2011; 80:283–293. doi:10.1016/j.pep.2011.08.005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
44 Malakhov MP、Mattern MR、Malakhova OA、Drinker M、Weeks SD、Butt TR、SUMO融合和SUMO特异性蛋白酶,用于高效表达和纯化蛋白质。 结构功能基因组学杂志。 2004; 5:75–86. doi:10.1023/B:JSFG.0000029237.70316.52。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
45 Marblestone JG,Edavettal SC,Lim Y,Lim P,Zuo X,Butt TR。SUMO融合技术与传统基因融合系统的比较:SUMO增强表达和溶解度。 蛋白质科学。 2006; 15:182–189. doi:10.1110/ps.051812706。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
46 Moon AF,Mueller GA,Zhong X,Pedersen LC。蛋白质结晶的协同方法:固定臂载体与表面熵降低的结合。 蛋白质科学。 2010; 19:901–913. doi:10.1002/pro.368。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
47 Liu Y,Manna A,Li R,Martin WE,Murphy RC,Cheung AL,Zhang G.金黄色葡萄球菌SarR蛋白的晶体结构。 美国国家科学院院刊2001; 98:6877–6882. doi:10.1073/pnas.121013398。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
48 Ke A,Wolberger C.从MATa1同源域-麦芽糖结合蛋白嵌合体的晶体结构深入了解MATa1/MATalpha2的结合协同性。 蛋白质科学。 2003; 12:306–312. doi:10.1110/ps.0219103。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
49 Kobe B,Center RJ,Kemp BE,Poumbourios P.人T细胞白血病病毒1型gp21胞外结构域结晶为麦芽糖结合蛋白嵌合体的晶体结构揭示了逆转录病毒跨膜蛋白的结构进化。 美国国家科学院院刊1999; 96:4319–4324. doi:10.1073/pnas.96.8.4319。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
50 Kuge M,Fujii Y,Shimizu T,Hirose F,Matsukage A,Hakoshima T。使用融合蛋白获得适合X射线分析的晶体:含有DNA复制相关元件结合因子DNA结合域的GST融合蛋白的结晶。 蛋白质科学。 1997; 6:1783–1786. doi:10.1002/pro.5560060822。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
51 Tang L,Guo B,Javed A,Choi JY,Hiebert S,Lian JB,van Wijnen AJ,Stein JL,Stein GS,Zhou GW.转录因子急性髓性白血病-1/多瘤增强因子结合蛋白2alphaB/核心结合因子α2核基质靶向信号的晶体结构。 生物化学杂志。 1999; 274:33580–33586. doi:10.1074/jbc.274.47.33580。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
52 Zhang Z、Devarajan P、Dorfman AL、Morrow JS。 α-Na,K-ATP酶锚蛋白结合域的结构。 生物化学杂志。 1998; 273:18681–18684. doi:10.1074/jbc.273.30.18681。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
53 Ware S,Donahue JP,Hawiger J,Anderson WF。通过载体蛋白驱动结晶获得的纤维蛋白原γ链整合素结合和因子XIIIa交联位点的结构。 蛋白质科学。 1999; 8:2663–2671. doi:10.1110/ps.8.12.2663。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
54 Stoll VS、Manohar AV、Gillon W、MacFarlane EL、Hynes RC、Pai EF。 VanH的硫氧还蛋白融合蛋白,屎肠球菌的D-乳酸脱氢酶:克隆、表达、纯化、动力学分析和结晶。 蛋白质科学。 1998; 7:1147–1155. doi:10.1002/pro.5560070508。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
55 Corsini L、Hothorn M、Scheffzek K、Sattler M、Stier G.硫氧还蛋白作为载体驱动结晶的融合标签。 蛋白质科学。 2008; 17:2070–2079. doi:10.1110/ps.037564.108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
56 Rosenbaum DM、Cherezov V、Hanson MA、Rasmussen SG、Thian FS、Kobilka TS、Choi HJ、Yao XJ、Weis WI、Stevens RC、Kobilka-BK。GPCR工程为β2肾上腺素能受体功能提供了高分辨率的结构见解。 科学。 2007; 318:1266–1273. doi:10.1126/science.1150609。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
57 Jaakola副总裁,Griffith MT,Hanson MA,Cherezov V,Chien EY,Lane JR,Ijzerman AP,Stevens RC。 与拮抗剂结合的人A2A腺苷受体的2.6埃晶体结构。 科学。 2008; 322:1211–1217. doi:10.1126/science.1164772。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
58 Cherezov V、Rosenbaum DM、Hanson MA、Rasmussen SG、Thian FS、Kobilka TS、Choi HJ、Kuhn P、Weis WI、Kobilca BK、Stevens RC。 工程化人β2肾上腺素能G蛋白偶联受体的高分辨率晶体结构。 科学。 2007; 318:1258–1265. doi:10.1126/science.1150577。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
59 Madej T、Addess KJ、Fong JH、Geer LY、Geer RC、Lanczycki CJ、Liu C、Lu S、Marchler-Bauer A、Panchenko AR、Chen J、Thiessen PA、Wang Y、Zhang D、Bryant SH.MMDB:三维结构和大分子相互作用。 《核酸研究》2012; 40:D461–464。 doi:10.1093/nar/gkr1162。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
60 Lim K、Ho JX、Keeling K、Gilliland GL、Ji X、Ruker F、Carter DC。 日本血吸虫谷胱甘肽S-转移酶的三维结构与来自HIV的gp41的六氨基酸保守中和表位融合。 蛋白质科学。 1994; 3:2233–2244. doi:10.1002/pro.5560031209。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
61 Donahue JP、Patel H、Anderson WF、Hawiger J.通过载体蛋白驱动结晶获得的纤维蛋白原γ链血小板整合素识别片段的三维结构。 美国国家科学院院刊1994; 91:12178–12182. doi:10.1073/pnas.91.25.12178。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
62 詹毅,宋X,周GW.利用GST融合蛋白进行调节蛋白结构域的结构分析。 基因。 2001; 281:1–9. doi:10.1016/s0378-1119(01)00797-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
63. Quiocho FA、Spurlino JC、Rodseth LE。 麦芽糊精转运/化学感受器的高分辨率结构揭示了紧密低聚糖结合的广泛特征。 结构。 1997; 5:997–1015. doi:10.1016/s0969-2126(97)00253-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
64 Spullino JC,Lu GY,Quiocho FA.麦芽糖或麦芽糊精结合蛋白的2.3-A分辨率结构,该蛋白是细菌主动运输和趋化性的主要受体。 生物化学杂志。 1991; 266:5202–5219. doi:10.2210/pdb1mbp/pdb。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
65 Sharff AJ、Rodseth LE、Spurlino JC、Quiocho FA。麦芽糊精结合蛋白参与主动运输和趋化的两个结构域之间的大配体诱导铰链扭曲运动的结晶学证据。 生物化学。 1992; 31:10657–10663. doi:10.1021/bi00159a003。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
66 McTigue MA、Williams DR、Tainer JA。 血吸虫药物和疫苗靶点的晶体结构:来自日本血吸虫的谷胱甘肽S-转移酶及其与主要抗血吸虫药吡喹酮的复合物。 分子生物学杂志。 1995; 246:21–27. doi:10.1006/jmbi.1994.0061。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
67 Katti SK,LeMaster DM,Eklund H.大肠杆菌硫氧还蛋白在1.68A分辨率下的晶体结构。 分子生物学杂志。 1990; 212:167–184. doi:10.1016/0022-2836(90)90313-B。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
68 Jeng MF、Campbell AP、Begley T、Holmgren A、Case DA、Wright PE、Dyson HJ。 氧化和还原大肠杆菌硫氧还蛋白的高分辨率溶液结构。 结构。 1994; 2:853–868. doi:10.1016/s0969-2126(94)00086-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
69 Sheng W,Liao X.酵母泛素样蛋白Smt3的溶液结构:结构上不太明确的序列在蛋白质识别中的作用。 蛋白质科学。 2002; 11:1482–1491. doi:10.1110/ps.0201602。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
70 Mossessova E,Lima CD。Ulp1-SUMO晶体结构和遗传分析揭示了保守的相互作用和酵母细胞生长所必需的调节元件。 分子细胞。 2000; 5:865–876. doi:10.1016/s1097-2765(00)80326-3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
71 Kapust RB,Waugh DS。大肠杆菌麦芽糖结合蛋白在促进融合多肽的溶解度方面非常有效。 蛋白质科学。 1999; 8:1668–1674. doi:10.1110/ps.8.8.1668。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
72 Parker MW,Lo Bello M,Federici G.人胎盘谷胱甘肽S-转移酶的结晶。 分子生物学杂志。 1990; 213:221–222. doi:10.1016/s0022-2836(05)80183-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
73 季霞,张鹏,阿姆斯特朗·RN,吉利兰·GL。mu基因类谷胱甘肽S-转移酶的三维结构。 同工酶3-3和谷胱甘肽二元复合物的结构分析,分辨率为2.2-A。 生物化学。 1992; 31:10169–10184. doi:10.1021/bi00157a004。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
74 Baneyx F.重组蛋白在大肠杆菌中的表达。 Curr Opin生物技术。 1999; 10:411–421. doi:10.1016/s0958-1669(99)00003-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
75 Routzahn KM,Waugh DS。补充亲和标签对MBP融合蛋白溶解度的差异影响。 结构功能基因组学杂志。 2002; 2:83–92. doi:10.1023/a:1020424023207。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
76 Assenberg R、Delmas O、Graham SC、Verma A、Berrow N、Stuart DI、Owens RJ、Bourhy H、Grimes JM。溶血病毒基质(M)蛋白的表达、纯化和结晶。 《水晶学报》。 2008; 传真64:258–262。 doi:10.1107/S1744309108004557。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
77 Liu X,Chen Y,Wu X,Li H,Jiang C,Tian H,Tang L,Wang D,Yu T,Li X.SUMO融合系统促进了生物活性人成纤维细胞生长因子23(FGF23)的可溶性表达和高产量应用微生物生物技术。 2012; 96:103–111. doi:10.1007/s00253-011-3864-4。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
78 Peroutka RJ,Elshourbagy N,Piech T,Butt TR.使用工程SUMO融合物增强哺乳动物细胞中的蛋白质表达:分泌型磷脂酶A2。 蛋白质科学。 2008; 17:1586–1595. doi:10.1110/ps.035576.108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
79 Butt TR、Edavettal SC、Hall JP、Mattern MR、SUMO难表达蛋白融合技术。 《蛋白质实验纯化》,2005年; 43:1–9. doi:10.1016/j.pep.2005.03.016。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
80 Zuo X,Li S,Hall J,Mattern MR,Tran H,Shoo J,Tan R,Weiss SR,Butt TR.在大肠杆菌中通过SUMO融合增强膜蛋白的表达和纯化。 结构功能基因组学杂志。 2005; 6:103–111. doi:10.1007/s10969-005-2664-4。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
81 Zuo X、Mattern MR、Tan R、Li S、Hall J、Sterner DE、Shoo J、Tran H、Lim P、Serafianos S、Kazi L、Navas-Martin Weiss SR、Butt TR。使用SUMO融合表达和纯化SARS冠状病毒蛋白。 蛋白质实验纯化2005; 42:100–110. doi:10.1016/j.pep.2005.02.004。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
82. Liu L,Sprrier J,Butt TR,Strickler JE。使用工程SUMO融合物增强杆状病毒/昆虫细胞系统中的蛋白质表达。 蛋白质实验纯化2008; 62:21–28. doi:10.1016/j.pep.2008.07.010。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
83. Vazquez E、Corchero JL、Villaverde A.生产后蛋白质稳定性:细胞工厂以外的问题。 Microb细胞事实。 2011; 10:60. doi:10.1186/1475-2859-10-60。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
84 Sahdev S、Khattar SK、Saini KS。 通过细菌表达系统生产活性真核蛋白:现有生物技术策略综述。 分子细胞生物化学。 2008; 307:249–264. doi:10.1007/s11010-007-9603-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
85 Nausch H,Huckauf J,Koslowski R,Meyer U,Broer I,Mikschofsky H.在大肠杆菌中重组生产人白细胞介素6。 公共科学图书馆一号。 2013; 8:e54933。 doi:10.1371/journal.pone.0054933。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
86 Kim TW、Chung BH、Chang YK。 重组大肠杆菌补料分批培养法在细胞质中产生可溶性人白细胞介素-6。 生物技术计划。 2005; 21:524–531. doi:10.1021/bp049645j。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
87 Tomczak A、Sontheimer J、Drechsel D、Hausdorf R、Gentzel M、Shevchenko A、Eichler S、Fahmy K、Buchholz F、Pisabarro MT。基于3D轮廓的方法,以蛋白质组为基础发现新型人类趋化因子。 公共科学图书馆一号。 2012; 7:e36151。 doi:10.1371/journal.pone.0036151。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
88 Kirkpatrick RB、Grooms M、Wang F、Fenderson H、Feild J、Pratta MA、Volker C、Scott G、Johanson K。通过无缝SUMO标记和去除细菌产生生物活性犬白细胞介素-1β。 蛋白质实验纯化2006; 50:102–110. doi:10.1016/j.pep.2006.05.022。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
89 Cui X,Han Y,Pan Y,Xu X,Ren W,Zhang S.南非爪蛙(非洲爪蟾)白细胞介素-8(IL-8)的分子克隆、表达和功能分析Dev-Comp Immunol。 2011; 35:1159–1165. doi:10.1016/j.dci.2011.04.005。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
90 朱峰,王强,蒲华,顾S,罗力,尹Z。利用SUMO融合伙伴优化大肠杆菌中可溶性人干扰素-γ的产生。 世界微生物生物技术杂志。 2013; 29:319–325. doi:10.1007/s11274-012-1185-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
91 Hoffmann A、Muller MQ、Gloser M、Sinz A、Rudolph R、Pfeifer S.通过SUMO融合系统重组生产具有生物活性的人TNF-α-摇瓶培养高产率。 蛋白质实验纯化2010; 72:238–243. doi:10.1016/j.pep.2010.03.022。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
92. Nibbs RJ、Salcedo TW、Campbell JD、Yao XT、Li Y、Nardelli B、Olsen HS、Morris TS、Proudfot AE、Patel VP、Graham GJ。 β-趋化因子巨噬细胞炎性蛋白4对C-C趋化因子受体3的拮抗作用,氨基末端丙氨酸-甲硫氨酸交换强烈增强了这一特性。 免疫学杂志。 2000; 164:1488–1497. doi:10.4049/jimmunol.164.3.1488。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
93 Proudfoot AE、Buser R、Borlat F、Alouani S、Soler D、Offord RE、Schroder JM、Power CA、Wells TN。氨基末端修饰的RANTES类似物对RANTES受体表现出不同的作用。 生物化学杂志。 1999; 274:32478–32485. doi:10.1074/jbc.274.45.32478。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
94 Lu Q、Burns MC、McDevitt PJ、Graham TL、Sukman AJ、Fornwald JA、Tang X、Gallagher KT、Hunsberger GE、Foley JJ、Schmidt DB、Kerrigan JJ、Lewis TS、Ames RS、Johanson KO。 生产生物活性趋化因子的优化程序。 2009年《Prot Exp Purif.》; 65:251–260. doi:10.1016/j.pep.2009.017.17。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
95 Ganz T.防御素和其他抗菌肽:历史观点和更新。 梳状化学高通量屏幕。 2005; 8:209–217. doi:10.2174/11386207053764594。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
96 Daher KA,Lehrer RI,Ganz T,Kronenberg M.人防御素cDNA克隆的分离和表征。 美国国家科学院院刊1988; 85:7327–7331. doi:10.1073/pnas.85.19.7327。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
97 Tongaonkar P、Golji AE、Tran P、Ouellette AJ、Selsted ME。中性粒细胞弹性蛋白酶和蛋白酶对人类α-defensin HNP1前体的高保真加工和激活3。 公共科学图书馆一号。 2012; 7:e32469。 doi:10.1371/journal.pone.0032469。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
98 Li X,Leong党卫军。 一种以色谱仪为中心的生物过程,用于消除新抗菌肽候选生物活性生产中的可溶性聚集。 《色谱杂志》2011; 1218:3654–3659. doi:10.1016/j.chroma.2011.04.017。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
99 Li Y.大肠杆菌中抗菌肽的重组生产:综述。 蛋白质实验纯化2011; 80:260–267. doi:10.1016/j.ep.2011.08.001。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
100. 陈YQ,张仕卿,李伯承,邱伟,焦波,张杰,刁梓。 使用两个融合伙伴在大肠杆菌中表达细胞毒性阳离子抗菌肽。 蛋白质实验纯化2008; 57:303–311. doi:10.1016/j.pep.2007.09.012。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
101 Si LG、Liu XC、Lu YY、Wang GY、Li WM。 活性人β-防御素-3在大肠杆菌中的可溶性表达及其对宿主细胞生长的影响。 中国医学杂志(英文)2007; 120:708–713. [ 公共医学 ] [ 谷歌学者 ] -
102 Skosyrev VS、Kulesskiy EA、Yakhnin AV、Temirov YV、Vinokurov LM。 重组抗菌肽肉毒素IA在大肠杆菌细胞中的表达。 蛋白质实验纯化。2003; 28:350–356. doi:10.1016/s1046-5928(02)00697-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
103 Tay DK、Rajagopalan G、Li X、Chen Y、Lua LH、Leong SS。 一种新型抗菌肽的新生物生产路线。 生物技术生物工程。 2011; 108:572–581. doi:10.1002/bit.22970。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
104 Li JF,Zhang J,ZhangZ,Ma HW,Zhang-JX,ZhangsQ。利用SUMO融合伙伴在大肠杆菌中生产具有生物活性的人β-防御素-4。 蛋白质杂志2010; 29:314–319. doi:10.1007/s10930-010-9254-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
105 Durr UH,Sudheendra US,Ramamoorthy A.LL-37,抗菌肽cathelicidin家族唯一的人类成员。 Biochim生物物理学报。 2006; 1758:1408–1425. doi:10.1016/j.bbamem.2006.03.030。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
106 Bommarius B、Jenssen H、Elliott M、Kindrachuk J、Pasupuleti M、Gieren H、Jaeger KE、Hancock RE、Kalman D.抗菌肽和宿主防御肽在大肠杆菌中的高效表达和纯化。 肽。 2010; 31:1957–1965. doi:10.1016/j.peptides.2010.08.008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
107 Li JF,Zhang J,Song R,ZhangJX,Shen Y,Zhang-SQ。使用SUMO融合伙伴在大肠杆菌中生产细胞毒性阳离子抗菌肽。 应用微生物生物技术。 2009; 84:383–388. doi:10.1007/s00253-009-2109-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
108 Souza IA、Cino EA、Choy WY、Cordeiro MN、Richardson M、Chavez-Olortegui C、Gomez MV、Prado MA、Pradi VF。 钙通道中活性重组Phoneutria毒素的表达。 有毒。 2012; 60:907–918. doi:10.1016/j.toxicon.2012.05.026。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
109 Cao P,Yu J,Lu W,Cai X,Wang Z,Gu Z,Zhang J,Ye T,Wang M。通过小的泛素相关修饰物融合在大肠杆菌中表达和纯化马氏中蟾蜍毒液中的抗肿瘤镇痛肽。 生物技术计划。 2010; 26:1240–1244. doi:10.1002/btpr.433。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
110 Chong S、Mersha FB、Comb DG、Scott ME、Landry D、Vence LM、Perler FB、Benner J、Kucera RB、Hirvonen CA、Pelletier JJ、Paulus H、Xu MQ。使用来自蛋白质剪接元件的自裂解亲和标记单柱纯化游离重组蛋白质。 基因。 1997; 192:277–281. doi:10.1016/s0378-1119(97)00105-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
111 Chong S,Montello GE,Zhang A,Cantor EJ,Liao W,Xu M-Q,Benner J.利用蛋白质剪接元件的C末端裂解活性在单一色谱步骤中纯化重组蛋白。 1998年《核酸研究》; 26:5109–5115. doi:10.1093/nar/26.22.5109。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
112 Morassutti C,De Amicis F,Bandiera A,Marchetti S.通过内含物介导系统在细菌细胞中表达SMAP-29 cathelicidin-like肽。 蛋白质实验纯化2005; 39:160–168. doi:10.1016/j.pep.2004.11.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
113 Morassutti C,De Amicis F,Skerlavaj B,Zanetti M,Marchetti S.使用改良的VMA内含子表达系统在转基因植物中生产重组抗菌肽。 FEBS信函。 2002; 519:141–146. doi:10.1016/s0014-5793(02)02741-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
114. 王浩、孟XL、徐JP、王杰、马CW。 在大肠杆菌中使用内含物诱导的自裂解系统从小菜蛾pxCECA1中生产、纯化和表征天蚕素。 应用微生物生物技术。 2012; 94:1031–1039. doi:10.1007/s00253-011-3863-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
115 Wu WY、Miller KD、Coolbaugh M、Wood DW。 肠内蛋白介导的一步纯化大肠杆菌分泌的人抗体片段。 蛋白质实验纯化2011; 76:221–228. doi:10.1016/j.pep.2010.12.004。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
116 Reulen SW,van Baal I,Raats JM,Merkx M.使用带有C末端硫酯的单域抗体高效、化学选择性地合成免疫胶束。 BMC生物技术。 2009; 9:66. doi:10.1186/1472-6750-9-66。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
117 Kim AR,Doherty-Kirby A,Lajoie G,Rylett RJ,Shilton BH.两种大规模纯化重组人胆碱乙酰转移酶的方法。 蛋白质实验纯化2005; 40:107–117. doi:10.1016/j.pep.2004.12.011。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
118 Vitali F,Henning A,Oberstrass FC,Hargous Y,Auweter SD,Erat M,Allain FH-T。使用分段同位素标记PTB的两个最C末端RNA识别基序的结构。 EMBO J.2006; 25:150–162. doi:10.1038/sj.emboj.7600911。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
119 Melandri F,Grenier L,Plamondon L,Huskey WP,Stein RL。泛素醛抑制异肽酶T的动力学研究。 生物化学。 1996; 35:12893–12900. doi:10.1021/bi9612935。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
120 Borodovsky A、Kessler BM、Casagrande R、Overkleeft HS、Wilkinson KD、Ploegh HL。 一种新的针对氘基化酶的活性位点定向探针揭示了USP14的蛋白酶体关联。 EMBO J.2001; 20:5187–5196. doi:10.1093/emboj/20.18.5187。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
121 Borodovsky A、Ovaa H、Kolli N、Gan Erdene T、Wilkinson KD、Ploegh HL、Kessler BM。基于化学的功能蛋白质组学揭示了去泛素酶家族的新成员。 化学生物。 2002; 9:1149–1159. doi:10.1016/s1074-5521(02)00248-x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
122 Hemelaar J、Galardy PJ、Borodovsky A、Kessler BM、Ploegh HL、Ovaa H。基于化学的功能蛋白质组学:泛素和泛素样特异性蛋白酶的基于机制的活性分析工具。 蛋白质组研究杂志2003; 3:268–276. doi:10.1021/pr0341080。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
123 Hemelaar J、Galardy PJ、Borodovsky A、Kessler BM、Ploegh HL、Ovaa H。基于化学的功能蛋白质组学:泛素和泛素样特异性蛋白酶的基于机制的活性分析工具。 蛋白质组研究杂志2004; 3:268–276. doi:10.1021/pr0341080。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
124 Dang LC,Melandri FD,Stein RL。泛素C末端7-氨基-4-甲基香豆素在氘化酶作用下水解的动力学和机理研究。 生物化学。 1998; 37:1868–1879. doi:10.1021/bi9723360。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
125 Hassiepen U、Eidhoff U、Meder G、Bulber JF、Hein A、Bodendorf U、Lorthiois E、Martoglio B。一种以泛素-罗丹明-10-甘氨酸为底物的去泛素化蛋白酶的灵敏荧光强度测定法。 分析生物化学。 2007; 371:201–207. doi:10.1016/j.ab.2007.07.034。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
126 Orcutt SJ,Wu J,Eddins MJ,Leach CA,Strickler JE。用于选择性和敏感检测Ub/Ubl蛋白酶的生物发光分析平台。 Biochim生物物理学报。 2012; 1823:2079–2086. doi:10.1016/j.bbamcr.2012.06.004。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
127 Humphries HE,Christodoulides M,Heckels JE。脑膜炎奈瑟菌第1类外膜蛋白在大肠杆菌中的表达和使用自裂亲和标签的纯化。 蛋白质实验纯化2002; 26:243–248. doi:10.1016/s1046-5928(02)00534-x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
128 Banki MR,Wood DW公司。 肠肽和亲和树脂替代蛋白质纯化和放大。 Microb细胞事实。 2005; 4:32. doi:10.1186/1475-2859-4-32。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
129 Banki MR、Feng L、Wood DW。 使用自切割弹性蛋白样多肽标签进行简单的生物分离。 自然方法。 2005; 2:659–661. doi:10.1038/nmeth787。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
130 Fong BA、Gillies AR、Ghazi I、LeRoy G、Lee KC、Westblade LF、Wood DW。 使用自裂弹性蛋白样多肽标签纯化大肠杆菌RNA聚合酶。 蛋白质科学。 2010; 19:1243–1252. doi:10.1002/pro.403。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
131 Fong BA、Wu WY、Wood DW。 通过盐替代优化ELP内含子介导的蛋白质纯化。 蛋白质实验纯化2009; 66:198–202. doi:10.1016/j.pep.2009.03.009。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
132 Wu WY、Mee C、Califano F、Banki MR、Wood DW。 自裂聚集标签纯化重组蛋白。 国家协议。 2006; 1:2257–2262. doi:10.1038/nprot.2006.314。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
133 Banki MR、Gengross TU、Wood DW。 新型且经济的重组蛋白纯化:利用体内多羟基丁酸酯(PHB)基质结合进行内含物介导的蛋白纯化。 蛋白质科学。 2005; 14:1387–1395. doi:10.1110/ps.041296305。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
134 Gillies AR、Mahmoud RB、Wood DW。 PHB-内含物介导的蛋白质纯化策略。 方法分子生物学。 2009; 498:173–183. doi:10.1007/978-1-59745-196-3_12。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
135 王Z,吴浩,陈杰,张杰,姚毅,陈国强。 一种用于纯化基于疏水性聚羟基脂肪酸纳米粒子的重组蛋白的新型自分裂相蛋白标签。 实验室芯片。 2008; 8:1957–1962. doi:10.1039/b807762b。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
136 Barnard GC、McCool JD、Wood DW、Gerngross TU。基于嗜酸Ralstonia eutropha的整合重组蛋白表达和纯化平台。 应用环境微生物。 2005; 71:5735–5742. doi:10.1128/AEM.71.10.5735-5742.2005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
137 Wang Z,Li N,Wang Y,Wu Y,Mu T,Zheng Y,Huang L,Fang X.泛素内含子和SUMO2-内含子融合系统,用于增强蛋白质的生产和纯化。 蛋白质实验纯化2012; 82:174–178. doi:10.1016/j.pep.2011.11.017。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
138 Shen A、Lupardus PJ、Morell M、Ponder EL、Sadaghiani AM、Garcia KC、Bogyo M。简化,使用可诱导的自动处理酶标签增强蛋白质纯化。 公共科学图书馆一号。 2009; 4:e8119。 doi:10.1371/journal.pone.0008119。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
139 Mao H.一种用于一步纯化游离重组蛋白的自裂解分选酶融合物。 蛋白质实验纯化2004; 37:253–263. doi:10.1016/j.pep.2004.06.013。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
140 Ruan B,Fisher KE,Alexander PA,Doroshko V,Bryan PN。将枯草杆菌素工程成一种氟触发的加工蛋白酶,用于一步蛋白质纯化。 生物化学。 2004; 43:14539–14546. doi:10.1021/bi048177j。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
141. Capon DJ、Chamow SM、Mordenti J、Marster SA、Gregory T、Mitsuya H、Byrn RA、Lucas C、Wurm FM、Groopman JE、Broder S、Smith DH。 设计用于艾滋病治疗的CD4免疫粘附素。 自然。 1989; 337:525–531. doi:10.1038/337525a0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
142 Strohl WR,Knight DM。生物制药的发现和发展:当前问题。 Curr Opin生物技术。 2009; 20:668–672. doi:10.1016/j.copbio.2009.10.012。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
143 Czajkowsky DM,Hu J,Shao Z,Pleass RJ.Fc-融合蛋白:新进展和未来展望。 EMBO Mol Med.2012; 4:1015–1028. doi:10.1002/emmm.201201379。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
144 鲁珀宁DC,Akilesh S.FcRn:新生儿Fc受体成熟。 Nat Rev免疫学。 2007; 7:715–725. doi:10.1038/nri2155。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
145 Huang C.受体-Fc融合疗法、陷阱和MIMETIBODY技术。 Curr Opin生物技术。 2009; 20:692–699. doi:10.1016/j.copbio.2009.10.010。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
146 Jazayeri JA、Carroll GJ。 基于Fc的细胞因子:工程化高级治疗的前景。 生物药物。 2008; 22:11–26. doi:10.2165/00063030-200822010-00002。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
147 Beck A,Reichert JM。治疗性Fc融合蛋白和肽作为抗体的成功替代品。 MAbs公司。 2011; 3:415–416. doi:10.4161/mabs.3.5.17334。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
148 Nimmerjahn F,Ravetch合资公司。 Fcgamma受体作为免疫反应的调节器。 Nat Rev免疫学。 2008; 8:34–47. doi:10.1038/nri2206。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
149 Carter PJ公司。 介绍当前和未来的蛋白质疗法:蛋白质工程的观点。 实验细胞研究2011; 317:1261–1269. doi:10.1016/j.yexcr.2011.02.013。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
150. 熊S,樊J,Kitazato K。抗病毒蛋白氰卵磷脂-N的生产和应用现状。 应用微生物生物技术。 2010; 86:805–812. doi:10.1007/s00253-010-2470-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]


