滤泡性淋巴瘤(FL)和弥漫性大B细胞淋巴瘤(DLBCL)的GCB亚型来源于生发中心B细胞 1 有针对性的重新测序研究揭示了NFkB途径中各种基因的突变 2 , 三 有助于激活B细胞(ABC)DLBCL亚型,但迄今为止,很少发现GCB特异性突变 4 在这里,我们报告了影响多梳组癌基因的复发性体细胞突变 6 EZH2型 ,编码负责三甲基化H3K27的组蛋白甲基转移酶。 最近在几种癌症类型中发现组蛋白H3K27me3去甲基化酶UTX突变 5 , EZH2型 是受癌症突变影响的第二种组蛋白甲基转移酶。 这些突变取代EZH2蛋白(Y641)SET结构域中的单个酪氨酸,发生在21.7%的GCB DLBCL、7.2%的FL中,并且在ABC DLBCL中不存在。 我们的数据与带有突变Y641的EZH2蛋白降低酶活性的概念一致 在体外 .
DNA测序技术的进展最近使基因组和转录组的特征能够以足够的分辨率识别体细胞点突变 7 – 9 为了对可能导致B细胞非霍奇金淋巴瘤(NHL)的新突变有新的认识,我们使用Illumina技术对从FL患者的恶性淋巴结活检中纯化的基因组DNA和RNA进行测序(“FL样本a”)(方法)。 FL患者A经免疫组化鉴定为1级FL,共表达CD10、BCL2和BCL6。 选择这个样本进行序列分析是因为它的核型异常简单( 补充图1 ),缺少t(14;18)(q32;q21),以及其他大规模蚀变( 补充图2-5 ; 补充表1和2 ). 我们分析了该肿瘤的外显子序列,以确定基因组(WGSS)和转录组(WTSS)的突变( 表1 和方法)。 对FL患者的匹配组成DNA进行测序,以揭示“种系”序列变异(方法)。 我们从肿瘤基因组文库中产生了25.6个对齐的千兆位酶(Gb),平均产生9.47倍的冗余碱基覆盖率,从WTSS文库中又产生了2.2 Gb的对齐序列,外显子内平均产生18.86倍的冗余碱覆盖率( 表1 ; 方法)。 我们重点分析了预测会影响蛋白质编码序列的新变化(方法)。 在这些变体中( 补充表3 ),我们发现了一个影响 EZH2型 该基因编码EZH2 SET结构域的一部分。 EZH2是PRC2复合物的催化成分,负责向组蛋白3(H3K27)的赖氨酸27中添加甲基 10 从而抑制与含有三甲基H3K27的组蛋白相关的位点的转录。 我们通过确认该突变存在于肿瘤DNA中,而不存在于构成性非肿瘤DNA中(方法),确定该突变在本质上是体细胞突变,预计将用组氨酸取代Y641。 我们还确认了该患者样本中的突变是杂合的。
表1。
库描述 原始读取(对) 映射的读取 总序列覆盖率(bp) 外显子平均覆盖深度
FL样本A,匹配生殖系基因组DNA 93,473,829 163,216,278 7,986,844,356 2.80
FL样本A,肿瘤WTSS 51,729,560 63,262,348 2,277,444,528 18.9
FL样本A,肿瘤基因组DNA 351, 666, 782 563,762,488 27,024,661,976 9.47
要确定 EZH2型 在DLBCL样本的突变状态下,我们接下来使用WTSS对31例DLBCL患者样本和7个DLBCL细胞系的转录本进行测序。 基于来源细胞(COO)表达分类 11 原发性淋巴瘤标本分为ABC(n=12)、GCB(n=15)和不可分亚型(n=2)(方法; 补充表4 ). 覆盖范围 EZH2型 WTSS数据库中的数据一直很高,患者样本中的数据覆盖率从5.3倍到187倍不等(中位数为48.7倍)。 密码子641的覆盖范围从5倍到295倍不等(中位数为46.5倍; 补充表4 ). 我们在这31个患者样本中的4个和4个细胞系中发现了Y641突变( 表2 ). 没有其他突变 EZH2型 检测到所有突变均为杂合子。 这些突变的惊人复发表明,Y641的突变 EZH2型 是淋巴瘤的常见特征。 值得注意的是,尽管UTX基因座的平均碱基覆盖深度是11.4倍,但我们在这些文库中没有发现UTX突变的证据。
表2。 所有突变的位置和影响 EZH2型 由WTSS确定的FL和DLBCL
样本ID 样本类型或细胞系名称 年龄 性别 t(14;18) 基因组位置 突变 * 效果
HS0804标准 FL(样品A) 44 F类 不 电话:7:148139661 T->C Y->H
HS0639型 DLBCL(DLBCL) 60 M(M) 是的 电话:7:148139661 T->C Y->小时
HS0648型 DLBCL(DLBCL) 92 F类 不 电话:7:148139661 T->A型 是->否
第0640页 DLBCL(DLBCL) 68 F类 是的 chr7:148139660 A->C Y->S
HS0942型 DLBCL基因 73 M(M) 是的 电话:7:148139661 T->A型 是->否
HS0798型 数据库 45 M(M) 是的 电话:7:148139661 T->A型 是->否
HS0841型 KARPAS卡帕斯422 73 F类 是的 电话:7:148139661 T->A型 是->否
HS0900型 SU-DHL-6型 43 M(M) 是的 电话:7:148139661 T->A型 是->否
HS0901型 WSU-DLCL2型 41 M(M) 是的 表7:148139660 A->T Y->F
HS1163型 OCI-LY1型 不适用 不适用 是的 电话:7:148139661 T->A 是->否
我们通过Sanger测序251例FL样本中包含该密码子的外显子,确定了FL和DLBCL肿瘤中Y641突变的流行率,其中30例与组织学转化时采集的DLBCL样本相匹配,320例原始DLBCL样品(包括最初的31例患者样本)( 补充表5 ). 这表明共有18个FL和35个DLBCL样本具有杂合Y641突变。 值得注意的是,WTSS检测到的所有Y641突变都证明了这两个等位基因的表达( 补充表4 ). 为了寻找该基因中的其他突变位点,我们还对该基因的所有外显子进行了测序 EZH2型 在24名FL患者中(除了FL患者A),仅发现一例 EZH2型 突变不影响Y641( 图1 ; 补充表5 ). 这种影响N635的突变与Y641突变一起被发现,我们证实这两种突变都是顺式的。 我们确认,这些突变是在7个FL(包括“样本A”)和2个DLBCL患者中的体细胞突变,这些患者的生殖系DNA是可用的。
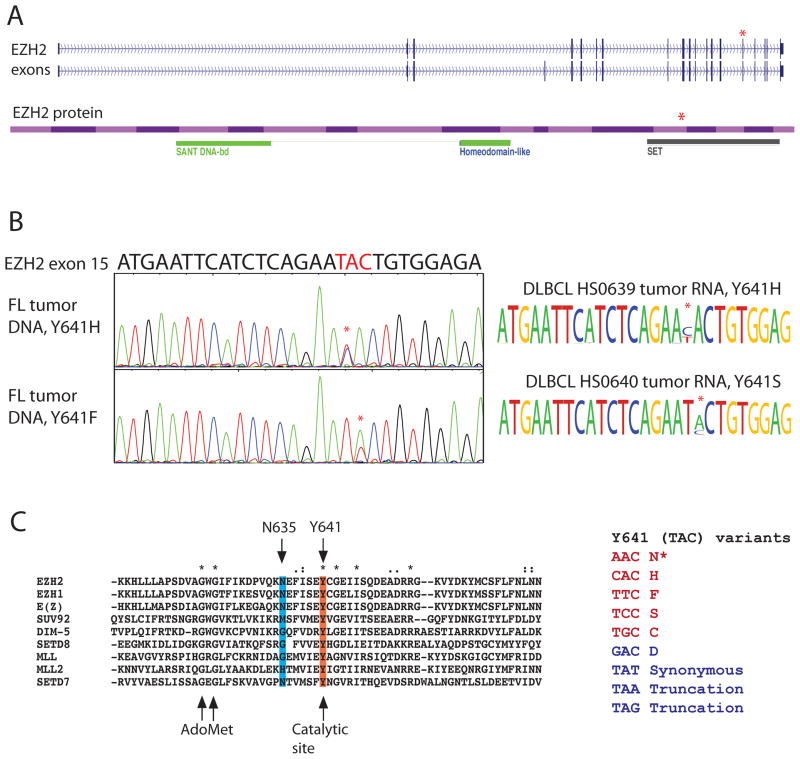
图1。 Y641的复发突变 EZH2型 .
(A) EZH2基因座的基因组组织、可选外显子和蛋白质结构域。 影响Y641基因第15外显子突变的位置 EZH2型 基因和蛋白质用红色星号表示。 (B) 测序结果图解。 毛细血管测序(左)或Illumina WTSS(右)检测到不同淋巴瘤样本中密码子641的五种不同突变和氨基酸替换中的三种。 (C) 多重对齐 EZH2型 、EZH1(其paralog)、 果蝇 正交曲线 E(Z) 和其他六种人类SET结构域蛋白证明了SET结构区的谱内和谱间序列保守性。 ClustalX报告的保护代码如上所示 24 EZH2型 影响保守的SET结构域(橙色)催化位点中的关键酪氨酸 果蝇 正交曲线 E(Z) 。除了一个例外,所有 EZH2型 FL和DLBCL的突变改变了这种氨基酸。 唯一的例外是一个双突变体(FL),第二个体细胞突变影响N635(蓝色)。 所有突变体包含该密码子的8个可能的非同义变体中的5个(右下角,红色)。 值得注意的是,观察到的五种氨基酸变化的频率不同。 我们检测到Y641F(49%)略微富集,其次是Y641S(21%)、Y641N(15%)和Y641H(13%),只有一个Y641C(2%)的例子( 补充表5 ). 在未观察到的变异体(D,蓝色)中,两个变异体将导致截短的蛋白质,而第三个则会引入天冬氨酸残基。 这些变化的模式和性质(A->G,A->T,T->G,T->A)向我们表明,这些突变不太可能是由AID诱导的该位点的体细胞过度突变引起的 25 .
为了排除这种突变也可能发生在非恶性生发中心B细胞或其他类型淋巴瘤中的可能性,我们对8个CD77的外显子15的这一区域进行了测序 + -使用Sanger测序和靶向超深Illumina重新测序,从反应性扁桃体和23个反应性淋巴结(正常B细胞的来源)以及80个其他淋巴瘤类型的样本中富集成中心细胞样本(方法; 补充图6 ; 补充表6 ). 我们还对从另外两个正常成中心细胞样本生成的WTSS库进行了测序( 补充表4 ). 与我们的假设相一致的是,Y641突变是恶性B细胞特有的,这些样本中没有一个显示出Y641或测序区域内其他地方发生突变的证据( 表3 ). 值得注意的是,所有具有已知COO的DLBCL样本也为阳性 EZH2型 突变属于GCB亚型而非ABC亚型。 这揭示了DLBCL的GCB亚型中Y641突变的显著富集( 表3 ; n=18/83 GCB vs 0/42 ABC,P=0.00168,双尾Fisher精确检验)。
表3。
样品类型 #分析的样品数量 #样品数量 EZH2型 Y641突变 Y641突变的流行率
佛罗里达州
1级 133 10 7.5%
2级 60 4 6.7%
3级 28 2 7.1%
总飞行高度层 221 16 7.2%
FL和DLBCL对 *
佛罗里达州 30 2 6.7%
DLBCL(DLBCL) 30 4 13.3%
总FL-衍生 60 6 10.0%
DLBCL(DLBCL)
GCB公司 83 18 21.7%
PMBCL公司 24 1 4.2%
基础知识 42 0 0%
U型 25 0 0%
非GCB 22 0 0%
无法使用的 § 124 12 9.7%
主DLBCL合计 320 31 9.7%
MCL公司 25 0 0%
SLL公司 30 0 0%
PTCL公司 25 0 0%
细胞系
GCB细胞系 ¥ 7 5 71.4%
ABC细胞系 ¥¥ 2 0 0%
温和的
反应性淋巴结 23 0 0%
纯化CD77 + 成中心细胞 ¶ 8 0 0%
主要NHL样品总数 681 53 7.8%
细胞系总数 9 5 55.5%
完全良性 31 0 0%
接下来,我们通过生成计算模型来评估各种Y641突变对EZH2 SET结构域的结构和潜在功能的影响( 补充图7 )使用高度保守的MLL1 SET结构域的晶体结构 12 作为结构模板(方法)。 我们的模型表明,Y641与H3组蛋白尾部的赖氨酸27侧链相互作用,正如其他SET结构域蛋白所建议的那样 13 虽然没有 EZH2型 SET结构域突变已在人类中报道,详细的突变表型已在 果蝇 .一种突变将酪氨酸同源性改变为 EZH2型 Y641的特征在于 果蝇 正交曲线 E(z) 在名为“E(z)”的等位基因中 1 ”. 果蝇 E(z) 1 突变蛋白被发现不能三甲基化H3K27 在体外 14 .
我们试图在无细胞甲基化试验中直接确定Y641突变的EZH2是否影响PRC2的催化活性。 单个克隆,每个克隆包含四种最常检测到的突变之一( 图1 ),与PRC2的其他成分一起首次表达。 纯化并测试PRC2复合物 在体外 使用ELISA和H3K27me3特异性抗体检测H3K27三甲基化活性(方法)。 结果( 图2 )表明,与野生型EZH2相比,所有四个Y641突变体在H3K27肽的三甲基化能力方面持续表现出显著降低(约7倍)。 这一生化结果表明,在我们的测序研究中观察到的四种主要Y641变体可能导致PRC2复合物对三甲基H3K27的能力降低 体内 .
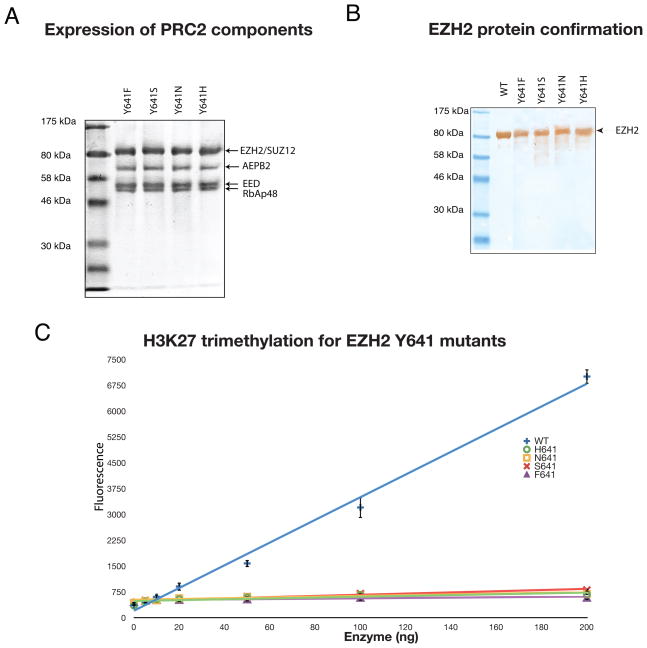
图2。 In-vitro公司 突变型和野生型PRC2的组装和功能分析 EZH2型 .
(A) 野生型EZH2和四个Y641突变体中的每一个与野生型AEPB2、EED、SUZ12和RbAp48一起使用杆状病毒表达系统在SF9细胞中共同表达(方法)。 这五种蛋白质结合在一起形成酶活性PRC2复合物 在体外 SF9细胞纯化的复合物显示了这些蛋白中的每一种的强表达,并证实了它们与PRC2的结合和组装。 (B) Western blot证实了四个突变结构中每个结构的EZH2蛋白的表达。 (C) 然后使用生物素化组蛋白H3(21-44)肽和S-腺苷蛋氨酸(在检测缓冲液中)对纯化的复合物进行检测,以检测酶活性。 甲基化组蛋白H3是使用一种高度特异的抗体来测量的,该抗体只识别组蛋白H4的三甲基化K27残基(方法)。 用时间分辨荧光(620nm)检测二级抗体,并用铕标记。 以不同的纯化PRC2量(0至200ng)测试每个突变株(和野生型EZH2)的PRC2甲基化酶活性。 计算出H、N、S和F突变体的四个突变体的比活性分别为0.001、0.0012、0.0011和0.0009 pmol/min/ug(平均值=0.00105)。 野生型酶(蓝色)的比活性为0.0071(约为6.8倍)。 误差条反映了三次测量的标准偏差。
其他报告表明 EZH2型 mRNA与组织中癌症进展相关 EZH2型 表达通常较低或检测不到,如乳腺和前列腺 6 , 15 然而, EZH2型 mRNA在正常生发中心B细胞中丰富 16 ,以及有条件地击倒小鼠 EZH2型 正交分析表明,SET结构域是B细胞早期发育所必需的,包括免疫球蛋白重链的重排( IGH公司 )轨迹 17 .鉴于以下明显要求 EZH2型 在生发中心B细胞中 EZH2型 与明显直接增加的 EZH2型 乳腺mRNA丰度观察 6 和前列腺 15 癌症。 两者的表达 EZH2型 和 BMI1公司 (PRC1的催化成分)与B细胞NHL的恶性程度有关,这两种蛋白数量平衡的紊乱被认为是淋巴腺病的早期事件 18 然而 EZH2型 迄今为止,还没有发现与B细胞恶性肿瘤或任何其他癌症有关。
虽然其生物学机制尚不清楚,但我们的发现表明 EZH2型 Y641突变,可能是H3K27三甲基化减少,在GCB淋巴瘤的发病机制中起作用。 经过仔细研究的苯丙氨酸/酪氨酸开关 19 已知该位点可以调节SET结构域蛋白可以添加的甲基数目,而不会影响其整体催化活性。 虽然Y641残基与苯丙氨酸/酪氨酸开关位点不同,但我们体外实验的结果并不排除这些突变可能改变EZH2的产物(或靶点)特异性的可能性。 鉴于最近的研究表明,与正常B细胞相比,淋巴瘤PRC2靶点的DNA甲基化增强,我们的发现尤其及时 20 , 21 .H3K27通过PRC2的三甲基化可能是DNA甲基化的前体,在某些情况下,DNA甲基转移酶可能与PRC2物理偶联 22 因此,Y641突变可能导致在FL多梳靶点观察到的差异DNA甲基化 20 和DLBCL 21 .
总之,我们确定了影响 EZH2型 SET结构域,并将其与仅GCB亚型的FL和DLBCL病例相关联。 我们的数据表明 EZH2型 SET结构域是t(14;18)(q32;q21)后GCB恶性肿瘤中最常见的遗传事件之一。 突变的酪氨酸对应于EZH2蛋白活性位点中的一个关键残基,与果蝇类似突变的功能研究一致 E(z) 同源物,我们发现含有突变EZH2蛋白的PRC2复合物表现出降低的H3K27三甲基化活性 在体外 我们已经证明,所有Y641突变的样本中都存在EZH2的野生型拷贝,并且通过转录组测序检测到突变样本中这两个等位基因的表达。 这一点,再加上所有发生突变的淋巴瘤 EZH2型 似乎有影响Y641的突变 EZH2型 除了UTX的突变失活模式外,UTX似乎表现为肿瘤抑制基因 5 .除了复发失活突变外 UTX公司 EZH2是唯一一个影响H3K27甲基化状态的蛋白,被确定为癌症体细胞突变的靶点,也是第一个SET结构域的复发突变似乎仅限于特定淋巴瘤亚型的蛋白。
方法 样品采集 使用了来自初始患者(FL患者A)的两个样本。 根据流式细胞术检测到的CD19和lambda的共同表达,两者的肿瘤含量约为70%,均为“新鲜”冷冻源。 第一个是在诊断时拍摄的,用于WTSS和WGSS。 第二个是在进展时获得的,经过流式分选,纯度>95%。 通过核型和荧光分析 就地 使用双色双融合探针进行杂交(FISH),以检测是否存在易位t(14;18)。 通过阵列比较杂交(aCGH)和指纹图谱分析拷贝数变化 26 Affymetrix 500K阵列的杂合性丢失(LOH)。 WTSS分析的所有DLBCL样本均为新鲜冷冻活组织,流式细胞术检测肿瘤含量>50%。 本研究中使用的所有其他标本均在诊断时获得,取自存档的新鲜冷冻组织或冷冻肿瘤细胞悬液。 使用Miltenyi磁珠(德国Bergisch-Gladbach,Miltenyi-Biotec)从活患者的外周血和CD19-阴性分类的肿瘤细胞悬液中为已故患者获取生殖系DNA。 所有淋巴瘤样本均由血液病理学家(R.D.G.)根据2008年世界卫生组织标准进行诊断。 良性标本包括反应性儿童扁桃体或使用Miltenyi珠从反应性扁桃体中分离出的纯化CD77阳性中心粒细胞(Miltenyi-Biotec,Bergisch-Gladbach,德国)。 这些肿瘤标本是作为不列颠哥伦比亚大学-英国哥伦比亚癌症机构研究伦理委员会(BCCA REB)批准的研究项目的一部分收集的,符合赫尔辛基宣言。 使用WTSS或WGSS分析样本的所有患者均获得知情同意。 我们的协议规定,这些数据不会发布到公共领域,但可以通过分层访问机制提供给机构的指定调查员,这些调查员通过材料转让协议同意遵守BCCA REB要求的相同道德和隐私原则。
Illumina文库的制备和测序 使用AllPrep DNA/RNA Mini Kit(美国加利福尼亚州巴伦西亚的齐亚根)和DNaseI处理从总淋巴结切片中提取RNA。 对于全转录组鸟枪测序(WTSS/RNA-seq)分析,我们使用了一种类似于我们之前描述的方案的改进方法 7 简单地说,PolyA + 按照制造商的说明,使用MACS mRNA分离试剂盒(Miltenyi Biotec,Bergisch Gladbach,德国)从5–10ug DNaseI处理的总RNA中纯化RNA。 从纯化的polyA合成双标记cDNA + RNA,使用Superscript双链cDNA合成试剂盒(Invitrogen,Carlsbad,CA,USA)和浓度为5μM的随机六聚体引物(Invitrogen)。 该cDNA通过超声波破碎,并按照Illumina配对文库制备协议(Illuminia,Hayward,CA,USA)制备配对文库。
用于构建全基因组鸟枪测序(WGSS)文库的基因组DNA是使用Qiagen AllPrep DNA/RNA Mini Kit(美国加利福尼亚州巴伦西亚市Qiangen)从相同的活检材料中制备的。 在构建文库之前,通过分光光度法(260/280和260/230)和凝胶电泳评估DNA质量。 使用功率设置为“7”的Sonic Dismembrator 550,以30秒的脉冲间隔冷却30秒(加拿大安大略省渥太华市Fisher Scientific公司的Cup Horn),将DNA剪切10分钟,并在8%的PAGE凝胶上进行分析。 将200-300bp的DNA部分从凝胶切片中分离出来,在4°C下用300μl洗脱缓冲液(5:1,LoTE缓冲液(3 mM Tris-HCl,pH 7.5,0.2 mM EDTA)-7.5 M醋酸铵)洗脱过夜,并使用Spin-X过滤管(Fisher Scientific)和乙醇沉淀进行纯化。 使用Illumina Inc.(Illumina,Hayward,USA)提供的改良配对末端方案制备WGSS文库。 这涉及DNA末端修复和使用Klenow片段(3′至5′外显子缺失)形成3′腺苷悬液,并连接到Illumina PE适配器(带5′悬液)。 适配器连接产物在QIAquick自旋柱上纯化(QIAquick spin columns,Valencia,CA,USA),并使用Phusion DNA聚合酶(NEB,Ipswich,MA,USA。 使用8%PAGE凝胶从适配器结扎伪影中纯化出所需大小范围的PCR产物。 使用安捷伦DNA 1000系列II试验(安捷伦,加州圣克拉拉,美国)和Nanodrop 7500分光光度计(Nanodrot,威明顿,德国,美国)评估和量化DNA质量,随后将DNA稀释至10nM。 使用Quant-iT dsDNA HS检测试剂盒和Qubit荧光计(Invitrogen,Carlsbad,CA,USA)确认最终浓度。 为了进行测序,使用v1簇试剂在Illumina簇工作站上生成簇。 使用Illumina GA上的v3测序试剂生成配对读取 ii(ii) 平台遵循制造商的说明。 使用Illumina的基因组分析管道v1.0进行图像分析、基数计算和误差校准。 配对的WTSS和WGSS文库被测序为36、50或76个周期。 WGSS库由13条36纳米读取的流动单元通道、16条50纳米读取的通道和6条76纳米读取的路径组成。
使用读取索引进行有针对性的超深度重新测序 该程序描述了EZH2第15外显子的单个PCR扩增、单个扩增子的索引以及随后的汇集和测序。 单个索引允许对来自多路复用库中单个样本的读取进行反褶积,这样可以在同一库中同时对多个样本进行排序。 单个样本的基因组DNA标准化为5ng/uL,每个样本的5ng用Phusion DNA聚合酶(美国马萨诸塞州伊普斯威奇新英格兰生物实验室)以96-well格式用基因特异性引物(引物EZH2_015R3和引物EJH2_015F, 补充表7 )产生~300bp的扩增子。 热启动PCR条件:98°C,60s,然后36个循环(98°C-10s,60°C-15s,72°C-30s),最终延伸72°C,5min。 在Biomek F/X(Beckman Coulter,Fullerton,CA,USA)上使用AMPure珠(Beckman-Coulter,CA,US)清洁扩增子,并用40uL洗脱缓冲液EB洗脱(QIAGEN,US)。 使用1X TAE缓冲液在1.2%SeaKem LE琼脂糖凝胶(Cambrex,East Rutherford,NJ,USA)上对清洁的扩增物进行QC测试。 频带由QBit量化 ™ 荧光计(Invitrogen,Carlsbad,CA,USA)高灵敏度分析。 然后在室温下30分钟(T4 DNA Pol 5U,DNA Pol I(Klenow)1U,T4 PNK 100U,dNTP混合物0.4mM(Invitrogen),在50uL反应中对大约500ng的每个扩增子DNA样品进行磷酸化和最终修复。 使用AMPure珠清洁端对反应,并使用Klenow(exo-)5U和0.2mM dATP在1X Klenow缓冲液(Invitrogen)中向3′端添加dATP,并在37°C的四元热循环器中培养30分钟(MJ Research,美国)。 使用Biomek FX再次清洁AMPure珠子上的DNA。 使用0.03uM适配器(多路复用适配器1和2, 补充表7 ),100ng DNA,T4 DNA连接酶5U,0.2mM ATP,1X T4 DNA连接酶缓冲液(Invitrogen),室温下30分钟。使用Biomek FX上的AMPure珠清洁连接的DNA。 选择的DNA样本在QBit上进行量化 ™ (Invitrogen)。 使用引物1.0和2.0(IDT,美国)和96个自定义引物(引物索引如 补充表6 ). PCR程序如下:98°C持续60s,然后进行15个周期的98°C、10s、65°C、15s、72°C、30s。 使用AMPure珠清洁PCR产物,并在40uL洗脱缓冲液EB(美国QIAGEN)中洗脱。 通过QC凝胶评估产品质量:1.75%SeaKem LE琼脂糖1X TAE(每个扩增子0.2uL)和Bioanalyzer-1000(安捷伦科技公司,美国加利福尼亚州圣克拉拉)。 然后将每个板中的所有96~400bp扩增物(每个孔15uL)汇集到一个单独的1.5mL微量离心管中。 因此,一个试管代表96个不同DNA模板的96个聚合和索引PCR产物。 使用8%PAGE凝胶(1X TAE)纯化400bp DNA粒级,并在4°C下于400μl洗脱缓冲液(5:1,LoTE缓冲液(3 mM Tris-HCl,pH 7.5,0.2 mM EDTA)-7.5 M醋酸铵中从凝胶片中洗脱过夜。 凝胶块使用Spin-X过滤管过滤(美国宾夕法尼亚州匹兹堡费希尔科学公司)。 使用乙醇沉淀DNA,并使用安捷伦DNA 1000系列II分析(安捷伦科技,加州圣克拉拉,美国)定量,然后稀释至10nM。 使用Quant-iT-dsDNA HS检测试剂盒和QBit确认最终浓度 ™ 荧光计(Invitrogen)。 从每个索引样本构建一个单独的文库(包含多达96个不同模板DNA的扩增子)。 这些库中的每一个都在单个流动池通道上进行了测序。
肿瘤DNA和RNA序列的SNV分析 所有读取结果都与人类参考基因组(hg18)或(对于WTSS)与基因组文件进行了比对,该基因组文件使用MAQ比对器扩增了一组所有外显子-外显子连接序列 27 v0.7.1。 使用与我们之前描述的方法类似的方法,在对齐的基因组序列读取和转录组读取中识别候选单核苷酸变体(SNV) 7 在本研究中,我们的变体调用的一个关键区别是我们小组目前正在开发的贝叶斯SNV识别算法(“SNVmix”)的应用(版本0.11.7; http://compbio.bccrc.ca/?page_id=204 ) 28 该方法能够识别覆盖率最低为两个高质量(Q20)基地的SNV。 所有被评估为多态性(SNP)的位点都被忽略,包括与dbSNP或Venter个人基因组中的位置匹配的变体 29 ,Watson,匿名亚洲人 30 和约鲁班 31 个人。 此外,该患者生殖系DNA基因组序列中发现的所有候选突变均被忽略。 对于目标重新排序实验,密码子641的覆盖率通常大于1000倍读取深度。 因此,我们使用跨越该站点的所有明确映射的读取来确定质量不匹配的读取百分比(Illumina基本质量≥20)。 报告中每个样本的这些百分比 补充信息(补充表6) .
用于SNV鉴定和Sanger序列验证的Amplicon测序 第15外显子 EZH2型 用EZH2_ASP_1和EZH2-ASP_2从基因组DNA中扩增。 将M13正向-21和M13反向的识别位点添加到其5′端,以便对扩增子进行直接Sanger测序。 除非另有说明,扩增子是从肿瘤和匹配的正常患者DNA的基因组DNA中产生的。 使用突变检测仪对所有毛细血管痕迹进行分析,并对所有变体进行目测检查,以确认其在肿瘤中的存在和生殖系痕迹中的缺失。
EZH2野生型和突变型SET结构域的计算建模 EZH2 SET结构域序列用于在蛋白质数据库中搜索同源建模的结构模板。 MLL1 SET域的可用晶体结构(PDB ID 2w5z) 12 被确定为最佳模板(SET域的序列一致性为39%,没有对齐间隙)。 通过蛋白质建模服务器SWISS-model构建EZH2-SET结构域的三维模型 32 由于MLL1是H3K4结合蛋白,因此有人担心EZH2(K27)的靶赖氨酸残基可能不存在于相同的构象中。 另一个问题是MLL1晶体结构为开放构象,与封闭构象相比,这种构象降低了甲基转移酶活性。 构象变化可能会改变Y641的位置。 为了证实这一点,我们使用其他结构作为模板构建了替代模型。 我们使用了H3K9结合蛋白EHMT1(PDB ID 2RFI)、DIM-5(1PEG)、SUV39H2(2R3A)和G9a(2O8J)以及H3K36结合蛋白SETD2(3H6L)。 与Y641相对应的保守酪氨酸残基的显著重叠证实,无论是开放构象还是闭合构象,Y641在所有蛋白质中的位置都保持不变。 1PEG和2RFI中的共结晶H3肽帮助我们证实了K4和K9在这些模型中的构象非常相似。 因此,我们假设EZH2中的K27将形成接近模型所示的构象。
体外 EZH2 H3K27三甲基化测定
利用Refseq EZH2的定点突变生成突变构建物( NM_004456 )带有N末端的His标签。 使用杆状病毒表达系统(pVL1392,使用 巴米希 和 限制酶 ). 这五种蛋白质结合在一起形成酶活性PRC2复合物 在体外 通过Western blot证实四个突变结构中每个结构的EZH2蛋白的表达,并使用抗EZH2。 检测板涂有生物素化组蛋白H3(21-44)肽。 将纯化的PRC2与S-腺苷甲硫氨酸(在测定缓冲液中)一起加入平板中以检测酶活性。 甲基化组蛋白H3是使用一种高度特异的小鼠衍生单克隆抗体测量的,该抗体只识别组蛋白H4的三甲基化K27残基 33 (活动主题,目录编号39535。)。 用时间分辨荧光(620nm)检测二级抗体,并用铕标记。 以不同的纯化PRC2量(0至200ng)测试每个突变株(和野生型EZH2)的PRC2甲基化酶活性。
细胞系 数据库 34 ,KARPAS卡帕斯422 35 ,SU-DHL-6 36 和WSU-DLCL2 37 是从DSMZ和所有“OCI-LY”获得的细胞系 38 这些线来自NIH的L Staudt博士。
原细胞(COO)测定 根据制造商的方案(Affymetrix),将总RNA反向转录(一个周期)并与U133-2 Plus阵列杂交。 使用稳健的多芯片分析(RMA)规范化CEL文件。 根据Lenz等人描述的185-基因模型,利用ABC和GCB的模型分数计算原始细胞(COO)。 11 以及Wright等人描述的贝叶斯公式 39 .
肿瘤DNA拷贝数分析 如前所述,进行BAC阵列比较基因组杂交 40 没有发现任何重大变化。 如前所述,使用Affymetrix 500K SNP阵列分析肿瘤DNA的大拷贝数变化 41 使用外周血作为匹配的正常对照。 测序数据也被用来直接推断大规模缺失和扩增的存在。 如前所述,这是通过概率识别正常和肿瘤基因组文库之间明确映射读取的比例偏差来实现的 28 。由于匹配正常组织的序列读取量较低,因此首先使用对齐参考读取来定义包含200个映射读取的等覆盖率基因组箱。 正常基因组的测序深度提供了684029个bins,平均大小为3953 bp,代表了hg18组装的2.942 Gbases。 使用隐马尔可夫模型(HMM)将连续区域划分为五种离散状态:拷贝数丢失(HMM 1)、中性(HMM 2)、增益(HMM 3)、扩增(HMM 4)和高水平扩增(HMM5 42 。所有段及其HMM状态都包含在 补充表2 并显示在 补充图5 .
致谢 本研究的部分资金来自国家癌症研究所癌症基因组办公室(见下文)、加拿大国家癌症研究院(NCIC)特里·福克斯基金会新前沿项目拨款(拨款编号016003/拨款类型230/项目名称:癌症生物学:滤泡淋巴瘤作为癌症进展模型) 和Genome Canada/Genome BC Grant Competition III(项目名称:滤泡淋巴瘤基因组的高分辨率分析)授予J.M.C.、M.A.M.、R.D.G.和D.E.H.,并得到了Terry Fox基金会(批准号:019001)的支持。 此外,N.A.J.通过NCIC(019005)和迈克尔·史密斯健康研究基金会(MSFHR)(ST-PDF-01793)颁发的奖项,成为特里·福克斯基金会的研究员。 M.A.M.是特里·福克斯(Terry Fox)的年轻调查员和迈克尔·史密斯(Michael Smith)的高级研究学者。 A.J.M.获得了白血病和淋巴瘤协会的奖学金。 R.D.M.是Vanier学者(加拿大卫生研究院),也得到了MSFHR高级研究生奖学金的支持。 本研究的实验室工作由基因组科学中心、不列颠哥伦比亚省癌症研究中心和转化与应用基因组中心承担,该中心是省级卫生服务局实验室的一个项目。 作者感谢卑诗省癌症基金会和国际狮子俱乐部的支持。 作者感谢D.Gerhard的有益讨论。 特别感谢C.Suragh和A.Drobnies提供的专业项目管理援助。 根据NO1-CO-12400号合同,该项目全部或部分由国家癌症研究所、国家卫生研究院的联邦资金资助。 本出版物的内容不一定反映卫生与公共服务部的观点或政策,提及商品名称、商业产品或组织也不意味着美国政府的认可。
脚注 作者贡献: M.A.M.、R.D.G.、D.E.H.和J.M.C.构思了这项研究,并领导了实验的设计。 R.D.M.进行了WGSS和WTSS分析 图1 和 2 然后和M.A.M.一起写了手稿。 N.A.J.准备了样品,进行了样品分类和COO分析,并对文本做出了贡献。 O.G.和R.D.M.分析了基因表达数据。 T.M.S.、A.J.M.和J.E.P.对毛细管序列数据进行了序列验证实验和目视检查。 D.S.和M.M.构建了多路复用库,用于EZH2的深度重新排序。 H.Z.、M.K.、P.S.、J.F.C.、D.Y.和M.T.进行了酶分析。 I.B.进行了统计分析,并对手稿作出了贡献。 J.A.和S.J.为EZH2制作了模型,并为手稿做出了贡献。 M.B.和B.W.准备样品并进行FACS。 F.K.和R.K.H.验证了RNA中的表达结果。A.D.、H.Q.、R.C.和S.S.进行了拷贝数分析。 A.T.、Y.Z.、R.H.、M.H.和R.M.制作测序文库并进行测序。 R.V.处理了原始测序数据。 R.G.确定了候选突变。 J.S.、M.H.、S.A.构思了实验并对文本做出了贡献。
工具书类
1 Alizadeh AA等。通过基因表达谱确定的不同类型的弥漫性大B细胞淋巴瘤。 自然。 2000; 403 (6769):503–511. doi:10.1038/35000501。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Compagno M等人。在弥漫性大B细胞淋巴瘤中,多个基因的突变导致NF-kappaB的失调。 自然。 2009; 459 (7247):717–721. doi:10.1038/nature07968。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Kato M等。B细胞淋巴瘤中A20的频繁失活。 自然。 2009; 459 (7247):712–716. doi:10.1038/nature07969。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
4 Bea S等。弥漫性大B细胞淋巴瘤亚群具有独特的遗传特征,可影响肿瘤生物学并改善基于基因表达的生存预测。 鲜血。 2005; 106 (9):3183–3190. doi:10.1182/bloud-2005-04-1399。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
5 van Haaften G等。组蛋白H3K27脱甲基酶基因UTX在人类癌症中的体细胞突变。 自然遗传学。 2009年doi:10.1038/ng.349。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
6 Kleer CG等。EZH2是侵袭性乳腺癌的标志物,并促进乳腺上皮细胞的肿瘤转化。 美国国家科学院院刊,2003年; 100 (20):11606–11611. doi:10.1073/pnas.1933744100。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
7 Morin R等。使用随机引物cDNA和大规模平行短阅读测序分析HeLa S3转录组。 生物技术。 2008; 45 (1):81–94. doi:10.144/00112900。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
8 Mortazavi A、Williams BA、McCue K、Schaeffer L、Wold B.通过RNA-Seq对哺乳动物转录体进行定位和量化。 自然方法。 2008; 5 (7):621–628. doi:10.1038/nmeth.1226。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9 Ley TJ等。细胞遗传学正常的急性髓细胞白血病基因组的DNA测序。 自然。 2008; 456 (7218):66–72. doi:10.1038/nature07485。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
10 Kirmizis A等人。人类多梳靶基因的沉默与组蛋白H3 Lys 27的甲基化有关。 基因开发2004; 18 (13):1592–1605. doi:10.1101/gad.1200204。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Lenz G等。大B细胞淋巴瘤中的基质基因特征。 《N Engl J Med.2008》; 359 (22):2313–2323. doi:10.1056/NEJMoa0802885。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Southall SM,Wong PS,Odho Z,Roe SM,Wilson JR。MLL1 SET结构域活性和表观遗传标记识别所需额外因子的结构基础。 分子细胞。 2009; 33 (2):181–191. doi:10.1016/j.molcel.2008.12.029。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
13. Dillon SC,Zhang X,Trievel RC,Cheng X。SET域蛋白超家族:蛋白赖氨酸甲基转移酶。 基因组生物学。 2005; 6 (8):227. doi:10.1186/gb-2005-6-8-227。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
14 Joshi P等。显性等位基因识别Polycomb抑制复合物2组蛋白甲基转移酶所需的SET域残基。 生物化学杂志。 2008; 283 (41):27757–27766. doi:10.1074/jbc。 M804442200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
15 Varambally S等。多梳组蛋白EZH2参与前列腺癌的进展。 自然。 2002; 419 (6907):624–629. doi:10.1038/nature01075。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
16 Raaphorst FM等。前沿:多梳基因表达模式反映了人类生发中心不同的B细胞分化阶段。 免疫学杂志。 2000; 164 (1):1–4. doi:10.4049/jimmunol.164.1.1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
17 Su IH等。Ezh2通过组蛋白H3甲基化和Igh重排控制B细胞的发育。 自然免疫学。 2003; 4 (2):124–131. doi:10.1038/ni876。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
18 van Kemenade FJ等。BMI-1和EZH2多梳组蛋白的共表达与B细胞非霍奇金淋巴瘤的循环细胞和恶性程度相关。 鲜血。 2001; 97 (12):3896–3901. doi:10.1182/bloud.v97.12.3896。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 Couture JF、Dirk LM、Brunzelle JS、Houtz RL、Trievel RC。 SET域蛋白甲基转移酶产物特异性的结构起源。 美国国家科学院院刊2008; 105 (52):20659–20664. doi:10.1073/pnas.0806712105。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
20 O’Riain C等。滤泡性淋巴瘤中基于阵列的DNA甲基化分析。 白血病。 2009年doi:10.1038/leu.2009.114。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
21 Martin-Subero JI等。通过结合表观基因组和转录分析,对成熟侵袭性B细胞淋巴瘤的生物学和起源的新见解。 鲜血。 2009; 113 (11):2488–2497. doi:10.1182/bloud-2008-04-152900。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
22 病毒E等。多梳组蛋白EZH2直接控制DNA甲基化。 自然。 2006; 439 (7078):871–874. doi:10.1038/nature04431。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
23 Hans CP等。一种显著的弥漫成分可预测3级滤泡性淋巴瘤的低生存率,但细胞学亚型不能预测生存率。 鲜血。 2003; 101 (6):2363–2367. doi:10.1182/bloud-2002-07-2298。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
24 Thompson JD、Gibson TJ、Higgins DG。 使用ClustalW和ClustalX进行多序列比对。 当前协议生物信息学。 2002; 第2章(第2-3单元)doi:10.1002/0471250953.bi0203s00。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
25 Pasqualucci L等。B细胞弥漫性大细胞淋巴瘤中多种原癌基因的过度突变。 自然。 2001; 412 (6844):341–346. doi:10.1038/35085588。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
26 Krzywinski M等人。检测人类基因组重排的BAC克隆指纹方法。 基因组生物学。 2007; 8(10):R224。 doi:10.1186/gb-2007-8-10-r224。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
27 Li H,Ruan J,Durbin R.使用映射质量分数映射短DNA测序读取和调用变体。 基因组研究2008; 18 (11):1851–1858. doi:10.1101/gr.078212.108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
28 Shah SP等。单核苷酸分辨率下小叶乳腺肿瘤的突变进化。 自然。 2009; 461 (7265):809–813. doi:10.1038/nature08489。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
29 列维·S等人。单个人类的二倍体基因组序列。 《公共科学图书馆·生物》。 2007; 5(10):e254。 doi:10.1371/journal.pbio.0050254。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
30 王杰等。亚洲个体的二倍体基因组序列。 自然。 2008; 456 (7218):60–65. doi:10.1038/nature07484。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
31 Bentley DR等人。使用可逆终止剂化学进行精确的全人类基因组测序。 自然。 2008; 456 (7218):53–59. doi:10.1038/nature07517。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 Kopp J,Schwede T.注释三维蛋白质结构同源模型的SWISS-MODEL知识库。 核酸研究2004; 32(数据库问题):D230–234。 doi:10.1093/nar/gkh008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
33. Baskind HA等。asxl2的功能保守性,该基因是果蝇增强子和多梳组基因asx的鼠同源物。 公共科学图书馆一号。 2009; 4(3):e4750。 doi:10.1371/journal.pone.0004750。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
34 Beckwith M、Longo DL、O'Connell CD、Moratz CM、Urba WJ。 磷酸酯类诱导的、细胞周期特异的、对人类B淋巴瘤细胞系的生长抑制。 美国国家癌症研究所杂志,1990年; 82 (6):501–509. doi:10.1093/jnci/82.6.501。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35 Dyer MJ、Fischer P、Nacheva E、Labastide W、Karpas A。一种新的人类B细胞非霍奇金淋巴瘤细胞系(Karpas 422),表现出t(14;18)和t(4;11)染色体易位。 鲜血。 1990; 75 (3):709–714. [ 公共医学 ] [ 谷歌学者 ]
36 爱泼斯坦AL等人,《人类恶性淋巴瘤生物学》。 四、 十种弥漫性组织细胞淋巴瘤细胞系的功能特征。 癌症。 1978; 42 (5):2379–2391. doi:10.1002/1097-0142(197811)42:5<2379::aid-cncr2820420539>3.0.co; 2-4. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
37 Al-Katib AM等。Bryostatin 1在弥漫性大细胞淋巴瘤异种移植物中下调mdr1并增强长春新碱的细胞毒性。 1998年临床癌症研究; 4 (5):1305–1314. [ 公共医学 ] [ 谷歌学者 ]
38 Tweeddale ME等。高级别恶性淋巴瘤中克隆原细胞的存在:一个预后因素。 鲜血。 1987; 69 (5):1307–1314. [ 公共医学 ] [ 谷歌学者 ]
39 Wright G等。一种基于基因表达的方法,用于诊断弥漫性大B细胞淋巴瘤的临床不同亚群。 美国国家科学院院刊,2003年; 100 (17):9991–9996. doi:10.1073/pnas.1732008100。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
40 Cheung KJ等。通过阵列比较基因组杂交对滤泡性淋巴瘤进行基因组全谱分析,发现具有显著预测意义的DNA拷贝数失衡。 鲜血。 2009; 113 (1):137–148. doi:10.1182/bloud-2008-02-140616。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
41 Delaney AD,Qian H,Friedman JM,Marra MA。Affymetrix映射阵列在基因拷贝数变异诊断中的应用。 当前协议人类基因。 2008; 第八章(第八单元):13。 doi:10.1002/0471142905.hg0813s59。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
42 Shah SP等。使用强大的HMM生物信息学将拷贝数多态性整合到阵列CGH分析中。 2006; 22(14):e431-439。 doi:10.1093/bioinformatics/btl238。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。