摘要 转化生长因子-β(TGF-β)是一种与伤口愈合和肺纤维化发病机制有关的细胞因子。 TGF-β刺激肌成纤维细胞分化,其特征是可收缩平滑肌(SM)特异蛋白的表达,如SM–α-肌动蛋白。 在本研究中,我们检测了血清反应因子(SRF)在TGF-β诱导人肺成纤维细胞(HLF)肺肌成纤维细胞分化机制中的作用。 TGF-β刺激HLF中SM–α-actin的表达,这与SRF表达和活性的深刻诱导平行。 药物性SRF抑制剂(CCG-1423)或通过腺病毒介导的SRF短发夹RNA(shSRF)转导抑制SRF,阻断SRF和SM–α-actin对TGF-β的反应表达,而不影响Smad介导的TGF-α信号传导。 然而,SRF自身的强制表达并不能促进SM–α-actin的表达,而组成性反式激活SRF融合蛋白(SRF-VP16)的表达足以诱导SM–α-actin表达,这表明SRF的表达和反式激活都很重要。 forskolin或iloprost激活蛋白激酶A(PKA)可显著抑制TGF-β诱导的SM–α-actin表达,这与抑制SRF表达和活性有关,但与Smad介导的基因转录无关。 总之,这是第一次直接证明TGF-β诱导的肺肌成纤维细胞分化是由SRF介导的,PKA通过下调SRF表达水平和SRF活性来抑制肌纤维细胞分化,而不依赖于Smad信号。
关键词: 转化生长因子-β、血清反应因子、肌成纤维细胞、蛋白激酶A、Smad
临床相关性 本研究证明血清反应因子在转化生长因子-β介导肺肌成纤维细胞分化中的重要作用。 抑制血清反应因子可能是治疗肺纤维化的一种有用策略。
特发性肺纤维化(IPF)是一种进行性、致命性疾病,其特征是肺实质纤维化和肺结构变形。 目前还没有有效的治疗方法,需要确定药物干预的新靶点。 肺泡成纤维细胞在转化生长因子(TGF)-β的刺激下,通过改变其基因表达谱作出反应 从头开始的 平滑肌细胞中常见的细胞骨架和收缩蛋白的表达( 1 , 2 )导致成纤维细胞和平滑肌细胞之间处于中间状态的表型,称为 肌成纤维细胞 ( 三 , 4 ). 平滑肌(SM)–α-肌动蛋白是一种并入应激丝的收缩蛋白,是肌成纤维细胞分化的公认标志。
TGF-β,一种与实验性肺纤维化和人类疾病发病机制相关的细胞因子( 5 – 8 )是一种成熟的肌成纤维细胞分化诱导剂。 在细胞水平上,已知TGF-β通过跨膜受体丝氨酸/苏氨酸激酶发出信号,磷酸化并激活其 规范的 信号中间体,受体激活的Smad蛋白(Smad2/3),导致它们与共同介导物Co-Smad(Smad4)异源三聚体化,复合物的核积累,以及Smad-binding元件(SBE)的激活,这些元件调节靶基因的转录( 9 , 10 ). 先前对培养的肺成纤维细胞的研究表明,SBE在介导TGF-β诱导的SMα-actin启动子激活中起作用( 11 – 13 )而其他人则暗示TGF-β控制元件(TCE)由Sp1/3转录因子激活并由Kruppel-like因子调节( 14 – 16 ). 此外,研究表明,cAMP升高激动剂前列腺素E2可在不影响Smad信号的情况下,减弱TGF-β诱导的肺肌成纤维细胞分化( 17 , 18 ).
在血管平滑肌细胞(VSMC)中,SM-gene转录主要通过血清反应因子(SRF)与其靶点的结合来控制 顺式 -元件,CArG盒(CC(AT) 6 大多数SM基因启动子区域内的GG)( 19 ). SRF激活通常由G蛋白偶联受体激动剂(如内皮素-1)诱导( 20 )如前所述,它是VSMC中SM基因表达的强大刺激物( 21 ). 此外,我们还发现,在VSMC中,SRF活性对蛋白激酶A(PKA)的调节高度敏感( 21 ). 然而,SRF在TGF-β诱导的肌成纤维细胞分化中的作用尚不清楚。 利用小鼠SM–α-肌动蛋白启动子CArG突变的前期研究( 16 )或诱饵CArG寡核苷酸( 22 ),并不表明肺成纤维细胞中TGF-β诱导的SM-actin转录对CArG的绝对需求。 这些数据与大鼠成纤维细胞系中TGF-β激活SM–α-actin表达的CArG需求的证据形成对比( 23 ).
鉴于这些相互矛盾的观察结果,我们试图( 1 )使用药理学和siRNA方法检查SRF在TGF-β诱导的肺肌成纤维细胞分化中的作用,以及( 2 )测试PKA对SRF的调节是否可以解释cAMP提升剂对TGF-β诱导的肌成纤维细胞分化的抑制。
材料和方法 人肺成纤维细胞的分离和原代培养 从接受肺纤维化肺移植患者的移植肺中获取组织样本,并将其置于Dulbecco改良Eagle's培养基(DMEM)中。 将有肺泡的肺切碎,在PBS中清洗,然后在含有补充有10%胎牛血清、2 mM L-谷氨酰胺、100 U/ml链霉素、250 ng/ml两性霉素B和100 U/ml青霉素的DMEM的生长培养基中,将其置于10-cm的平板上。 扩大的成纤维细胞群体随后在4-5天后进行继代培养,从而形成均质成纤维细胞群。 从第5-10代开始使用所有原代培养物,并在塑料上生长。 在所有实验中,细胞在含有0.1%牛血清白蛋白(BSA)和2 mM L-谷氨酰胺的DMEM中隔夜剥夺血清,然后用激动剂刺激。
瞬时DNA转染和腺病毒介导的基因转导 按照标准制造商的方案,使用LipofectAMINE PLUS试剂(Invitrogen)进行瞬时DNA转染。 如前所述,腺病毒介导的基因转导是通过在含有0.1%BSA的培养基中培养含有所需腺病毒(每个细胞100个噬菌体形成单位[pfu])的细胞来实现的( 24 ).
DNA和其他试剂 野生型SRF的质粒由Julian Solway博士(伊利诺伊州芝加哥市芝加哥大学)提供。 构成活性SRF-VP16嵌合蛋白的质粒,其中SRF的C末端反激活域被病毒共激活物VP16的反激活域取代( 25 )和嵌合蛋白GAL4-VP16的质粒是Joseph Miano博士(纽约州罗切斯特市罗切斯特大学)赠送的礼物。 大鼠−764碱基对SM–α-actin启动子的萤火虫荧光素酶报告子是Sem Phan博士(密歇根大学,密歇根州安娜堡)赠送的一份礼物,如前所述( 13 ). 之前使用了由两份CArG元件(SRF-Luc)驱动的萤火虫荧光素酶报告器( 21 , 26 – 28 ). 由四份Smad-binding元件(SBE-Luc)拷贝驱动的萤火虫荧光素酶报告器由Bert Vogelstein博士提供,之前曾使用过( 24 ). 胸腺嘧啶激酶启动子(TK)驱动肾小球荧光素酶的质粒来自普罗米加(威斯康星州麦迪逊)。 表达针对SRF的短发夹RNA的重组缺陷型腺病毒(Ad-shSRF),或表达针对GFP的shRNA的对照腺病毒(Ad-shGFP),由Joseph Miano博士(罗切斯特大学)提供,如前所述( 29 ). CCG-1423来自Cayman Chemical(密歇根州安阿伯)。 抗-VASP抗体和TGF-β来自EMD Biosciences(新泽西州吉布斯敦)。 Forskolin(FSK)来自Fisher生物试剂公司(新泽西州Fair Lawn)。 β-actin和SM–α-actin抗体来自Sigma(密苏里州圣路易斯)。 SRF和Smad4抗体来自Santa Cruz Biotechnology(加州圣克鲁斯)。 磷化Smad2和Smad2抗体来自细胞信号(Danvers,MA)。
西方印迹法 用所需的激动剂刺激静止细胞后,在含有25 mM HEPES(pH 7.5)、150 mM NaCl、1%Triton X-100、0.1%SDS、2 mM EDTA、2 mM-EGTA、10%甘油、1 mM NaF、200μM Na-甲氧钒酸钠和蛋白酶抑制剂(1μg/ml亮氨酸肽、1μg/ml抑肽酶、1 mM-PMSF)的RIPA缓冲液中溶解细胞。 通过以20000× 克 10分钟,在Laemmli缓冲液中煮沸,进行聚丙烯酰胺凝胶电泳,用0.5μg/ml一级所需的一级抗体进行Western blotting分析,然后用1:3000稀释的HRP-结合二级抗体(EMD)进行分析,并通过增强化学发光(ECL)反应进行开发(Pierce,Rockford,IL)。
荧光素酶报告分析 在24孔板中培养次级流入细胞,并与期望的萤火虫荧光素酶报告质粒(500 ng/ml)和20 ng/ml TK共同转染- 雷尼利亚 荧光素酶质粒。 将细胞放置在生长培养基中过夜,然后饥饿血清24小时,然后用所需的激动剂刺激相关时间。 然后用磷酸盐缓冲盐水清洗细胞,并在蛋白提取试剂中溶解。 对裂解液进行萤火虫和 雷尼利亚 使用Promega Dual荧光素酶分析试剂盒(Promega)的荧光素素酶活性。 为了解释转染效率的差异,将每个样本的萤火虫荧光素酶活性标准化为 雷尼利亚 荧光素酶活性。
统计分析 所有数据都代表了至少三个独立实验的结果。 学生分析了定量数据 t吨 测试和值 P(P) <0.05被认为具有统计学意义。
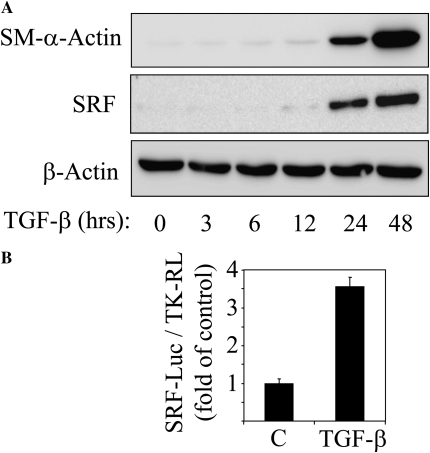
结果 图1A 显示TGF-β在血清缺乏的人肺成纤维细胞中深度诱导SM–α-actin表达,而管家β-actin无变化,表明肌成纤维细胞分化。 有趣的是,SRF被认为是普遍表达的,在静息状态下的肺成纤维细胞中有极低的表达,但其表达是由TGF-β以类似于SM–α-肌动蛋白诱导的时间过程深度诱导的。 在这方面,静止的肺成纤维细胞与血管平滑肌细胞截然不同,后者在基础状态下大量表达SRF(数据未显示)。 重要的是,TGF-β诱导的SRF表达与SRF活性的增加有关,由两个CArG元件驱动的SRF-荧光素酶报告子进行评估( 图1B ). 这表明TGF-β可能通过以下途径刺激SRF-依赖性基因转录( 1 )上调SRF表达和( 2 )刺激SRF反式激活。
图1。
转化生长因子(TGF)-β诱导的平滑肌(SM)-α-肌动蛋白的表达伴随着血清反应因子(SRF)的表达和激活。 ( 一 )将人肺成纤维细胞生长至低通量,血清饥饿过夜,并用2 ng/ml TGF-β刺激指定的时间。 用所示的抗SM–α-actin、SRF或β-actin抗体对细胞提取物进行Western blotting分析。 ( B类 )将亚流入的人肺成纤维细胞转染SRF-萤火虫荧光素酶报告子(SRF-luc)、胸腺嘧啶激酶驱动的肾小球荧光素素酶(TK-RL)对照报告子和血清饥饿过夜,然后用载体(C)或2 ng/ml TGF-β刺激24小时。 然后,在细胞裂解液中测量萤火虫荧光素酶(SRF-Luc)的活性,并将其归一化为肾小球荧光素酶(TK-RL)的活性。 数据表示三次实验的结果,一式三份。
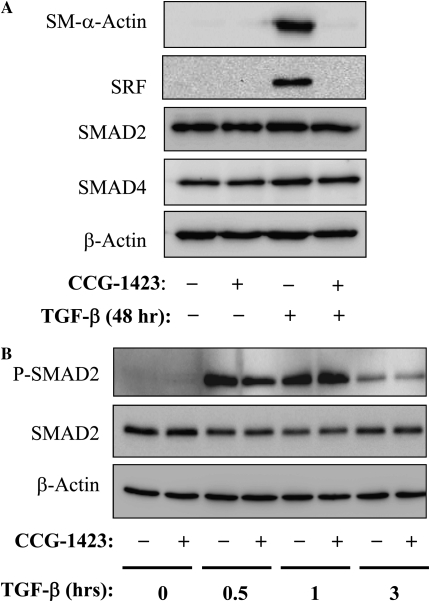
为了检测是否需要SRF来表达SM–α-actin以响应TGF-β,我们首先使用了最近描述的SRF药物抑制剂CCG-1423( 30 ). 如所示 图2A CCG-1423预处理可完全抑制TGF-β诱导的SM-α-actin表达。 CCG-1423还抑制SRF蛋白的表达以响应TGF-β,这与之前报道的SRF在诱导自身基因转录中的作用一致( 31 , 32 ). 相反,CCG-1423不影响Smad2、Smad4或β-actin的表达( 图2A )TGF-β诱导Smad2磷酸化的nor( 图2B )表明CCG-1423对TGF-β诱导的SMα-actin表达的调节独立于典型的Smad信号。
图2。
药物性SRF抑制剂CCG-1423下调SM–α-actin和SRF表达。 ( 一 )用10μM CCG-1423预处理血清饥饿的人肺成纤维细胞1小时,然后用2 ng/ml TGF-β刺激48小时。 通过Western blotting分析细胞提取物,并根据指示使用针对SM–α-actin、SRF、Smad2、Smad4或β-actin的抗体。 ( B类 )用10μM CCG-1423预处理血清饥饿的人肺成纤维细胞1小时,然后用2 ng/ml TGF-β刺激指定时间。 通过Western blotting分析细胞提取物与抗磷酸化S-mad2(Ser465/Ser467)、总Smad2或β-肌动蛋白的抗体。
为了进一步研究SRF对SM–α-肌动蛋白表达的潜在需求,我们通过腺病毒介导的针对SRF的短发夹RNA(Ad-shSRF)的表达,使用了SRF敲除方法。 如所示 图3 在不影响Smad2、Smad4或β-actin表达的情况下,用Ad-shSRF而非对照Ad-shGFP转导人肺成纤维细胞可有效抑制SRF表达。 重要的是,SRF的敲除与TGF-β对SM–α-actin表达的完全抑制有关。 结果显示在 图2 和 三 强烈建议SRF的表达和/或活性是TGF-β诱导的肌成纤维细胞分化所必需的。
图3。
SRF敲除下调SM–α-actin表达。 用表达抗SRF短发夹RNA的重组缺陷型腺病毒(Ad-shSRF)或在0.1%牛血清白蛋白中表达抗GFP短发夹病毒(Ad-shGFP)的对照腺病毒转导亚流入的人肺成纤维细胞48小时,然后用2 ng/ml TGF-β刺激细胞48小时。 通过Western blotting分析细胞提取物与SRF、SM–α-actin、Smad2、Smad4或β-actin抗体,如图所示。
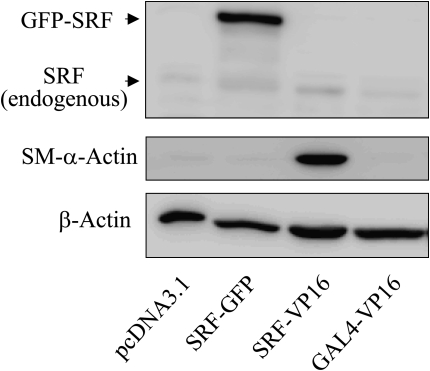
给定TGF-β对SRF和SM–α-actin的平行诱导( 图1 )以及SM–α-actin表达对SRF的依赖性,以响应TGF-β( 图2 和 三 ),我们试图确定SRF的强制过度表达是否足以驱动SM–α-actin的表达。 由于DNA转染原代培养的人肺成纤维细胞的局限性,我们使用HT-1080纤维肉瘤细胞系,该细胞系允许高效的瞬时转染,并且在基础状态下也表达低水平的SRF。 为了区分内源性和异位性SRF,我们使用GFP标记的SRF cDNA。 如所示 图4 ,GFP-SRF的异位表达未能增加HT-1080细胞中SM–α-actin蛋白的水平。 相反,组成活性嵌合蛋白SRF-VP16的表达,其中SRF的C末端转录激活域被病毒共激活物VP16的转录激活域取代( 25 ),诱导SM–α-actin表达( 图4 ). SRF-VP16的这种作用是SRF特有的,因为GAL4-VP16嵌合蛋白的表达(包含VP16的转录激活域,但不包含GAL4 DNA结合域,该结合域不与SRF靶向顺式元件CArG盒相互作用)不会诱导SM–α-actin的表达( 图4 ). 这些数据表明,SRF自身的表达不足以表达SM–α-actin,但也需要SRF的反激活。 有趣的是,尽管SRF-VP16能有效促进SM–α-actin的表达,但它并没有显著诱导内源性SRF的表达( 图4 )这表明SRF基因转录可能需要其他机制。
图4。
SRF过表达本身不足以驱动SM–α-肌动蛋白的表达。 用空白载体或对照载体cDNA(pcDNA3.1)、GFP标记的野生型SRF、组成活性SRF-VP16融合蛋白或GAL4-VP16融合蛋白质转染HT-1080细胞48小时。 如图所示,用抗SRF、SM–α-肌动蛋白或β-肌动蛋白的抗体通过蛋白质印迹分析细胞提取物。 注意,针对SRF C末端的SRF抗体不能识别SRF-VP16,因为SRF的C末端反激活域被病毒共激活物VP16的反激活域所取代( 25 ).
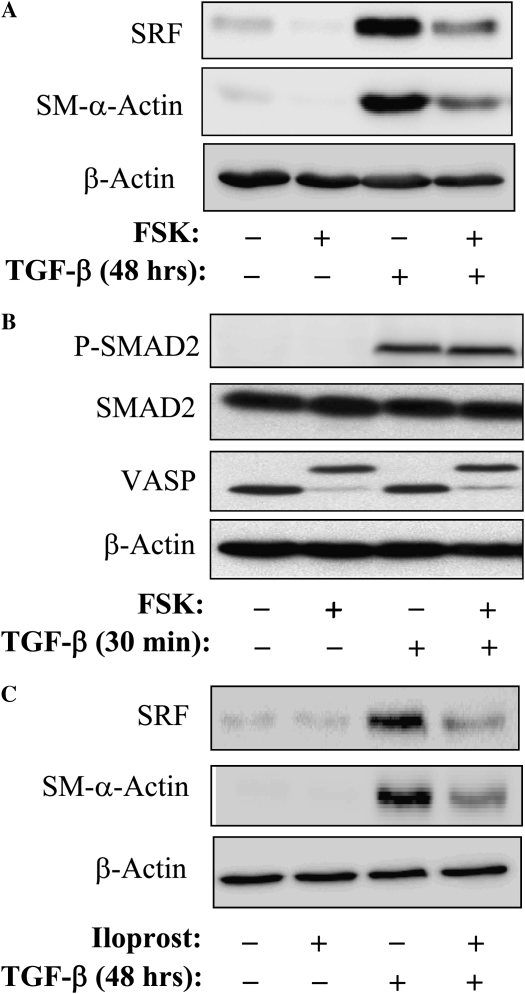
我们以前曾报道过,G蛋白偶联激动剂(如内皮素-1或细胞外ATP)诱导的SRF活性和SMα-肌动蛋白表达对蛋白激酶A(PKA)在血管平滑肌细胞中的调节高度敏感( 21 , 26 ). 因此,我们研究了PKA是否调节TGF-β诱导的人肺成纤维细胞中SRF和SM–α-actin的表达。 图5A 表明,通过腺苷酸环化酶激活剂FSK刺激PKA,可深度抑制TGF-β诱导的人肺成纤维细胞SRF和SMα-actin的表达,而对β-actin表达无影响。 FSK对TGF-β诱导的Smad2磷酸化没有影响( 图5B )而其在PKA激活中的有效性通过PKA底物、血管扩张剂刺激的磷酸蛋白VASP的磷酸化得到证实( 33 ),由磷酸化VASP的电泳迁移率变化确定( 图5B ),由PKA介导( 21 ). 此外,稳定的前列环素类似物伊洛前列素通过前列腺素受体发出信号,激活PKA( 34 )对TGF-β诱导的SMα-actin和SRF表达具有类似的抑制作用( 图5C ).
图5。
cAMP提剂抑制TGF-β诱导的SMα-actin和SRF表达。 ( 一 )用10μM forskolin(FSK)预处理血清饥饿的人肺成纤维细胞15分钟,然后用2 ng/ml TGF-β刺激48小时。 采用免疫印迹法对细胞提取物进行分析,并根据指示使用抗SRF、SM–α-actin或β-actin抗体。 ( B类 )用10μM FSK预处理血清饥饿的人肺成纤维细胞15分钟,然后用2 ng/ml TGF-β刺激30分钟。 通过Western blotting分析细胞提取物与磷酸化S-mad2(Ser465/Ser467)、总Smad2、血管扩张剂刺激的磷酸蛋白(VASP)或β-肌动蛋白的抗体。 VASP的电形态迁移率随其被PKA磷酸化而发生变化( 21 ). ( C类 )用10μM Iloprost(Ilo)预处理血清饥饿的人肺成纤维细胞15分钟,然后用2 ng/ml TGF-β刺激48小时。 采用免疫印迹法对细胞提取物进行分析,并根据指示使用抗SRF、SM–α-actin或β-actin抗体。
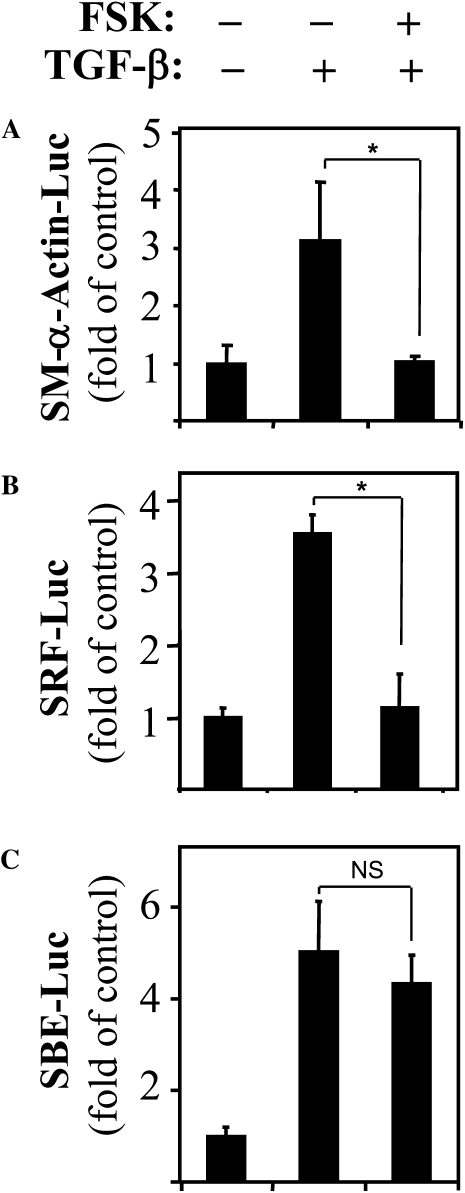
为了进一步明确PKA对SM–α-actin表达的转录控制,我们使用了包含SRF结合位点(CArG盒)和SBE的SM–α-actin启动子(-764碱基对)荧光素酶报告子( 13 ). 如所示 图6A ,TGF-β诱导荧光素酶活性的3倍诱导,FSK处理可消除这种诱导。 这表明PKA对SM–α-actin表达的调节发生在基因转录水平。 此外,FSK阻断了TGF-β诱导的由两个CArG元件驱动的SRF-荧光素酶报告子的激活( 图6B ),不影响TGF-β对SBE-荧光素酶报告子的激活( 图6C ). 总之,这些数据强烈表明,PKA通过抑制SRF表达和活性而抑制TGF-β诱导的SMα-actin表达,但不抑制Smad依赖性基因转录。
图6。
PKA通过抑制SRF而非Smad-binding elements(SBE)来调节TGF-β诱导的SMα-actin启动子激活。 用荧光素酶报告子转染人肺成纤维细胞,获得−764碱基对( 一 )SM–α-肌动蛋白启动子( B类 )SRF萤光素酶报告基因,或( C类 )SBE-荧光素酶报告子和胸腺嘧啶激酶驱动肾小球(TK-RL)对照报告子。 用10μM FSK预处理血清饥饿细胞15分钟,然后用2 ng/ml TGF-β刺激24小时。 然后在细胞裂解液中测量荧光素酶的活性,并将其归一化为肾小球的活性。 数据表示至少三次实验的结果,一式三份(* P(P) < 0.05).
讨论 我们研究的第一个重要观察结果是,TGF-β刺激肺成纤维细胞可导致SRF表达的深刻诱导( 图1 ). 在缺乏血清的条件下,SRF的水平相对较低,但在用TGF-β治疗24至48小时后,SRF表达被诱导到更典型的静止平滑肌细胞水平。 这种上调在时间上与SM–α-actin表达的诱导相关,表明这两种事件之间存在联系。 我们的观察结果与之前的一致 体内 使用博莱霉素诱导的肺纤维化大鼠模型进行的研究,在该模型中,SRF表达增加,同时诱导SM–α-actin阳性肌成纤维细胞( 35 ).
TGF-β诱导SRF表达的机制存在多种可能性,包括转录调控。 Spencer和Misra的SRF启动子突变研究( 31 )建立了血清诱导SRF的CArG依赖性。 我们的数据表明,在HT1080细胞中,通过过表达SRF-VP16而分离的SRF反式激活对内源性SRF的表达影响微乎其微,同时诱导了SM–α-actin表达的深刻诱导( 图4 ). 这些数据和其他研究的结果表明,SRF转录可能需要其他机制,包括Sp1、Egr-1和CCAATT结合元件( 32 ). 鉴于TGF-β可以招募Sp1( 16 ),TGF-β对SRF的初始转录可能通过Sp1发生。 另一方面,对SRF基因5′非翻译区的分析很有可能预测在CArG盒上游存在假定的SBE(我们的未发表的观察结果),这表明TGF-β也可以为SRF启动子激活招募典型的Smad信号。 因此,TGF-β(不一定通过CArGs)对SRF表达的初始诱导可能随后通过新合成(和反式激活)的SRF以正反馈方式驱动SRF启动子。 最后,翻译后调节也可能发挥作用,因为在我们的附加实验中,在暴露48小时后去除TGF-β导致SRF蛋白的消失速度比SM–α-肌动蛋白的消失快得多,这表明SRF不太稳定。 同样,Misra及其同事观察到SRF的广泛磷酸化( 36 ),这可能会影响其稳定性。 我们实验室目前正在调查这些可能性。
本研究的第二个重要结论是TGF-β诱导的肺肌成纤维细胞分化依赖于可诱导的SRF表达( 图2 和 三 ). 然而,使用HT-1080纤维肉瘤细胞系,我们还发现SRF表达本身不足以诱导SM–α-actin,并且需要SRF反激活( 图4 ). 虽然将癌细胞系的结果外推到从原代培养获得的结果时要谨慎,但我们选择使用HT1080细胞系来促进SRF和SRF-VP16转染到足够百分比的细胞中,以评估其功能效果。 第二,虽然它不能再现分化肌成纤维细胞的某些表型特征(低增殖能力),但它确实是研究诱导收缩基因表达和SRF表达的有用模型,因为它在基础状态下保持这些蛋白的低水平, 类似于人肺成纤维细胞的原代培养。
血清或G蛋白偶联受体激活SRF的公认机制涉及RhoA激活和肌动蛋白动力学的调节( 37 – 39 ). 公布的数据表明RhoA的作用( 40 )在介导TGF-β诱导的肌成纤维细胞分化中,我们已使用特定的Rho激酶抑制剂证实了这一点(数据未显示)。 考虑到TGF-β诱导的SRF和SMα-actin激活的延迟效应( 图1A )也可能存在需要合成和释放其他介质的中间步骤。 1-磷酸鞘氨醇,对TGF-β产生反应( 40 )已知能刺激RhoA和SRF( 41 )可能就是这样一个调解人。 其他潜在机制可能包括TGF-β诱导的Smad3/SRF相互作用( 12 ),或抑制Smad7和SRF之间的相互作用减弱( 42 ).
最后,我们的数据表明,SRF可能是负调控肺成纤维细胞分化的重要靶点,这可能具有潜在的治疗重要性。 其他研究人员已经表明,PGE2通过cAMP的升高诱导其抗纤维化作用,这种作用独立于Smad信号( 17 , 18 ). 我们的观察结果还表明,通过cAMP升高(FSK和iloprost)发出信号的药物对SM-α-actin表达的Smad依赖性调节,更重要的是,这是通过抑制SRF实现的( 图5 , 6 ). cAMP抑制SRF活性的机制尚不完全清楚。 我们以前的研究表明,cAMP通过激活蛋白PKA抑制VSMC中的SRF活性( 21 , 26 ). 众所周知,PKA可以磷酸化RhoA( 43 ),提示通过抑制RhoA调节SRF的潜在机制。 第二,我们之前的结果( 21 )并呈现数据( 图5B )显示PKA对血管扩张剂刺激的磷酸蛋白(VASP)的磷酸化。 鉴于VASP促进肌动蛋白聚合和SRF活化( 44 )鉴于磷酸化VASP不能结合肌动蛋白丝( 45 )VASP可以为PKA对SRF的调控提供额外的机制。 第三,SRF本身可以被PKA磷酸化( 46 )可能表明PKA对SRF有直接调节作用。 最后,cAMP最近被证明可以刺激cAMP激活的交换蛋白Epac( 47 )也可能调节肌成纤维细胞的纤维化特征,如胶原合成( 48 ),和增殖( 49 , 50 )表明cAMP可能对SRF和/或SM–α-actin表达进行PKA非依赖性调节。 我们实验室正在研究这些可能性。
致谢 作者感谢Julian Solway博士(芝加哥大学)、Joseph Miano博士(罗切斯特大学)、Sem Phan博士(密歇根大学)和Bert Vogelstein博士(约翰·霍普金斯大学)提供DNA和腺病毒试剂。
本研究得到了美国国立卫生研究院HL071755(给N.O.D.)和美国心脏协会博士后奖学金AHA 0520109Z(给N.S.)的支持。
最初作为DOI:10.1165/rcmb.2008-0288OC出版于2009年1月16日
利益冲突声明 : 作者中没有一人与对本手稿主题感兴趣的商业实体有财务关系。
工具书类
1 Leask A,Abraham DJ。TGF-β信号转导与纤维化反应。 FASEB J 2004; 18:816–827. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Phan SH.肺纤维化中的成纤维细胞表型。 美国呼吸细胞分子生物学杂志2003; 29:S87–S92。 [ 公共医学 ] [ 谷歌学者 ]
三。 Hinz B、Phan SH、Thannickal VJ、Galli A、Bochaton-Piallat ML、Gabbiani G。肌成纤维细胞:一种功能,多种来源。 《美国病理杂志》2007年; 170:1807–1816. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
4 Powell DW、Mifflin RC、Valentich JD、Crowe SE、Saada JI、West AB。肌成纤维细胞:I.旁分泌细胞在健康和疾病中的重要作用。 美国生理学杂志1999; 277:C1–C9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
5 Broekelmann TJ、Limper AH、Colby TV、McDonald JA。 转化生长因子β1存在于人肺纤维化细胞外基质基因表达部位。 美国国家科学院院刊1991; 88:6642–6646. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
6 Kang HR、Cho SJ、Lee CG、Homer RJ、Elias JA。 转化生长因子(TGF)-β1通过涉及基质金属蛋白酶-12的bax依赖性双激活途径刺激肺纤维化和炎症。 生物化学杂志2007; 282:7723–7732. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
7 桑塔纳A、萨克塞纳B、诺布尔NA、金李、马歇尔BC。 博莱霉素诱导的肺纤维化中转化生长因子β亚型(β1、β2、β3)的表达增加。 美国呼吸细胞分子生物学杂志1995; 13:34–44. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
8 Phan SH,Kunkel SL。博莱霉素诱导的肺纤维化中肺细胞因子的产生。 1992年实验肺研究; 18:29–43. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9 Feng XH,Derynk R.通过Smads在TGF-β信号转导中的特异性和多功能性。 2005年细胞开发生物年鉴; 21:659–693. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
10 Derynck R,Zhang YE。TGF-β家族信号转导中Smad依赖性和Smad非依赖性通路。 《自然》2003; 425:577–584. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
11 Subramanian SV、Polikandriotis JA、Kelm RJ Jr、David JJ、Orosz CG、Strauch AR。通过pur阻遏蛋白和sp1/smad辅活化因子之间的动态相互作用介导转化生长因子β活化的肌成纤维细胞中血管平滑肌α-actin基因转录的诱导。 分子生物学细胞2004; 15:4532–4543. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 邱平,冯晓华,李磊。在肌成纤维细胞分化过程中,smad3和srf-相关复合物的相互作用介导TGF-β1信号调节sm22转录。 《分子细胞心脏病学杂志》2003; 35:1407–1420. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
13. Hu B,Wu Z,Phan SH.Smad3介导转化生长因子-β诱导的α-平滑肌肌动蛋白表达。 美国呼吸细胞分子生物学杂志2003; 29:397–404. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
14 Adam PJ、Regan CP、Hautmann MB、Owens GK。 正作用和负作用的kruppel-like转录因子结合体内平滑肌细胞分化标记物sm22alpha表达所需的转化生长因子β控制元件。 生物化学杂志2000; 275:37798–37806. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
15 Hu B,Wu Z,Liu T,Ullenbruch MR,Jin H,Phan SH.肠富kruppel-like因子与smad3相互作用抑制肌成纤维细胞分化。 美国呼吸细胞分子生物学杂志2007; 36:78–84. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
16 Cogan JG、Subramanian SV、Polikandriotis JA、Kelm RJ Jr、Strauch AR。肌成纤维细胞分化过程中血管平滑肌α-actin基因转录需要与mcat增强子近端的sp1/3蛋白结合。 生物化学杂志2002; 277:36433–36442. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
17 Thomas PE、Peters-Golden M、White ES、Thannickal VJ、Moore BB。PGE(2)对TGF-beta1诱导的肌成纤维细胞分化的抑制是独立的,但涉及细胞形状和粘附依赖性信号。 美国生理学杂志肺细胞分子生理学2007; 293:L417–L428。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
18 Kolodsick JE、Peters-Golden M、Larios J、Toews GB、Thannickal VJ、Moore BB。前列腺素E2通过e.前列腺素受体2信号传导和环磷酸腺苷升高抑制成纤维细胞向肌成纤维细胞的转化。 美国呼吸细胞分子生物学杂志2003; 29:537–544. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 血清反应因子:在不同的基因表达程序之间切换。 《分子细胞心脏病学杂志》2003; 35:577–593. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
20 毛J,袁H,谢伟,西蒙·米兰芳,吴丹。G蛋白在不同受体调节血清反应因子介导的基因转录中的特异性参与。 生物化学杂志1998; 273:27118–27123. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
21 Davis A、Hogarth K、Fernandes D、Solway J、Niu J、Kolenko V、Browning D、Miano JM、Orlov SN、Dulin NO。内皮素-1和ATP激活蛋白激酶A的功能意义:PKA对srf依赖性基因表达的负调控。 细胞信号2003; 15:597–604. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
22 Roy SG,Nozaki Y,Phan SH.大鼠肺成纤维细胞向肌成纤维细胞分化过程中α-平滑肌肌动蛋白基因表达的调节。 国际生物化学细胞生物学杂志2001; 33:723–734. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
23 豪特曼MB,亚当PJ,欧文斯GK。 TGF-β在平滑肌和非平滑肌细胞中诱导平滑肌α-肌动蛋白的相似性和差异性。 《动脉硬化血栓血管生物学》1999; 19:2049–2058. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
24 Yau DM、Sethakorn N、Taurin S、Kregel S、Sandbo N、Camoretti-Mercado B、Sperling AI、Dulin NO.通过rgs3调节smad介导的基因转录。 摩尔药理学2008; 73:1356–1361. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
25 Grueneberg DA、Natesan S、Alexandre C、Gilman MZ。增强血清反应因子DNA结合活性的人类和果蝇同源域蛋白。 科学1992; 257:1089–1095. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
26 Hogarth DK、Sandbo N、Taurin S、Kolenko V、Miano JM、Dulin NO。PKA在细胞外ATP对血管平滑肌细胞表型调节中的双重作用。 美国生理学杂志《细胞生理学》2004; 287:C449–C456。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
27 Sandbo N,Qin Y,Taurin S,Hogarth DK,Kreutz B,Dulin NO。蛋白酶体抑制剂对血清反应因子依赖性基因表达的调节。 摩尔药理学2005; 67:789–797. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
28 Sandbo N、Taurin S、Yau DM、Kregel S、Mitchell R、Dulin NO。细菌脂多糖对平滑肌α-肌动蛋白表达的下调。 2007年心血管研究; 74:262–269. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
29 Chow N、Bell RD、Deane R、Streb JW、Chen J、Brooks A、Van Nostrand W、Miano JM、Zlokovic BV。血清反应因子和心肌蛋白介导阿尔茨海默病表型中的动脉收缩过度和脑血流失调。 美国国家科学院院刊2007; 104:823–828. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
30 Evelyn CR、Wade SM、Wang Q、Wu M、Iniguez-Lluhi JA、Merajver SD、Neubig RR。Ccg-1423:rhoa转录信号的小分子抑制剂。 Mol Cancer Ther 2007; 6:2249–2260. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
31 Spencer JA,Misra RP。血清反应因子基因的表达受血清反应因子结合位点的调节。 生物化学杂志,1996年; 271:16535–16543. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
32 Spencer JA,Misra RP。srf基因的表达通过ras/sp/srf介导的机制来响应血清生长信号。 癌基因1999; 18:7319–7327. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
33. Butt E、Abel K、Krieger M、Palm D、Hoppe V、HoppeJ、Walter U.体外和完整人类血小板中黏着局部血管扩张刺激磷酸蛋白(VASP)的CAMP和CGMP依赖性蛋白激酶磷酸化位点。 生物化学杂志1994; 269:14509–14517. [ 公共医学 ] [ 谷歌学者 ]
34 Bos CL、Richel DJ、Ritsema T、Peppelenbosch MP、Versteeg HH。 信号转导中的前列腺素和前列腺素受体。 国际生物化学细胞生物学杂志2004; 36:1187–1205. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35 Yang Y,Zhe X,Phan SH,Ullenbruch M,Schuger L.博来霉素诱导的肺损伤过程中血清反应因子亚型参与肌成纤维细胞分化。 美国呼吸细胞分子生物学杂志2003; 29:583–590. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
36 Misra RP、Rivera VM、Wang JM、Fan PD、Greenberg ME。血清反应因子在血清刺激的成纤维细胞中合成后,通过磷酸化被广泛修饰。 分子细胞生物学1991; 11:4545–4554. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
37 Miralles F,Posern G,Zaromytidou AI,Treisman R.肌动蛋白动力学通过调节其辅激活子mal来控制srf活性。细胞2003; 113:329–342. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
38 Sotiropoulos A、Gineitis D、Copeland J、Treisman R。血清反应因子的信号调节激活由肌动蛋白动力学变化介导。 细胞1999; 98:159–169. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
39 Hill CS、Wynne J、Treisman R.rho家族GTPases rhoa、rac1和cdc42hs通过srf.Cell 1995调节转录激活; 81:1159–1170. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
40 Kono Y、Nishiuma T、Nishimura Y、Kotani Y、Okada T、Nakamura S、Yokoyama M。鞘氨醇激酶1通过TGF-beta1调节人和小鼠肺成纤维细胞的分化。 美国呼吸细胞分子生物学杂志2007; 37:395–404. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
41 Lockman K、Hinson JS、Medlin MD、Morris D、Taylor JM、Mack CP。1-磷酸鞘氨醇通过激活单独的血清反应因子辅助因子来刺激平滑肌细胞分化和增殖。 生物化学杂志2004; 279:42422–42430. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
42 Camoretti-Mercado B、Fernandes DJ、Dewundara S、Churchill J、Ma L、Kogut PC、McConville JF、Parmacek MS、Solway J.通过smad7抑制转化生长因子β增强血清反应因子依赖性转录。 生物化学杂志2006; 281:20383–20392. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
43 Lang P,Gesbert F,Delespine-Carmagnat M,Stancou R,Pouchelet M,Bertoglio J.蛋白激酶rhoa的磷酸化介导细胞毒性淋巴细胞中环状AMP的形态和功能效应。 EMBO J 1996; 15:510–519. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
44 Walders-Harbeck B、Khaitlina SY、Hinssen H、Jockusch BM、Illenberger S。血管扩张剂刺激的磷酸蛋白通过与单体肌动蛋白直接结合促进肌动蛋白聚合。 FEBS Lett 2002; 529:275–280. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
45 Harbeck B、Huttelmaier S、Schluter K、Jockusch BM、Illenberger S。血管扩张剂刺激磷酸蛋白的磷酸化调节其与肌动蛋白的相互作用。 生物化学杂志2000; 275:30817–30825. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
46 Gauthier-Rouviere C、Vandrome M、Lautredou N、Cai QQ、Girard F、Fernandez A、Lamb N。血清反应因子核定位信号:环腺苷酸依赖性蛋白激酶活性在控制核移位中的一般意义。 分子细胞生物学1995; 15:433–444. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
47 de Rooij J、Zwartkruis FJ、Verheijen MH、Cool RH、Nijman SM、Wittinghofer A、Bos JL。 Epac是一种由环腺苷酸直接激活的rap1鸟嘌呤核苷酸交换因子。 《自然》1998; 396:474–477. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
48 Yokoyama U、Patel HH、Lai NC、Aroonsakool N、Roth DM、Insel PA。循环AMP效应器epac整合促纤维化和抗纤维化信号。 美国国家科学院院刊2008; 105:6386–6391. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
49 Huang S,Wettlaufer SH,Hogaboam C,Aronoff DM,Peters-Golden M.前列腺素E(2)通过E前列腺素2受体和camp信号抑制患者源性正常肺成纤维细胞中胶原的表达和增殖。 美国生理学杂志肺细胞分子生理学2007; 292:L405–L413。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
50 Huang SK,Wettlaufer SH,Chung J,Peters-Golden M.前列腺素E2通过PKA和EPAC-1的选择性作用抑制特定的肺成纤维细胞功能。 美国呼吸细胞分子生物学杂志2008; 39:482–489. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
美国呼吸细胞和分子生物学杂志的文章由以下网站提供 美国胸科学会