摘要 在乳腺癌和结肠癌中,转化生长因子(TGF)-β信号最初具有抗肿瘤作用,抑制肿瘤生长,但最终发挥促癌作用,增加运动能力和癌症扩散。 在前列腺癌中,使用人体样本的研究已将TGF-βII型受体(TβRII)的缺失与较高的肿瘤分级相关联。 为了确定抑制TGF-β途径对前列腺癌的影响,我们将前列腺中表达致瘤SV40大T抗原的转基因小鼠与表达显性阴性TβRII突变体的转基因小鼠杂交( 挪威船级社 )在前列腺中。 在前列腺中发现了转基因和转化生长因子-β1的表达,作为转化生长因子-β信号传导标志物的纤溶酶原激活物抑制剂I型的蛋白水平降低与 挪威船级社 虽然肿瘤前列腺的大小没有增大,但与仅表达大T抗原转基因的年龄匹配的对照小鼠相比,表达这两种转基因的小鼠的转移量增加。 我们的研究首次证明前列腺癌中TGF-β信号传导的中断在促进肿瘤转移中起着因果作用。
关键词: 转化生长因子-β、前列腺癌、转移、先证素、转基因小鼠
介绍 前列腺癌是一种异质性疾病,通常从前列腺上皮内瘤变(PIN)发展为局部侵袭性癌和潜在的转移性癌。 局部浸润性癌的外科治疗产生的10年无进展生存率大于90%。 相比之下,转移癌的发展使生存概率下降到30%左右[ 1 ]. 转移发生在晚期前列腺癌中,其中一些癌症的 p53,RB 和TGF-βII型受体(TβRII)已被鉴定[ 2–5 ]. TβRII转导普遍存在的多效性细胞因子转化生长因子(TGF)-β的信号,TGF-β参与多种途径,包括生长抑制、凋亡和分化[ 6–8 ]. TGF-β信号传导涉及配体与TβRII胞外区的结合,TGF-, 以及随后Smad信号分子的磷酸化,这些信号分子可以激活下游靶点的转录,如纤溶酶原激活物抑制剂I型(PAI-I)[ 9,10 ]. 尽管TβRII的丢失与前列腺癌有关,但其对肿瘤进展的影响尚未确定。 我们研究了前列腺癌转基因小鼠模型,以检测阻断TGF-β信号通路对肿瘤发展和进展的影响。
大先证素(LPB)启动子引导前列腺上皮细胞表达SV40大T抗原( 标签 ) [ 11 ],在早期区域缺失以去除小t抗原。 致癌的 标签 据报道,通过隔离和灭活两个抑癌基因, 第53页 和 皇家银行 与前列腺癌相关[ 2,3 ]. 两个LPB- 标签 12T-7f和12T-10系用于研究前列腺肿瘤进展的不同方面。 12T-7f系在23周龄时发生致命大小的前列腺肿瘤,其中包括高级前列腺上皮内瘤变(HGPIN)和偶发浸润性癌灶(IC)[ 12 ]. 我们选择这条线来测试阻断TGF-β信号是否会促进癌前体向更具局部侵袭性和/或转移性癌症的进展。 然而,12T-10系出现了包含HGPIN和侵袭性神经内分泌癌的小前列腺病变,6个月后转移[ 13 ]. 选择该系以确定抑制TGF-β途径是否会改变转移表型。
虽然用先证素启动子构建了多个株系,以靶向显性阴性TβRII突变体( 挪威船级社 )在转基因小鼠的前列腺中,没有一个系表达 挪威船级社 转基因(未发表的观察结果)。 锌诱导金属硫蛋白(MT)启动子非常适合在前列腺中表达转基因,因为前列腺中天然含有高水平的锌,并且在上皮中表达多个MT[ 14 ]. 这个 挪威船级社 构建物具有Flag表位,包含人类TβRII的细胞外、跨膜和膜旁结构域(aa 1–191),但缺乏下游信号传导的细胞质激酶结构域[ 15 ]. 过度表达 挪威船级社 转基因通过与天然低水平的内源性TβRII竞争TGF-β配体并与内源性TGF-α受体I型结合,在转基因小鼠中产生显性负突变[ 16 ]. 通过用12T-7f和12T-10小鼠繁殖MT-DNIIR小鼠,我们假设 挪威船级社 转基因 标签 肿瘤会抑制TGF-β信号传导并改变肿瘤表型。
材料和方法 转基因小鼠的产生和基因分型 低压断路器- 标签 将大鼠LPB基因的5′-侧翼区域(-10834至+28bp)与 标签 基因缺失突变体( 2005年1月 )去除了小t抗原的表达[ 12 ]. CD1小鼠株中保持了12T-7f和12T-10株系。 MT-DNIIR转基因小鼠(MT-DNIIR-27)是使用截短的人类TβRII(Flag表位为 挪威船级社 MT启动子控制下的转基因[ 15 ]. 本研究中使用的MT-DNIIR系在B6D2小鼠株中保持不变。 第12T-7fT页 标签 +/- 雌性与MT-DNIIR交配 DNIIR公司+/+ 雄性小鼠在相似的小鼠背景下产生12T-7f/MT-DNIIR和MT-DNIIR小鼠。 12T-7f/MT-DNIIR和MT-DNIIR小鼠在饮用水中补充25 mM硫酸锌以增强转基因表达。 第12T-7f页 标签 +/- 雌性与B6D2F1雄性交配,以在相同的小鼠背景下产生对照12T-7f和非转基因(NT)小鼠。 一些对照12T-7f和NT小鼠在饮用水中补充25 mM硫酸锌。 第12页,第10页 标签 +/+ 雌性与MT-DNIIR交配 挪威船级社 +/+ 雄性小鼠产生12T-10/MT-DNIIR小鼠。 为了控制遗传背景,12T-10 标签 +/+ 雌性与B6D2F1雄性交配产生12T-10小鼠。 12T-10/MT-DNIIR或12T-10小鼠均未在饮用水中补充25 mM硫酸锌。 小鼠的基因型为 挪威船级社 用蛋白酶K消化和乙醇提取法对小鼠尾部基因组DNA进行聚合酶链反应(PCR)转基因分析。 正向TβRII引物(5′-TCCACCGCACGTTCAGAAG-3′)和反向Flag引物(5′-ATCGTCATCGTCTTTGTAGTC-3′)产生一个506bp的扩增子[ 15 ]. 小鼠的基因型为 标签 使用正向LPB引物(5′-TAGCATCTTGTTCTTAGTCTT-3′)和反向LPB引物通过PCR分析转基因 标签 引物(5′-CTCCTCTCAAGACCTAGAGGTCCA-3′)产生430 bp的扩增子[ 12 ]. 内源性小鼠酪蛋白基因的外显子7是 标签 使用正向酪蛋白引物(5′;-GATGTGCTCCAGGCTAAAGTT-3′)和反向酪蛋白引子(5′,-AGAAACGGAATGTTGGAGT-3′)进行PCR反应,生成540-bp扩增子[ 12 ].
组织制备和组织病理学分析 根据范德比尔特大学动物护理委员会的政策,小鼠在吸入麻醉剂后因颈椎脱位而死亡。 在解剖显微镜下,前列腺通常被解剖成四个不同的叶(腹叶、侧叶、背叶和前叶)。 当无法分离侧叶和背叶时,这些组织被视为背外侧叶。 同时采集精囊、输精管、睾丸、尿道旁腺、膀胱、球部尿道腺、主动脉旁淋巴结、颈部淋巴结、腰椎、肝、肺、肾、脾、脑、肾上腺、腮腺和颌下腺进行组织学检查。 组织要么在干冰上冷冻并储存在-80°C下,要么固定在10%福尔马林中,然后使用标准技术进行处理并嵌入石蜡中。 于上午5点切割石蜡层组织,切片用于H&E染色、免疫组织化学和 就地 杂交。 两位病理学家(S.B.S.和R.L.R.)根据国家癌症研究所人类癌症小鼠模型联合会前列腺病理委员会的组织病理学定义,以盲法对组织学进行分类[ 17 ].
免疫组织化学 在5µm厚的石蜡切片上进行免疫染色,石蜡切片用标准技术脱蜡并重新水化[ 13 ]. 使用了以下主要抗体(PBS中指示的稀释液):(a) SV40标签 ,Ab-2(1:100;致癌研究产品,马萨诸塞州波士顿); (b) CG,牛SP-1(1:1000;迪亚索林,静水,明尼苏达州); 和(c)TGF-β1,sc-146(1:200;加州圣克鲁斯圣克鲁斯生物技术公司)。 对于 标签 -免疫染色切片中,使用相同浓度的对照小鼠腹水(西格玛,圣路易斯,密苏里州)作为阴性对照。 对于CG-免疫染色切片,使用相同浓度的正常兔免疫球蛋白X903(Dako,Carpintia,CA)作为阴性对照。 对于TGF-β1-免疫染色切片,以10倍于一级抗体浓度的对照肽(sc-146P)与一级抗体一起加入作为阴性对照,或使用相同浓度的正常兔免疫球蛋白作为阴性对照。 用3,3′-二氨基联苯胺四氯化物(Dako)进行显色。 玻片用苏木精复染,脱水,盖玻片。 使用MetaMorph图像分析程序对部分免疫染色进行量化。
DNIIR原位杂交 现场 杂交是在5µm厚的石蜡切片上进行的,石蜡切片用标准技术脱蜡并重新水化[ 15 ]. 将切片杂交到 35 S标记的正、反义核糖探针。 MT-DNIIR质粒用线性化 生态 RI,用T7聚合酶制备反义探针。 传感探头由 Xba公司 I线性化质粒和T3聚合酶。 将载玻片暴露于4°C的感光乳剂中1个月,然后用D19显影剂显影,在1%乙酸中固定,并在30%硫代硫酸钠中清除。 切片用0.2%甲苯胺蓝复染。 柯达Ektachrome胶片(伊士曼柯达,纽约州罗切斯特)用于使用显微镜(蔡司,纽约州桑伍德)在相位对比、亮场和暗场照明下拍摄照片。
定量实时逆转录酶聚合酶链反应(RT-PCR) 使用RNeasy Midi试剂盒75144从冷冻样品中提取RNA,包括用DNase 79254(Qiagen,Valencia,CA)处理。 根据分光光度计上的吸光度测定RNA浓度,并通过琼脂糖凝胶电泳评估RNA质量。 挪威船级社 使用Lightcycler荧光温度快速空气循环器(印第安纳波利斯罗氏分子生物化学公司)和cDNA标准曲线以及双链DNA结合荧光探针SYBR Green测定拷贝数。 该cDNA模板由MT-DNIIR质粒产生。 前锋 挪威船级社 引物(5′;-AGAAGAATAAACACCACAATCC-3′)和反向 挪威船级社 引物(5′;-ATCCAACGCGGTAGAGTAGAAGA-3′)产生了一个128-bp的扩增子。 熔融曲线分析证实了扩增子在每个反应中的特异性。 使用Lightcycle软件(3.5版),根据系列稀释(1:10)标准曲线(10)计算mRNA的拷贝数 9 -10 三 副本)。 使用七点分析的拟合点法,将连续稀释的标准品与未知样品同时放大,以生成线性标准曲线。 此外,使用cDNA模板、正向β-肌动蛋白引物(5′;-ACGCCAGGTCATCACTATTG-3′)和反向h-肌动蛋白引物(5′;-ATGTACTCAGGCCGGGGA-3′),开发了β-肌动蛋白的实时RT-PCR作为负载对照。
Western Blot和条带定量 通过在RIPA缓冲液(PBS,pH 7.4,1%NP-40,0.5%脱氧胆酸钠,0.1%SDS)中对冷冻组织进行超声和离心提取蛋白质,该缓冲液补充有1 mM PMSF和完整的迷你蛋白酶抑制剂混合物,1836153(德国曼海姆罗氏)。 蛋白质浓度通过Lowry方法使用Bio-Rad蛋白质分析500-0006测定(加利福尼亚州Hercules的Bio-Rad实验室)。 蛋白质裂解物用β-巯基乙醇处理,并在70°C下加热10分钟,然后在NuPage 7%Tris-醋酸盐凝胶EA035A(Invitrogen,Carlsbad,CA)中电泳。 蛋白质在30 V下过夜转移到Invitrolon PVDF膜LC2005(Invitrogen)。 在含有0.1%吐温的TBS中,用含有5%脱脂牛奶的封闭缓冲液封闭膜。 对于PAII检测,使用封闭缓冲液中1:1000稀释度的抗PAI-I多克隆抗体TP223(Torrey Pines Biolaboraties,Houston TX),然后使用1:2000稀释率的辣根过氧化物酶相关抗兔Ig NA9340(Amersham Biosciences,Beckinghamshire,England,UK)。 使用ECL加RPN2132(Amersham Biosciences)和Kodak BioMax MR Film 870-1302(Eastman Kodak)对条带进行可视化。
为了进行′-肌动蛋白检测,在70°C下,通过在剥离缓冲液(2%SDS,62.5 mM Tris-HCl,pH 7.4,100 mMβ-巯基乙醇)中培养30分钟,剥离PAI-I西部膜。 然后用单克隆抗β-肌动蛋白抗体A5441(Sigma)在1:5000的封闭缓冲液中封闭并探测细胞膜,然后用1:2000稀释度的辣根过氧化物酶连接的抗鼠Ig NA931V(Amersham Biosciences)在封闭缓冲液里探测细胞膜。 使用ECL+RPN2132和柯达BioMax MR胶片870-1302对带状物进行可视化。
为了进行波段定量,对曝光的胶片进行扫描,以在Adobe Photoshop中获得TIFF图像。 对于每个膜图像,使用Scion图像分析程序(Scion,Frederick,MD)测量恒定区域中的带强度。 将带强度值传输至Microsoft Excel程序进行统计分析。
统计分析 异链酶 t吨 -通过测试比较两组的Western blot数据。 采用Fisher精确检验和广义线性模型(Logistic回归模型)比较两组的转移数据。 P(P) 值<0.05被认为具有统计学意义。 这些分析是与范德比尔特癌症中心生物统计共享资源合作进行的。
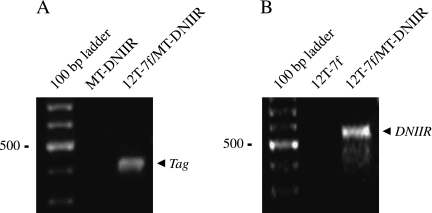
结果 转基因小鼠的制备与鉴定 12T-7f系是杂合的 标签 转基因,而12T-10系是纯合的 标签 转基因。 MT-DNIIR系是纯合的 挪威船级社 转基因。 因此,12T-7f小鼠与MT-DNIIR小鼠杂交产生12T-7f/MT-DNIIR后代和MT-DNIIR对照后代。12T-7f小鼠与B6D2F1小鼠杂交产生12T-7f对照后代和NT后代。12T-10小鼠与MT-DNIIR小鼠杂交产生12T-10/MT-DNIIR小鼠。 将12T-10小鼠与B6D2F1小鼠杂交,产生12T-10对照后代。利用从小鼠尾部分离的基因组DNA,通过PCR对后代进行基因分型( 箭头 , 图1 , 一 和 B类 ).
图1。
转基因小鼠转基因检测。 (A) 使用Tag转基因引物集进行PCR基因分型的示例。 Tag-amplified产品的预期规模为430 bp。 在12T-7f/MT-DNIIR样品中检测到转基因,但在MT-DNIIR样品中未检测到转基因。 (B) 使用DNIIR转基因引物集进行PCR基因分型的示例。 DNIIR扩增产物的预期大小为506 bp。 在12T-7f/MT-DNIIR样品中检测到转基因,但在12T-7样品中未检测到转基因。
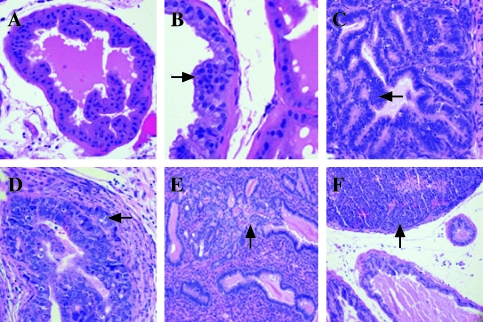
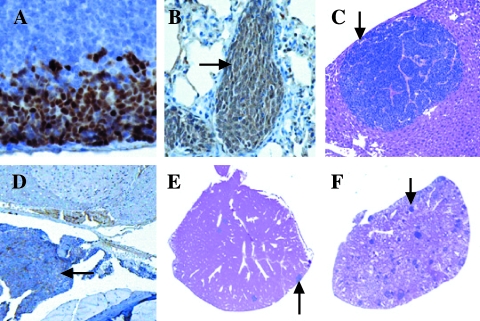
前列腺的组织学检查显示,在表达T抗原的小鼠中,前列腺发生了进行性肿瘤,但在其他小鼠中,病变很小或没有。 两位病理学家(S.B.S.和R.L.R.)以盲法将前列腺分类为无组织学异常(NHA)、低级别前列腺上皮内瘤变(LGPIN)、HGPIN、微创癌(MI)、IC或未分化癌(UC)[ 13,17 ]. 与正常区域相比,LGPIN和HGPIN的特征是上皮细胞在基底膜结合的原有腺体内分层和拥挤,并伴有细胞学异常,如细胞核增大( 箭头 , 图2 , A–C ). HGPIN与LGPIN的区别在于这些特征的加重,包括显著的核异型性、更多的深染细胞核以及较高的有丝分裂和凋亡率( 箭头 , 图2 , B类 和 C类 ). MI被认为是单个细胞或细胞群突破含HGPIN腺体基底膜进入周围基质的病灶( 箭头 , 图2 D类 ). 当病变范围比上述MI更广时,将其指定为IC,腺体病灶显示浸润( 箭头 , 图2 E类 ). UC以侵袭性病变为特征,常表现为正常前列腺结构的破坏性过度生长,缺乏腺体分化,但具有神经内分泌分化的细胞学和组织学特征( 箭头 , 图2 F类 ). MT-DNIIR和NT小鼠主要表现为NHA或LGPIN,很少表现为HGPIN,但前列腺中没有癌症。 鉴于癌症仅在表达T抗原的小鼠中被发现,且主要发生在背外侧叶,我们将重点放在这些小鼠的背外侧前列腺(DLP)上进行进一步的实验( 表1 ).
图2。
转基因动物组织病理学图解(H&E)。 (A) NHA位于12周龄NT小鼠的DLP中。 (B) LGPIN(箭头)位于23周龄MT-DNIIR鼠标的DLP中。 (C) 18周龄12T-7小鼠的DLP中的HGPIN(箭头)。 (D) 9个月大的12T-10小鼠DLP中的MI(箭头)。 (E) 20周龄12T-7f/MT-DNIIR鼠标的DLP中的IC(箭头)。 (F) 10个月大的12T-10/MT-DNIIR鼠标副总裁中的UC(箭头)。
表1。
线路 鼠标编号 年龄 AP公司 DLP公司 副总裁 变质地点
12T-7f/MT-DIIR公司 9237 12周 HGPIN公司 HGPIN公司 国家公路局 无
12T-7f/MT-DIIR公司 9240 12周 HGPIN公司 HGPIN公司 国家公路局 无
12T-7f/MT-DIIR公司 9241 12周 HGPIN公司 HGPIN公司 国家公路局 无
12T-7f/MT-DIIR公司 A3474 12周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3476型 12周 HGPIN公司 HGPIN公司 国家公路局 无
12T-7f/MT-DIIR公司 A3477飞机 12周 HGPIN公司 HGPIN公司 LGPIN码 无
12T-7f/MT-DIIR公司 A3478飞机 12周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3231型 12周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3242型 12周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3246飞机 12周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3479型 12周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3483型 12周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3484飞机 12周 HGPIN公司 HGPIN公司 国家公路局 无
12T-7f/MT-DIIR公司 9201 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 9207 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 9208 16周 HGPIN公司 HGPIN,集成电路 HGPIN公司 肺
12T-7f/MT-DIIR公司 A3187型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3190型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3199型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3203 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3204型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3207型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3208型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 第3209页 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3499飞机 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3505型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3117飞机 16周 HGPIN公司 HGPIN公司 国家公路局 无
第12T-7f页 A3120型 16周 HGPIN公司 HGPIN公司 HGPIN公司 肺
第12T-7f页 A3218飞机 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3221型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3228型 16周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3232型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3233型 16周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3234飞机 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3235 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3239型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3243飞机 16周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3244型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3247飞机 16周 HGPIN公司 HGPIN公司 LGPIN码 肺
第12T-7f页 A3249型 16周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3251型 16周 HGPIN公司 HGPIN公司 国家公路局 无
第12T-7f页 A3252型 16周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3276飞机 16周 HGPIN公司 HGPIN、IC、UC HGPIN、IC、UC 液态氮
12T-7f/MT-DIIR公司 9215 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 9218 18周 HGPIN公司 HGPIN,集成电路 HGPIN公司 肺、肝、LN、脊柱
12T-7f/MT-DIIR公司 9239 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3028型 18周 HGPIN公司 HGPIN公司 HGPIN公司 肺
12T-7f/MT-DIIR公司 A3078型 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 3194年 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3195型 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 A3490型 18周 HGPIN公司 HGPIN公司 HGPIN公司 肺
12T-7f/MT-DIIR公司 A3491型 18周 HGPIN公司 HGPIN公司 HGPIN公司 肺、肝
第12T-7f页 A3104飞机 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3108飞机 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3283飞机 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3285型 18周 HGPIN,集成电路 HGPIN公司 LGPIN码 无
第12T-7f页 A3286飞机 18周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 9212 20周 HGPIN,集成电路 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 9219 20周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 9223 20周 HGPIN,集成电路 HGPIN,集成电路 HGPIN公司 无
12T-7f/MT-DIIR公司 A3087型 20周 HGPIN公司 HGPIN公司 LGPIN码 无
12T-7f/MT-DIIR公司 A3210 20周 HGPIN公司 HGPIN,集成电路 LGPIN码 肺
第12T-7f页 9194 20周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 9195 20周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 9197 20周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3271飞机 20周 HGPIN公司 HGPIN公司 HGPIN公司 肺、肝、脊柱
第12T-7f页 A3274型 20周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3384 20周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3387飞机 20周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3391型 20周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 9220 23周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 9227 23周 HGPIN公司 HGPIN,集成电路 国家公路局 肺
12T-7f/MT-DIIR公司 A3018型 23周 HGPIN公司 HGPIN公司 LGPIN码 无
12T-7f/MT-DIIR公司 A3030型 23周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-7f/MT-DIIR公司 2008年3月 23周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 9245 23周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 9246 23周 HGPIN公司 HGPIN公司 HGPIN公司 无
第12T-7f页 A3258型 23周 HGPIN公司 HGPIN,集成电路 HGPIN公司 无
第12T-7f页 A3265飞机 23周 HGPIN公司 HGPIN公司 LGPIN码 无
第12T-7f页 A3278型 23周 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-10/MT-DNIIR公司 A3130型 6个月 HGPIN公司 HGPIN公司 密歇根州HGPIN 无
12T-10/MT-DNIIR公司 A3131型 6个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
12T-10/MT-DNIIR公司 A3132型 6个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
12T-10/MT-DNIIR公司 A3133型 6个月 HGPIN公司 HGPIN公司 HGPIN公司 肺
12T-10/MT-DNIIR公司 A3134飞机 6个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
第12页,第10页 A3158型 6个月 HGPIN公司 HGPIN公司 HGPIN公司 无
第12页,第10页 A3159飞机 6个月 HGPIN公司 HGPIN公司 HGPIN公司 无
第12页,第10页 A3160型 6个月 HGPIN公司 HGPIN公司 HGPIN公司 无
第12页,第10页 A3161型 6个月 HGPIN公司 HGPIN公司 HGPIN公司 无
第12页,第10页 A3164型 6个月 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-10/MT-DNIIR公司 A3142型 7个月 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-10/MT-DNIIR公司 A3143型 7个月 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-10/MT-DNIIR公司 A3144型 7个月 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-10/MT-DNIIR公司 A3145型 7个月 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-10/MT-DNIIR公司 A3146型 7个月 HGPIN公司 HGPIN公司 HGPIN公司 无
第12页,第10页 A3162型 7个月 HGPIN公司 密歇根州HGPIN HGPIN公司 肺
第12页,第10页 A3163飞机 7个月 HGPIN公司 HGPIN公司 HGPIN公司 无
第12页,第10页 A3169型 7个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
第12页,第10页 A3170飞机 7个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
第12页,第10页 A3171飞机 7个月 HGPIN公司 密歇根州HGPIN HGPIN公司 肺
12T-10/MT-DNIIR公司 A3150型 8个月 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-10/MT-DNIIR公司 A3151型 8个月 HGPIN公司 HGPIN,集成电路 HGPIN公司 无
12T-10/MT-DNIIR公司 A3152型 8个月 HGPIN公司 HGPIN、密歇根州、IC HGPIN公司 无
12T-10/MT-DNIIR公司 A3407飞机 8个月 HGPIN公司 密歇根州HGPIN 密歇根州HGPIN 肺、肝
第12页,第10页 A3175 8个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
第12页,第10页 A3176型 8个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
第12页,第10页 A3177型 8个月 HGPIN公司 HGPIN公司 HGPIN公司 无
第12页,第10页 A3178型 8个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
第12页,第10页 A3179型 8个月 HGPIN公司 HGPIN公司 HGPIN公司 无
12T-10/MT-DNIIR公司 A3403型 9个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
12T-10/MT-DNIIR公司 A3404飞机 9个月 HGPIN公司 密歇根州HGPIN 密歇根州HGPIN 肺、肝、LN
12T-10/MT-DNIIR公司 A3405型 9个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
12T-10/MT-DNIIR公司 A3406飞机 9个月 HGPIN公司 密歇根州HGPIN 密歇根州HGPIN 肺、肝
12T-10/MT-DNIIR公司 A3408飞机 9个月 HGPIN公司 密歇根州HGPIN HGPIN公司 肺、肝
第12页,第10页 A3394飞机 9个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
第12页,第10页 A3395型 9个月 HGPIN公司 密歇根州HGPIN HGPIN公司 肺
第12页,第10页 A3396飞机 9个月 密歇根州HGPIN HGPIN、密歇根州、IC HGPIN公司 肺、肝
第12页,第10页 A3397飞机 9个月 HGPIN公司 密歇根州HGPIN HGPIN公司 肺
12T-10/MT-DNIIR公司 A3135飞机 10个月 密歇根州HGPIN 密歇根州HGPIN HGPIN、IC、UC 肺、肝、LN
12T-10/MT-DNIIR公司 A3137型 10个月 HGPIN公司 HGPIN,集成电路 HGPIN、IC、UC 肺,LN
12T-10/MT-DNIIR公司 A3138型 10个月 HGPIN,集成电路 密歇根州HGPIN HGPIN公司 肺
第12页,第10页 A3168型 10个月 HGPIN公司 HGPIN,集成电路 密歇根州HGPIN 无
第12页,第10页 A3180 10个月 HGPIN公司 密歇根州HGPIN HGPIN公司 肺
第12页,第10页 A3184飞机 10个月 HGPIN公司 密歇根州HGPIN HGPIN公司 无
第12页,第10页 A3185型 10个月 HGPIN公司 HGPIN公司 密歇根州HGPIN 肺、肝
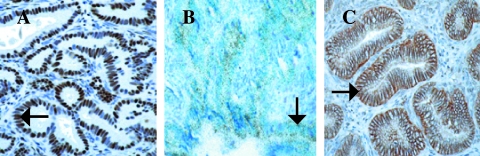
前列腺病变中同时表达转基因和转化生长因子-β1 由于人类前列腺癌起源于腺上皮,因此证明上皮中存在这两种转基因非常重要。 两者都有 标签 和 挪威船级社 根据免疫组化分析,转基因在12T-7f/MT-DNIIR和12T-10/MT-DNIIR小鼠的管腔上皮细胞中表达 标签 ( 箭头 , 图3 一 )和 就地 杂交分析 挪威船级社 ( 箭头 , 图3 B类 ). 我们发现稳定水平的 挪威船级社 实时RT-PCR检测肿瘤进展过程中的表达( 表2 ). 此外,根据免疫组织化学分析,TGF-β1在前列腺中被发现并定位于上皮( 箭头 , 图3 C类 ). 基于Meta-Morph分析,TGF-β1的染色强度相似。 TGF-β的存在证明使用显性阴性TβRII阻断TGF-α信号传导是合理的。 因此,在12T-7f/MT-DNIIR和12T-10/MT-DNIIR中出现的前列腺上皮病变中,可以看到转基因和TGF-β1的表达。
图3。
转基因小鼠转基因表达检测。 (A) 免疫组织化学分析的一个例子显示,Tag在12T-7f/MT-DNIIR小鼠DLP的HGPIN病变(箭头)中表达。 (B) 原位杂交的光场图显示12T-7f/MT-DNIIIR小鼠DLP中HGPIN病变(箭头)中DNIIR的表达。 (C) 免疫组织化学分析的一个例子显示TGF-β1在12T-7f小鼠DLP的HGPIN病变(箭头所示)中的定位。
表2。
线路 鼠标编号 年龄 组织
挪威船级社 水平
β-肌动蛋白 液位比 挪威船级社 /β-肌动蛋白
12T-7f/MT-DIIR公司 9237 12周 DLP公司 东经3.65+04 东经1.00度+10度 2006年5月7日
12T-7f/MT-DIIR公司 9241 12周 DLP公司 1.85东经+05 4.24东经+10 2006年4月4日
12T-7f/MT-DIIR公司 9201 16周 DLP公司 7.65东经+04 1.19东经+10 6.4E-06年
12T-7f/MT-DIIR公司 9208 16周 DLP公司 1.06E+05 1.03东经+10 1.0E-05年
12T-7f/MT-DIIR公司 9218 18周 DLP公司 1.80东经+04 东经5.53度+09度 3.3东经-06
12T-7f/MT-DIIR公司 A3028型 18周 DLP公司 6.02东经+04 2.60东经+10 2006年9月23日
12T-7f/MT-DIIR公司 9212 20周 DLP公司 4.98东经+04 4.35E+10 1.1E-06年
12T-7f/MT-DIIR公司 9223 20周 DLP公司 3.10东经+04 4.07东经+10 7.6东至07
12T-7f/MT-DIIR公司 9227 23周 DLP公司 2.40东经+04 1.07东经+10 2006年2月2日
12T-7f/MT-DIIR公司 A3030型 23周 DLP公司 5.76电子+04 1.08东经+10 5.3E-06年
12T-7f/MT-DIIR公司 A3407飞机 8个月 肝转移 1.69东经+07 5.89电子+10 2.9E-04年
12T-7f/MT-DIIR公司 A3404飞机 9个月 肝转移 1.79东经+03 5.67东经+10 3.2E-08年
12T-7f/MT-DIIR公司 A3135飞机 10个月 肝转移 东经1.30度+03度 6.02东经+10 2008年2月2日
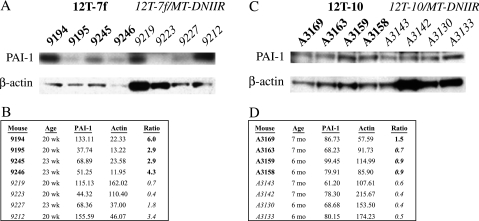
DNIIR转基因的表达降低了TGF-β下游靶点PAI-I的水平 PAI-I表达受TGF-β的正向调节[ 9,10 ]. 使用PAI-I作为TGF-β信号转导的标记物 挪威船级社 转基因可以破坏TGF-β信号传导。 Western blot分析用于测定年龄匹配小鼠组织中PAI-I和β-actin的水平。 使用Scion Image分析程序对PAI-I水平进行量化,并通过β-肌动蛋白水平对蛋白质负荷进行标准化。 12T-7f/MTDNIIR小鼠PAI-I的平均归一化水平显著低于12T-7f小鼠PAI-1的平均归一化水平( P(P) < .05) ( 图4 , 一 和 B类 ). 同样,12T-10/MT-DNIIR小鼠PAI-I的平均正常化水平显著低于12T-10小鼠PAI-I的平均标准化水平( P(P) < .05) ( 图4 , C类 和 D类 ). 因此 挪威船级社 转基因积极抑制前列腺中TGF-β信号传导。
图4。
转基因小鼠PAI-I水平的定量和标准化。 (A) 作为12T-7f和12T-7f/MTDNIIR小鼠负荷控制的PAI-I和β-actin的蛋白质印迹。 (B) (A)中来自蛋白质印迹的条带强度以及PAI-I与β-肌动蛋白的比率的总结。 12T-7f/MT-DNIIR小鼠的平均比率显著低于12T-7f小鼠(P<0.05)。 (C) 在12T-10和12T-10/MT-DNIIR小鼠中作为负载对照的PAI-I和β-肌动蛋白的蛋白质印迹。 (B) (C)中Western blot的条带强度以及PAI-I与β-肌动蛋白的比值总结。 12T-10/MT-DNIIR小鼠的平均比率显著低于12T-10小鼠(P<0.05)。
与12T-7f小鼠相比,12T-7f/MT-DNIIR小鼠倾向于发展更多的IC,但不会发展更大的前列腺 12T-7f/MT-DNIIR前列腺肿瘤的组织学进展( n个 =39)小鼠与12T-7f小鼠相似( n个 =41)从12周龄到23周龄。 这两个品系都主要发育有HGPIN,伴有前列腺腺增生和超细胞间质。 为了确定肿瘤中TGF-β抑制的丧失是否刺激了生长,我们测量了湿前列腺重量,并通过计算体重百分比对动物大小的差异进行了标准化。 比较12T-7f/MT-DNIIR和12T-7f小鼠前列腺重量占体重的百分比,发现肿瘤大小没有增加(数据未显示)。 在12T-7f/MT-DNIIR小鼠中很少观察到侵袭性尿道周围和球部尿道肿瘤( n个 =2)和12T-7f小鼠( n个 = 1). 在12T-7f/MT-DNIIR小鼠前列腺的常规切片中,局部浸润性癌的病灶更常见( n个 =6)比12T-7f小鼠( n个 = 3) ( 表1 ). 无对照MT-DNIIR小鼠( n个 =50)和NT小鼠(NT, n个 =56)从12周龄到10个月龄发展为IC。
12T-7f/MT-DNIIR小鼠比12T-7f小鼠更容易发生广泛转移 12T-7f/MT-DNIIR和12T-7f小鼠均发生了主动脉旁淋巴结的显微神经内分泌转移( 箭头 , 图5 一 ),肺部( 箭头 , 图5 B类 ),肝脏( 图5 C类 ),很少有骨头(12T-7f/MT-DNIIR, n个 = 1; 第12T-7f页, n个 = 1) ( 箭头 , 图5 D类 ). 转移瘤经组织学鉴定,具有典型的神经内分泌分化特征。 转移病灶免疫阳性 标签 ( 箭头 , 图5 一 ),转化生长因子-β1( 箭头 , 图5 B类 )和神经内分泌标记物嗜铬粒蛋白A(CG),证实其转基因表达和神经内分泌分化( 箭头 , 图5 D类 ). 更多12T-7f/MT-DNIIR小鼠( n个 =7)与年龄匹配的12T-7f小鼠相比发生了转移( n个 = 4) ( 表1 ). 肺转移最常见,而肝转移发生在这些动物中的一部分,似乎表明转移更为广泛。 12T-7f细胞系肝转移的比较( n个 = 1) ( 箭头 , 图5 E类 )和12T-7f/MT-DNIIR线路( n个 = 2) ( 箭头 , 图5 F类 )在12T-7f/MT-DNIIR小鼠中显示出更广泛的转移。 在12T-7f小鼠模型中的这些结果表明,前列腺肿瘤中TGF-β途径的缺失会促进转移性疾病。
图5。
12T-7f/MT-DNIIR小鼠和12T-7f小鼠的转移性病变及免疫组化分析。 (A) 12T-7f/MT-DNIIR小鼠主动脉旁淋巴结中Tag-expressing转移灶(箭头所示)。 (B) 12T-7小鼠肺中TGF-β1表达的转移灶(箭头所示)。 (C) 12T-7小鼠肝脏H&E染色的转移灶(箭头所示)。 (D) 12T-7f小鼠腰椎中CG-表达的转移病灶(箭头所示)。 (E) 20周龄12T-7f小鼠肝脏微转移(箭头所示)。 (F) 18周龄12T-7f/MT-DNIIR小鼠肝脏广泛微转移(箭头所示)。
与12T-10小鼠相比,12T-10/MT-DNIIR小鼠倾向于发展更多的IC,但前列腺不会变大 表征 挪威船级社 在12T-10细胞系的肿瘤中过度表达对肿瘤进展的影响更为显著。 12T-10/MT-DNIIR小鼠原发性前列腺肿瘤的组织学进展与12T-10小鼠相似。 12T-10/MT-DNIIR小鼠( n个 =22)和12T-10小鼠( n个 =23)从6个月到10个月大,逐渐发展为HGPIN、前列腺局部浸润性神经内分泌癌和神经内分泌转移。 比较12T-10/MT-DNIIR和12-T10小鼠的前列腺重量(占体重的百分比),发现肿瘤大小没有增加(数据未显示)。 在12T-10/MT-DNIIR中很少观察到侵袭性尿道周围和球部尿道肿瘤( n个 =3)和12T-10( n个 =1)小鼠。 在12T-10/MT-DNIIR小鼠中IC的发生率较高( n个 =5)比12T-10小鼠( n个 = 2) ( 表1 ).
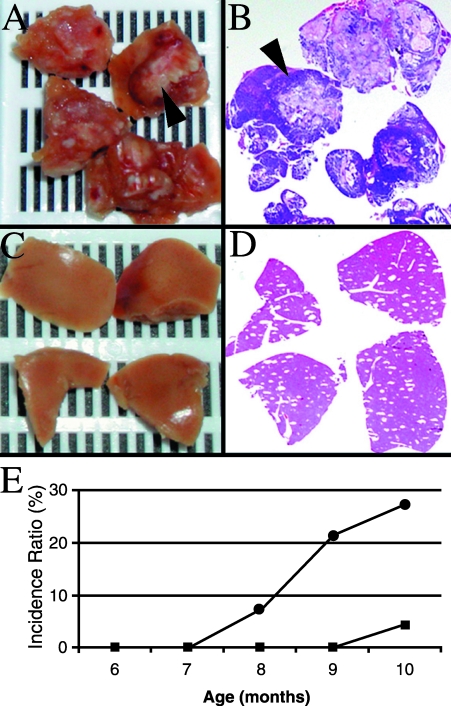
12T-10/MT-DNIIR小鼠比12T-10小鼠发生更广泛的转移 12T-10/MT-DNIIR和12T-10小鼠发生LN、肺和肝转移的频率与12T-7f/MT-DNIIR和12T-7f小鼠相似,但更频繁。 根据免疫组化和实时RT-PCR分析,转移灶表达 标签 、TGF-β1、CG和 挪威船级社 ( 表2 ). 根据组织学检查,12T-10/MT-DNIIR之间的累积转移发生率没有差异( n个 =8)和12T-10( n个 =7)只小鼠( 表1 ). 然而,与12T-10小鼠相比,12T-10/MT-DNIIR小鼠的转移疾病程度显著增加。 12T-10/MT-DNIIR小鼠肝和肺中明显的转移性结节( 箭头 , 图6 , 一 和 B类 )但在年龄匹配的12T-10小鼠的这些器官中未观察到明显的转移( 图6 , C类 和 D类 ). 比较12T-10/MT-DNIIR小鼠(●, n个 =6/22)和12T-10(■, n个 =1/23)小鼠表现出统计显著性( P(P) <.05)在12T-10/MT-DNIIR小鼠中的增加( 图6 E类 ). 此外,仅对有转移的小鼠进行比较,结果显示具有统计学意义( P(P) <.05)12T-10/MT-DNIIR小鼠总转移增加( n个 =6/8)与12T-10小鼠相比( n个 = 1/7). 在12T-10小鼠模型中的这些结果表明,转移性前列腺癌中TGF-β信号的丢失会增加转移病灶的数量。
图6。
12T-10/MT-DNIIR小鼠和12T-10小鼠转移的比较。 (A和B)12T-10/MT-DNIIR小鼠肝脏中的大体转移病灶(箭头所示)以及伴随的组织学检查。 (C和D)年龄匹配的12T-10小鼠的肝脏没有明显损伤,并伴有组织学检查。 (E) 12T-10/MT-DNIIR(●,n=22)小鼠与12T-10(■,n=23)小鼠总转移率随时间变化的比较。 12T-10/MT-DNIIR小鼠的转移发生率显著高于12T-10小鼠(P<0.05)。
讨论 总之,本研究证明TGF-β信号传导的中断调节晚期前列腺癌的进展,特别是转移。 尽管在表达 挪威船级社 和 标签 转基因,增加没有统计学意义( 表3 ). 因此,对转移的影响不仅仅是由于IC的增加。 相反,这种影响一定是对转移的发展和/或转移部位的生长产生的。 因为MT启动子不是前列腺特异性的,不能排除对免疫系统或血管生成的更直接影响。 尽管如此 挪威船级社 转基因在前列腺肿瘤中具有破坏TGF-β通路的直接作用,如PAI-I水平的显著降低所证明的。PAI-I水平的降低是一种介导细胞外基质蛋白水解的尿激酶型纤溶酶原激活剂(uPA)的抑制剂, 这可能是我们模型中转移增加的一个可能机制,因为已经证明PAI-I在包括PC-3细胞在内的几个人类前列腺癌细胞系中处于低水平,并且通过稳定转染提高PAI水平可以减少小鼠PC-3细胞的转移[ 18,19 ]. TGF-β的其他细胞内效应物也可能与前列腺癌转移的诱导有关。 据报道,在乳腺癌和结肠癌中,TGF-β信号最初具有负作用,但最终对肿瘤进展产生积极影响。 例如,阻断TGF-β对肿瘤生长很重要,但随后TGF-α途径的恢复有助于肿瘤细胞的运动、上皮细胞向间充质细胞的转化以及最终的转移[ 20,21 ]. 这些报告侧重于非前列腺癌,并使用了不同的系统,例如将细胞系注射到小鼠体内以形成肿瘤和转移。
表3。
线路 年龄 集成电路 转移
12T-7f/MT-DIIR公司 12-23周 第6页,共39页 第7页,共39页(2页至肝脏)
第12T-7f页 12-23周 第3页,共41页 第4页,共41页(1页至肝脏)
12T-10/MT-DNIIR公司 6-10个月 第5页,共22页 第8页,共22页(共6页 * )
第12页,第10页 6-10个月 第2页,共23页 第7页,共23页(共1页 * )
MT-DNIIR公司 12周-10个月 第0页,共50页 第0页,共50页
NT公司 12周-10个月 第0页,共56页 第0页,共56页
在人类前列腺癌中,TβRII的丢失最常见于晚期疾病[ 4,5 ]这表明该途径对该疾病的传播没有积极影响。 这些研究将功能失调的TGF-β受体通路与原发部位的肿瘤分级相关,但并没有证明受体的丢失与癌症进展有关。 我们在两个转基因动物模型中的研究证明,TGF-β调节的中断对增加转移负担很重要,而不是病理相关性。 这对于在终末期疾病中主要转移到骨的前列腺癌尤其重要,因为在骨中自然会发现高TGF-β水平[ 22 ]. 转移起始和生长将是未来研究和治疗的重要目标,因为限制转移将使前列腺癌的治疗更加成功[ 1 ]. 大多数人前列腺癌转移瘤是中分化至低分化腺癌,但这些小鼠模型与其他SV40 T抗原模型类似,会发展为具有神经内分泌分化的侵袭性和转移性低分化癌[ 17 ]. 研究人类前列腺癌的小鼠转基因模型有一些局限性,因为小鼠不会自然发展为前列腺癌,并且小鼠的结果并不总是直接转化为人类。 然而,最近的一份报告已经确定神经内分泌表型和TGF-β通路是人类前列腺癌的重要预后因素[ 23 ]. 虽然TGF-β的缺失与前列腺癌的进展有关,但尚不确定该缺失是肿瘤进展的原因还是后果。 我们的前列腺癌动物模型显示出与人类前列腺癌相似的遗传和组织病理学变化。 我们在这些模型中的数据首次表明,TGF-β调节缺失作为转移负担增加的原因,具有临床相关的选择性优势。 我们希望利用这些模型来识别新的TGF-β靶点,并在人体样本中进行测试。
确认 作者感谢西蒙·海沃德对本手稿的有益建议和批判性阅读。
缩写
AP公司 前列腺前部
DLP公司 背外侧叶
挪威船级社 显性阴性TβRII突变体
HGPIN公司 高级前列腺上皮内瘤变
集成电路 浸润性癌
LGPIN码 低度前列腺上皮内瘤变
液态氮 淋巴结
遇见 转移
医疗保险 微侵袭癌
机器翻译 金属硫蛋白
国家公路局 无组织学异常
NT公司 非转基因
PAI-I项目 I型纤溶酶原激活物抑制剂
PIN码 前列腺上皮内瘤变
逆转录聚合酶链反应 逆转录聚合酶链式反应
标签 SV40大T抗原
TβRII TGF-βⅡ型受体
TGF公司 转化生长因子
加州大学 未分化癌
副总裁 腹侧前列腺
周 周
脚注
1 本研究部分得到了国防部拨款PC992022、NCI拨款R01-CA-76142、NIH人类癌症小鼠模型联合会拨款NCI U01-CA-98013和T.J.Martell基金会的Frances Williams Preston实验室的支持。 转基因小鼠由范德比尔特-英格拉姆癌症中心转基因核心/ES细胞共享资源(NCI拨款2P30-CA-68485)培育。
工具书类
1 Ohori M、Goad JR、Wheeler TM、Eastham JA、Thompson TC、Scardino PT。前列腺癌根治术能否改变低分化前列腺癌的进展? 《泌尿外科杂志》。 1994; 152:1843–1849. doi:10.1016/s0022-5347(17)32398-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Quinn DI、Henshall SM、Head DR、Golovsky D、Wilson JD、Brenner PC、Turner JJ、Delprado W、Finlayson JF、Stricker PD、Grygiel JJ、Sutherland RL。前列腺癌根治术治疗中p53核聚积的预后意义。 癌症研究2000; 60:1585–1594. [ 公共医学 ] [ 谷歌学者 ]
三。 Bookstein R、Rio P、Madrelerla SA、Hong F、Allred C、Grizzle WE、Lee WH。 前列腺癌视网膜母细胞瘤基因表达的启动子缺失和缺失。 美国国家科学院院刊,1990年; 87:7762–7766. doi:10.1073/pnas.87.19.7762。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
4 Kim IY,Ahn HJ,Lang S,Oefelein MG,Oyasu R,Kozlowski JM,Lee C.转化生长因子β受体表达缺失与前列腺癌患者预后不良相关。 1998年临床癌症研究; 4:1625–1630. [ 公共医学 ] [ 谷歌学者 ]
5 Guo Y,Jacobs SC,Kyprianou N.前列腺癌转化生长因子β(TGF-beta1)Ⅰ型和Ⅱ型受体蛋白和mRNA表达的下调。 国际癌症杂志。 1997; 71:573–579. doi:10.1002/(sici)1097-0215(19970516)71:4<573::aid-ijc11>3.0.co; 二维。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
6 Morton DM,Barrack ER。通过生长因子和细胞外基质调节转化生长因子β1对前列腺癌细胞增殖的影响。癌症研究1997; 55:2596–2602. [ 公共医学 ] [ 谷歌学者 ]
7 Brodin G,ten Dijke P,Funa K,Heldin CH,Landstrom M。去势后正常和恶性前列腺中smad表达和激活的增加与凋亡相关。 1999年癌症研究; 59:2731–2738. [ 公共医学 ] [ 谷歌学者 ]
8 Danielpour D.NRP-152大鼠前列腺基底上皮细胞向管腔表型的转分化:糖皮质激素、胰岛素样生长因子-I和转化生长因子β的调节。 细胞科学杂志。 1999; 112(第2部分):169–179。 doi:10.1242/jcs.112.2169。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9 Datta PK、Blake MC、Moses HL。 转化生长因子-β诱导的Smads和Sp1之间的物理和功能相互作用对纤溶酶原激活物抑制物-1表达的调节。 生物化学杂志。 2000; 275:40014–40019. doi:10.1074/jbc。 C000508200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
10 Hua X,Miller ZA,Wu G,Yigong S,Lodish HF.转化生长因子β诱导纤溶酶原激活物抑制剂-1基因转录的特异性:启动子DNA、转录因子、µE3和Smad蛋白的相互作用。 美国国家科学院院刊1999; 96:13130–13135. doi:10.1073/pnas.96.23.13130。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Yan Y,Sheppard PC,Kasper S,Lin L,Hoare S,Kapoor A,Dodd JG,Duckworth ML,Matusik RJ。先证素启动子的大片段靶向转基因小鼠前列腺的高水平转基因表达。 前列腺。 1997; 32:129–139. doi:10.1002/(sici)1097-0045(19970701)32:2<129::aid-pros8>3.0.co; 2小时。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
12 Kasper S、Sheppard PC、Yan Y、Pettigrew N、Borowsky AD、Prins GS、Dodd JG、Duckworth ML、Matusik RJ。转基因前列腺肿瘤的发展、进展和雄激素依赖性:前列腺癌模型。 实验室投资。 1998; 78:319–334. [ 公共医学 ] [ 谷歌学者 ]
13. Masumori N、Thomas TZ、Case T、Paul M、Kasper S、Chaurand P、Caprioli RM、Tsukamoto T、Shappell SB、Matusik RJ。一种先证素大T抗原转基因小鼠系发展出具有转移潜能的前列腺腺癌和神经内分泌癌。 癌症。 2001; 决议61:2239–2249。 [ 公共医学 ] [ 谷歌学者 ]
14 Ghatak S,Oliveria P,Kaplan P,Ho SM。雄性大鼠前列腺中金属硫蛋白mRNA水平的表达和调节:前列腺腹侧缺乏表达,前列腺背外侧受性激素调节。 前列腺。 1996; 29:91–100. doi:10.1002/(SICI)1097-0045(199608)29:2<91::AID-PROS4>3.0.CO; 2-K型。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
15 Serra R、Johnson M、Filvaroff EH、LaBorde J、Sheehan DM、Derynck R、Moses HL。 在小鼠骨骼组织中表达一个截短的、激酶缺陷的TGF-βII型受体可促进最终软骨细胞分化和骨关节炎。 细胞生物学杂志。 1997; 139:541–552. doi:10.1083/jcb.139.2.541。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
16 Wang XJ,Greenhalgh DA,Bickenbach JR,Jiang A,Bundman DS,Krieg T,Derynck R,Roop DR。转基因小鼠表皮中显性阴性II型转化生长因子β(TGF-β)受体的表达阻断了TGF-β介导的生长抑制。 美国国家科学院院刊,1997年; 94:2386–2391. doi:10.1073/pnas.94.6.2386。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
17 Matusik R、Masumori N、Thomas T、Case T、Paul M、Kasper S、Shappell S。前列腺癌转基因小鼠模型。 收件人:Matzuk M、Brown C、Kumar T,编辑。 当代内分泌:内分泌中的转基因。 加拿大托托瓦:Humana Press Inc; 2001年,第401-425页。 [ 谷歌学者 ]
18 Lyon PB,见WA、Xu Y、Cohen MB。 前列腺癌细胞系中纤溶酶原激活物活性的多样性和调节。 前列腺。 1995; 27:179–186. doi:10.1002/pros.299270402。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 Soff GA、Sanderowitz J、Gately S、Verrusio E、Weiss I、Brem S、Kwaan HC。 在无胸腺小鼠模型中,人前列腺癌细胞表达纤溶酶原激活物抑制剂1抑制原发性肿瘤生长、肿瘤相关血管生成以及肺和肝转移。 临床投资杂志。 1995; 96:2593–3600. doi:10.1172/JCI118323。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
20 Yin JJ、Selander K、Chirgwin JM、Dallas M、Grubbs BG、Wieser R、Massague J、Mundy GR、Guise TA。 TGF-β信号传导阻断抑制乳腺癌细胞和骨转移瘤分泌PTHrP。 临床投资杂志。 1995; 103:197–206. doi:10.11172/JCI3523。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
21 Derynk R,Akhurst RJ,Balmain A.TGF-β信号在肿瘤抑制和癌症进展中的作用。 自然遗传学。 2001; 29:117–129. doi:10.1038/ng1001-117。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
22 Pfeilschifter J,Mundy GR.促骨激素对骨培养中β型转化生长因子活性的调节。 美国国家科学院院刊1987; 84:2024–2028. doi:10.1073/pnas.84.7.2024。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
23 Singh D、Febbo PG、Ross K、Jackson DG、Manola J、Ladd CP、Tamayo P、Renshaw AA、D'Amico AV、Richie JP、Lander ES、Loda M、Kantoff TR、Golub TR、Sellers WR。 基因表达与前列腺癌临床行为相关。 癌细胞。 2002; 1:203–209. doi:10.1016/s1535-6108(02)00030-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]