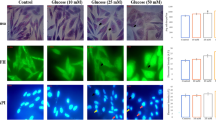
摘要
目标/假设
方法
结果
结论/解释
图形摘要

其他人正在查看的类似内容

介绍
方法
伦理学
小鼠和人CPC的分离
利用纳米线微阵列和生物信息学分析进行miRNA表达谱分析
qPCR分析
蛋白质印迹分析
MS分析
荧光素酶检测
miR-30c过度表达和 Vdac1型 击倒
半胱氨酸天冬氨酸蛋白酶3/7活性测定
miR-30c-5p对线粒体膜电位(MMP)的保护作用
糖尿病心脏体内miR-30c-5p的过度表达
统计
结果
糖尿病-小鼠CPC中失调的miRNAs可调节其功能
qPCR分析部分验证了Nanostring小鼠CPC数据
使用MS在小鼠CPC中确定的新靶点并通过western blot分析验证
萤光素酶检测已确认 Vdac1型 作为小鼠CPC中miR-30c-5p的直接靶点
miR-30c-5p的过度表达通过下调VDAC1减少糖尿病小鼠CPC的凋亡细胞死亡
miR-30c-5p在糖尿病小鼠CPC中拯救MMP
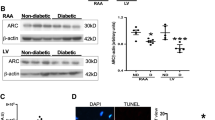
体内miR-30c-5p过度表达可减轻糖尿病对CPC的有害影响
糖尿病诱导人CPC靶向miRNAs失调
讨论
数据可用性
缩写
美国: -
任意单位 中国共产党: -
心脏祖细胞 CDK6: -
细胞周期蛋白依赖性激酶6 GSK-3β: -
糖原合成酶激酶3β MEF2C公司: -
肌细胞特异性增强因子2C 小核糖核酸: -
微小核糖核酸 基质金属蛋白酶: -
线粒体膜电位 巴基斯坦国家石油公司: -
渗透过渡孔 qPCR: -
定量实时PCR 澳大利亚皇家建筑师协会: -
右心耳 Sca-1型 + : -
干细胞抗原-1阳性 3英尺UTR: -
3′-未翻译区域 VDAC1: -
电压依赖性阴离子选择性通道1
工具书类
世界心脏联合会(2020)世界上最常见的死因。 可从以下位置获得 www.world-hart-federation.org/wp-content/uploads/2017/05/WCC2016_CVDs_infographic-1.pdf 2020年2月访问 Isomi M,Sadahiro T,Ieda M(2019)治疗心力衰竭的心脏再生进展和挑战。 心脏病杂志73:97–101。 https://doi.org/10.1016/j.jjcc.2018.10.002 Satthenapalli VR、Lamberts RR、Katare RG(2017)简明综述:糖尿病心脏再生的挑战:综合综述。 干细胞35:2009–2026。 https://doi.org/10.1002/stem.2661 Tzahor E,Poss KD(2017)《心脏再生策略:保持内心年轻》。 科学356:1035–1039。 https://doi.org/10.1126/science.aam5894 《柳叶刀》编辑(2014)关注的表达:SCIPIO试验。 柳叶刀383:1279。 https://doi.org/10.1016/S0140-6736 (14)60608-5 美国心脏协会(2019):发育中心脏的心肌发生受C-kit阳性心脏干细胞调节。 Circ Res 124:e28。 https://doi.org/10.1161/RES.0000000000000252 美国心脏协会(2019)撤回:心脏干细胞在心脏病理生理学中的作用:人类心肌生物学的范式转变。 Circ Res 124:e24。 https://doi.org/10.1161/RES.000000000000248 Gude NA,Sussman MA(2019)心脏再生疗法:多种修复途径。 心血管医学趋势30(6):338–343 Abbott JD,Huang Y,Liu D,Hickey R,Krause DS,Giordano FJ(2004)基质细胞衍生因子-1α在心肌梗死后干细胞向心脏募集中起着关键作用,但不足以在无损伤的情况下诱导归巢。 循环110:3300–3305。 https://doi.org/10.1161/01.CIR.0000147780.30124.CF(中文) Hatzistergos KE,Saur D,Seidler B等人(2016)间充质干细胞对cKit+心脏干细胞的刺激作用是由SDF1/CXCR4和SCF/cKit信号通路介导的。 循环研究119:921–930。 https://doi.org/10.1161/CIRCRESAHA.116309281 Katare R、Oikawa A、Cesselli D等人(2013年),增强戊糖磷酸途径可恢复糖尿病患者心脏祖细胞的可用性。 心血管研究97:55–65。 https://doi.org/10.1093/cvr/cvs291 Khaksar M、Sayyari M、Rezaie J、Pouyafar A、Montazersaheb S、Rahbarghazi R(2018)高糖条件限制了小鼠心脏祖细胞在体内外环境中的血管生成/心脏生成能力。 细胞生物化学功能36:346–356。 https://doi.org/10.1002/cbf.3354 Mehra P,Guo Y,Nong Y等(2018)糖尿病小鼠心脏间充质细胞对细胞治疗介导的心肌修复无效。 心脏基础研究113:46 Palomer X,Pizarro-Delgado J,Vazquez-Carrera M(2018)糖尿病心肌病的新兴参与者:心脏破碎生物标志物还是治疗靶点? 《药物科学趋势》39:452–467。 https://doi.org/10.1016/j.tips.2018.02.010 Rawal S、Nagesh PT、Coffey S等人(2019年),心肌特异性microRNA-208a的早期失调与糖尿病心肌的适应性不良心脏重塑有关。 心血管糖尿病18:13 Hathaway QA、Pinti MV、Durr AJ、Waris S、Shepherd DL、Hollander JM(2018)《调节microRNA表达:糖尿病和线粒体的心脏》。 美国生理学杂志《心脏循环生理学》314:H293–H310。 https://doi.org/10.1152/ajpheart.00520.2017 Rawal S、Munasinghe PE、Shindikar A等(2017)促血管生成microRNA-126和microRNA132的下调是糖尿病心脏微血管病的早期调节剂。 心血管研究113:90–101。 https://doi.org/10.1093/cvr/cvw235 Rawal S、Munasinghe PE、Nagesh PT等人(2017)miR-15a/b的下调加速了2型糖尿病人和小鼠心脏的纤维化重塑。 临床科学(伦敦)131:847–863。 https://doi.org/10.1042/CS20160916 Fomison Nurse I、Saw EEL、Gandhi S等人(2018)糖尿病诱导心脏中促衰老miR-34a的激活,但对心肌细胞和心脏祖细胞有不同的影响。 细胞死亡差异25:1336–1349。 https://doi.org/10.1038/s41418-017-0047-6 Gorabi AM、Bianconi V、Pirro M、Banach M、Sahebkar A(2019)《微RNA对心脏干细胞的调节:最新进展》,《生物药物治疗学》120:109447。 https://doi.org/10.1016/j.biopha.2019.109447 Chandrasekera DNK、Neale JPH、van Hout I等(2020)microRNA-532上调增强糖尿病心脏心肌细胞凋亡。 细胞凋亡25:388–399。 https://doi.org/10.1007/s10495-020-01609-1 Lew JK、Pearson JT、Saw E等人(2020)运动调节微小RNA,以保护糖尿病心脏的冠状动脉和心脏功能。 Circ Res 127(11):1384–1400。 https://doi.org/10.1161/CIRCRESAHA.120.317604 Dixit P,Katare RG(2019)心脏祖细胞的分离和表征。 分子生物学方法2029:161–173 Rawal S,Ram TP,Coffey S等人(2016),射血分数正常的人类2型糖尿病心脏中心血管microRNA的差异表达模式。 国际心脏病杂志202:40–43。 https://doi.org/10.1016/j.ijcard.2015.08.161 Manning P、Munasinghe PE、Bellae Papannarao J、Gray AR、Sutherland W、Katare R(2019年),急性体重减轻可恢复肥胖个体中失调的循环微RNA。 临床内分泌代谢杂志104:1239–1248。 https://doi.org/10.1210/jc.2018-00684 Paraskevopoulou MD、Georgakilas G、Kostoulas N等人(2013)DIANA-microT web服务器v5.0:服务集成到miRNA功能分析工作流中。 核酸研究41:W169–W173。 https://doi.org/10.1093/nar/gkt393 Wong N,Wang X(2015)miRDB:微RNA靶点预测和功能注释的在线资源。 核酸研究43:D146–D152。 https://doi.org/10.1093/nar/gku1104 Betel D、Wilson M、Gabow A、Marks DS、Sander C(2008)《微RNA》。组织资源:靶点和表达。 核酸研究36:D149–D153。 https://doi.org/10.1093/nar/gkm995 Agarwal V,Bell GW,Nam JW,Bartel DP(2015)预测哺乳动物mRNA中的有效microRNA靶点。 伊利夫4:e05005 Szklarczyk D、Morris JH、Cook H等人(2017)2017年的STRING数据库:质量控制蛋白质关联网络,可广泛访问。 核酸研究45:D362–D368。 https://doi.org/10.1093/nar/gkw937 Hom JR、Quintanilla RA、Hoffman DL等人(2011)。通透性转换孔控制心肌线粒体成熟和心肌细胞分化。 Dev细胞21:469–478 Esfandiari F、Fathi A、Gourabi H、Kiani S、Nemati S、Baharvand H(2012)糖原合成酶激酶-3抑制促进人诱导的多能干细胞衍生神经祖细胞的增殖和神经分化。 干细胞开发21:3233–3243。 https://doi.org/10.1089/scd.2011.0678 Li H、Radford JC、Ragusa MJ等(2008)转录因子MEF2C影响体内神经干/祖细胞的分化和成熟。 美国国家科学院院刊105:9397–9402 Scheicher R、Hoelbl-Kovacic A、Bellutti F等人(2015)CDK6是造血和白血病干细胞激活的关键调节因子。 血液125:90–101。 https://doi.org/10.1182/bloud-2014-06-584417 Shore GC(2009)《细胞凋亡:VDAC的问题》。 EMBO代表10:1311–1313。 https://doi.org/10.1038/embor.2009.249 Rota M、LeCapitaine N、Hosoda T等人(2006年)糖尿病会促进心脏干细胞老化和心力衰竭,这可以通过p66shc基因的缺失来预防。 循环研究99:42–52。 https://doi.org/10.1161/01.RES.0000231289.63468.08 Noseda M、Harada M、McSweeney S等人(2015)PDGFR-alpha对成年小鼠心肌中的心源性克隆Sca1+干/祖细胞进行了界定。 国家公社6:6930 Katare R、Caporali A、Zentilin L等人(2011年)通过嗜心病毒载体使用PIM-1进行静脉基因治疗,通过促进前生存信号传导阻止糖尿病心肌病的进展。 圆形决议108:1238–1251。 https://doi.org/10.1161/CIRCRESAHA.110.239111 Marunouchi T、Sasaki K、Yano E、Tanonaka K(2019)心脏Sca-1阳性细胞而非c-Kit阳性细胞的移植可保留大鼠心肌梗死后存活心肌的线粒体耗氧量。 药理学杂志140:236–241。 https://doi.org/10.1016/j.jphs.2019.07.005 Konemann S,Sartori LV,Gross S等人(2020)Sca-1+和Sca-1-细胞分泌组在心力衰竭中的心脏保护作用:不相等,但同样重要? 心血管研究116:566–575。 https://doi.org/10.1093/cvr/cvz140 Dixit P、Donnelly H、Edamatsu M、Galvin I、Bunton R、Katare R(2017)同一患者心房、心室和外周血的祖细胞表现出与心脏修复相关的功能差异。 国际心脏病杂志228:412–421。 https://doi.org/10.1016/j.ijcard.2016.11.178 Veldman-Jones MH、Brant R、Rooney C等人(2015)评估NanoString技术的稳健性和敏感性计数器平台,以实现临床样本的多重基因表达分析。 癌症研究75:2587–2593。 https://doi.org/10.1158/0008-5472.CAN-15-0262 Welten SM、Bastiaansen AJ、de Jong RC等(2014)抑制14q32 MicroRNAs miR-329、miR-487b、miR-494和miR-495可增加缺血后的新生血管形成和血流恢复。 循环研究115:696–708。 https://doi.org/10.1161/CIRCRESAHA.114.304747 Kureel J,John AA,Prakash R,Singh D(2018)MiR 376c通过靶向Wnt3和ARF-GEF-1促进的β-catenin反式激活增强抑制成骨细胞生成。 《细胞生物化学杂志》119:3293–3303。 https://doi.org/10.1002/jcb.26490 Lee S,Yoon DS,Paik S,Lee KM,Jang Y,Lee JW(2014)microRNA-495通过靶向Sox9抑制人间充质干细胞的软骨分化。 干细胞开发23:1798–1808。 https://doi.org/10.1089/scd.2013.0609 Sun F,Fu H,Liu Q等(2008)miR-34a下调CCND1和CDK6诱导细胞周期阻滞。 FEBS信函582:1564–1568。 https://doi.org/10.1016/j.febslet.2008.03.057 Duisters RF、Tijsen AJ、Schroen B等人(2009)miR-133和miR-30调节结缔组织生长因子:微RNA在心肌基质重塑中作用的意义。 Circ Res 104:170–178,176页,178页之后。 https://doi.org/10.1161/CIRCRESAHA.108.182535 Raut SK、Singh GB、Rastogi B等(2016)miR-30c和miR-181a协同调节糖尿病诱导的心肌肥大中的p53-p21通路。 分子细胞生物化学417:191–203。 https://doi.org/10.1007/s11010-016-2729-7 Naghdi S,Hajnoczky G(2016)VDAC2特异性细胞功能和潜在结构。 Biochim生物物理学报1863:2503–2514