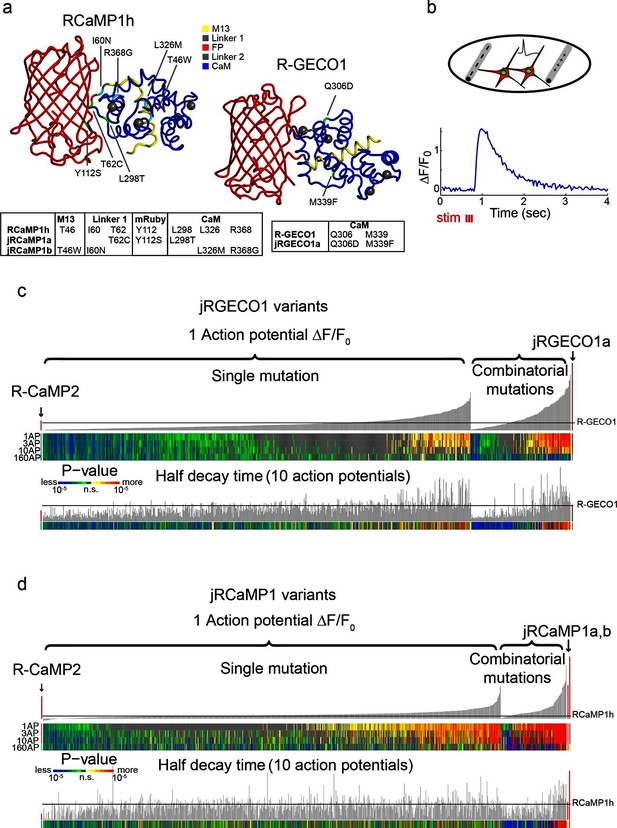
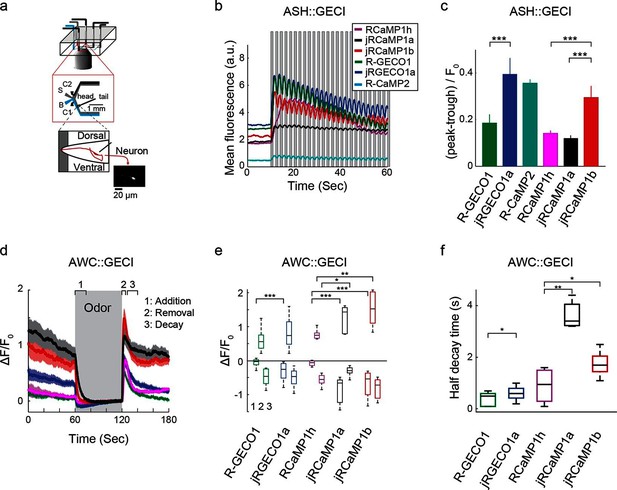
我们测试了jRGECO1a、jRCaMP1a、JRCaMPlb及其父代指标和R-CaMP2( Inoue等人,2015年 )在小鼠体内初级视皮层(V1)( Chen等人,2013b ) ( 图3a , 视频1 ). 大多数V1神经元可以被驱动到火动作电位以响应漂移光栅( Mrsic-Flogel等人,2007年 ; Niell和Stryker,2008年 ). V1神经元被腺相关病毒(AAV)感染,该病毒在人类突触蛋白1启动子(AAV-SYN1-red GECI变体)下表达一种红色GECI变体,并于16-180天后成像。 使用可调谐超快激光器(Insight DS+;Spectra-Physics)在1040 nm或1100 nm下进行双光子激发。 L2/3神经元胞浆内可见红色荧光。 视觉刺激包括向对侧眼睛的八个方向呈现的移动光栅( Akerboom等人,2012年 ; Chen等人,2013b ). 与单个神经元相对应的感兴趣区域显示了视觉刺激诱发的荧光瞬变,这些瞬变在试验中是稳定的,并可调节到刺激方向( 图3b ). 所有测试结构的方向调整都类似( 图3-图补充1 ). 荧光瞬态跟踪感觉刺激的动力学( 图3b–d , 视频1 ). 基于应用的指标比基于mRuby的指标更准确地跟踪,因为它们的动力学更快(刺激结束后,R-GECO1,175个细胞的信号半衰变时间为300±22 ms;jRGECO1a,395个细胞为390±20 ms;R-CaMP2,310个细胞为330±16 ms;jRCaMP1a,347个细胞为640±30 ms;jRC aMP1b,95个细胞为500±45 ms; 表达RCaMP1h的细胞活性较弱,难以可靠表征,平均值±标准偏差,材料和方法)。
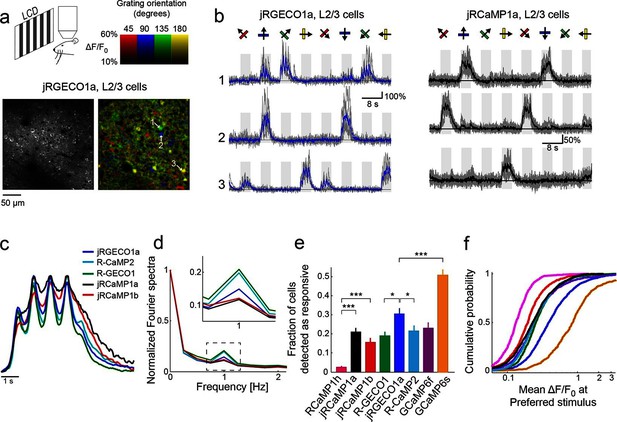
jRGECO1a和jRCaMP1a以及jRCaMP 1b在小鼠初级视觉皮层的表现。 ( 一 )上图,实验示意图。 底部,表达jRGECO1a的V1 L2/3细胞图像(左),以及根据神经元的首选方向(色调)和响应幅度(亮度)进行彩色编码的相同视野。 ( b )表达jRGECO1a(左)和jRCaMP1a(右)的三个L2/3神经元的踪迹示例。 叠加单个试验(灰色)和5个试验的平均值(jRGECO1a和jRCaMP1a分别为蓝色和黑色)。 八个光栅运动方向由箭头指示,如上图所示。 首选的刺激是引起最大反应的方向。 jRGECO1a记录道与面板中指示的单元格相对应 一 (另请参见 视频1 ). ( c )神经元对其首选刺激的平均反应(175个细胞,R-GECO1;310,R-CaMP2;395,jRGECO1a;347,jRCaMP1a;95,jRCa MP1b。对于jRGECOIa和jRCaMP 1a,n=4只小鼠,对于所有其他结构,n=3只小鼠。面板c-f基于相同的数据集( d日 )用RCaMP1h、R-GECO1、R-CaMP2、jRGECaMP1a、jRCaMPlb和jRGECO1a转导的1 Hz漂移光栅驱动的神经元的傅里叶谱归一化为0 Hz振幅。 1 Hz响应振幅的插入放大视图。 ( e(电子) )当表达不同的钙指标时,检测到对视觉刺激有反应的细胞分数(ANOVA测试,p<0.01)。 与RCaMP1h相比,jRCaMP1a和jRCaMP 1b的这一分数分别高出8倍和6倍,与R-GECO1相比,jRGECO1a的这一比例高出60%(Wilcoxon秩和检验;*,p<0.05;**,p<0.01;***,p<0.001)。 误差条对应于s.e.m(26个视场,RCaMP1h;45,jRCaMP1a;31,jRCa MP1b;30,R-GECO1;40,jRGECO1a;33,R-CaMP2;23,GCaMP6s;29,GCaMP 6f)( (f) )首选刺激的ΔF/F振幅分布。 右移曲线,如jRGECO1a vs.R-GECO1或jRCaMP1a/b vs.jRCaMP 1h,表明响应幅度增强(jRCaMPa 1a和jRCa MP1b vs.RCaMP1的75个百分位值分别为0.36和0.27 vs.0.18,jRGECO3a vs.GCaMP6f的0.66 vs.0.38)。 (1210个细胞,R-GECO1;861,RCaMP1h;1733,R-CaMP2;1605,jRGECO1a;1981,jRCaMP1 a;971,jRCa MP1b;907,GCaMP6f;672,GCaMP 6s),颜色与 e(电子) .
https://doi.org/10.7554/eLife.12727.010
我们使用标准指标比较了红色GECI的性能( Chen等人,2013b ). 灵敏度的一个衡量标准是在视觉皮层中检测到的反应性神经元的比例( 图3e ). 对于jRCaMP1a和jRCaMP 1b,该分数比RCaMP1高8倍和6倍(p<10 -6 Wilcoxon秩和检验),与GCaMP6f相当。 jRGECO1a的分数比R-GECO1高60%(p=0.012),比R-CaMP2高40%(p=0.03),比GCaMP6f高30%(p=0.1),但比GCaMP 6s低40%(p<10 -4 ). 平均ΔF/F 0 在首选视觉刺激(材料和方法)下,与RCaMP1h相比,jRCaMP1和jRCaMP 1b的灵敏度也有所提高( 图3f ). 体内jRGECO1a反应大于其他红色GECI和GCaMP6f,但仍小于GCaMP6反应。
据报道,GCaMP的长期高表达会影响神经元健康( Tian等人,2009年 ; Chen等人,2013b ). GCaMP6核填充细胞对感官刺激的反应减弱,衰变时间变慢,定向选择性降低( Tian等人,2009年 ; Chen等人,2013b ). 我们在小鼠V1中表达了超过130天的jRGECO1a、jRCaMP1a和jRCaMP 1b。 与GCaMP指标不同,未观察到核填充( 图3-图补充2a )可能是由于红色GECI序列中的NES。 红色GECI随着时间的推移表现出稳定的性能,尽管在表达180天后观察到jRCaMP1b的定向选择性略有下降( 图3——补充图2b–d ). 有趣的是,与GCaMP6相比,测试的红色GECI的长期表达似乎更稳定( Chen等人,2013b ). 这些数据表明,jRGECO1a和jRCaMP1a/jRCaMP 1b可以用于需要长期表达的实验。
根据培养神经元的测量结果,视觉皮层中测得的jRGECO1a和jRCaMP1a反应小于预期值( 图2a , 图4c )并且低于GCaMP6生产的产品( Chen等人,2013b ). 固定脑组织切片的高分辨率显微镜显示,用jRGECO1a标记但不用jRCaMP1a/b标记的神经元中有明亮的荧光点状。jRGECO1a点状与溶酶体标志物LAMP-1共同定位( 图4-图补充1a ) ( Katayama等人,2008年 ). 在培养的神经元中也发现类似的点状突起,但数量较少(Wilcoxon秩和检验,p<0.001, 图4——补充图1b ). 在体内成像时,含有点状突起的ROI的基线荧光高达90%,但峰值ΔF/F较低 0 与周围的胞体(10个细胞和39个穿孔, 图4-图补充1c ). 这意味着溶酶体中荧光、无反应的jRGECO1a的积累降低了体内成像的信噪比。
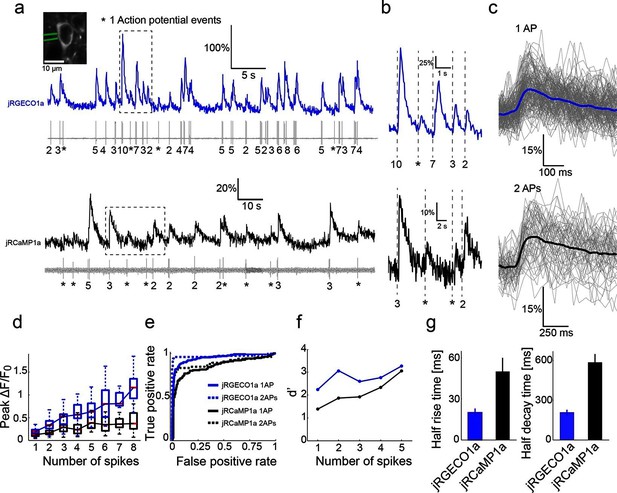
小鼠视觉皮层的联合成像和电生理学。 ( 一 )同时从表达jRGECO1a(顶部,蓝色)和jRCaMP1a(底部,黑色)的神经元测量荧光动力学和峰值。 每个脉冲的峰值数量显示在轨迹下方(单个峰值用星号表示)。 左插图,一个用记录吸管(绿色)表达jRCaMP1a的神经元。 ( b )根据动作电位爆发进行缩放(对应于中的方框 一 ). 顶部,jRGECO1a; 底部,jRCaMP1a。 ( c )jRGECO1a荧光变化响应1个AP(顶部,来自11个细胞的199个峰,n=6只小鼠),jRCaMP1a荧光改变响应2个AP(底部,来自10个细胞的65个峰,n=5只小鼠)。 蓝色(顶部)和黑色(底部)线是中间记录道。 ( d日 )峰值荧光变化的分布与一个时间段内动作电位数量的关系(jRGECO1a,蓝框:199 1AP事件;2 AP:100 ms时间段内70个事件;3 AP:29125 ms;4 AP:34150 ms;5 AP:35175 ms;6 AP:22200 ms;7 AP:14225 ms;8 AP:21250 ms。jRCaMP1a,黑框:135 1 AP事件; 2个AP:65150毫秒; 3个AP:71200毫秒; 4个AP:52250毫秒; 5个AP:33300毫秒; 6个AP:20、350毫秒; 7个AP:14350毫秒; 8个AP:11350毫秒)。 每个框对应第25到75个 第个 分布的百分位数(q 1 和q 三 分别),晶须长度达到极限数据点或1.5 我 (问题3-问题1)。 ( e(电子) )jRGECO1a和jRCaMP1a的接收机工作特性(ROC)曲线,用于对1个和2个AP进行分类(jRGECO 1a:320个4s舱内无AP发射事件,jRCaMP 1a:274个5s舱内没有AP发射事件、1个AP和2个APs数据与 d日 ). ( (f) )检测灵敏度指数(d')是一个时间段内峰值数量的函数(与中的参数相同) d–e日 ). ( 克 )比较2 AP反应的jRGECO1a和jRCaMP1a的平均半上升(左)和衰减(右)时间。 误差条对应于s.e.m。
https://doi.org/10.7554/生活.12727.014
我们还在V1成像的所有红色GECI体内图像中检测到绿色荧光(500–550 nm)。 绿色荧光在900 nm激发下可见,但在1040 nm激发下不可见,这表明红色GECI至少分为两种。 绿色荧光在细胞质中分布不均匀,没有钙离子报告( 图4——补充图2 , 3a–b段 ). 事实上,在900 nm处分数荧光强度较大的jRGECO1a神经元表现出较低的响应幅度。 jRGECO1a的较长表达时间增加了900nm处的相对强度,并与较低的峰值ΔF/F类似地相关 0 ( 图4补充图3c–d F检验,p值<0.002)。 这些数据表明,哺乳动物大脑中的长期表达会降低红色GECI的敏感性。
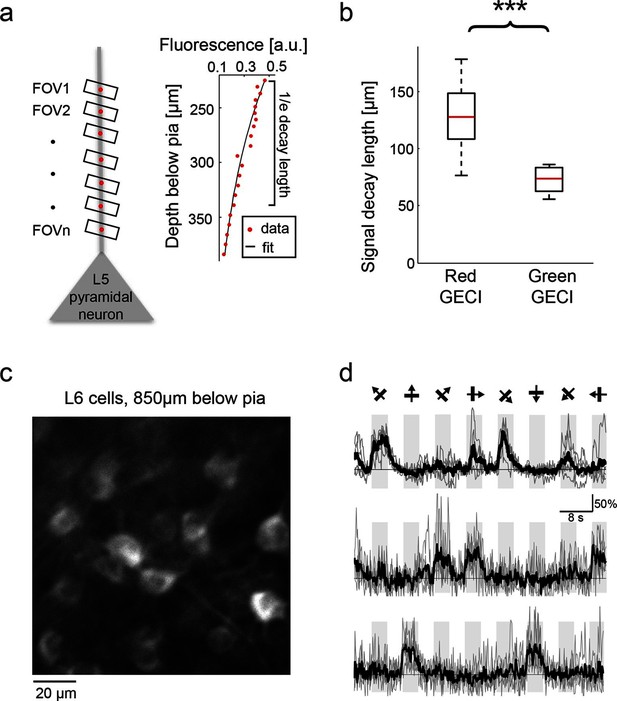
与基于GFP的传感器相比,红色探针成像受激发光散射和荧光吸收的影响较小( 图2——图补充1 )可以在体内进行更深入的成像( Horton等人,2013年 ). 为了估计荧光如何随成像深度衰减,我们对第(L)5层细胞的顶端树突进行成像( 图5a ). 我们对作为深度函数测量的荧光信号进行了指数衰减拟合。 红色GECI荧光衰减较慢(130±30μm; 感染RCaMP1h、R-GECO1或jRGECO1a的小鼠中位值±s.d.,19个树突,n=3只,GCaMP6荧光(75±15μm; 中位数±标准日,14个树突,n=2只感染GCaMP6s或GCaMP6的小鼠; p<0.0001,Wilcoxon秩和检验)( 图5b ).
使用红色GECI进行深层组织成像。 ( 一 )左,测量示意图。 在不同深度(FOVs 1-n)对L5神经元顶端树突进行成像。 右,来自L5顶端树突(红点)的RCaMP1h荧光作为成像深度的函数。 对于固定激发光,由于散射和吸收损失,亮度随成像深度而降低。 衰减的特征是对信号拟合指数函数(实心黑线)。 ( b )从表示绿色(GCaMP6s或GCaMP6 f)或红色(RCaMP1h、jRCaMP1 a和jRGECO1a)GECI的枝晶测得的指数衰减系数。 红色GECI信号衰减系数显著长于绿色GECI(Wilcoxon秩和检验,p<0.0001;红色GECI有3只小鼠和19个树突;绿色GECI有2只小鼠和14个树突)。 ( c )L6神经元,软脑膜下850μm。 NTSR1-cre鼠标( Gong等人,2007年 )感染了FLEX-SYN1-NES-jRCaMP1a AAV。 ( d日 )来自三个示例L6神经元的示例轨迹。 叠加单个试验(灰色)和5个试验的平均值(黑色)。 八个光栅运动方向由箭头指示,如上图所示。
https://doi.org/10.7554/eLife.12727.018
这增强了成像深度,例如可以在L6中进行深层成像。 我们通过将AAV-SYN1-FLEX-jRCaMP1a病毒注射到大鼠的视皮层来感染L6神经元 NTSR1号机组 -cre(L6特异性标记)小鼠( Gong等人,2007年 ). 感染四周后,我们可以检测到L6细胞(至软脑膜下方900μm处)对视觉刺激的定向调节性体细胞瞬变( 图5c、d ).
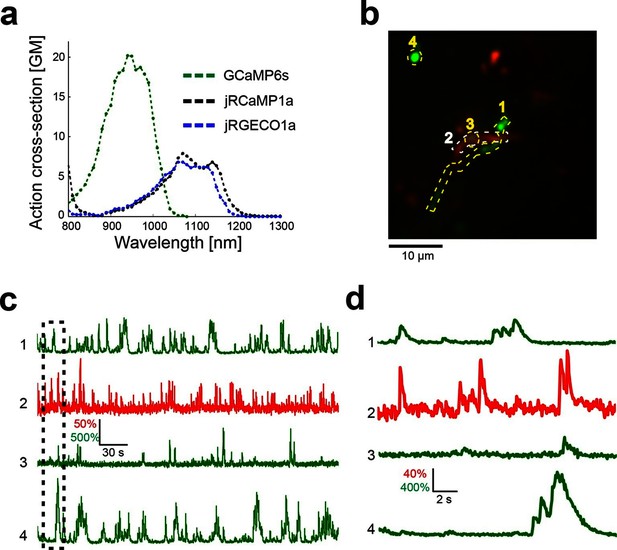
红色GECI的光谱特性允许与绿色GCaMP6指示剂一起进行双色成像。 为了演示空间混合神经元突起的双色功能成像,将FLEX-SYN1-jRGECO1a AAV注射到L5神经元特异表达cre重组酶的小鼠株V1中(KJ18-cre)[ Gerfen等人,2013年 ])将SYN1-GCaMP6s AAV注射到皮质LM中,LM将轴突发送到V1( 安德曼等人,2011年 ; Oh等人,2014年 ). 使用1000 nm的单一激励源激励两个指示器。 在V1的L1进行成像,可以可靠地检测到来自重叠轴突和树突的信号( 图6 , 视频2 ). 我们注意到,当成像相对较大的细胞隔室,如细胞体或顶端树突时,红色GECI的漂白程度较低( 视频1 – 2 ),但薄轴突明显漂白。 更大的隔室更宽容,因为成像分子的漂白和扩散之间的动态平衡。
小鼠视觉皮层的双色成像。 ( 一 )钙饱和GCaMP6s、jRCaMP1a和jRGECO1a的双光子作用光谱。 对纯化蛋白进行测量(材料和方法)。 ( b )KJ18-cre小鼠L1(软脑膜下50μm)L5顶端树突(红色)和LM轴突(绿色)的图像。 ( c )ΔF/F 0 轴突(绿色)和树突(红色)ROI的痕迹,如 b ( 视频2 ). ( d日 )中虚线框对应的放大 c .
https://doi.org/10.7554/eLife.12727.019