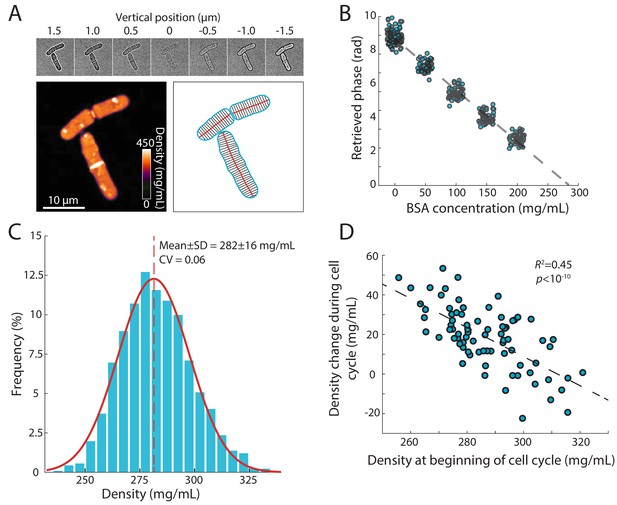
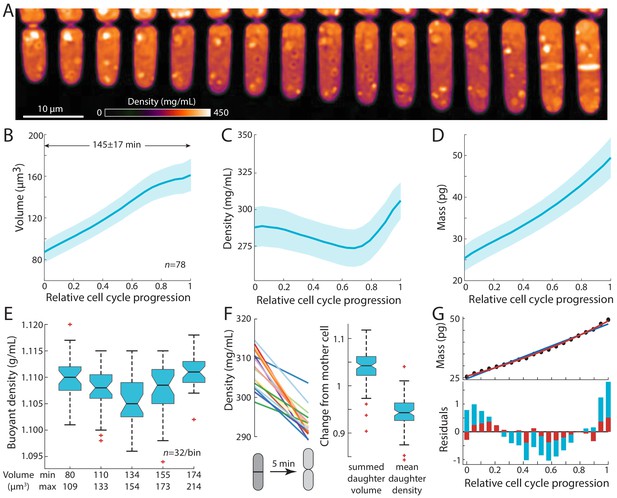
这里,我们建立了一种基于z-用于量化活细胞内细胞密度动态的亮场图像堆栈。我们发现指数期分裂酵母细胞的干密度为282±16 mg/mL(图1C-E)浮力质量密度为1.108±0.005 g/mL(图2E),与其他生物体的测量结果相当(Neurohr和Amon,2020年;Bryan等人,2010年). 野生型裂变酵母细胞的密度在整个细胞周期中有系统地变化,变化范围为~10%(图2C)而干物质合成的相对速率在整个细胞周期阶段保持不变(反映出指数累积)(图2F、G). 这些定量研究结果利用细胞尺寸的精确亚像素测量和自动分析平台,与使用其他方法对裂变酵母进行的定性密度研究一致(Rappaz等人,2009年;米奇逊,1957年;Stonyte等人,2018年).
我们的数据支持一个模型,在该模型中,细胞周期中的这些密度变化是体积增长程序化变化的产物,伴随着恒定的相对质量生物合成速率。因此,体积生长和生物合成在整个细胞周期中没有紧密耦合。在G2期尖端生长期间,细胞内密度稳步下降(图2C和3C公司)表明在此期间,体积增长速度超过了生物合成速度。有丝分裂和胞质分裂期间密度稳步上升(图2C)当体积增长停止或减缓时。子细胞分离后(细胞出生),随着新细胞端的扩张,细胞体积迅速增加,密度下降(图2F; Atilgan等人,2015年)可能是由于水侵。
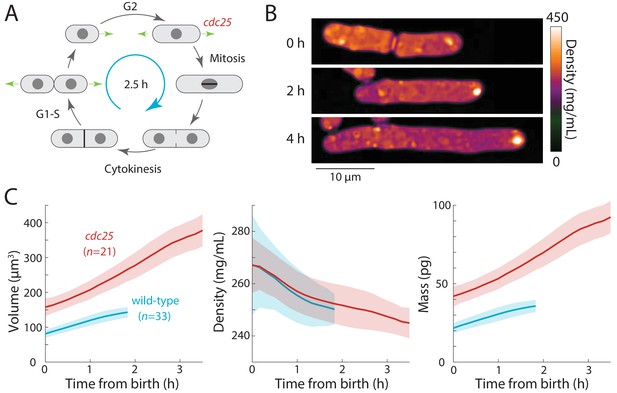
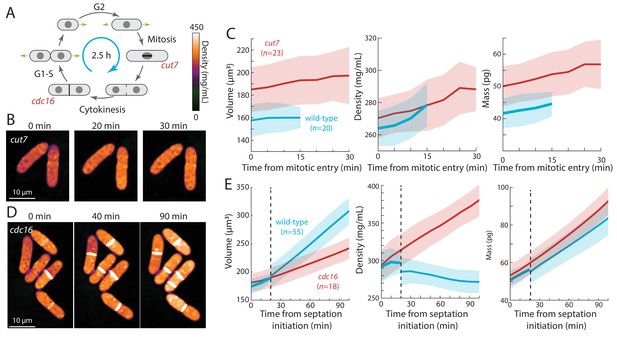
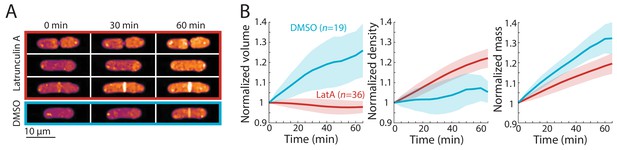
与此模型一致,细胞周期进展或体积增长的扰动直接加剧了密度变化。cdc25随着细胞异常伸长,G2期延迟的突变体表现出密度的稳定下降(图3)这让人联想到在很大的芽殖酵母细胞和衰老哺乳动物细胞中观察到的细胞质稀释(Neurohr等人,2019年). 纺锤体检查点有丝分裂停止期间(剪切7)或通过调节SIN途径抑制胞质分裂(cdc16),体积增长减缓,但质量合成不受影响,导致密度稳定增加(图4C、E). latrunculin A对细胞生长的抑制导致密度稳定增加,而与细胞周期阶段无关(图5). 这些发现表明,任何影响细胞周期进展或生长的扰动都可能改变密度动力学。细胞周期阻滞通常用于细胞同步化,通常是为了应对DNA损伤等压力而触发的。我们的研究表明,这种扰动并不像人们通常认为的那样无害;停搏不仅影响细胞周期进展和细胞大小,还引起细胞内密度的变化和其他潜在的下游生理变化。
我们的研究提供了整个细胞周期中单个分裂酵母细胞质量动力学的定量测量。我们发现大量积累是连续的,与以前的研究一致(米奇逊,1957年;Stonyte等人,2018年). 值得注意的是,我们的定量测量表明质量动力学本质上是指数的(图2D,G,图2——图补充3A)与其他细胞类型的研究结果一致(Godin等人,2010年). 有趣的是,对其他细胞类型的密度和生长的研究报告了一些不同的细胞周期模式。在芽殖酵母中,浮力密度在G1早期最低,在芽形成时在G1晚期和S期上升(Bryan等人,2010年). 此外,与我们在裂变酵母中的发现不同,S期和M期细胞周期阻滞以及latrunculin A处理不会导致芽殖酵母中浮力密度的增加(图5). 在人类细胞中,大规模生长在有丝分裂早期继续,但在中期停止,在胞质分裂晚期恢复,可能伴有细微的振荡(Liu等人,2020;Miettinen等人,2019年). 在细胞周期的大部分时间里,人类细胞的密度是恒定的,但有丝分裂减少(浮质减少0.5%,相当于干质密度减少>10%),同时有丝分裂四舍五入期间体积增加10-30%;然后胞质分裂密度略有增加(Son等人,2015年;Zlotek-Zlotkiewicz等人,2015年). 在细菌中大肠杆菌,密度从出生到分裂略有不同,但表面积与质量的比率相对恒定,这表明生物合成与表面积合成有关(Oldewurtel等人,2019年). 在这里,我们发现在裂变酵母中,质量与表面积的关系也比体积更密切,特别是当隔膜两侧的表面积被考虑在内时(图2——补充图3B–D). 然而,例如latruculin A处理的细胞(图5B)证明了物质积累和表面积增长不是密不可分的,可以解耦。细胞密度调节的一般规则是否会从生物体和细胞类型之间的比较中产生,还有待观察。
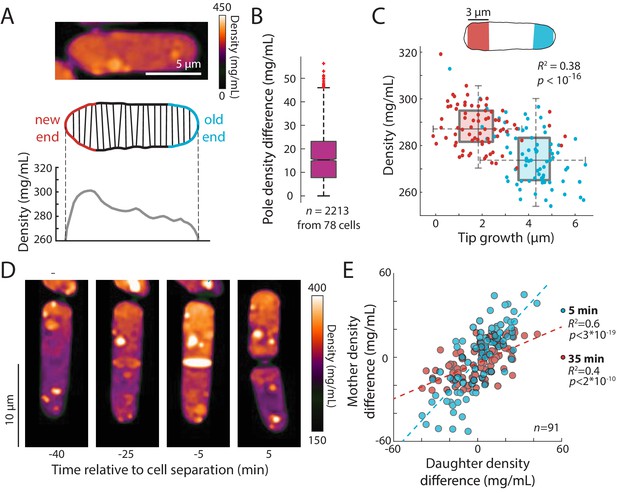
我们的发现也为体积生长速率和亚细胞密度调节之间的关系提供了见解。裂殖酵母细胞通过顶端生长进行生长,这涉及到新细胞壁和质膜在生长顶端的延伸和组装;这种生长是通过细胞极性机制、胞吐作用、壁生长和机制以及膨压的复杂整合来实现的(Martin和Arkowitz,2014年;Chang和Martin,2009年). 除了体积增长对密度的全球影响外,我们发现的密度模式的有趣极化(图6)提示尖端生长更直接地影响局部细胞密度模式。空间梯度表明,局部密度与叶尖生长相关,生长端密度较低(图6C). 目前尚不清楚是什么细胞成分导致了这种空间格局,以及它们是在生长细胞尖端被积极耗尽还是集中在非生长区域。FITC染色显示总蛋白/RNA分布不对称(图6——图补充2).这种梯度可能是由膜结合或无膜细胞器的分布引起的;除非存在扩散屏障(可能是原子核),否则它不太可能由可溶、自由扩散的粒子产生。我们注意到,在受损(羰基化)蛋白质的免疫荧光中检测到极化模式,这可能会影响复制老化(Erjavec等人,2008年). 在间期建立的极化密度模式通常通过细胞分裂传播,并似乎由子细胞遗传,导致谱系间密度的差异(图6D、E). 这些模式如何导致细胞谱系中的不对称行为,如生长模式和衰老,仍有待探索(Chang和Martin,2009年;Erjavec等人,2008年). 哺乳动物细胞中也观察到密度的空间异质性;这些模式是否与细胞形状、细胞器或细胞质密度的变化有关尚待确定(Oh等人,2019年;Choi等人,2007年;Tolde等人,2018年).
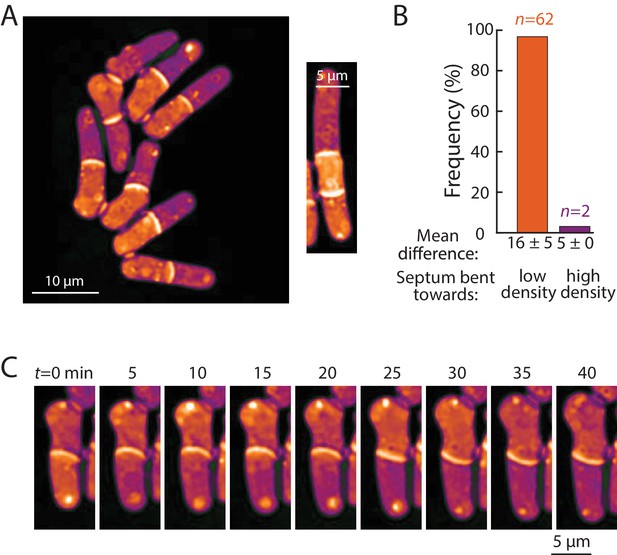
细胞内密度变化对细胞功能的影响才刚刚开始被认识到。我们观察到的5-20%的密度变化可能会影响细胞质中大多数(如果不是全部)细胞成分的浓度,这可能会对细胞反应的生物化学以及大分子拥挤和粘度产生深远的影响,例如通过影响扩散(米奇逊,2019年;Neurohr等人,2019年;van den Berg等人,2017年;Zhou等人,2008;吕比·菲尔普斯,2000). 我们发现的一个有趣的暗示是,观察到的密度变化可能意味着细胞质物理性质的细胞周期依赖性和空间变化。在这里,我们提供了证据表明密度也会影响细胞力学,从而影响细胞形状。子隔室之间的细胞内渗透压和密度差异强烈耦合,弹性隔室壁的弯曲证明了这一点(图7). 密度可能通过对大分子拥挤的影响来影响压力,大分子拥挤会产生与水的置换相关的胶体渗透压(米奇逊,2019年). 胶体渗透压的差异被认为会影响核的大小(米奇森,2019;Harding和Feldherr,1959年),但实验证据表明拥挤与力的产生有关体内总体上仍然不足。因此,我们的发现为以下观点提供了重要支持:不同密度的大分子可以产生足够大的胶体渗透压差异,从而改变细胞形状。我们推测,细胞分裂时密度的增加可能通过增加膨胀压力提供机械力,以促进细胞间的分离和细胞壁的膨胀(Atilgan等人,2015年),并可能影响其他细胞周期阶段细胞壁内的机械应力分布。
尽管密度发生了这些变化,但作为一个种群,细胞的密度分布保持相对紧密(CV~6%;图1C),表明存在维持密度水平的稳态机制。事实上,与体内平衡相一致,我们的发现表明在细胞周期过程中密度波动得到了部分修正(图1D). 一种可能的体内平衡机制是通过调节体积增长率。在裂变酵母中,随着密度增加的扰动,体积增长率急剧增加,密度恢复正常(Knapp等人,2019年). 密度如何影响体积增长率,可能是通过某些细胞内因子的浓度或通过对细胞内压力的影响,尚待阐明。在其他情况下,细胞也可能通过调节生物合成速率来保持密度(Miettinen等人,2019年). 需要进一步研究细胞密度对特定细胞过程的影响,以了解密度变化对细胞生理学的全部影响。