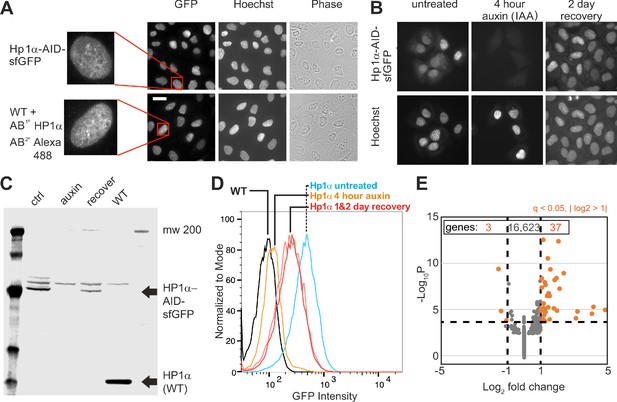
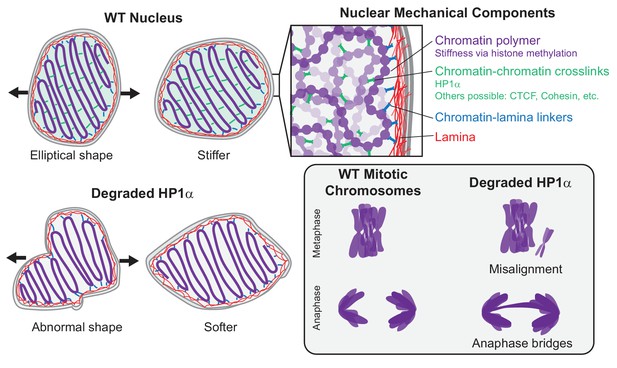
鉴于HP1α在基于染色质的核力学中的机械作用,我们假设HP1α也可能有助于有丝分裂染色体力学。 与间期核力学反应一样,异染色质最近被证明控制有丝分裂染色体的力学( Biggs等人,2019年 ). 以前有报道称,大多数HP1α在前期通过磷酸化H3S10从染色体上去除,已知磷酸化会破坏HP1α-H3K9me 2,3 绑定( Fischle等人,2005年 ; Hirota等人,2005年 ). 然而,一些HP1α结合在整个有丝分裂过程中保持( Serrano等人,2009年 )提示HP1α在有丝分裂染色体机制中可能起作用。
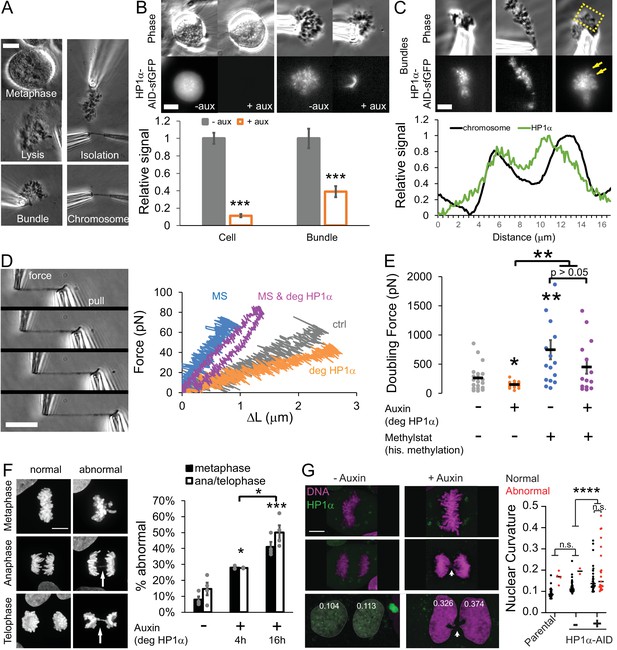
我们使用了荧光成像和微移液管微操作方法( Biggs等人,2019年 ; Sun等人,2018年 )在不使用或使用生长素处理4小时以降解HP1α( 图5B ). 前中期细胞显示染色体结合和弥漫的细胞质HP1α-AID-sfGFP信号。 生长素诱导降解后,细胞质和染色体HP1α-AID-sfGFP信号几乎完全消失( 图5B ). 为了进一步验证有丝分裂染色体上是否存在HP1α,我们通过温和的裂解和捕获从细胞中分离出有丝分裂的染色体束。 对这些没有细胞质高背景荧光的孤立束进行荧光成像,我们可以观察到HP1α在有丝分裂染色体上清晰存在( 图5A ). 除了集中病灶外,HP1α-AID-sfGFP也存在于染色体臂上( 图5C 和 图5——图补充1,A B ). 活细胞的共焦成像显示,集中病灶位于着丝粒周围区域( 图5——补充图1C )与之前发布的报告一致( Akram等人,2018年 ; Fischle等人,2005年 ; Hirota等人,2005年 ; Serrano等人,2009年 ). 通过额外的荧光成像,我们观察到HP1α-AID-sfGFP在生长素诱导的降解过程中丢失( 图5B C ). 因此,我们确认内源性HP1α-AID-sfGFP与有丝分裂染色体臂和着丝粒周相关,并且在生长素处理4小时后降解。
HP1α是有丝分裂染色体的一个机械成分,有助于有丝分裂的正确分离。 ( A类 )使用微量移液管从活细胞中分离有丝分裂染色体的步骤示例图像。 ( B类 )通过相位对比和HP1α-AID-sfGFP荧光强度对代表性活有丝分裂细胞和分离的有丝分裂染色体束进行成像。 通过测量细胞或染色体束的荧光减去背景荧光计算的值,归一化为未经处理的细胞HP1α荧光强度的平均强度。 p值报告为***<0.001,通过学生的t检验计算。 ( C )裂解细胞外分离的有丝分裂束的内源性HP1α-AID sfGFP荧光的示例图像。 黄色方框表示绘制图形线扫描的区域。 行扫描显示染色体臂上有HP1α。 ( D类 )力拉伸实验的示例图像。 右移液管从左移液管中抽出,从而拉伸染色体并使左移液器偏转。 左侧“力”吸管具有预先测量的弯曲常数(单位:pN/um),用于计算力。 左图为不同条件下的力延伸实验痕迹示例。 ( 电子 )每种条件下的平均倍增力(100%应变)图,单位为微微牛顿,由力延伸轨迹的斜率和初始染色体长度决定。 对于B-E,对照组和处理的生长素的n=20,甲基stat的n=16,处理的生长素甲基stat为n=14,通过学生的t检验计算p值。 ( F类 )通过后期桥接或不分离的异常有丝分裂分离的示例图像。 对照未处理细胞(-)或生长素处理细胞(+)在4或16小时内出现后期桥或非分裂/非整倍体,有丝分裂细胞显示异常中期错位(黑条)和后期/末期错位(白条)的百分比图。 中期错位三到四个生物复制实验(黑点),包括n=16、15、20、37-辅助,n=33、33、24+辅助4小时,n=22、48、58、54+辅助16小时。后期和末期错位3-4个实验(黑点子),包括n=29、23、30、30-辅助,n=32、29、18+辅助4个小时,n=20、35、36、, 45+辅助16小时p值报告为*<0.05,**<0.01,***<0.001,***<0.0001,通过Student t检验计算。 ( G公司 )通过有丝分裂追踪24小时HP1α-AID-sfGFP细胞-生长素或+生长素,以确定异常有丝分裂是否导致通过核曲率测量的子核形状异常(17个有丝分裂中的亲本34个核;23个有丝裂中的-生长蛋白46个核;26个有丝分化中的+生长蛋白51个核,单向方差分析中的p值)。 出现异常有丝分裂的百分比 图5——补充图1D 。误差条表示标准误差。 A-C中的比例尺=10μm,F=20μm。
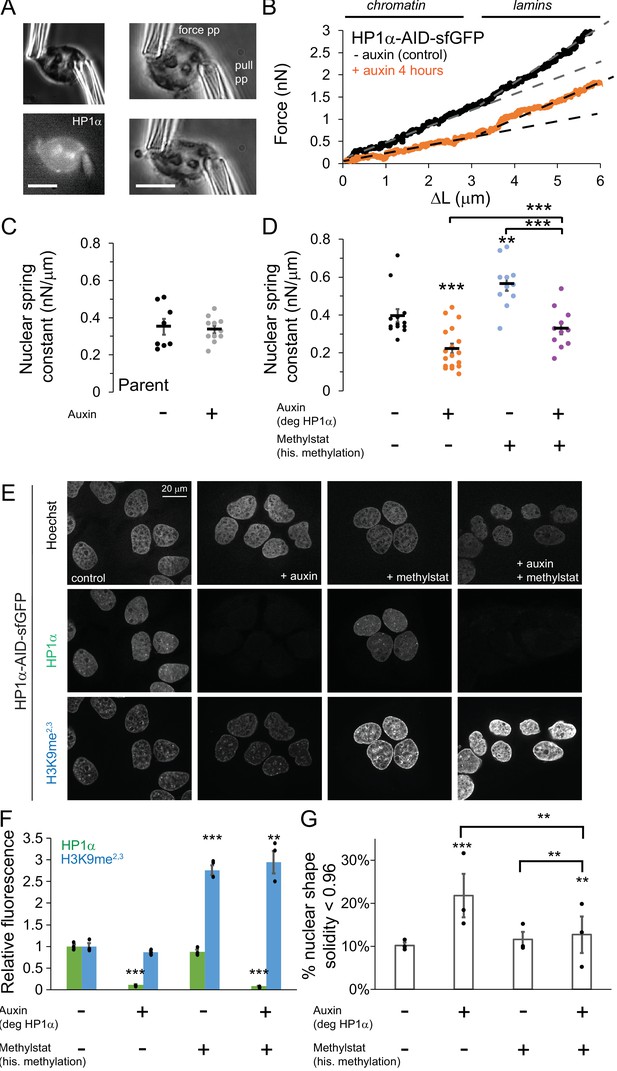
通过显微操作力测量研究了HP1α在有丝分裂染色体中的机械作用。 分离出的染色体束由一个微量移液器保持,而另外两个微量移样器用于捕获和分离单个染色体( 图5D ). 然后用硬吸管延伸单个有丝分裂染色体,而另一个硬得多的力吸管的偏转提供了一个力测量,其方式与我们对间期核的实验相同( 图5D ). 对于每个单独的染色体,我们计算了力与延伸图( 图5D ). 由于23条人类染色体中的每一条都是唯一的长度,我们通过外推力延伸斜率来计算长度相关测量值,以确定“加倍力”——染色体长度加倍的力(即100%应变时的力, 图5E ). 由于移液管握住染色体的两端,张力分布在整个染色体上( 图5D 示例图像)。 因此,测量的阻力包括染色体臂和着丝粒周围区域的染色质以及HP1α的贡献。 我们发现HP1α的缺失使有丝分裂染色体加倍力降低了约40%,从对照细胞的262±50pN(弹簧常数27pN/μm)降至生长素处理细胞的148±12pN(16pN/μm)(p=0.03, 图5E )表明HP1α对有丝分裂染色体机制有重要贡献。
接下来,我们研究组蛋白甲基化和HP1α蛋白是否在有丝分裂期间分别控制染色体机制,就像在间期一样。 通过甲基化抑制剂处理增加组蛋白甲基化在有丝分裂染色体的机械硬度中起着关键作用( Biggs等人,2019年 ). 此外,有证据表明核小体上的表观遗传标记之间存在直接的生物化学相互作用,与标记阅读蛋白(如HP1α)无关( Bilokapic等人,2018年 ; Zhiteneva等人,2017年 ). 因此,我们旨在确定组蛋白甲基化和HP1α是否独立影响有丝分裂染色体僵硬。
我们用组蛋白去甲基化酶抑制剂methylstat处理细胞,以通过添加生长素来控制有或没有HP1α的细胞中甲基化组蛋白的水平。 从用甲基化抑制物处理以增加甲基化组蛋白水平的细胞中分离出的有丝分裂染色体确实显示出显著的、大于100%的倍增力,从262±50 pN增加到745±164 pN(p=0.005, 图5 ,D和E),重述之前对HeLa细胞的结果( Biggs等人,2019年 ). 从同时使用甲基化抑制剂(增加甲基化)和生长素(降解HP1α)的细胞中分离出的有丝分裂染色体具有与仅使用甲基化激素(452±116 pN)处理的细胞相当的倍增力(p=0.18, 图5 、D和E)。 相反,与生长素和甲基stat相比,仅用生长素处理的细胞有丝分裂染色体具有显著不同的倍增力(148对452 pN,p=0.005)。 数据表明,组蛋白甲基化独立于HP1α使有丝分裂染色体变硬,因此在决定有丝分裂的染色体机制中起主导作用。 同时,我们强调,HP1α在野生型细胞有丝分裂染色体机制中显然起着重要作用。
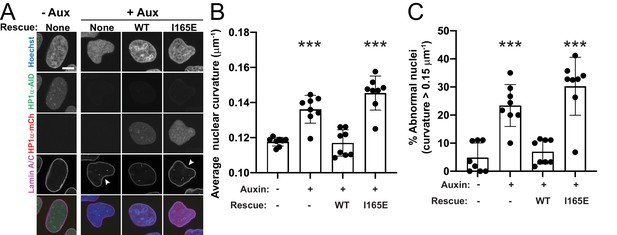
众所周知,HP1α缺失会导致染色体不稳定、异常重组、后期桥和染色体滞后( Chu等人,2014年 ). 因此,HP1α在中期染色体机制中的作用可能在有丝分裂期间具有功能重要性。 为了验证这一点,我们测量了对照组、4小时和16小时生长素处理的HP1α降解群体在染色体分离期间中期或后期桥中染色体错位的有丝分裂细胞的百分比。 HP1α耗竭导致中期错位显著增加,从对照组的8%增加到生长素4小时组的28%和生长素16小时组的41%,以及由ana/末期桥测量的种族隔离失调,从生长素四小时组的15%增加到28%,生长素16h组的50%(均p<0.05, 图5F ). 因此,HP1α的缺失破坏了染色体机制,并通过染色体错位和错配导致有丝分裂功能障碍。
据报道,有丝分裂异常也会破坏子细胞的核形态( Gisselsson等人,2001年 ). 因此,我们通过有丝分裂对未使用或使用生长素处理的细胞进行24小时的跟踪,以确定有丝分裂异常是否会导致有丝分裂后的核形态异常。 亲代或未经处理的HP1α-AID-sfGFP细胞中的异常有丝分裂很少见,但它会导致子细胞具有高核曲率(红点, 图5G ). HP1α降解的细胞发生异常有丝分裂的频率更高( 图5 、F和G)。 有趣的是,有丝分裂正常和异常后,HP1α降解的子细胞在有丝分裂后4小时的G1期表现出平均核曲率增加( 图5G ). 这些数据表明,HP1α降解后的有丝分裂异常可能不是核形状异常的主要原因,因为在这些条件下正常有丝分裂会导致有丝分裂后子核的曲率同样高( 图5G ). 综上所述,HP1α对有丝分裂染色体的正常机制和功能是必要的,其缺失会导致有丝分裂异常,并独立地导致子代间期细胞核形状异常。