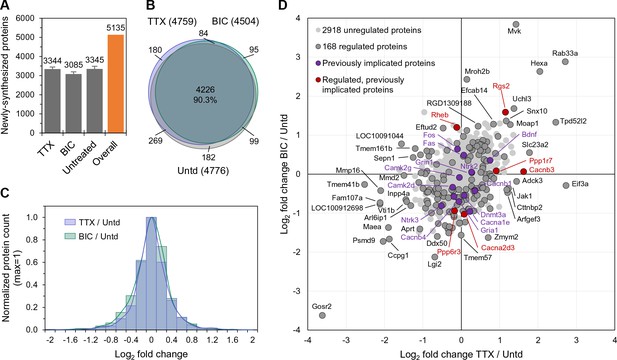
为了确定细胞对神经活动操纵的早期反应,我们用TTX或荷包牡丹碱处理培养的海马细胞2小时,以诱导放大或缩小的过程( Turrigiano等人,1998年 )在此期间,使用叠氮高丙氨酸(AHA)和BONCAT对新合成的蛋白质进行代谢标记( Dieterich等人,2006年 ; Schanzenbächer等人,2016年 ). 我们将TTX和荷包牡丹碱处理的样品中新合成的蛋白质组相互比较,并与未处理的对照组进行比较,分析了五个生物复制品。 使用MaxQuant对蛋白质进行鉴定和量化( 考克斯和曼恩,2008年 ),符合以下标准:(i)每种确定的蛋白质至少有一个肽(ii)在至少1/5中检测到的蛋白质( 图1A-B )或2/5(所有后续图)实验和(iii)在Met对照组中未检测到的蛋白质(见材料和方法)。 与全球蛋白质组相比,我们的AHA标记蛋白质的蛋氨酸含量没有差异( 褐家鼠 ,UniProtKB数据库),因为平均每100个氨基酸中分别存在2.42和2.40 Met残基( 图1——图补充1I ). 如所示 图1A ,我们在每个治疗组中鉴定了3000多个蛋白质,总共鉴定了5000多个独特的蛋白质(将各组蛋白质相加,参见 补充文件1 ). 大多数蛋白质在至少3/5个重复中被鉴定,不同功能群中蛋白质的相对代表性以及蛋白质的丰度在不同条件下没有差异( 图1——补充图1A–C ). 每个治疗组内与复制品相关的蛋白质强度与每个2小时治疗组的蛋白质强度密切相关( 图1——补充图1D–G ). 如前所述( Schanzenbächer等人,2016年 )活性操作并未导致蛋白质组整体大小发生显著变化( 图1A ). 事实上,这三组蛋白质的重叠超过90%( 图1B ). 在各组中唯一鉴定出的新合成蛋白质分别为180、95和182个TTX组、荷包牡丹碱组和未处理组,约占每个新生蛋白质组的3-6%。 我们分析了这些独特的蛋白质,发现其中大多数是在一次重复中检测到的( 图1——图补充1H ). 在3/5个重复中检测到少量蛋白质(TTX、bicuc和未处理的分别为4、2和3),代表细胞骨架相关蛋白和信号分子( 图1——图补充1H ).
活性增强或降低2小时后新合成的蛋白质组。 ( A类 )如图所示,条形图显示每组中新合成蛋白质的平均数量。 误差条代表5个生物复制品的±SEM。 ( B类 )维恩图显示了每个治疗组(TTX或荷包牡丹碱)和未治疗对照组中表达的蛋白质的数量(括号内)和重叠。 ( C类 )蛋白质折叠变化(对数 2 )显示了与未处理的样品相比,每个处理组的总体蛋白质组调节。 ( D类 )散点图显示了所有显著调节的蛋白质(深灰色;n=168;ANOVA,FDR=0.05)以及之前在稳态缩放中涉及的蛋白质的调节(红色)。 浅灰色或紫色显示的蛋白质没有显著调节。
https://doi.org/10.7554/eLife.33322.003
无论是活性的刺激(bicc)还是抑制(TTX)都不会引起蛋白质的系统性变化(例如全局上调或下调)( 图1C )而是诱导不同组蛋白的上调或下调。 我们使用无标签定量(LFQ)对蛋白质表达水平的这些变化进行了重点分析( Cox等人,2014年 )分析不同组中已鉴定肽的强度( 图1——补充图1C ). 总之,我们检测到168个蛋白,其表达水平通过增强或降低活性或通过两种操作显著调节( 补充文件2 ). 在 图1D ,由增强和降低的活性显著上调或下调的蛋白质分别显示在右上象限和左下象限。 请注意,这两个象限中的蛋白质调节并没有提供有关活动操作方向的信息(例如,向上或向下,“极性”),而是可以指示偏离活动设定点的绝对值。 其他蛋白的表达水平显著增加,这与增强(左上象限)或降低(右下象限)活性有关( 图1D ). 原则上,这些类别的调节蛋白可以检测或表示偏离设定值的偏移量和偏移量的符号。 我们将这些受调控的蛋白质与之前由其他组参与稳态缩放的35种蛋白质的精选列表进行了比较( 补充文件2 ; Schanzenbächer等人,2016年 ). 我们在我们的数据集中发现了六种以前与缩放有关的蛋白质,包括两种Ca2+通道亚基(Cacn3和Cacna2d3)、两种蛋白磷酸酶(Ppp1r7和Ppp6r3)和两种G蛋白家族成员(Rheb和Rgs2)。
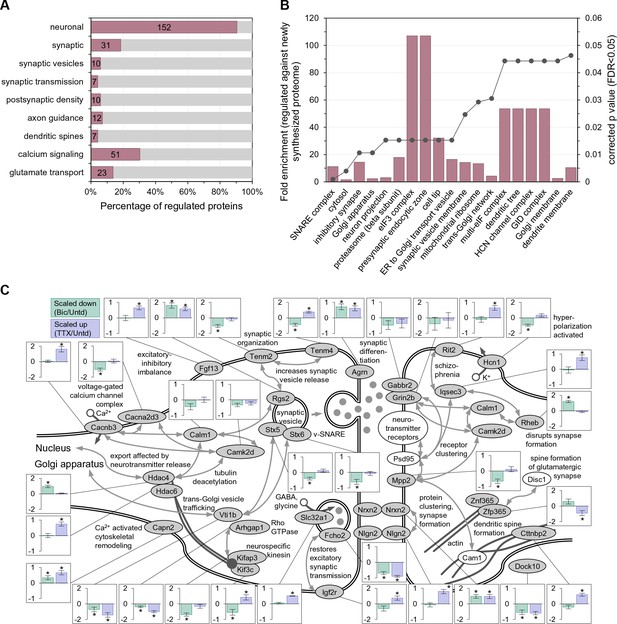
在活性增强或降低2小时后,哪些功能蛋白质类表现出显著的差异调节? 我们对168个显著调控蛋白进行了基因注释(GO)分析,发现大多数(152/168)调控蛋白具有神经元功能,许多与突触功能相关( 图2A , 补充文件3 )这表明大多数受显著调控的蛋白质并不仅仅是与常见的细胞或代谢功能相关的。 以未经处理的样品中新合成的蛋白质为背景,我们研究了活性操作对哪些特定功能基团的调节( 图2B , 补充文件3 ). 在表现出显著富集的前20个术语中,有许多术语与分泌途径有关,包括高尔基体、内质网到高尔基体的转运囊泡和高尔基体膜。 在突触内,我们注意到许多蛋白质的调节,包括神经官能蛋白2(Nlgn2)、神经毒素2(Nrxn2)、Agrin(Agrn)和Slc32a1( 图2C ).
增强或降低活性2小时后表现出显著调节的蛋白质的丰富功能组。 ( A类 )所有168个受调控蛋白质的基因本体丰富类别。 大多数蛋白质与神经元功能组相关。 请注意,单个调节蛋白可以属于多个组。 ( B类 )细胞功能富集分析显示所示组(左y轴,条)的折叠富集以及校正的p值(右y轴,线)。 ( C类 )与突触和核功能相关的显著调节蛋白。 条形图插页显示了按比例缩小(小琥珀色处理;浅绿色条)或按比例增大(TTX处理;薰衣草条)的规则。
https://doi.org/10.7554/eLife.33322.005
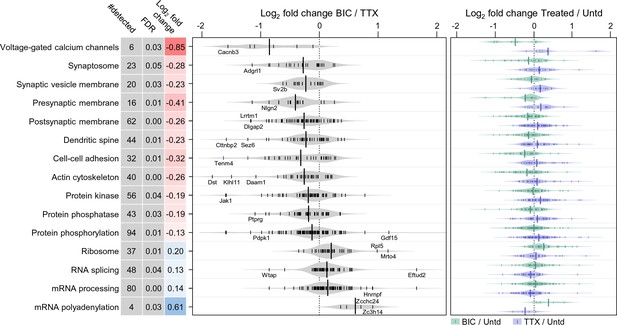
向上或向下操纵活动是否会导致蛋白质组受到差异调节,从而反映操纵的“符号”? 我们发现许多蛋白质组在活性调控组之间表现出显著的差异调节( 图3 , 补充文件4 ). 例如,TTX治疗后显著上调的蛋白质官能团(荷包牡丹碱治疗后下调的蛋白质官能团)包括以下类别:电压门控Ca2+通道、突触体、树突棘以及细胞粘附, 肌动蛋白细胞骨架和与磷酸化和去磷酸化相关的蛋白质。 光谱的另一端是与蛋白质翻译相关的几个蛋白质组,它们受TTX治疗的负调控,而受荷包牡丹碱的正调控( 图3 ). 蛋白质的极性依赖性调节的一些例子也显示在 图2C 例如,驱动蛋白Kif3c、囊泡相关蛋白syntaxin 5(Stx5)、超极化激活通道Hcn1和疾病相关蛋白Teneurin跨膜蛋白4(Tenm4)。
活性增强或降低2小时后,某些蛋白质功能类别的极化差异调节。 用TTX或小苏打碱处理2小时后,选定的受显著调节的蛋白质类和途径的豆区显示出极化调节# detected:分配给指定组的蛋白质数量,FDR:错误发现率,Log 2 折叠变化:荷包牡丹碱与TTX处理神经元的强度比。 蛋白质(黑色标记)被分为功能类别和途径,如材料和方法中所述。 灰色的豆图显示了比丘林和TTX之间的比较,绿色和蓝色的图显示了每个治疗组与对照组的比较。
https://doi.org/10.7554/eLife.33322.006
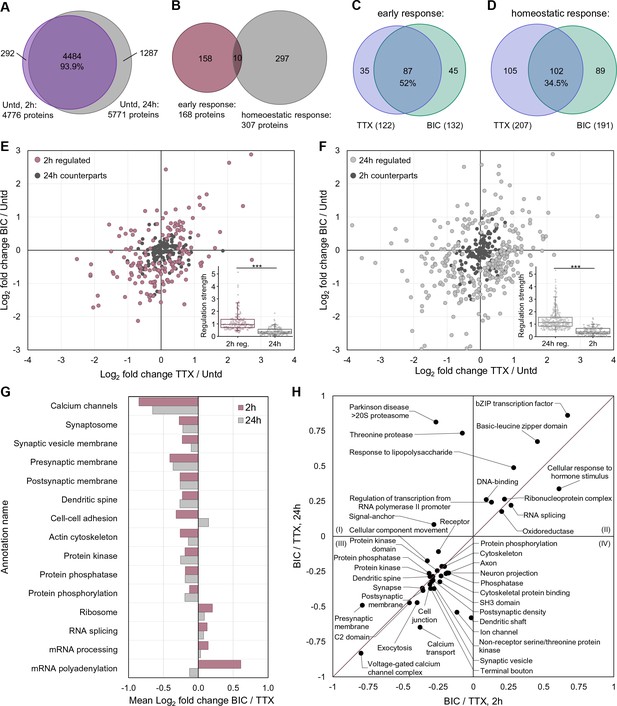
随着时间的推移,对活动偏差的蛋白质组反应如何演变? 为了解决这个问题,我们比较了2小时活动操作(荷包牡丹碱或TTX)后显著调节的新生蛋白和24小时操作(最初描述为 Schanzenbächer等人,2016年 ). 在缺乏活性操作的情况下,在这两个时间点鉴定的新合成蛋白质组在很大程度上(约94%)重叠( 图4A 和 图4——图补充1A ). 有292(2小时)和1287(24小时)蛋白质在一个时间点被唯一识别,但在另一个时间点将无法识别。 利用肽强度,我们分析了这些独特蛋白质相对于总库的相对丰度,发现它们的丰度较低( 图4——图补充1A )这表明,无法在一组中检测到它们可能是由于灵敏度不足。 接下来,我们分析了每个时间点(2小时168个,24小时307个)显著调节的蛋白质,发现重叠水平很低(10个蛋白质)( 图4B 和 图4——补充图1B , 补充文件5 ),不会比偶然的预期大得多。 如中所述 图1D TTX和荷包牡丹碱显著调节了大部分蛋白质; 在2小时时,52%的受调控蛋白表现出两种处理的调节作用( 图4C ). 我们感兴趣地注意到,由TTX或荷包牡丹碱唯一调节的蛋白质部分增加( 图4D )这表明,随着治疗持续时间的增加,蛋白质组反应的独特性发生了演变,可能更侧重于稳态效应器机制。
突触缩放2小时和24小时后神经元蛋白质组重构的比较。 ( A类 )维恩图显示2小时和24小时未处理神经元中表达的蛋白质重叠( B类 )维恩图显示突触缩放2小时或24小时后显著调节的蛋白质的重叠。 ( C类 )维恩图显示了2小时后TTX和水蛭素治疗显著调节的蛋白质的重叠。括号内是各组调节蛋白质的总数。 ( D类 )Venn图显示了24小时后TTX和双ucculine处理显著调节的蛋白质的重叠。括号中是每组调节蛋白质的总数。 ( E类 )散点图显示2小时时的调节蛋白(淡紫色点)和24小时时的相应调节(黑色点)。 插图显示了同一组蛋白质的中位数调节强度。 ( F类 )散点图显示24小时时受调控的蛋白质(灰点)和2小时时相应的调控(黑点)。 插图显示了同一组蛋白质的中位数调节强度。 ( 克 )蛋白质组的功能注释表明,尽管重叠的单个调节蛋白质在2小时和24小时内很少出现,但在上调和下调处理之间存在相似的蛋白质组,表现出不同的调节。 ( H(H) )在2小时和24小时受到类似调节的蛋白质组的更详细功能特征。
https://doi.org/10.7554/eLife.33322.007
接下来,我们重点分析了在2小时或24小时时间点显示出显著调控的蛋白质的翻译动力学。 我们检查了每个时间点的显著调节蛋白质,然后在另一个(不显著)调节时间点检查了相同的蛋白质。 在 图4E ,紫红色圆点代表在2小时时调节的蛋白质,在右上象限和左下象限分别显示增强(荷包牡丹碱处理)或降低(TTX处理)活性后,蛋白质上调和下调。 该图中的黑点显示了这些相同蛋白质在24小时时的调节。原点附近的黑点聚集表明,在2小时时受到显著调节的新合成蛋白质在24小时时基本上不受调节 图4F ,灰点表示在24小时调节的蛋白质,黑点表示在2小时调节的这些相同的蛋白质。同样,原点周围的黑点簇表明在2小时时间点这些蛋白质没有显著调节。 虽然几乎没有证据表明,在两种活动操作后的2小时和24小时内,相同的单个蛋白质都受到调节,但我们考虑了功能性蛋白质组可能在这两个时间点都受到调节的可能性,该组内的单个调节蛋白质在2小时与24小时时有所不同。事实上, 我们发现了几个例子,其中一个功能蛋白组在两个时间点都有显著的调节,尽管组内的各个蛋白在每个时间点都不同( 图4G和H , 补充文件4 ). 例如,“电压门控钙通道”组在2小时和24小时均受到显著调节,但各个亚单位在时间点上有所不同(例如,Cacn3和Cacna2d3在2小时,Cacn4在24小时)。 在 图4H ,落在对角线上的蛋白质组在2小时和24小时的时间点都以相同的方向调节,包括突触传递、树突棘、突触、突触后密度、轴突等。 只有少数组,包括苏氨酸激酶和帕金森氏病20S蛋白酶体在24小时时被完全调节( 图4H ). 这些数据表明,大多数蛋白质组在这两个时间点上都是调节的热点,即使组内的单个调节蛋白质不同。
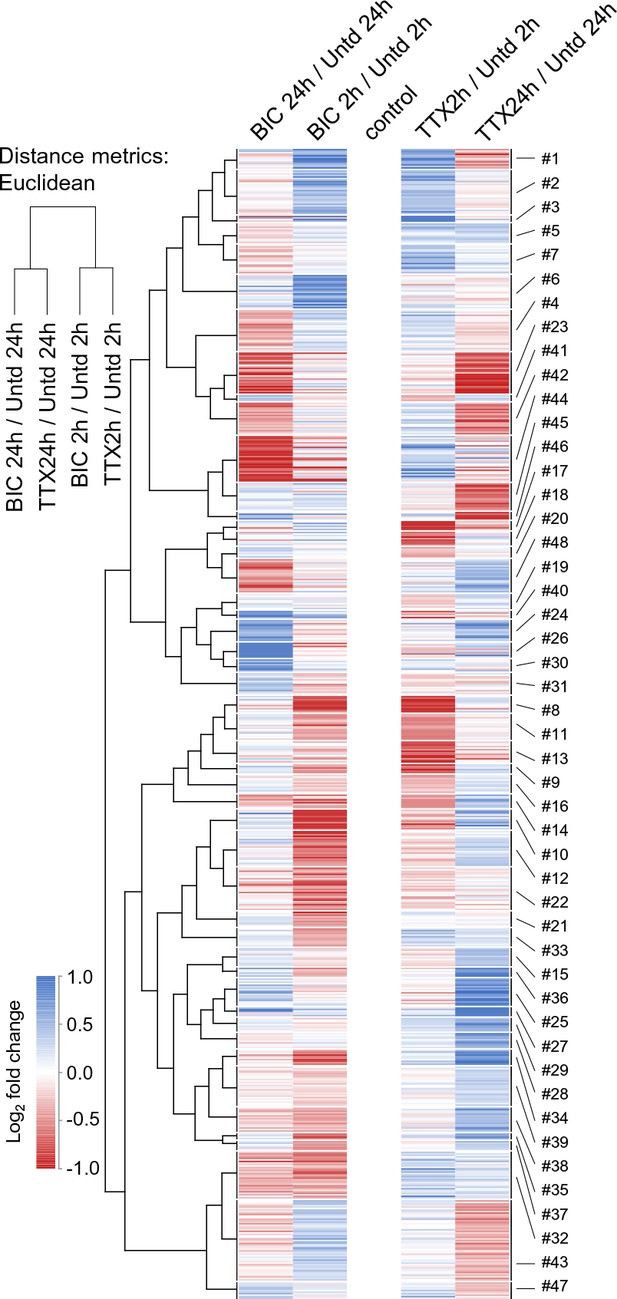
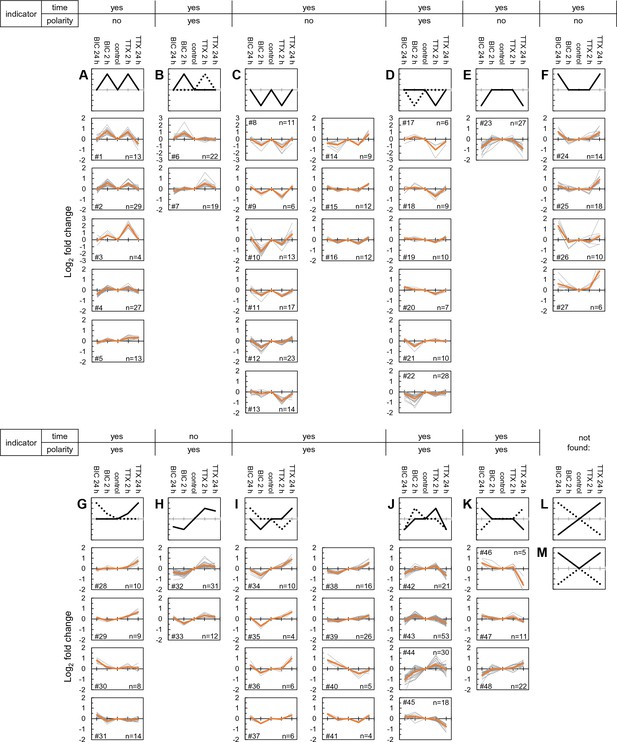
接下来,我们对所有显著调节的蛋白质进行了荟萃分析,除了新合成的不同于未处理样品的蛋白质外,还考虑了两个时间点和/或上下标度条件之间显著不同的蛋白质。 这组主要的比较结果产生了711个显著调节的蛋白质,这些蛋白质显著丰富了神经元标记物,而不是胶质标记物( 补充文件6 ). 我们检测了荷包牡丹碱和TTX处理的样品在2小时和24小时对每个蛋白质的调节,以发现共同调节模式( 图5 和 6 ). 我们使用自组织映射(SOM)将单个蛋白质的各种调控模式分类并组织成相似的组,计算每个簇的平均折叠变化,然后使用层次聚类检查组之间的关系( 图5 ). 为了提取重复的调节模式,我们将单个调节蛋白绘制为与未处理蛋白的偏差,包括在两个时间点和两种条件下在单个轴上的反应( 图6 , 补充文件7 ). 我们首先评估了要使用的最佳簇数,优化了簇内方差的最小化和簇间方差的最大化( 图6——图补充1A ). 基于这些考虑,我们选择了48个簇,每个簇包含4-53个蛋白质( 图6 , 补充文件7 ). SOM揭示了几种不同的监管模式,原则上可以作为活动操纵持续时间(2小时前或24小时后)或极性(增强或减少)的指标。 我们还分析了特定的调控模式是否丰富了特定功能类别的蛋白质( 图6——补充图1B , 补充文件7 ). 我们发现,SOM算法识别的大多数(11/12)调控模式是操纵时间/持续时间的指标。 例如,在2小时时显著调节的蛋白质,但在24小时时上调和下调的蛋白质都属于这一类,它们的调节模式由 图6A-D 也有许多“正弦波”形状调节蛋白的例子,其中早期(2小时)和晚期(24小时)时间点以相反的方式调节( 图6H ). 我们还观察到,在一种或两种条件下(“向上或向下梯形”),仅在24小时时间点对蛋白质进行调节( 图6E、F、K ). 梯形图案显著丰富了各种通道和转运蛋白( 图6——补充图1B ). 此外,发生的一些调控模式表明了活动操纵的极性(标志)。 极性指标是指蛋白质仅对一个(TTX)进行调节的簇 或 荷包牡丹碱)或两种活性操作均发生调节但信号相反(例如,TTX后蛋白质上调,荷包牡蛎碱后蛋白质下调,反之亦然)。 我们发现,自组织图确定的许多(7/12)调控模式是操纵极性的指示器。 极性敏感模式的例子包括“寻找太阳的蠕虫”( 图6G ; 富含激酶, 图6——补充图1B ),“正弦波”( 图6H )或“偏斜的W”( 图6I ),'倾斜的M'( 图6J )或“扁平梯形”( 图6K )配置文件。 我们感兴趣地注意到,我们的数据中也明显缺少一些简单的蛋白质调节模式( 图6L、M ). 例如,单个蛋白质调节的符号和大小可以传递有关活动操纵的时间和方向的信息,如 图6L 然而,没有观察到这种模式,尽管在其他一些集群中可以找到这种模式的一些子特征。 或者,时间信息,而不是极性信息,可以通过“V”或“倒V”传递( 图6M ); 在我们的数据中也没有观察到这种模式。 综上所述,这些数据表明,存在个别蛋白质调节模式,可以传递有关活性偏移持续时间(时间)或偏移极性(上尺度或下尺度)的信息。
自组织图定义了依赖时间和极性的蛋白质组调控簇。 ( A–M )图中显示了使用自组织映射获得的调控蛋白表达谱簇。 沿着簇顶部,表达式配置文件是否指示系统被操作的时间(例如2或24小时)或操作类型(向上或向下缩放)。 ( A类 )“M”剖面由五个簇和总共86种不同的蛋白质表示。 ( B类 )修改后的“M”剖面,由2个簇和41个不同的蛋白质表示。 ( C类 )“W”剖面由9个簇和总共117个不同的蛋白质表示。 ( D类 )修改后的“W”剖面,由6个簇和70个不同的蛋白质表示。 ( E类 )“倒梯形”剖面由1簇27个蛋白质表示。 ( F类 )“梯形”轮廓由4个簇和48个蛋白质表示。 ( 克 )由4个簇和41个蛋白质组成的“寻日蠕虫”图谱。 ( H(H) )“正弦波”剖面由2个簇和43个蛋白质表示。 ( 我 )由8个簇和77个蛋白质表示的“偏斜W”轮廓。 ( J型 )由4个簇和122个蛋白质表示的“偏斜的M”轮廓。 ( K(K) )“扁平梯形”轮廓由3个簇和38个蛋白质表示。 ( L和M )在我们新合成的蛋白质群体中,我们没有发现的两个特征包括“对角线”或“规则或倒V”。
https://doi.org/10.7554/eLife.33322.010
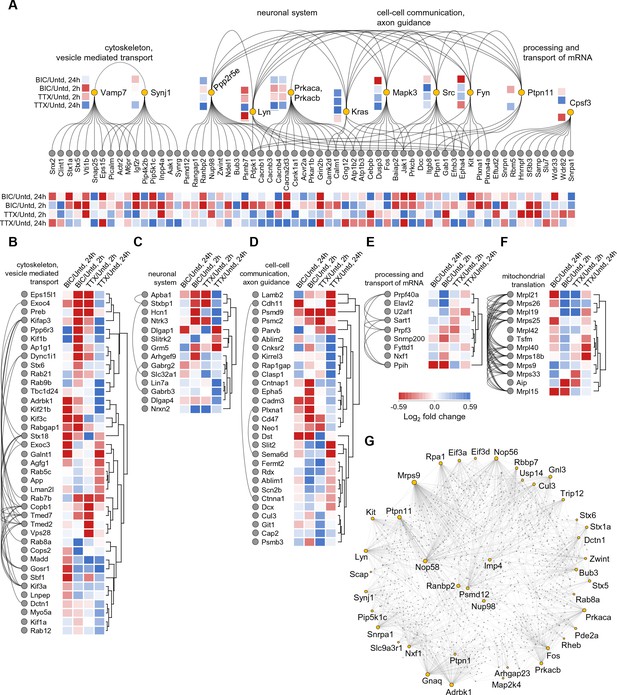
最后,为了检查大量受调控蛋白之间是否存在功能关系,我们进行了网络分析(见材料和方法),包括荷包牡丹碱或TTX治疗后2或24小时显著调控的任何蛋白( 图7 ),生成一个受调控的蛋白质相互作用图。 这项分析揭示了几个蛋白质网络,再次包含与细胞骨架和囊泡介导的运输相关的功能( 图7A、B )、神经元系统( 图7A、C ),细胞间通信( 图7A、D )mRNA的加工和转运( 图7A、E )和线粒体翻译( 图7F ). 在这些信号分子网络中,主要是蛋白激酶和磷酸酶成为中枢。 此外,cAMP依赖性蛋白激酶A的两个催化亚单位(Prkaca和Prkacb)在Bic和TTX刺激后显示出高度相关的变化,TTX刺激24小时后显著增加,Bic刺激2小时后显著减少。 Prkaca和Prkacb与多个调节蛋白相互作用,这些蛋白通常表现出相似的丰度变化,并且已知在突触传递和可塑性中发挥重要作用:电压门控钙通道辅助β亚基1、3和4(Cacnb1、3、4)和α亚基2δ3(Cacna2d3)、钙调素(Calmodulin) 钙依赖性蛋白激酶2亚单位δ(Camk2d)。 类似地,突触体结合蛋白-1(Synaptojanin-1)是一种通过调节磷脂酰肌醇-4,5-二磷酸的膜水平来影响突触传递和膜转运的蛋白质,在TTX治疗24小时后其丰度增加。 我们还观察到磷脂酰-4-和-5-磷酸激酶亚单位(Pip4k2b和Pip5k1c)和相关磷酸酶(Inpp4a)以及磷酸化AP-2以触发氯氰菊酯组装的AP2相关激酶1(Aak1)水平相应升高。 一些调节模式使信号通路的简单线性解释复杂化:一些作为调节激酶/磷酸酶下游靶点的调节蛋白通常是与一个以上调节激酶/磷酸酯酶的潜在相互作用体。 例如,调节蛋白Pdpk1本身是一种激酶,它与其他三种调节激酶(Lyn、Src和Fyn)以及调节磷酸酶(Ppp2r5e)相互作用,其中许多也相互作用( 图7A ). 此外,我们观察到,在Bic和TTX处理2小时后,一组线粒体核糖体蛋白亚基的丰度增加(Mrpl9、19、21和42;Mrps26),但在24小时后显示出不同的趋势( 图7F ).
时间和极性相关蛋白质组调控的网络分析。 ( A–G )使用String数据库,我们分析了所有711个调节蛋白的调节模式和调节蛋白之间的相互作用。 ( A类 )这里我们通过功能基团指出,最具交互作用的蛋白质和蛋白质基团包括( B类 )细胞骨架和囊泡介导的运输( C类 )神经系统( D类 )细胞间通讯和轴突引导( E类 )RNA的加工和运输,以及调节蛋白的高度交互作用组( F类 )与线粒体翻译相关。 ( 克 )描述了在蛋白质组中起高度相互作用的枢纽作用的调节蛋白。
https://doi.org/10.7554/eLife.33322.012
最后,我们研究了已知具有最多相互作用伙伴的调节蛋白。 在这个字符串分析中,我们承认我们只能捕获那些记录在案的相互作用(例如,对于研究得很好的蛋白质),因此可能会错过尚未详细研究的高度交互蛋白质。 考虑到这一警告,我们使用String数据库,确定了具有最高数量蛋白质相互作用的前40个受调控蛋白质( 图7G ). 这组蛋白质与其他蛋白质的相互作用平均为38.3,而随机抽样的40个蛋白质平均为5.6。 这种差异具有统计学意义(p<0.001)。 毫不奇怪,出现了几种激酶(例如Adrbk1、Prkaca、Prkachb、Lyn、Kit)以及磷酸酶(Ptpn1、Ptpn11)。 我们还观察到一些参与突触囊泡循环的蛋白质(syntaxins、Stx1a、Stx5、Stx6)以及有趣的是,与核孔复合体相关的蛋白质(Nup98和Ranbp2)。 具有许多相互作用伙伴的蛋白质的调节显然可以在突触缩放过程中对下游信号产生乘法效应。