常规单粒子CryoEM样品和层析网格表征
摘要
引言
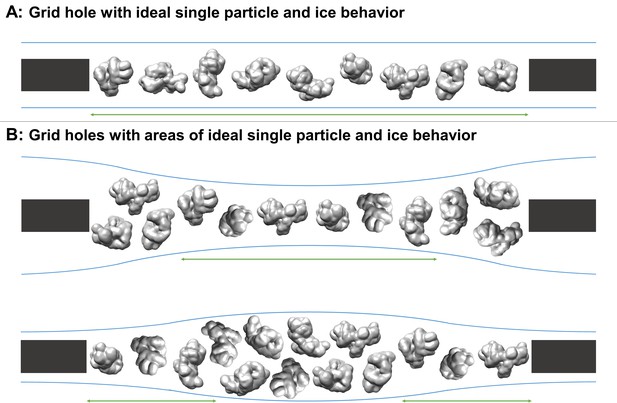
包含理想粒子区域和单粒子低温EM采集冰行为的网格孔横截面示意图。
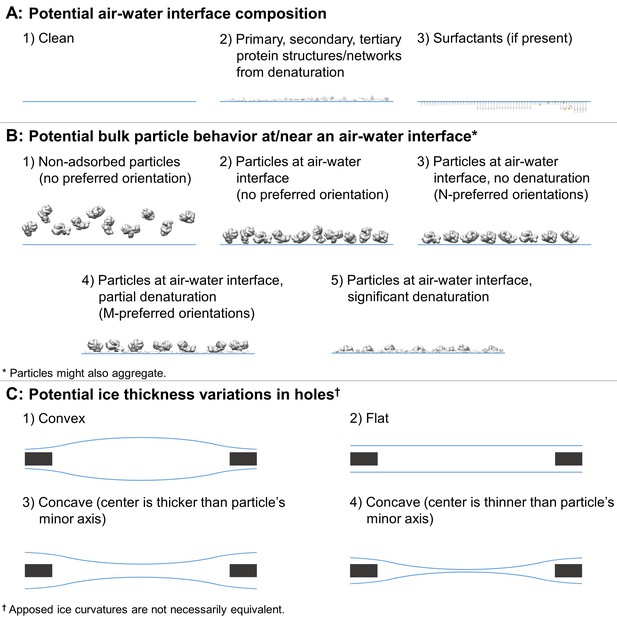
基于 图6 来自( Taylor和Glaeser,2008年 ).
结果和讨论
确定层析成像采集位置
单粒子层析成像分析
冰层厚度测量、颗粒层数量、优选方向估计以及颗粒层与空气-水界面的距离,由不同样品46个网格制备的单颗粒低温电磁网格的低温ET测定。
-
*本示例包含一段视频。 †为该样本保存数据集。 -
故意厚冰。
相同样品的表观气-水界面、颗粒和冰行为 表1 使用中的描述 图1 .
-
*其中包括一段视频作为示例。 †存放数据集用于采样。 -
注1:表观蛋白质片段/结构域被吸附到空气-水界面上。 注2:存在部分颗粒。 -
注3:非吸附颗粒与颗粒层接触。
冰层厚度
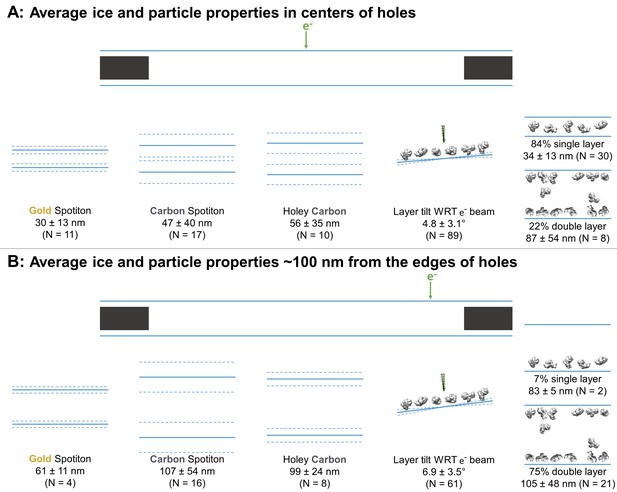
使用最小测量值、平均颗粒层倾斜度(实线)±(1个标准偏差和测量误差)(虚线)的平均冰厚(实线, 以及具有单颗粒层和/或双颗粒层(定义为“1”和/或“2”)的样品百分比 表1 )在孔的中心( A类 )距离空穴边缘约100nm( B类 ).
-
图3-源数据1 冰层厚度和角度测量 图3 . -
https://doi.org/10.7554/eLife.34257.007
跨部门描述
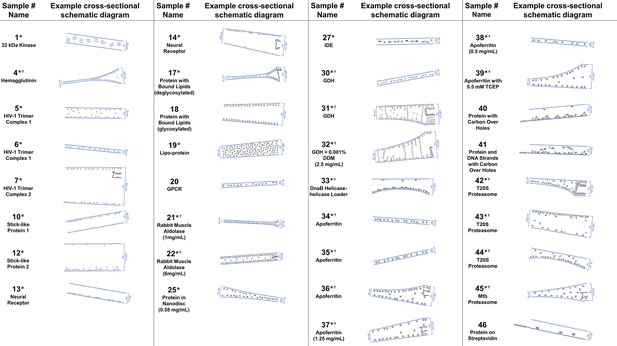
根据对单个断层图像的分析,选择孔中颗粒和冰行为的横截面示意图。
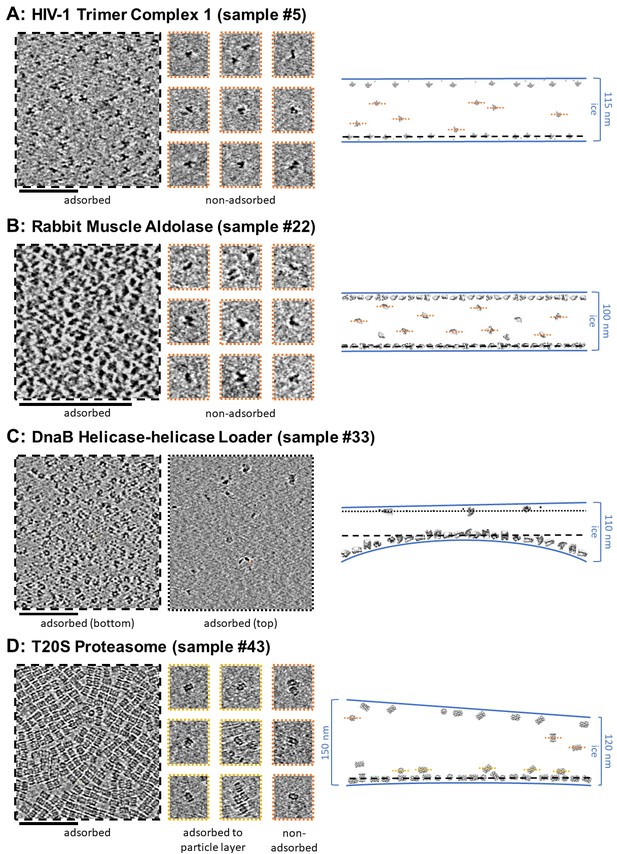
层析切片,约7纳米厚,显示了几个样品中吸附和非吸附颗粒的颗粒取向变化。
样本20。
绝大多数粒子局限于空气-水界面
颗粒吸附有时意味着优先定向

样品的气-水界面上的层析切片,约10 nm厚,显示清晰的蛋白质片段(示例用蓝色箭头表示)和/或部分颗粒(示例用绿色箭头表示),大致按照减少整体碎片的顺序呈现。
用cryoET观察变性蛋白质
样本34。
样品35。
样品36。
样品37。
样品38。
样品04。
样品05。
样品30。
样品42。
样品13。
蛋白质网络膜可能不利于颗粒
空气-水界面对称性和不对称性
样品12。
空穴中很大一部分区域在电子束方向上有重叠的粒子
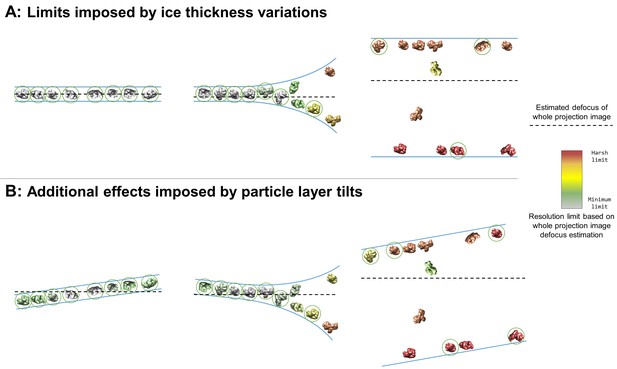
冰厚变化对收集和处理的限制( A类 )和颗粒层倾斜( B类 )考虑到传统低温电磁网格上孔中的绝大多数粒子都被吸附到空气-水界面上。
大多数空气-水界面相对于电子束是倾斜的
无基准低温ET可用于确定最佳单粒子收集区域和策略
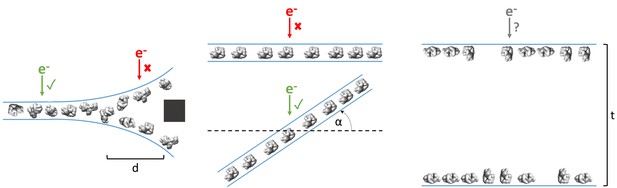
无基准低温ET可能揭示的典型单粒子和冰行为示例,以及此类特征如何影响单粒子收集策略。
无基准冷冻ET可用于了解关键蛋白质行为
样品6。
样品7。
样品17。
无信托SPT可以在无需额外准备的情况下生成从头开始的初始模型
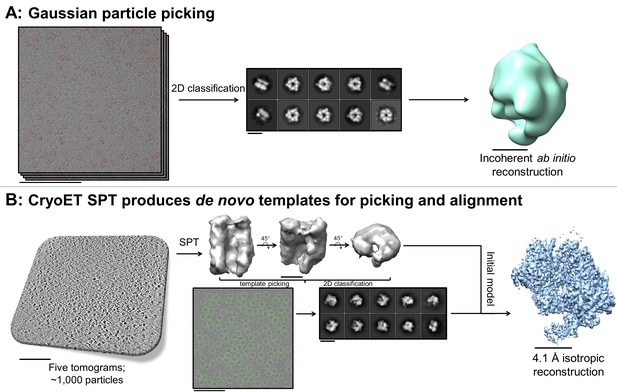
无教育标准贯入试验的从头开始初始模型。
样品33。
样品01。
样品10。
样品14。
样品19。
样本21。
样本22。
样本25。
样本27。
样本31。
样本32。
样本39。
样品43。
样本44。
样本45。
结论
材料和方法
网格准备
Tilt-series系列
倾斜系列对齐
CTF分辨率限制
估算和测量误差
数据存储和软件可用性
视频
数据可用性
-
碳纳米线网格上的Mtb 20S蛋白酶体被Spotiton插入 电子显微镜数据库公开提供(登录号:EMD-7154)。 -
谷氨酸脱氢酶单颗粒的CryoET 电子显微镜数据库公开提供(登录号EMPIAR-10132)。 -
谷氨酸脱氢酶的冷冻ET+0.001%DDM单颗粒 电子显微镜数据库公开提供(登录号EMPIAR-10134)。 -
DNAB螺旋装药器单粒子的CryoET 电子显微镜数据库公开提供(登录号EMPIAR-10135)。 -
0.5 mM TCEP单颗粒脱铁蛋白的低温ET 电子显微镜数据库公开提供(登录号EMPIAR-10141)。 -
Mtb 20S蛋白酶体单颗粒的CryoET 电子显微镜数据库公开提供(登录号EMPIAR-10145)。 -
用Spotiton将兔子肌肉醛缩酶放在金纳米线网格上 电子显微镜数据库公开提供(登录号:EMD-7138)。 -
碳纳米线网格上的兔肌肉醛缩酶被Spotiton插入 电子显微镜数据库(登录号:EMD-7139)公开提供。 -
Spotiton将纳米盘中的蛋白质放在金纳米线网格上 电子显微镜数据库(登录号EMD-7140)公开提供。 -
Spotiton使碳纳米线网格上的GDH+0.001%DDM骤降 电子显微镜数据库公开提供(登录号:EMD-7143)。 -
金Quantifoil网格上的DNAB解旋酶解旋酶装载器 电子显微镜数据库公开提供(登录号:EMD-7144)。 -
在多孔碳纳米线网格上用Spotiton插入载脂蛋白 电子显微镜数据库公开提供(登录号:EMD-7147)。 -
在多孔碳纳米线网格上用Spotiton插入载脂蛋白 电子显微镜数据库公开提供(登录号:EMD-7148)。 -
用Spotiton将载脂蛋白放在多孔金纳米线网格上 电子显微镜数据库公开提供(登录号:EMD-7149)。 -
载铁蛋白与0.5 mM TCEP在碳纳米线栅上用Spotiton插入 可在电子显微镜数据库公开获得(登录号EMD-7150)。
参考文献
-
蛋白质在界面上的吸附动力学:蛋白质构象在扩散吸附中的作用 生物化学与生物物理学报(BBA)——蛋白质结构和分子酶学 954 :253–264. https://doi.org/10.1016/0167-4838 (88)90080-5 -
SerialEM:使用样本位置预测在tecnai显微镜上自动获取倾斜序列的程序 显微镜学与微量分析 9 :1182–1183. https://doi.org/10.1017/S1431927603445911 -
蛋白质疏水蛋白和离子表面活性剂的竞争吸附:平行和顺序吸附及膨胀流变学 胶体和表面A:物理化学和工程方面 457 :307–317. https://doi.org/10.1016/j.colsurfa.2014.06.002 -
手套箱/试管机器人组合的开发:低温透射电镜显示的空气-水界面事件 超微显微镜 108 :1478–1483. https://doi.org/10.1016/j.ultramic.2008.03.014
文章和作者信息
作者详细信息
基金
西蒙斯基金会(SF349247)
克林顿·S·波特 布里吉特·卡拉格
纽约州科学、技术和创新基金会
克林顿·S·波特 布里奇特·卡拉格
国家普通医学科学研究所(GM103310)
克林顿·S·波特 布里吉特·卡拉格
阿古龙研究所(F00316)
克林顿·S·波特 布里吉特·卡拉格
美国国立卫生研究院(S10 OD019994-01)
克林顿·S·波特 布里吉特·卡拉格
国家少数民族健康与健康差异研究所(5G12MD007603-30)
大卫·杰鲁扎尔米
国家过敏和传染病研究所(疫苗研究中心的内部资助)
彼得·德光
科学、技术和研究机构
永子潭
美国国立卫生研究院(R01-MH1148175)
劳伦斯·夏皮罗
国立卫生研究院(R01 GM084162)
大卫·杰鲁扎尔米
致谢
版本历史记录
收到日期:2017年12月12日 接受日期:2018年5月17日 接受手稿出版日期: 2018年5月29日(第1版) 发布的记录版本: 2018年6月13日(第2版)
版权所有
韵律学
-
16,017 意见
-
2,241 下载
-
216 引用
下载链接
进一步阅读
-
生物化学和化学生物学 结构生物学和分子生物物理学
DNA回转酶是一种普遍存在的细菌酶,是由2个GyrA亚基和2个GryrB亚基异构化形成的IIA型拓扑异构酶,形成活性复合物。 DNA回转酶可以使DNA围绕GyrA的C末端结构域(CTD)循环,并使一个DNA双链通过另一个双链中建立的瞬时双链断裂(DSB)。 这导致从正(+1)到负(-1)超螺旋的转换,从而通过2步将负超螺旋引入细菌基因组,这是DNA复制和转录所必需的活动。 GyrA二聚体中的强蛋白界面必须被打破,以允许运输的DNA片段通过,通常认为界面通常是稳定的,只有在DNA运输时才会打开,以防止有害DSB进入基因组。 在本文中,我们证明DNA回转酶可以在两个活性异四聚体之间交换其DNA裂解界面。 这种所谓的接口“交换”(IS)可以在解决方案中的几分钟内发生。 我们还表明,回转酶对DNA的弯曲对切割是必需的,但对DNA结合本身并不是必需的,有利于is。DNA包裹和GyrB过量也有利于界面交换。 我们认为,两个异源四聚体之间的邻近性,通过GyrB齐聚以及DNA的结合和包裹,有利于快速界面交换。 这种交换不需要ATP,在氟喹诺酮类药物存在的情况下发生,并增加了仅通过回转酶活性进行非同源重组的可能性。 回转酶进行界面交换的能力解释了含有单个活性位点酪氨酸的回转酶异二聚体如何进行双链传代反应,因此为最近提出的DNA回转酶“旋转”机制提供了另一种解释(Gubaev等人,2016)。 -
生物化学和化学生物学 结构生物学和分子生物物理学
几十年来,维生素B6缺乏一直与人类大脑疾病的认知障碍有关。 尽管如此,将维生素B6与这些疾病联系起来的分子机制仍不清楚,补充维生素B6是否能改善认知也不清楚。 吡哆醛5'-磷酸磷酸酶(PDXP)是一种控制维生素B6的协同酶活性形式5'-磷酸盐吡哆醛(PLP)水平的酶,可能是维生素B6相关疾病的替代治疗切入点。 然而,目前还缺乏药物PDXP抑制剂来测试这一概念。 我们现在发现小鼠海马中PDXP和PLP水平的年龄依赖性下降,为PDXP抑制剂的开发提供了理论基础。 通过结合小分子筛选、蛋白质晶体学和生物层干涉法,我们发现、可视化并分析了7,8-二羟基黄酮(7,8-DHF)作为一种直接有效的PDXP抑制剂。 7,8-DHF以低微摩尔亲和力和亚微摩尔效力结合并可逆抑制PDXP。 在小鼠海马神经元中,7,8-DHF以PDXP-依赖性方式增加PLP。 这些发现证实了PDXP是一种可药用的靶点。 值得注意的是,7,8-DHF在脑疾病模型中是一种研究得很好的分子,尽管其作用机制仍存在争议。 我们发现7,8-DHF是PDXP抑制剂,这为围绕7,8-DHF在大脑中介导的效应的争议提供了新的机制性见解。






