使X射线自由电子激光晶体学能够从有限数量的晶体挑战生物系统
摘要
eLife摘要
介绍
结果
符号
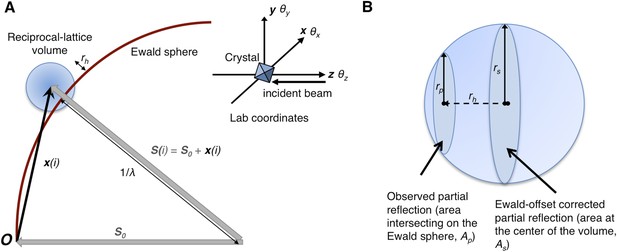
衍射实验的几何学和Ewald-偏移距离的计算, 第页 小时 .
重新定义后概述
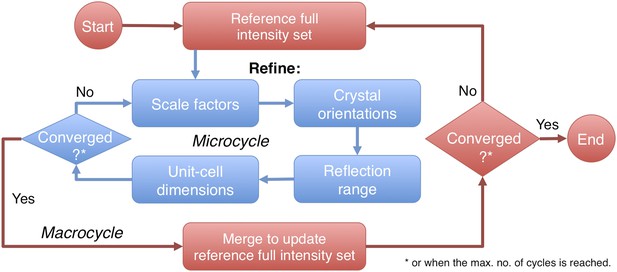
再定义后协议。
观测强度的准备
生成初始参考集和初始参数
数据处理方案的定义和比较
改进后数据的质量评估
-
* 这是使用索引的图像数 cctbx.xfel公司 程序,在嗜热菌蛋白酶的情况下,它是两个波长之一索引的图像数量。 -
† SASE:自放大自发发射。 -
‡ CSPAD:Cornell-SLAC像素阵列探测器。
-
一 括号中的值对应最高分辨率外壳。 -
b条 后细化参数显示为平均值,括号中有标准偏差。 -
c(c) 分子替换分数报告人 相位器 ( McCoy等人,2007年 ):对数似然增益(LLG)和平移函数(TFZ)。
-
一 括号中的值对应最高分辨率外壳。 -
b条 重定义后的参数显示为平均值,括号中为标准偏差。 -
c(c) 分子替换分数报告人 相位器 ( McCoy等人,2007年 ):对数似然增益(LLG)和平移函数(TFZ)。
-
一 括号中的值对应最高分辨率外壳。 -
b条 后细化参数显示为平均值,括号中有标准偏差。 -
c(c) 分子替换分数报告人 相位器 ( McCoy等人,2007年 ):对数似然增益(LLG)和平移函数(TFZ)。
肌红蛋白
后求精的收敛性
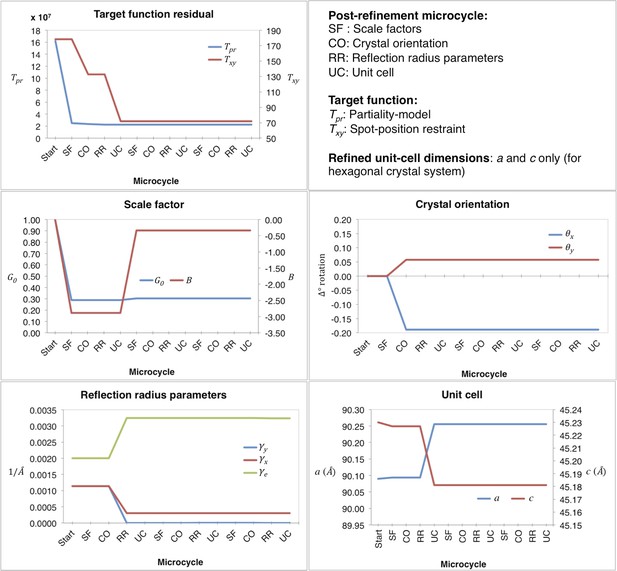
肌红蛋白后精制第一个大循环期间的后精制。
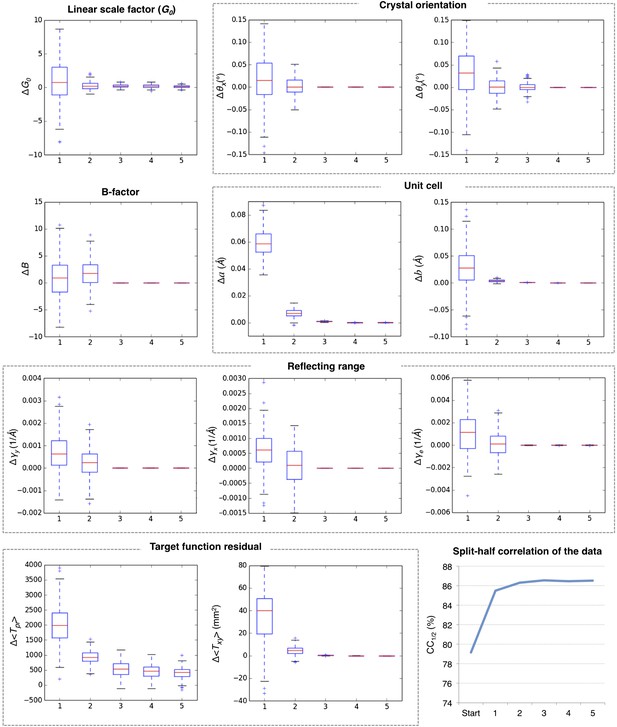
肌红蛋白五个大环后精制的收敛性。
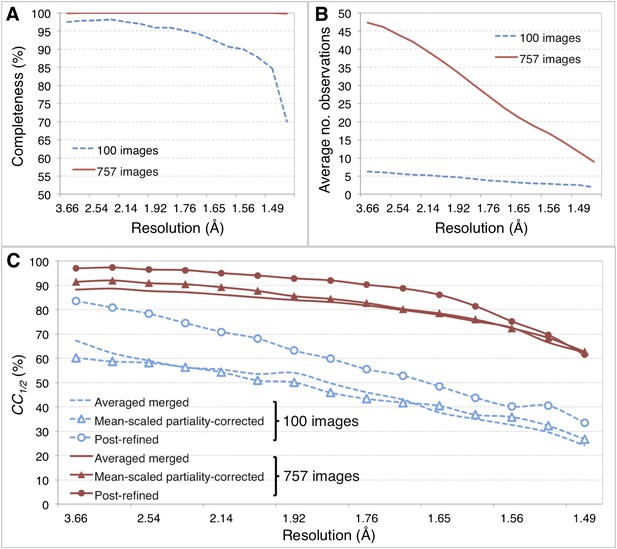
肌红蛋白的合并统计。
由于后期优化而带来的改进
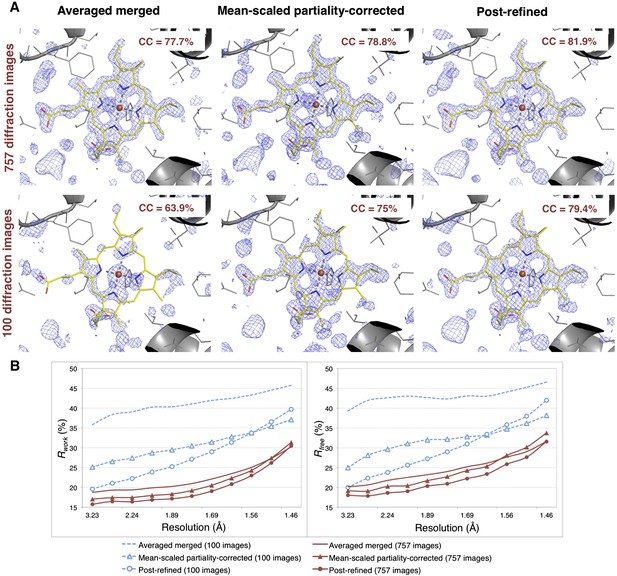
后细化和图像数量对肌红蛋白电子密度和模型质量的影响。
100个衍射图像足以细化肌红蛋白结构
与同步加速器数据集的比较
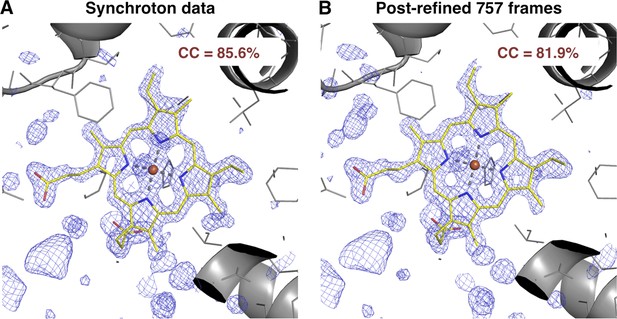
肌红蛋白同步加速器与后精炼XFEL衍射数据集的质量。
氢化酶
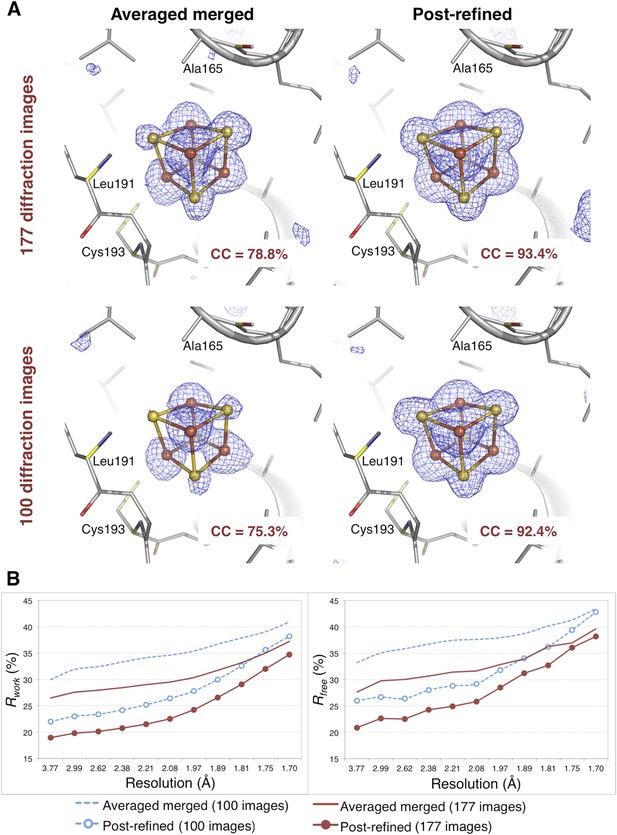
后精炼对氢化酶衍射数据集的影响。
嗜热菌蛋白酶
异常差异傅里叶峰高
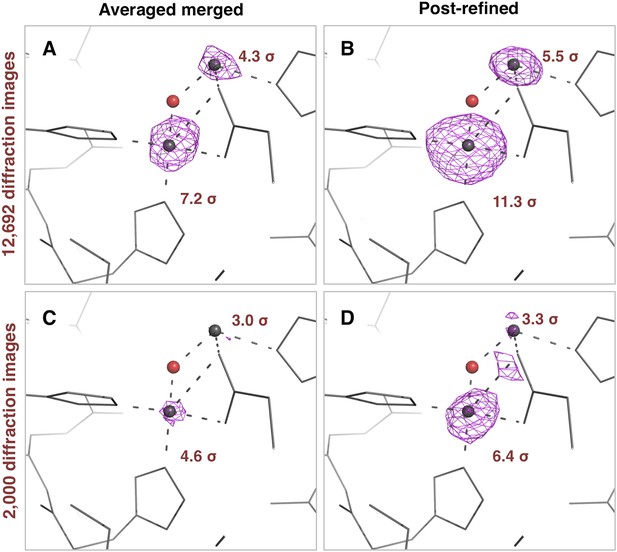
后细化对嗜热菌素衍射数据集中异常信号的影响。
差异图揭示了一个结合二肽
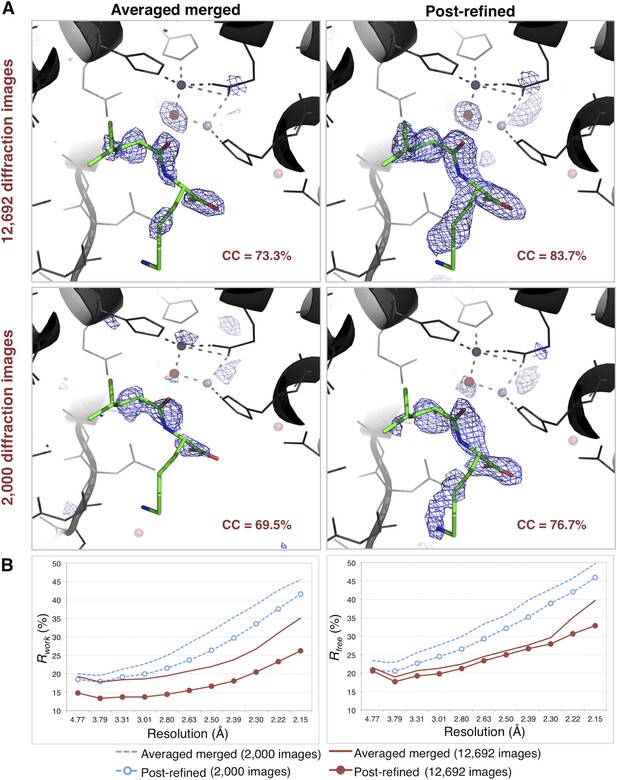
后精制对嗜热蛋白电子密度图和模型质量的影响。
完整性的影响
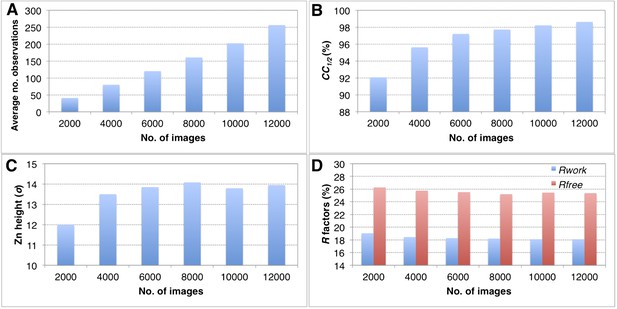
使用越来越多的衍射图像,以2.6º分辨率对后精制嗜热蛋白XFEL数据集进行结构细化的收敛性。
讨论
材料和方法
偏好模型
The distribution of
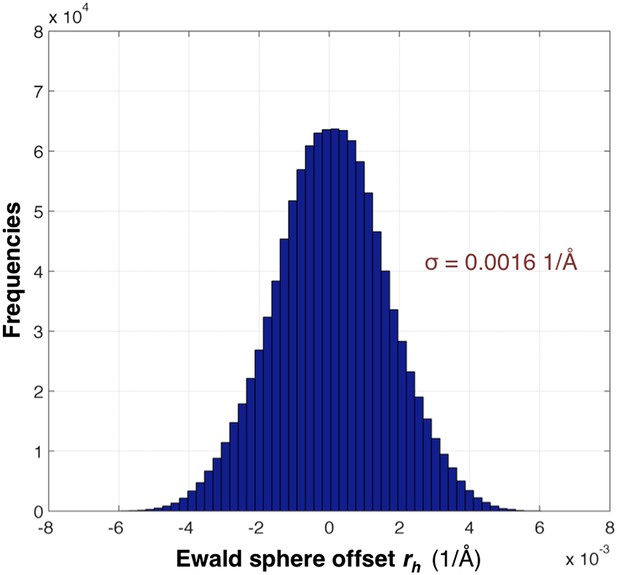
Ewald球体偏移的分布 第页 小时 .
计算倒格子点偏移
Ewald-偏移校正函数Eoc
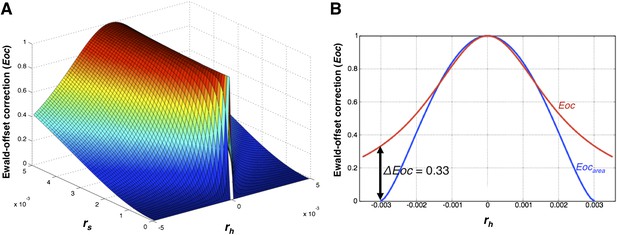
Ewald-偏移校正功能。
全强度校正
细化晶体取向、反射宽度和单位-细胞参数
反射选择标准
合并程序
衍射参数的偏导数
比例因子, G公司 0 和 B。
晶体旋转角度( θ x个 , θ 年 , θ z(z) ).
单位-细胞参数
反射半径, 第页 秒
极化校正
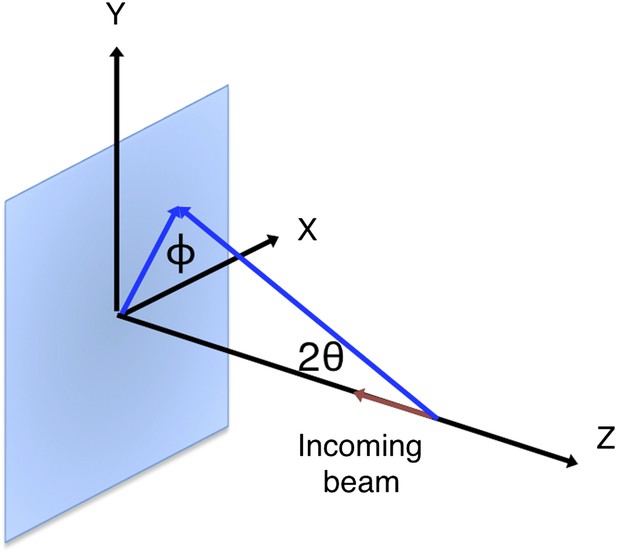
偏振校正用入射和衍射光束的几何形状。
分子替换和原子模型精化协议
计算机程序
在证明中添加注释
数据可用性
工具书类
-
大肠杆菌β-半乳糖苷酶晶体在室温/低温循环中的变化及其与低温退火的关系 结晶学报D辑,生物结晶学 63 :1139–1153. https://doi.org/10.107/S090744907045040
文章和作者信息
作者详细信息
基金
国家普通医学科学研究所(NIGMS)(GM103393)
威廉·魏斯
国家普通医学科学研究所(NIGMS)(GM095887)
亚伦·S·布鲁斯特 尼古拉斯·K·绍特
霍华德·休斯医学院(HHMI)(合作创新奖)
Axel T Brunger公司 威廉·魏斯
美国能源部(能源部)(DE-AC02-05CH11231)
亚伦·S·布鲁斯特 尼古拉斯·K·沙特
国家普通医学科学研究所(NIGMS)(GM102520)
亚伦·S·布鲁斯特 尼古拉斯·K·绍特
致谢
版本历史记录
收到日期:2014年10月31日 验收日期:2015年3月16日 已出版的接受手稿: 2015年3月17日(第1版) 发布的记录版本: 2015年4月15日(第2版)
版权
韵律学
-
3,960 意见
-
890 下载
-
101 引用
下载链接
进一步阅读
-
结构生物学和分子生物物理学
连接蛋白通过在并列细胞之间形成缝隙连接通道(GJCs)实现细胞间通讯。 连接蛋白26(Cx26)可由一氧化碳直接调节 2 这可能是通过K125的氨甲酰化作用介导的。 我们表明,将K125突变为谷氨酸,模拟氨甲酰化的负电荷,导致Cx26 GJCs组成性闭合。 通过低温电子显微镜,我们观察到K125E突变将构象平衡推向具有收缩孔入口的通道,类似于提高CO分压的效果 2 在以往的连接蛋白结构中,细胞质环是紊乱的,它在调节中起着重要作用,也是K125的位置。 通过进一步的冷冻电镜研究,我们捕获了Cx26的不同状态,并观察了细胞质环的密度。 这个环的位置、跨膜螺旋的构象和控制孔孔径的N末端螺旋的位置之间的相互作用提供了一种调节机制。 -
微生物学与传染病 结构生物学和分子生物物理学
肠杆菌科细菌与胃肠道出血和菌血症有关,是炎症性肠病患者败血症死亡的主要原因。 这些细菌易于进入血液的细菌行为和机制目前尚不清楚。 在此,我们报告非梅毒临床分离株 肠道沙门菌 血清型, 大肠杆菌 、和 柯氏柠檬酸杆菌 被迅速吸引到人类血清来源。 为了模拟胃肠道出血,我们使用了一种基于注射的微流体装置,发现人体血清的股骨体积足以诱导细菌对血清来源的吸引力。 这种反应是通过趋化性和趋化剂L-丝氨酸(一种血清中丰富的氨基酸,通过化学受体Tsr的直接结合识别)来协调的。 我们报告了第一个晶体结构 沙门氏菌 Tshimurium Tsr与L-丝氨酸的复合物,并鉴定Tsr同源物中共享的L-丝氨酸保守氨基酸识别基序。 我们发现Tsr在肠杆菌科和许多与血流感染相关的世界卫生组织优先病原体中广泛保守。 最后,我们发现肠杆菌科使用人类血清作为生长的营养来源,趋化性和化学受体Tsr为迁移到肠出血性病变中提供了竞争优势。 我们将这种细菌对血清的趋化行为、出血性病变的定植和血清营养素的消耗定义为“细菌吸血”,这可能与肠杆菌科的血流感染倾向有关。






