介绍
卵巢癌是女性生殖系统三大恶性肿瘤之一,在妇科恶性肿瘤中死亡率最高(Deb等人,2018年). 由于卵巢癌很难诊断,大多数卵巢癌患者都是在晚期被发现的,导致生存率下降(Grunewald和Ledermann,2017年). 目前,紫杉醇联合铂类化疗是卵巢癌患者的主要化疗方案。在化疗方案开始时,这些药物对80%以上的患者有效,但癌细胞对这些药物产生耐药性,导致癌症复发,从而使卵巢癌患者的五年生存率达到45%。此外,被诊断为晚期癌症患者的生存率低于30%(韦伯和约旦,2017年).
研究表明,对紫杉醇的耐药性涉及多种机制,包括多药耐药(MDR)蛋白的增加(Mihanfar等人,2019年)血管内皮生长因子表达的改变(秋山等人,2012年)、基质金属蛋白酶(胡等,2012;Kato等人,2012年)或微管相关蛋白(Ren等人,2016年). 多药耐药发生在许多人类癌症中,包括结肠癌、乳腺癌和肾癌(Amawi等人,2019年)并对化疗产生耐药性。ABC转运体如MDR1/P-gp的过度表达被认为是耐药的经典机制(Waghray和Zhang,2018年). P-gp由澳大利亚广播公司1P-gp启动子序列包含一个κB位点,可被核因子κB(NF-κB)识别和激活(Loaiza等人,2016年). 有报道称PI3K/Akt信号转导通路参与NF-κB介导的MDR(Solt和2008年5月). 据报道,伊维菌素和阿魏酸可以通过抑制EGFR/ERK/Akt/NF-κB通路,下调P-gp的表达,从而逆转耐药性(Muthusamy等人,2019年). 这表明使用合适的抑制剂抑制NF-κB介导的P-gp过度表达是逆转MDR的可行方法。
植物的天然产物是抗肿瘤药物的有效来源,其中一些已被证明可以调节MDR。许多类型的天然产物,如黄酮类化合物、生物碱和萜烯,已被证明能够抑制P-gp。木犀草醇是一种来源于植物根的异黄酮类化合物C.木马,具有多种药理作用,包括抗菌、抗真菌、抗疟和抗肿瘤活性(赵等,2013). 在本研究中,我们首次通过细胞增殖、罗丹明积累、荧光定量PCR、western blot和体内分析。我们研究了木薯醇对P-gp表达和功能的影响,并通过PI3K/Akt/NF-κB信号通路来调节P-gp蛋白,研究了木瓜醇的调节作用。目的是进一步开发木薯醇逆转卵巢癌耐药,并为木薯醇的潜在临床应用提供数据。
材料和方法
细胞系、抗体和试剂
A2780人卵巢癌细胞株和A2780/紫杉醇耐紫杉醇卵巢癌细胞系购自Keygen Biotech(中国江苏)。人类非小细胞肺癌细胞系A549和耐紫杉醇细胞系A549/Taxol由齐齐哈尔医学院杨教授捐赠。所有细胞均在37°C和5%Co的RPMI-1640细胞培养基(中国北京索拉比奥科技有限公司)中培养2培养基中添加10%灭活胎牛血清(美国纽约州吉布科市)和1%青霉素和链霉素。A2780/紫杉醇细胞在含有800 ng/mL紫杉醇的培养基中培养,然后在实验前2周切换到非药物培养基。抗P-gp(0.1μg/m;ab170904)、NF-κB/p65(1/2000,ab32536)、P-NF-κ)B/p65和VEGF(1/1000,ab239882)的抗体购自Abcam(英国剑桥);针对PI3K(1/1000,#4292)、Akt(1/1000,#9272)的抗体,第页-阿克特(1/1000,#9271),α-管蛋白(1/2000,#2144)、MMP-9(1/1000,#3852)、MRP1(1/1000、ab233383)、MRP2(1/2000、ab172630)、LRP(1/1000;#64099)、层粘连蛋白B(1/1000和#17416)和ß-肌动蛋白(1/1000,#4970)购自Cell Signaling Technology(美国马萨诸塞州CST)。
木豆醇由我们实验室提取,纯度大于98%。结构公式如所示图1A.木犀草醇的提取方法是指出版的提取方法,稍作修改(Liu等人,2011年). 具体而言,将压碎的鸽豌豆根用乙醇-水(80:20,V/V)溶液以1:10的固液比浸渍24 h,重复3次。使用旋转蒸发器浓缩滤液以获得粗提取物。粗提物用乙酸乙酯/蒸馏水(3/1,v/v)萃取,乙酸乙酯分离浓缩得到棕色产物。棕色产物用树脂柱分离,以水和乙醇为流动相,保留50%乙醇洗脱部分进行进一步纯化。使用硅胶柱,以氯仿-甲醇为流动相,从氯仿-乙醇(12:1,v/v)馏分中分离木犀草醇。结晶和再结晶后,得到白色晶体。木豆醇的HPLC和负离子模式质谱如所示补充图S1所有其他试剂均购自Sigma(美国密苏里州圣路易斯)。
甲基噻唑基二苯基四氮唑溴化物测定
待测电池(100µL;5×10三细胞/孔)接种在96-well板中并培养过夜。在二甲基亚砜(DMSO)中制备紫杉醇和木薯醇作为储备溶液,并稀释(1000、500、250、125、62.5、31.25、15.63、7.81、3.91、1.96和0.98μM)。用稀释溶液将种子细胞一式四份处理72小时。加入MTT,培养细胞4小时。然后去除培养基,并添加DMSO(150µL)。将盘子放在摇床中,以完全溶解紫色的formazan晶体。在570 nm处测量OD,并计算生长抑制率。所有实验重复三次。使用GraphPad Prism 7.0(美国加利福尼亚州拉霍亚市GraphPad-Software,Inc.)计算IC50值。折叠电阻(FR)通过除以IC计算50IC在耐药癌细胞中获得(含或不含逆转化合物)50非耐药的亲代癌细胞(侯赛因等人,2017年).
定量RT-PCR
制备含有2、4或8µM木薯醇的培养基,并与A2780/紫杉醇细胞孵育,以确定木薯醇对澳大利亚广播公司1,基质金属蛋白酶-9,血管内皮生长因子,管α1a和试管β3mRNA表达。共孵育48小时后,使用RNA提取试剂盒(Takara Bio Inc.,中国大连)分离总RNA,并使用逆转录试剂盒(Tokara)进行总RNA逆转录。使用Primer Premier 5.0设计实时定量PCR引物(补充表S1),和SYBR®Premix Ex Taq™II试剂盒(Takara)用于RT-qPCR分析。β-肌动蛋白被选为内参照基因;反应条件已经过描述(Huang等人,2017年). 相对基因表达由2计算-ΔΔCt方法。
罗丹明积累
对数单元格(4×105/mL密度)接种在12孔板中。添加阳性对照维拉帕米(8µM)和适当浓度的卡加诺,并在37°C下培养细胞2 h。然后,添加最终浓度为(1μg/mL)的罗丹明-123,并在37°C、5%CO下培养细胞2持续1小时。反应完成后,在4°C离心后丢弃上清液,用预冷PBS缓冲液(4°C)清洗细胞两次,终止罗丹明流出。然后将细胞重新悬浮在冷PBS中,并通过流式细胞术(Beckman Coulter,Fullerton,CA,美国)测定细胞内药物荧光,激发波长为466 nm,发射波长为535 nm。结果通过Expo32ADC软件(Beckman Coulter)进行分析。
西部印记
为了确定木豆醇是否通过PI3K/Akt信号通路影响P-gp的表达,我们测量了P-gp、t-Akt、,第页-A2780/紫杉醇细胞中的Akt、NF-κB/p65和p-NF-κ的B/p65。在提取总细胞蛋白之前,用木薯醇(2、4或8μM)处理A2780/紫杉醇细胞48小时。选择Western and IP细胞裂解缓冲液(P0013,Beyotime Biotechnology,Shanghai,China)作为全细胞蛋白提取裂解液。核蛋白分离方法严格按照说明书执行。具体来说,用细胞刮板刮去细胞,离心后收集细胞颗粒。每20µl细胞颗粒添加200µl补充有PMSF的细胞质蛋白提取试剂A。涡流5秒,以完全悬浮和分散细胞颗粒。冰浴10分钟后,添加10µl细胞质蛋白提取试剂B和涡流5秒。将样品冰浴1分钟后,再次旋涡5秒,然后将其置于12000 g的4°C离心机中5分钟。立即将上清液吸入预冷却的塑料管中,这是提取的细胞质蛋白。用SDS-PAGE分离等量的蛋白质并转移到聚偏氟乙烯膜上。阻断后,用相关的一级抗体探测膜结合蛋白。清洗膜,然后与二级抗体孵育;最后用增强化学发光试剂检测抗体结合蛋白。
在体内实验
从Vital River Experimental Animal Co.,Ltd.(中国北京)购买6周龄健康雌性纯BABL/c裸鼠(体重18–20 g)。将小鼠置于恒温层流箱中,并以12小时/12小时的光/暗循环保存在特定的无致病性环境中。根据1986年动物伦理准则(科学程序)法案修订条例(SI 2012/3039),齐齐哈尔第一医院动物护理福利委员会批准了动物实验和肿瘤细胞的使用;批准文号:QAEC20190043。
A2780/紫杉醇细胞在含有10%胎牛血清的RPMI-1640培养基中培养。收集对数生长期细胞,制备1×10活细胞浓度的悬浮液5/毫升。活细胞占总人口的95%以上。将细胞悬浮液皮下接种在每只裸鼠背部附近的右腋下(约105单元格)。接种1周后,将16只成功成瘤小鼠随机分为四组,确保足够数量进行统计分析:生理盐水组、紫杉醇组(0.5 mM/kg)、木犀草醇组(2 mM/kg。肿瘤植入成功后第1、8和15天通过尾静脉给药。每隔3天观察一次小鼠的体重和状况以及移植瘤的生长情况,共观察24天。肿瘤体积计算公式如下:V=(长×宽2)/2. 当肿瘤直径大于2cm或溃疡面积大于4mm时,通过吸入2.5%异氟醚蒸汽诱导昏迷后,通过颈部脱位对小鼠实施安乐死。24天后对剩余的小鼠实施安乐死。采集肿瘤组织进行免疫组织化学、荧光定量PCR和蛋白质印迹分析。
免疫组织化学染色
在石蜡包埋切片上进行免疫组织化学。详细的染色程序已在前面描述过(Xu等人,2017年).
统计分析
使用GraphPad Prism 7.0(加利福尼亚州拉霍亚GraphPad-Software)进行统计分析。各组间进行单因素方差分析。对于方差分析,根据不同的解释变量将观察到的方差分为多个分量*第页<0.05被认为是显著的。
结果
Cajanol能够逆转A2780/Taxol和A549/Taxol细胞对紫杉醇的耐药性。
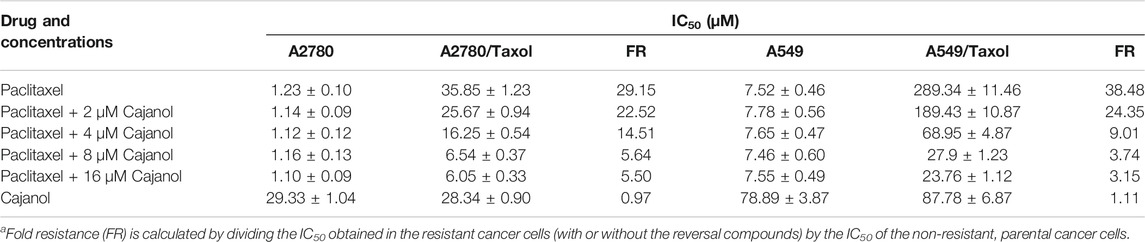
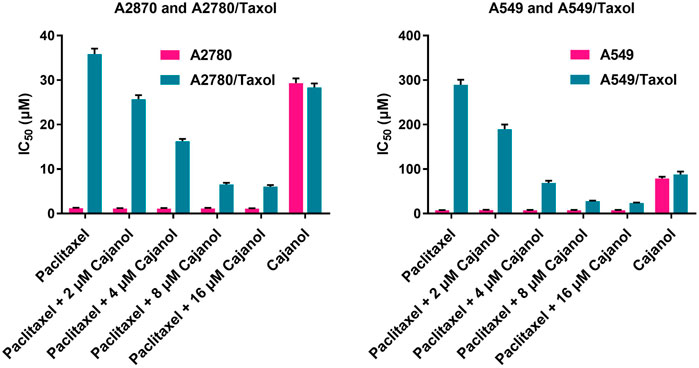
紫杉醇MTT IC50A2780和A2780/紫杉醇细胞处理72 h后的值分别为1.23±0.10µM和35.85±1.23µM(表1和图2). IC50紫杉醇与2、4、8或16μM木薯醇联合治疗的A2780/Taxol细胞的值分别为25.67±0.94µM、16.25±0.54µM、6.54±0.37µM和6.05±0.33µM。当木薯醇浓度为0µM、2µM,4µM和8µM或16μM时,A2780/Taxol细胞对A2780细胞的折叠阻力分别为29.15、22.52、14.51、5.64和5.50。对于A549/Taxol细胞,木犀草醇也表现出良好的耐药性逆转作用。IC50紫杉醇对A549细胞和A549/Taxol细胞的作用分别为7.52±0.46µM和289.34±11.46µM。用2µM、4µM,8µM或16μM木薯醇处理后,IC50紫杉醇对A549细胞的作用几乎没有改变,但IC50A549/Taxol细胞分别降至189.43±10.87μM、68.95±4.87μM、27.9±1.23μM和23.76±1.12μM。相应的折叠阻力也从38.48降至3.15。结果表明,木犀草醇与紫杉醇联合治疗显著抑制A2780/紫杉醇细胞,且IC50当木豆醇浓度为8µM时,该值降低了4倍以上。这些结果表明,木犀草醇可以有效逆转A2780/紫杉醇细胞对紫杉醇的耐药性,并且这种作用在高达8µM的浓度下具有浓度依赖性。
木豆醇通过抑制P-gp蛋白的表达恢复紫杉醇对A2780/紫杉醇细胞的敏感性
为了研究木薯醇恢复A2780/紫杉醇细胞对紫杉醇敏感性的机制,在不同浓度的木薯醇(2、4或8μM)处理后,测定A2780/Taxol细胞中耐药相关基因的表达。cajanol处理后ABCB1基因的表达呈浓度依赖性显著下调(图1B). 当cajanol浓度达到8μM时,ABCB1基因的表达约为对照组的10%。VEGF、MMP-9、Tubα1a和Tubβ3的表达水平没有变化。进一步,用western blots检测了木豆醇处理后A2780/紫杉醇细胞中P-gp、VEGF、MMP-9、α-管蛋白和βIII-管蛋白的蛋白表达,结果与荧光定量PCR结果一致(图1C、D). VEGF、MMP-9、α-管蛋白和βIII-管蛋白的表达水平没有显著变化,而P-gp的表达水平显著降低。这些结果表明,木豆醇可以通过抑制A2780/紫杉醇细胞中的MDR蛋白来逆转紫杉醇敏感性。
为了进一步确定木豆醇是否对其他MDR蛋白具有相同的抑制作用,我们测定了木豆醇处理的A2780/紫杉醇细胞中MRP1、MRP2和LRP蛋白的表达。Western blot结果显示,MRP1、MRP2和LRP的表达水平没有显著变化(图1C、D). 这些结果都表明cajanol特异性降低ABCB1和P-gp的表达。
木豆醇抑制A2780/紫杉醇细胞P-gp蛋白的转运
流式细胞术用于评估木豆醇对P-gp蛋白转运的影响。罗丹明-123通过P-gp转运,并可通过其黄绿色荧光发射进行检测。通过监测罗丹明-123在细胞中的积累,我们评估了不同浓度的木薯醇处理的A2780/紫杉醇细胞中P-gp蛋白的转运能力(图3). 对照细胞A2780(24.5%)的细胞内荧光强度显著高于未处理的A2780/紫杉醇细胞(3.7%)。经2、4或8μM木豆醇处理后,A2780/紫杉醇细胞的荧光强度分别增加到14.8%、18.5%和21.3%。P-gp抑制剂维拉帕米在8μM时也将A2780/紫杉醇细胞的荧光强度增加到23.8%。这一结果进一步证实了木薯醇通过抑制P-gp的表达,从而减少紫杉醇的外排,从而逆转耐药性的效用。
卡亚诺调节MDR通过A2780/紫杉醇细胞中的Akt/NF-κB/P-gp信号通路
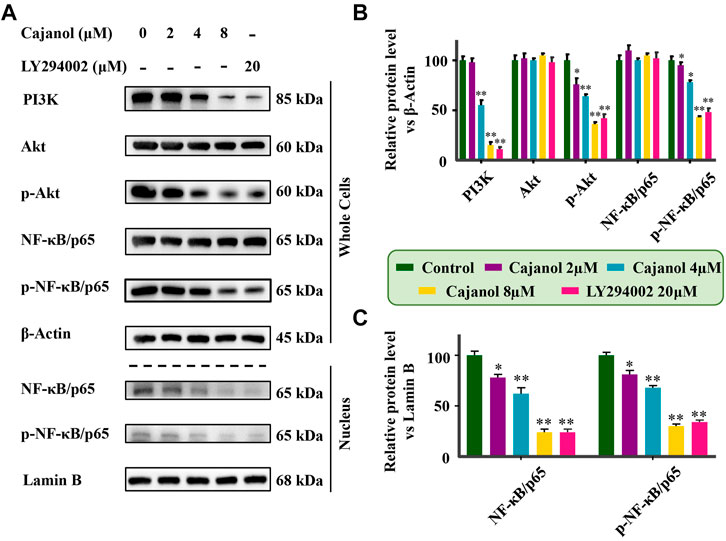
上述结果表明澳大利亚广播公司1木豆醇可抑制A2780/Taxol细胞中的P-gp,表明木豆醇可以抑制P-gp的转录和/或翻译。由于Akt和NF-κB信号转导与P-gp表达高度相关,因此推测木犀草醇可能通过Akt/NF-κB/P-gp信号通路调节P-gp。western blot检测PI3K、Akt和磷酸化Akt在A2780/紫杉醇细胞中的表达。值得注意的是,卡亚诺降低了PI3k和第页-Akt在A2780/紫杉醇细胞中的表达,但对Akt本身的表达没有显著影响(图4A、B). 此外,我们检测了木犀草醇对细胞和细胞核中NF-κB/p65和磷酸化NF-κ)B/p65表达的影响。与Akt和P-Akt类似,在用木薯醇处理的2780/Taxol细胞中观察到P-NF-κB/p65下调。随着木豆醇浓度的增加,细胞核内NF-κB/p65和p-NF-κ)B/p65的表达水平下调。为了验证抑制PI3K/Akt/NF-κB通路对P-gp蛋白表达的影响,使用PI3K抑制剂LY294002治疗A2780/紫杉醇细胞。LY294002治疗对Akt的表达有影响,第页-Akt8、NF-κB/p65、p-NF-κ的B/p65和p-gp与暴露于8μM卡亚诺后发现的类似。这些结果充分证明了木豆醇能够抑制A2780/紫杉醇细胞中PI3K和Akt的磷酸化,从而阻止NF-κB/p65的磷酸化和核移位,最终抑制P-gp的转录和翻译。
木犀草醇恢复小鼠对紫杉醇耐药转移瘤的敏感性
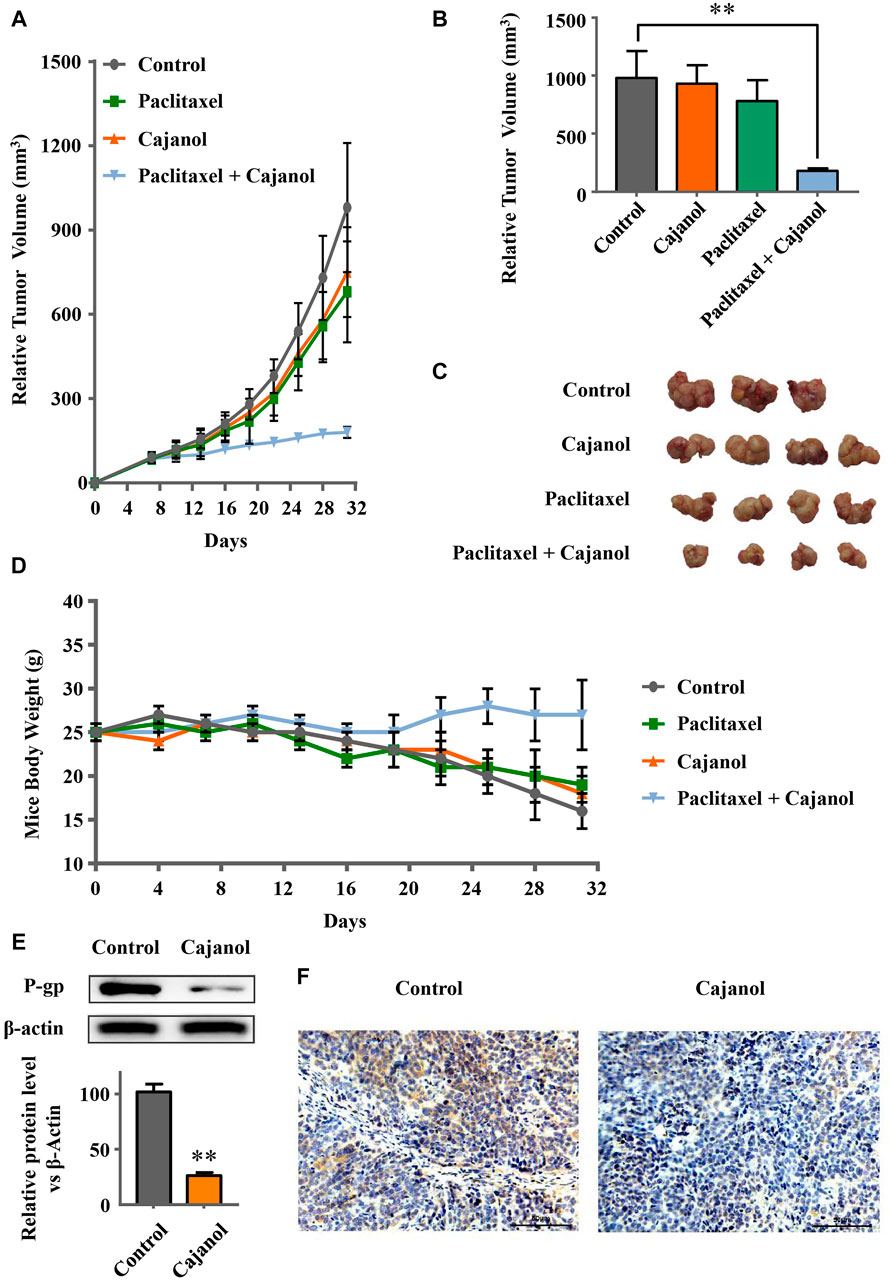
为了验证cajanol是否能恢复小鼠对紫杉醇的敏感性,我们使用A2780/Taxol细胞建立了BABL/c裸鼠肿瘤模型,分为以下四组:对照组、cajanol、紫杉醇和cajanol+紫杉醇,每组由4只成功建模的裸鼠组成。治疗24天后,联合组小鼠的肿瘤体积明显小于其他三组小鼠(图5A-C); 木瓜醇+紫杉醇组的最终肿瘤体积为182.4±20.4mm三而紫杉醇、卡雅诺和对照组的肿瘤体积为758±154 mm三680±176毫米三分别为981±215。治疗后,只有联合治疗组的小鼠能够保持约25克的体重,而其他三组的小鼠体重低于20克(图5D). 这些结果表明,木犀草醇(2 mM/kg)与紫杉醇(0.5 mM/kg体内对紫杉醇耐药肿瘤有显著抑制作用。
我们还测量了澳大利亚广播公司1mRNA和P-gp蛋白在肿瘤组织中的表达。Western blots显示木豆醇抑制肿瘤组织中P-gp的表达,与结果类似在体外(图5E). 免疫组织化学结果证实,木瓜醇治疗组P-gp的表达受到明显抑制(图5F).
讨论
对于晚期卵巢癌患者,以紫杉醇为基础的化疗目前是主要的治疗方法。然而,耐药性通常会出现,导致治疗失败和肿瘤复发。因此,需要更多研究和开发能够逆转这种耐药性的新治疗药物。
研究发现,90%以上的癌症相关死亡是由MDR引起的,MDR的主要原因是肿瘤中ABC转运蛋白的过度表达(高盛,2003年). 其中,多药耐药基因澳大利亚广播公司1被认为是引起紫杉醇耐药性的最重要机制之一。的过度表达澳大利亚广播公司1导致膜P-gp过度表达,从而降低细胞内紫杉醇的浓度,降低紫杉醇对肿瘤细胞的抑制作用(Schondorf等人,2002年;卢基亚诺娃,2010年;沈等,2016). 微管结构的改变是紫杉醇耐药的另一个原因;α-微管蛋白和ß-III-管蛋白会破坏微管的内部稳定性,降低紫杉醇的疗效(李杰等,2009;小林等,2011年). 此外,基质金属蛋白酶(MMP-9)通过增加血管内皮生长因子(VEGFA)及其受体(VEGFR)的表达促进肿瘤血管生成(Bergers等人,2000年). VEGF的异常表达可能与紫杉醇耐药有关。肿瘤组织通过上调P-gp释放VEGF(Li L.等人,2009年;秋山等人,2012年). 在这项工作中,我们发现木犀草醇可以抑制澳大利亚广播公司1基因和P-gp蛋白,但对血管内皮生长因子,基质金属蛋白酶-9α-微管蛋白或βIII-微管蛋白。结合流式细胞术的结果,我们证实木犀草醇可以通过调节P-gp蛋白的表达来减少紫杉醇从A2780/紫杉醇细胞的流出。除P-gp外,一些肿瘤细胞的MDR是由MDR-相关蛋白(MRP)引起的(科尔等人,1992年;Sodani等人,2012年)或肺阻力相关蛋白(LRP)(De Figueiredo-Pontes等人,2008年). 结果表明,这三种蛋白在A2780/紫杉醇细胞中的表达水平较低,在木豆醇处理后没有明显变化。
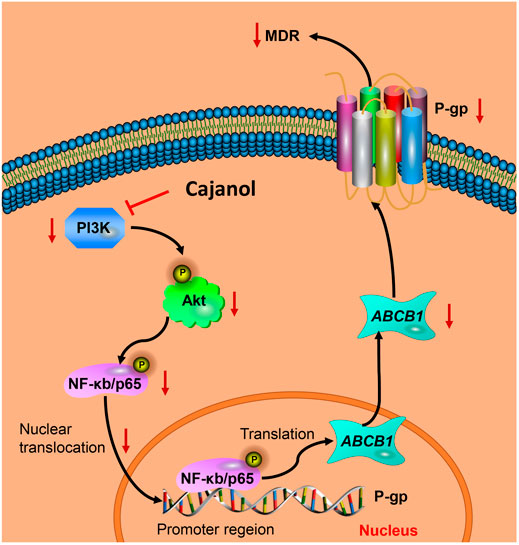
研究表明,PI3K/Akt信号通路与MDR密切相关,PI3K/Akt通路激活NF-κB系统,可能导致MDR1转录增加(Xi等人,2016年). 当PI3K/Akt途径被激活时,Akt蛋白被磷酸化,导致下游IκB-α的磷酸化及其与NF-κB的分离。在NF-κB核转位并与其识别位点结合后,MDR1基因的启动子被激活,基因表达被诱导(郭等,2016;Wu等人,2016年). 阻断PI3K/Akt通路可导致MDR1/P-gp蛋白表达下调,从而逆转MDR。本研究结果表明,cajanol可抑制PI3K的表达和Akt的磷酸化,从而抑制IκB的磷酸化。它还可以阻止NF-κB从细胞质转移到细胞核。因此,木犀草醇可以通过PI3K/Akt/NF-κB途径抑制P-gp的表达(图6).
过去30年来,研究人员一直在开发和合成P-gp抑制剂来逆转MDR。维拉帕米、硝苯地平、奎尼丁和环孢素A是已开发为第一代抑制剂的P-gp底物,但它们具有不可接受的副作用。第二代抑制剂,包括右维拉帕米和PSC833,在第一代药物的基础上进行了改进,以降低毒性(Boesch等人,1991年;Martin等人,1999年). 这些抑制剂是细胞色素P450的底物,它们干扰化疗药物的药代动力学。目前还没有合成抑制剂被批准用于临床,这促使研究人员从天然产物中探索新的逆转剂。据报道,阿魏酸可以通过NF-κB下调P-gp的表达(Muthusamy等人,2019年). 在本研究中,8μM木薯醇显著恢复A2780/紫杉醇细胞对紫杉醇的敏感性,2 mM/kg木薯醇和0.5 mM/kg紫杉醇显著抑制小鼠转移性肿瘤的生长。本研究结果将为开发有效的卵巢癌多药耐药抑制剂提供新思路。
结论
在本研究中,木豆醇通过抑制PI3K表达和Akt磷酸化来抑制NF-κB的磷酸化和核异位,从而降低P-gp蛋白的转录和翻译,最终降低紫杉醇外排诱导的MDR。本报告可能有助于进一步探讨木豆醇在卵巢癌治疗中的临床应用。
数据可用性声明
本文中包含了研究中提出的原始贡献/补充材料,可向相应作者进行进一步查询。
道德声明
动物研究由齐齐哈尔第一医院动物护理福利委员会根据1986年动物伦理准则(科学程序)法案修订条例(SI 2012/3039)批准;批准文号:QAEC20190043。
作者贡献
PL和JJ设计了研究。MS、HY、MG和WL分析数据。MS和ZG进行了研究。MS撰写了这篇论文。
利益冲突
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或金融关系的情况下进行的。
出版商笔记
本文中表达的所有声明仅为作者的声明,不一定代表其附属组织的声明,也不一定代表出版商、编辑和审稿人的声明。任何可能在本文中进行评估的产品,或制造商可能提出的索赔,都不受出版商的保证或认可。
补充材料
本文的补充材料可以在以下网站上找到:https://www.frontiersin.org/articles/10.3389/fphar.2021.783317/full#补充-材料
工具书类
Akiyama,K.、Ohga,N.、Hida,Y.、Kawamoto,T.、Sadamoto,Y.和Ishikawa,S.等人(2012年)。肿瘤内皮细胞通过MDR1上调获得耐药性通过肿瘤微环境中的VEGF信号传导。美国病理学杂志。180, 1283–1293. doi:10.1016/j.ajpath.2011.11.029
CrossRef全文|谷歌学者
Amawi,H.、Sim,H.M.、Tiwari,A.K.、Ambudkar,S.V.和Shukla,S.(2019年)。ABC转运蛋白介导的多药耐药肿瘤。高级实验医学生物。1141, 549–580. doi:10.1007/978-981-13-7647-4_12
PubMed摘要|CrossRef全文|谷歌学者
Bergers,G.、Brekken,R.、Mcmahon,G.,Vu,T.H.、Itoh,T.、Tamaki,K.等人(2000年)。基质金属蛋白酶-9在致癌过程中触发血管生成开关。自然细胞生物2, 737–744. doi:10.1038/35036374
PubMed摘要|CrossRef全文|谷歌学者
Boesch,D.、Muller,K.、Pourtier-Manzanedo,A.和Loor,F.(1991年)。通过非免疫抑制性环孢素衍生物SDZ PSC 833的亚微摩尔浓度恢复柔红霉素在多药耐药P388细胞中的保留。Exp.Cel Res公司196, 26–32. doi:10.1016/0014-4827(91)90452-z
PubMed摘要|CrossRef全文|谷歌学者
科尔,S.P.、巴德瓦吉,G.、杰拉赫,J.H.、麦基,J.E.、格兰特,C.E.、阿尔姆奎斯特,K.C.等人(1992年)。转运蛋白基因在耐多药人类肺癌细胞系中的过度表达。科学类258, 1650–1654. 数字对象标识代码:10.1126/science.1360704
PubMed摘要|CrossRef全文|谷歌学者
De Figueiredo-Pontes,L.L.、Pintáo,M.C.、Oliveira,L.C.、Dalmazo,L.F.、Jácomo,R.H.、Garcia,A.B.等人(2008年)。急性髓系白血病白血病干细胞中P-糖蛋白、MDR-相关蛋白1、乳腺癌耐药蛋白和肺耐药蛋白表达的测定。细胞计量学B临床。细胞74, 163–168. doi:10.1002/cyto.b200403
PubMed摘要|CrossRef全文|谷歌学者
Deb,B.、Uddin,A.和Chakraborty,S.(2018年)。miRNAs与卵巢癌:综述。《细胞生理学杂志》233, 3846–3854. doi:10.1002/jcp.26095
CrossRef全文|谷歌学者
Goldman,B.(2003)。多药耐药性:新药能帮助化疗取得抗癌疗效吗?J.国家。癌症研究所。95, 255–257. doi:10.1093/jnci/95.4.255
CrossRef全文|谷歌学者
Grunewald,T.和Ledermann,J.A.(2017年)。卵巢癌的靶向治疗。最佳实践。临床研究。障碍物。吉纳科尔。41, 139–152. doi:10.1016/j.bpobgyn.2016.12.001
PubMed摘要|CrossRef全文|谷歌学者
郭毅、丁毅、张毅和安浩(2016)。西那平通过下调FGFR4/FRS2α-Erk1/2途径介导的NF-κb活化逆转MCF-7/dox癌细胞的多药耐药性。植物医学23, 267–273. doi:10.1016/j.phymed.2015年12月17日
PubMed摘要|CrossRef全文|谷歌学者
Hu,X.,Li,D.,Zhang,W.,Zhou,J.,Tang,B.,and Li,L.(2012)。基质金属蛋白酶-9的表达与预后相关,并与卵巢癌细胞侵袭有关。架构(architecture)。妇科。障碍物。286, 1537–1543. doi:10.1007/s00404-012-2456-6
PubMed摘要|CrossRef全文|谷歌学者
Huang,C.Z.,Wang,Y.F.,Zhang,Y.,Peng,Y.M.,Liu,Y.X.,Ma,F.等人(2017)。盐酸头孢烷胺通过I-抑制PI3K/Akt S-信号通路逆转H-人卵巢癌A2780/紫杉醇C-细胞P-糖蛋白介导的M-多药耐药。昂科尔。代表。38, 2558–2564. doi:10.3892或2017.5879
PubMed摘要|CrossRef全文|谷歌学者
Hussein,N.、Amawi,H.、Karthikeyan,C.、Hall,F.S.、Mittal,R.、Trivedi,P.等人(2017年)。多巴胺D3受体拮抗剂PG01037、NGB2904、SB277011A和U99194逆转癌细胞株中ABCG2转运蛋白介导的耐药性。癌症快报。396, 167–180. doi:10.1016/j.canlet.2017.03.015
PubMed摘要|CrossRef全文|谷歌学者
Kato,T.、Fujita,Y.、Nakane,K.、Kojima,T.和Nozawa,Y.,Deguchi,T.等人(2012年)。ETS1通过上调MDR1和MMP9的表达促进耐Paclitaxel、激素无反应PC3前列腺癌细胞的化疗耐受和侵袭。生物化学。生物物理学。Res.社区。417, 966–971. doi:10.1016/j.bbrc.2011.12.047
PubMed摘要|CrossRef全文|谷歌学者
Kobayashi,Y.、Seino,K.、Hosonuma,S.、Ohara,T.、Itamochi,H.、Isonishi,S.等人(2011年)。尽管对顺铂有耐药性,但对Paclitaxel耐药的卵巢癌细胞株中的副作用人群增加。妇科。肿瘤。121, 390–394. doi:10.1016/j.ygyno.2010.12.366
PubMed摘要|CrossRef全文|谷歌学者
Li,J.、Liu,P.、Mao,H.、Wanga,A.和Zhang,X.(2009年A)。大黄素对Paclitaxel诱导的卵巢癌细胞凋亡的敏感性体外.昂科尔。代表。21, 1605–1610. doi:10.3892/or_00000394
PubMed摘要|CrossRef全文|谷歌学者
Li,L.、Jiang,A.C.、Dong,P.、Wang,H.、Xu,W.和Xu,C.(2009b)。MDR1/P-gp和VEGF协同增强紫杉醇诱导的Hep-2细胞多药耐药侵袭。安·外科学·Oncol。16, 1421–1428. doi:10.1245/s10434-009-0395-7
PubMed摘要|CrossRef全文|谷歌学者
Liu,X.L.,Zhang,X.J.,Fu,Y.J.、Zu,Y.G.、Wu,N.、Liang,L.等(2011)。木豆醇抑制大肠杆菌和金黄色葡萄球菌通过作用于膜和DNA损伤。Planta Med.公司。77, 158–163. doi:10.1055/s-0030-1250146
PubMed摘要|CrossRef全文|谷歌学者
Loaiza,B.、Hernández-Guterrez,S.、Montesinos,J.J.、Valverde,M.和Rojas,E.(2016)。核转录因子Kappa B下调通过P-糖蛋白调节降低骨髓源性细胞的化疗耐受性。架构(architecture)。医学研究。47, 78–88. doi:10.1016/j.arcmed.2016.05.004
PubMed摘要|CrossRef全文|谷歌学者
纽约卢基亚诺娃(2010)。同型半胱氨酸诱导人MCF-7乳腺癌细胞和人A2780卵巢癌细胞的多药耐药特征。实验肿瘤。32, 10–14.
PubMed摘要|谷歌学者
Martin,C.、Berridge,G.、Mistry,P.、Higgins,C.,Charlton,P.和Callaghan,R.(1999)。高亲和力逆转剂XR9576与P-糖蛋白的分子相互作用。英国药理学杂志。128, 403–411. doi:10.1038/sj.bjp.0702807
CrossRef全文|谷歌学者
Mihanfar,A.、Aghazadeh Attari,J.、Mohebbi,I.、Majidinia,M.、Kaviani,M.和Yousefi,M.等人(2019年)。卵巢癌干细胞:克服多药耐药性的潜在治疗靶点。J.Cel生理学234, 3238–3253. doi:10.1002/jcp.26768
CrossRef全文|谷歌学者
Muthusamy,G.、Gunaseelan,S.和Prasad,N.R.(2019年)。阿魏酸逆转P-糖蛋白介导的多药耐药性通过抑制PI3K/Akt/NF-κb信号通路。《营养学杂志》。生物化学。63, 62–71. doi:10.1016/j.jnutbio.2018.09.022
CrossRef全文|谷歌学者
Ren,F.、Shen,J.、Shi,H.、Hornicek,F.J.、Kan,Q.和Duan,Z.(2016)。卵巢癌治疗中克服多药耐药的新机制和方法。生物化学。生物物理学。学报1866, 266–275. doi:10.1016/j.bbcan.2016.1001
PubMed摘要|CrossRef全文|谷歌学者
Schöndorf,T.、Kurbacher,C.M.、Göhring,U.J.、Benz,C.、Becker,M.、Sartorius,J.等人(2002年)。抗肿瘤药物诱导卵巢癌细胞株MDR1-Gene表达。抗癌研究。22, 2199–2203.
PubMed摘要|谷歌学者
Shen,Y.、Zhang,X.Y.、Chen,X.、Ren,M.L.和Cai,Y.L.(2016)。奥曲肽逆转A2780/紫杉醇卵巢癌细胞株对紫杉醇化疗的耐药性体外.癌症研究与治疗杂志。12, 657–662. 数字对象标识代码:10.4103/0973-1482.151861
CrossRef全文|谷歌学者
Sodani,K.、Patel,A.、Kathawala,R.J.和Chen,Z.S.(2012年)。多药耐药中的多药耐药相关蛋白。下巴。J.癌症31, 58–72. doi:10.5732/cjc.011.10329
CrossRef全文|谷歌学者
Solt,L.A.和May,M.J.(2008)。IkapaB激酶复合物:NF-kappaB信号传导的主调节器。免疫学。物件。42, 3–18. doi:10.1007/s12026-008-8025-1
PubMed摘要|CrossRef全文|谷歌学者
Waghray,D.和Zhang,Q.(2018年)。在癌症治疗中抑制或规避多药耐药性P-糖蛋白。医学化学杂志。61, 5108–5121. doi:10.1021/acs.jmedchem.7b01457
PubMed摘要|CrossRef全文|谷歌学者
Webb,P.M.和Jordan,S.J.(2017年)。卵巢上皮癌流行病学。最佳实践。临床研究。障碍物。吉纳科尔。41, 3–14. doi:10.1016/j.bpobgyn.2016.08.006
PubMed摘要|CrossRef全文|谷歌学者
Wu,W.,Yang,J.L.,Wang,Y.L.,王,H.,Yao,M.,Wang.L.等(2016)。二甲双胍通过抑制NF-κb基因转录逆转肝癌细胞的多药耐药性。世界肝病杂志。8, 985–993. doi:10.4254/wjh.v8.i23.985
CrossRef全文|谷歌学者
Xi,G.,Hayes,E.,Lewis,R.,Ichi,S.,Mania-Farnell,B.,Shim,K.等人(2016)。CD133和DNA-PK通过PI3K-或Akt-NF-κb途径调节多药耐药胶质母细胞瘤细胞中的MDR1体外.癌基因35, 241–250. doi:10.1038/onc.2016.64
PubMed摘要|CrossRef全文|谷歌学者
Xu,J.、Liu,D.、Niu,H.、Zhu,G.、Xu,Y.、Ye,D.等人(2017)。白藜芦醇通过调节胃癌中PTEN/Akt信号通路抑制上皮-间充质转化(EMT)逆转阿霉素耐药。《实验临床杂志》。癌症研究。36, 19. doi:10.1186/s13046-016-0487-8
CrossRef全文|谷歌学者
Zhao,J.、Li,C.、Wang,W.、Zhao、C.、Luo,M.、Mu,F.等(2013)。低crea Lixii,新型内生真菌产生抗癌剂Cajanol,从鸽子豌豆(Cajanus Cajan[L.]Millsp.)中分离。J.应用。微生物。115, 102–113. doi:10.1111/jam.12195
PubMed摘要|CrossRef全文|谷歌学者