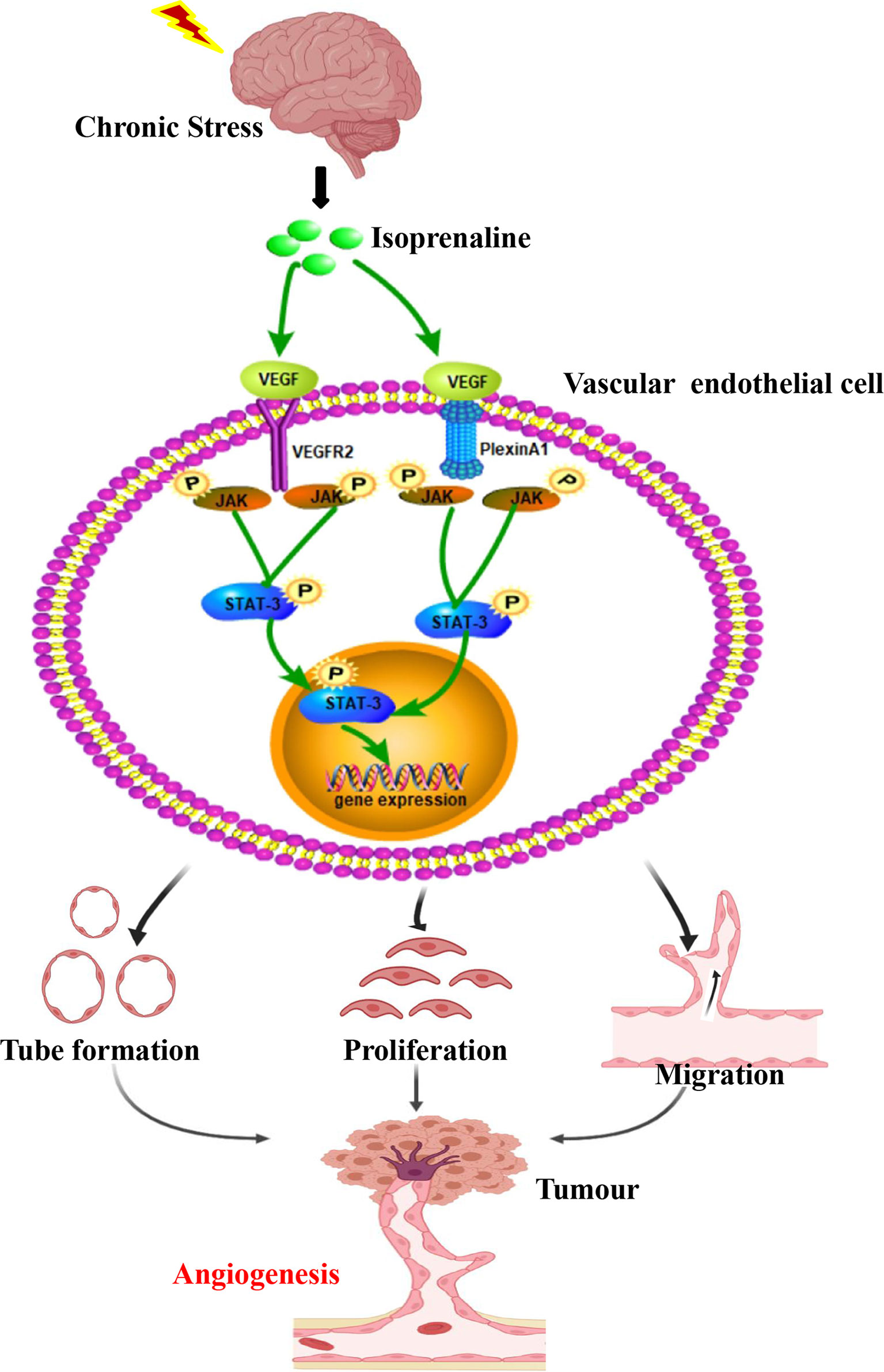
介绍
大多数临床肿瘤患者在被诊断为恶性肿瘤后,会产生休克、否认、焦虑和恐惧等多种心理压力。此外,手术和放化疗过程中引起的疼痛、恶心、呕吐、感染等副作用也会加剧患者的失望、愤怒和抑郁心理问题(1,2). 最近的证据表明,慢性应激通过促进肿瘤细胞生长、增加迁移或侵袭相关基因的表达,成为促进多种肿瘤类型进展的危险因素(三)促进血管生成(4). 一些研究表明,儿茶酚胺可以激活β2-肾上腺素能受体(β2-AR),从而调节肿瘤细胞和肿瘤微环境(5,6). 然而,对于肿瘤中应激诱导血管生成的确切机制,人们知之甚少。本研究主要探讨β2-AR激动剂异丙肾上腺素参与肿瘤血管生成的确切机制。
肿瘤血管生成与预后不良密切相关。通常,血管生成表明形成了新的血管,这在肿瘤的发展或转移中发挥了重要作用(7). 这些新血管不仅提供营养基础,而且为肿瘤细胞的远距离扩散提供条件。肿瘤血管生成涉及多个步骤,包括肿瘤细胞与血管内皮细胞(VEC)的联系通过某些生长因子连同相应的受体,以及促血管生成信号转导途径的激活。事实上,最近出现了针对VEGF和特定受体的血管生成治疗方法(8). 不幸的是,这些药物的疗效并不理想,尤其是对于晚期癌症患者;需要进一步研究以确定抗血管生成药物的作用(9).
过去的一项III研究将VEGF受体2(VEGFR2)作为晚期胃癌二线治疗的靶点(10,11). 然而,正如随机临床试验所表明的那样,这种治疗不能完全转化为优于标准治疗的生存率(12). 因此,必须探讨VEGFR2靶向治疗失败的责任人。
PlexinA1作为一种跨膜蛋白,不仅能与配体Sema3A、Sema3C、Sema 6D结合,而且能独立发挥生物学作用(13). 最近,已确定丛蛋白A1在肿瘤生物学中发挥重要作用,如血管生成或细胞存活(14). 有趣的是,在心脏形态发生过程中,丛蛋白A1和VEGFR2被Sema6D触发后可以产生复合物(15). 我们之前的研究检测了胃癌内的微血管密度,并报道了丛蛋白A1与血管生成的正相关(16). 丛蛋白A1和VEGFR2在胃癌VEC内共定位(17). 因此,我们还研究了丛蛋白A1和VEGFR2在慢性应激介导的肿瘤血管生成中的关系。这项工作强调了VEGFR2和丛蛋白A1水平及其在应激诱导的肿瘤血管生成中的功能相关性。
材料和方法
癌症患者和血液样本
335例恶性肿瘤患者由承德医科大学第一附属医院提供。有效问卷332份(99.1%),无效问卷3份(0.9%)。纳入标准包括:(1)患者经病理诊断为癌症;(2) 18-80岁;(3) 患者未服用抗抑郁药;(4) 患者没有任何妨碍理解研究或知情同意的情况。排除标准包括:(1)患有严重精神疾病和认知功能障碍的患者;(2) 拒绝参与研究且无法与研究人员正常沟通的患者;(3) 预期寿命小于3个月;(4) 听力和语言障碍患者。215名不同类型癌症患者的自我评定焦虑和自我评定抑郁结果可在表S1在征得上述332名患者同意的情况下,采集了215份血液样本。
Zung自评焦虑量表和Zung自评抑郁量表
采用Zung自评焦虑量表(ZSAS)评估焦虑程度,而ZSDS用于评估抑郁程度。然后将SAS和SDS指数得分分别分为2个水平:无显著精神病理学(SAS指数<50和SDS指数<53);存在不同程度的焦虑(SAS指数≥50)或抑郁(SDS指数≥53)。Zung评分不一定能给出焦虑或抑郁的临床诊断,相反,它表明了具有临床意义的症状的严重程度。
细胞培养和转染
人脐静脉内皮细胞(HUVECs)和人胃癌细胞株MGC803由中国军事医学科学院提供。所有这些细胞均在含有10%FBS的RPMI-1640培养基中培养。hCMEC/D3购自SCIENCE CELL Research Laboratories。hCMEC/D3细胞在内皮细胞培养基(ECM,类别号1001)中培养。用β2-AR激动剂、异丙肾上腺素(ISO)和β2-AR阻滞剂ICI 118551盐酸盐(ICI,Sigma-Aldrich,St.Louis,MO,USA)治疗HUVEC和hCMEC/D3。
携带shRNA序列的脂质体shRNA载体购自Gene Pharma(中国上海),序列为表1HUVEC被shplexinA1和shNC(阴性对照)转染Polyplus转染(法国斯特拉斯堡)。
细胞增殖试验
HUVEC以1×10的密度播种4细胞/孔置于96 well平底板中,并用不同浓度的ISO和ICI处理。孵育0、6、12、24和48小时后,使用CCK8细胞增殖检测试剂盒(中国北京索拉比奥科技有限公司)按照制造商规范测量HUVEC增殖,并使用微孔板阅读器在450 nm处测量吸光度。
定量RT-PCR
使用RNeasy Mini Kit(Invitrogen)提取总RNA。然后,收集提取的2µg总RNA,使用M-MLV逆转录系统试剂盒(美国威斯康星州麦迪逊市普罗米加)制备cDNA。所有PCR引物序列可在表1SYBR Green qPCR检测系统(美国威斯康星州麦迪逊市普罗米加)按照特定方案用于qRT-PCR。结果分析采用比较阈值循环方法,GAPDH作为内部参考。与此同时,2-ΔΔCt采用公式测定mRNA表达的折叠变化(FC)。
Western Blot分析
冷RIPA缓冲液(Thermo Scientific,Rockford,IL,USA)用于细胞裂解。使用Minute(TM)细胞质和细胞核分馏试剂盒(SC003)提取核蛋白。此后,我们使用BCA蛋白质检测试剂盒(中国北京索拉比奥科技有限公司)定量蛋白质含量。通过SDS-PAGE分离蛋白质后,将其转移到PVDF膜上。然后,使用主要单克隆抗体,包括小鼠抗VEGFR2、兔抗丛蛋白A1和小鼠抗gapdh(全部为Abcam,Cambridge,MA,UK)、兔抗组蛋白H3、兔抗JAK、兔抗STAT3、兔抗p-JAK和兔抗p-STAT3(全部为ABclonal有限公司,中国武汉),对每个膜进行过夜培养以及小鼠抗β-肌动蛋白抗体(Cell Signaling Technology,Danvers,MA,USA)。随后,进一步使用HRP标记的二级抗体(美国加利福尼亚州圣克鲁斯)培养细胞膜2小时。此外,使用增强化学发光(ECL)底物(美国伊利诺伊州罗克福德市皮尔斯)检测蛋白质印迹,而使用图像分析软件进行可视化。
ELISA检测
采集癌症患者的血液样本,在4°C下3000×g离心15分钟。根据特定方案,使用相应的人类ELISA试剂盒(Mlbio生物技术公司,中国上海)检测人血清儿茶酚胺和肾上腺素以及HUVEC细胞外VEGF水平。简而言之,使用微孔板阅读器测量450 nm的吸光度。
内皮细胞Transwell测定
在本实验中,使用CORING Transwell chambers NO:3422(英国马萨诸塞州图克斯伯里)对HUVEC迁移进行量化。200μl HUVEC(2×105细胞/ml)在上层用无血清培养基接种,底层的化学引诱剂是含有10%FBS的RPMI-1640。在37°C下培养24小时后,我们用棉签去除上层表面的细胞,而穿膜者进行固定和结晶紫染色。我们选择了5个视场(FOV)来计算透膜细胞数。
内皮细胞管形成试验
高浓度的Matrigel基底膜基质由BD Biosciences(英国马萨诸塞州贝德福德)提供。将50μl细胞外基质凝胶添加到预先冷却的96周板的每个孔中,在37°C中培养至少30分钟。HUVEC悬架(2×104细胞/ml)接种到固化凝胶上12h。使用倒置显微镜检查内皮管结构,同时使用Image-Pro Plus软件量化管面积。
在体内致瘤性试验
BALB/c裸鼠(雄性,6周龄,16–20 g)由Charles River Laboratories(中国北京)提供,并在单独通风的笼子系统中饲养。200μl MGC803胃癌细胞(1×106细胞/ml),然后在小鼠背部皮下注射悬浮液。小鼠腹腔注射5mg/kg/天ISO或0.2 mg/kg/天ICI。给对照组注射等量的生理盐水。4周后处死小鼠。
激光多普勒血流灌注治疗小鼠皮下肿瘤
用2%异氟烷以1 L/min的速度溶解于100%氧气中,麻醉皮下肿瘤发生小鼠,直至其对外界刺激无反应。然后将小鼠放在37°C的加热表面上,持续流动异氟醚,以确保血液灌注不会受到温度变化的显著影响。将每只老鼠放在无反射的吸光板上,处于俯卧位置。然后,启动了激光多普勒成像仪和采集软件。
统计分析
所有分析均一式三份。结果以平均值±标准差的方式表示。学生t检验和单向方差分析用于统计分析数据。P<0.05的差异表明具有统计学意义,如所有数字中的星号所示。
结果
根据ZSAS和ZSDS,焦虑和抑郁症状的患病率
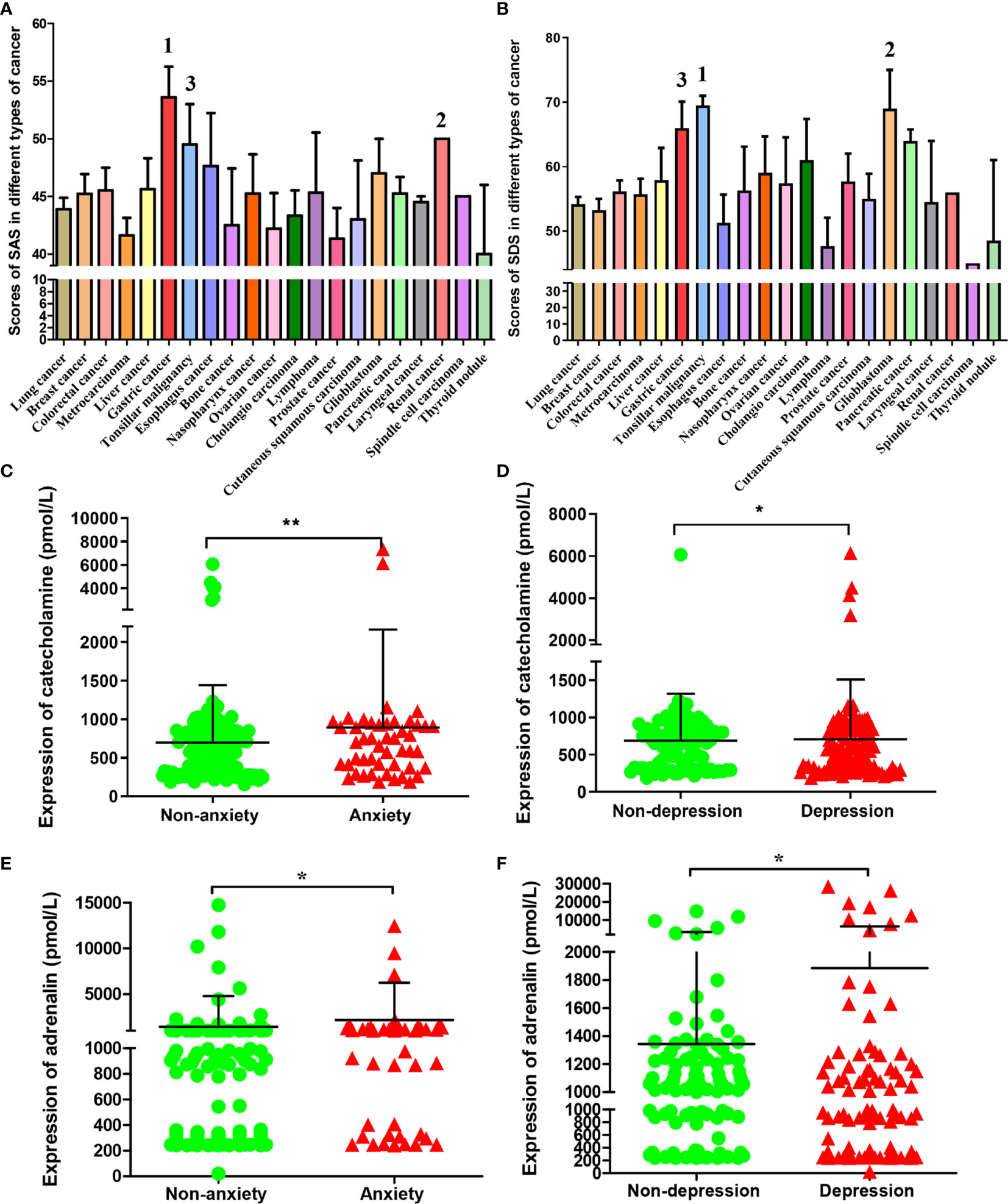
共有332名患者(99.1%)完成了问卷调查。其中,24.7%的癌症患者被描述为焦虑,57.5%的癌症患者根据这些标准表现为抑郁。当合并为焦虑-抑郁复合因素时,患病率为18.7%。在总样本量中,有205名患者(61.7%)有焦虑或抑郁的负面情绪。215名肿瘤患者的临床病理诊断和自我评价得分如下表S1根据不同肿瘤类型对这些患者的SAS和SDS指数进行统计分析。我们发现平均SAS指数排名前三的肿瘤是胃癌、肾癌和扁桃体恶性肿瘤(图1A)平均SDS指数排名前三的肿瘤是扁桃体恶性肿瘤、胶质母细胞瘤和胃癌。(图1B)结果表明,胃癌患者的焦虑和抑郁指数在我们检测的所有癌症中排名前三。
癌症患者的焦虑和抑郁促进血液中儿茶酚胺和肾上腺素的水平
根据ZSAS和ZSDS的指标得分,将这些癌症患者分为非焦虑、焦虑和非抑郁、抑郁组。测定外周血中慢性应激相关激素水平。因此,焦虑和抑郁患者的儿茶酚胺含量显著升高。(图1C、D)同样,研究发现焦虑和抑郁患者的肾上腺素显著增加。(图1E、F)
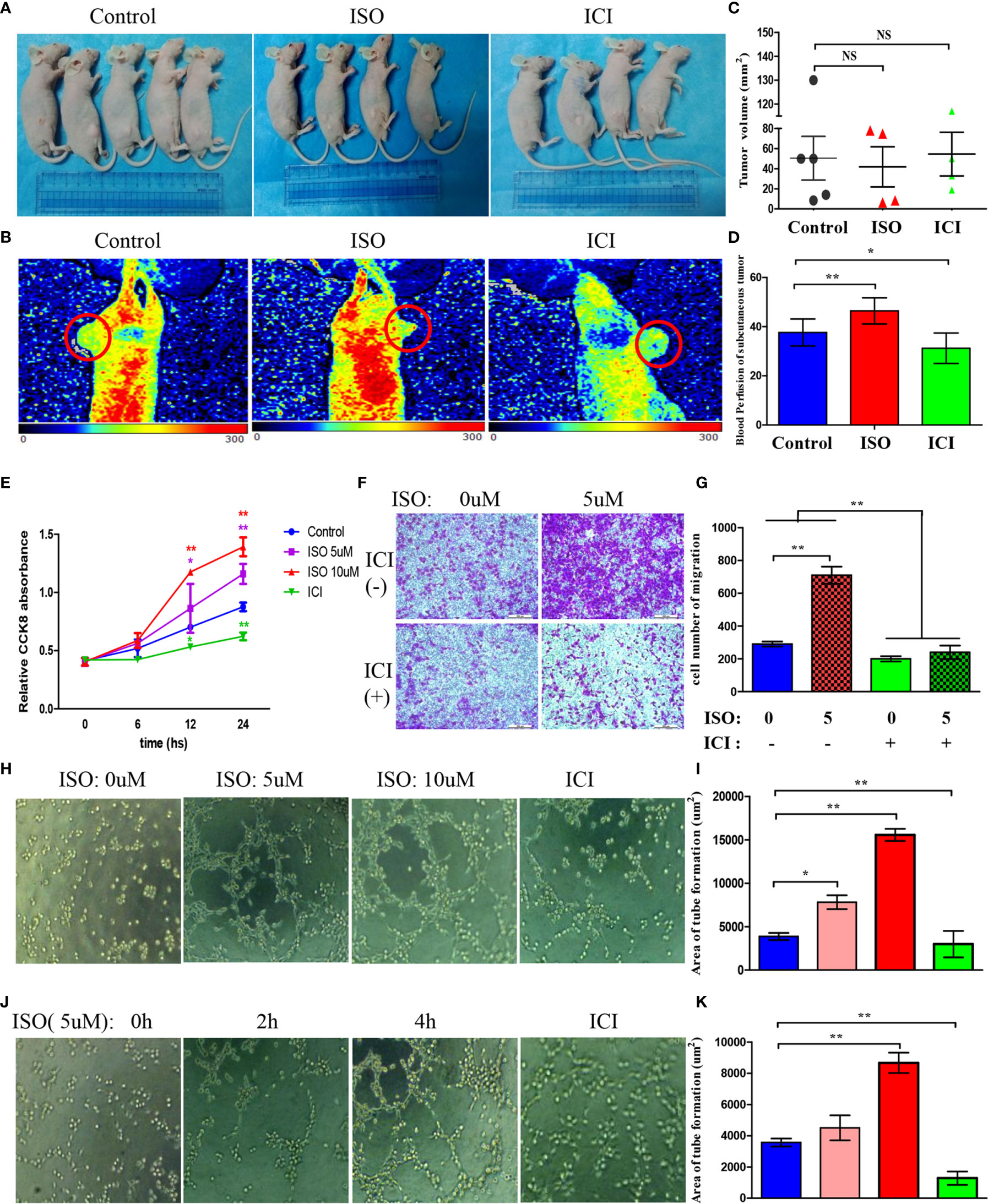
异丙肾上腺素促进肿瘤内血液灌注值
检查慢性压力是否影响体内肿瘤形成后,将MGC803细胞接种于小鼠皮下。(图2A)然而,ISO组和ICI组异种移植体积无显著差异。(图2C)这一发现与Caroline P.Le1之前的研究一致,该研究表明慢性应激对原发性肿瘤的生长没有影响(三). 为了评估压力如何影响肿瘤中的血管生成,我们使用激光多普勒血液灌注来量化血液灌注水平(图2B). 然后通过软件评估记录的ROI灌注值数据,血液灌注值的平均值显示为图2D总之,这些发现表明异丙肾上腺素通过影响肿瘤内血液灌注值而对血管生成起作用。
异丙肾上腺素促进HUVEC的增殖、迁移和成管
血管生成需要血管内皮细胞的增殖、迁移和管的形成。因此,我们用5、10μM ISO或10μM ICI处理HUVEC 6、12、24小时。异丙肾上腺素显著增强HUVEC的增殖能力。相反,与ICI孵育降低了增殖能力。(图2E)Transwell分析表明,5μM异丙肾上腺素处理促进了HUVEC的迁移,而ICI抑制了HUVeC的迁移。(图2F、G)使用浓度和时间不断增加的异丙肾上腺素培养HUVEC,此外,还有另一个ICI培养组。如这些发现所示,异丙肾上腺素促进HUVECs管的形成取决于其浓度(图2H)和治疗时间(图2J)而ICI孵育逆转了这种增加。HUVEC管状结构的面积统计如所示图2I–K总之,这些发现表明异丙肾上腺素通过影响血管内皮细胞的增殖、迁移和HUVEC的管状形成而对血管生成起作用,ICI可以逆转这种作用。
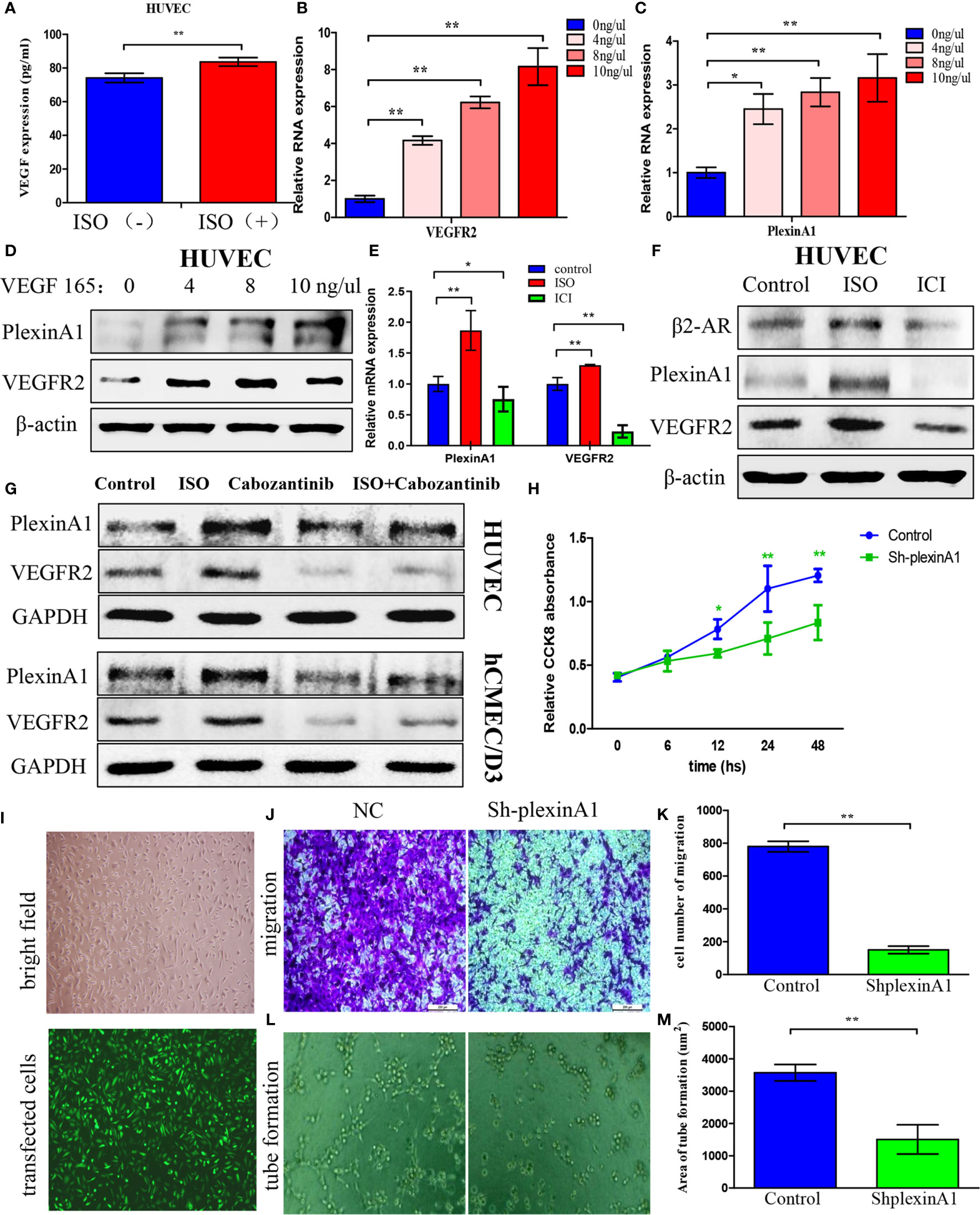
异丙肾上腺素促进HUVEC的VEGF自分泌,从而诱导丛蛋白A1和VEGFR2的表达
为了进一步检测应激对肿瘤血管生成的作用机制,我们评估了与ISO孵育后HUVECs中VEGF的表达。ISO处理后,HUVEC显示VEGF含量显著增加(图3A). 这表明压力可以促进血管内皮细胞的VEGF自分泌。然后我们使用人重组VEGF165培养HUVEC,以检测下游分子的变化。暴露于VEGF165增加了VEGFR2(图3B)和树脂A1(图3C)HUVEC中的mRNA水平取决于其浓度。此外,VEGF165处理增加了VEGFR2和丛蛋白A1的蛋白质水平。(图3D)
这些发现表明,ISO治疗显著促进了VEGF自分泌,VEGF进一步增加了VEGFR2和丛蛋白A1的表达。为了进一步证实这一过程,我们分别使用ISO和ICI,β2-AR的激动剂和特异性阻断剂来培养HUVEC。通过western blotting分析获得β2-AR的表达。(图3F)此外,我们的研究结果表明,ISO刺激上调了VEGFR2和丛蛋白A1,而ICI处理降低了mRNA(图3E)和蛋白质(图3F)VEGFR2和丛蛋白A1的表达。本研究选择了血管内皮生长因子受体2(VEGFR2)的选择性抑制剂卡波金汀尼(Cabozantinib)来阐明血管内皮生长激素受体2和丛蛋白A1在ISO促进血管生成中的作用。研究表明,卡波坦丁尼的IC50几乎>400 nM(18). 因此,我们选择40 nM卡波坦丁尼作为HUVEC和hCMEC/D3的研究浓度。我们的结果表明,阻断VEGFR2、ISO通过丛A1作用于血管内皮细胞。(图3G)总之,我们的观察结果表明ISO/β2-AR-VEGF-VEGFR2/plexinA1信号传导在介导肿瘤血管生成中起调节作用。
为了进一步验证丛A1的功能,我们在HUVEC中引入了shplexinA1干扰序列或控制shNC。根据GFP阳性细胞的百分比,转染效率约为76%。(图3I)然后,采用CCK8和穿孔法结合试管形成法,通过干扰丛蛋白A1的表达来评估丛蛋白A1对HUVEC的影响。我们发现shplexinA1可以显著降低细胞的增殖能力(图3H),迁移(图3J、K)和管道形成(图3L、M)在HUVEC中。总之,我们的发现表明丛蛋白A1在肿瘤血管生成中不可或缺。
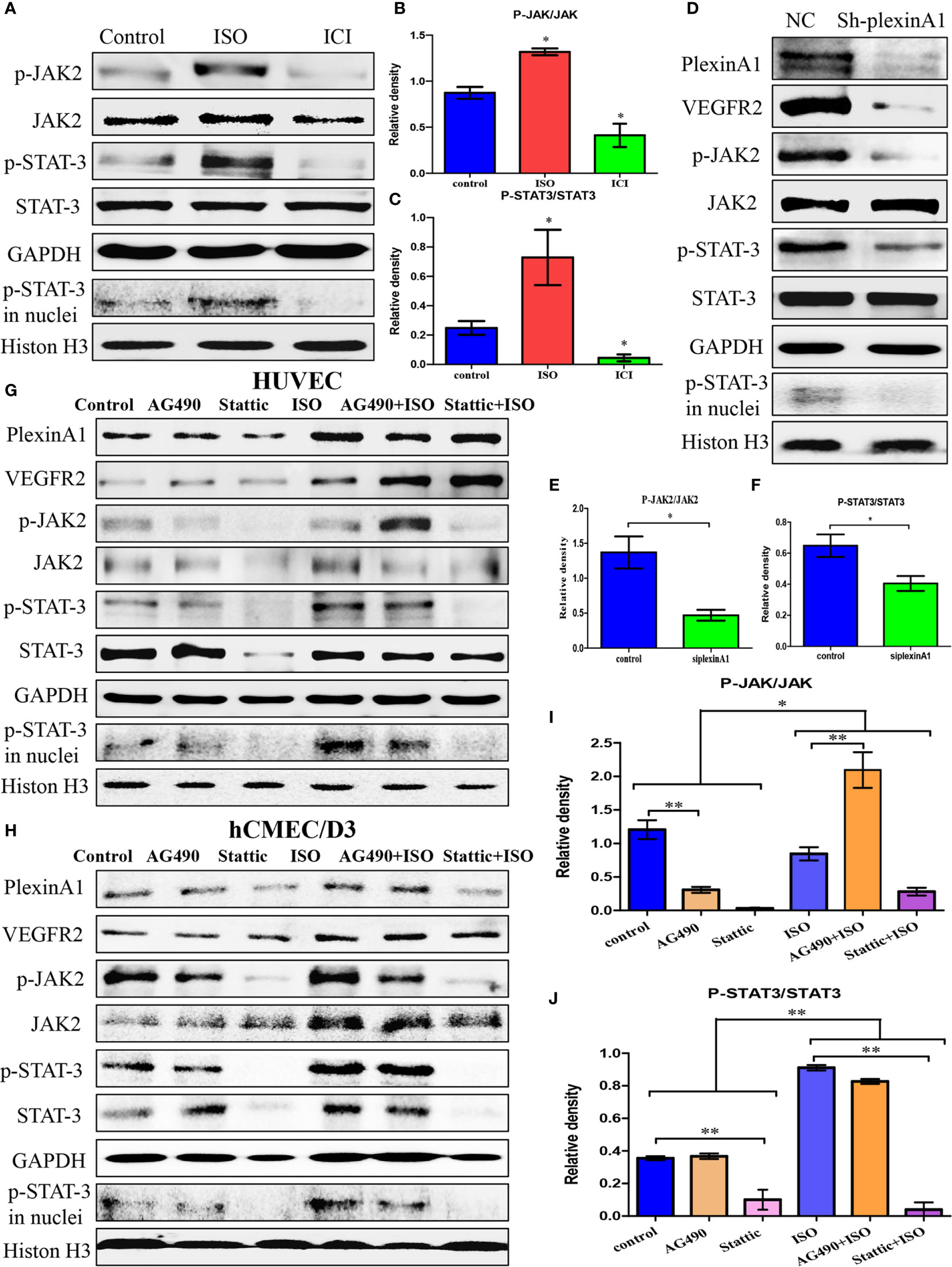
异丙肾上腺素通过丛蛋白A1/VEGFR2-JAK2-STAT3信号通路促进HUVECs激活
我们发现ISO不仅促进了丛蛋白A1和VEGFR2的表达,还激活了JAK2-STAT3通路。ISO主要促进JAK2和STAT3的磷酸化,增加p-STAT3转运。(图4A–C)为了进一步检测丛蛋白A1与上游和下游信号之间的机制,我们通过western blots测试了shplexinA1对JAK2-STAT3通路的影响。抑制丛蛋白A1强烈降低VEGFR2的表达以及JAK2和STAT3的磷酸化。同时,抑制丛蛋白A1也降低了p-STAT3的易位。(图4D–F)这些结果表明,ISO-plexinA1/VEGFR2-JAK2-STAT3信号可能与肿瘤血管生成有关。为了验证这一假设,分别使用JAK2磷酸化抑制剂AG-490和STAT3磷酸化抑制剂stattic检测异丙肾上腺素促进HUVEC活化。JAK2-STAT3通路抑制剂不影响PlexinA1和VEGFR2蛋白的表达,但可被异丙肾上腺素激活。(图4G)异丙肾上腺素对JAK2和STAT3的表达无影响,但增加了HUVEC中p-JAK2、p-JAK3的表达和p-STAT3移位。(图4G、I、J)在hCMEC/D3细胞的蛋白质水平上也观察到类似的结果。(图4H)这些结果表明,异丙肾上腺素能促进丛蛋白A1和VEGFR2蛋白的表达,进而激活JAK2-STAT3通路。
总之,这些结果表明,慢性应激促进VECs中的丛蛋白A1/VEGFR2-JAK2-STAT3,以促进血管生成。
讨论
慢性应激与下丘脑-垂体-肾上腺轴异常持续激活和交感神经系统兴奋有关,导致儿茶酚胺释放增加,尤其是去甲肾上腺素和肾上腺素。儿茶酚胺可以通过影响增殖、粘附、迁移和侵袭来调节肿瘤细胞的多种生物学行为(19). 此外,在肿瘤微环境中检测到高儿茶酚胺水平(20). 肿瘤微环境与血管和淋巴管交错。血管在肿瘤发展过程中起着至关重要的作用。迫切需要了解儿茶酚胺在肿瘤血管生成中的作用。
α-和β-肾上腺素能受体家族调节儿茶酚胺的生物功能。在儿茶酚胺受体中,β2-AR是最典型的受体。儿茶酚胺能激活β2-AR,提示预后不良。我们之前的研究发现,β2-AR激动剂通过stat3-CD44影响胃癌细胞的EMT(21). 其他研究人员还发现,异丙肾上腺素通过β2-AR-HIF-1α-蜗牛信号转导途径影响胃癌细胞EMT,从而影响胃癌的迁移和侵袭(22). 此外,前列腺癌中β2-AR基因敲除抑制肿瘤生长和血管生成(23). 通过采用卵巢癌动物模型,Thaker及其同事通过增强血管生成,确定了β2-AR在应激介导的肿瘤进展中的重要部分(4). 另一项研究报告称,慢性应激通过激活β2-AR-HIF-1α途径分泌VEGF来影响肿瘤血管生成。随着VEGF等促血管生成生长因子的显著表达,肿瘤微环境进入“高血管化”状态,从而促进肿瘤的恶性进展。在本研究中,我们使用选择性β2-AR激动剂和阻断剂来发现慢性应激调节肿瘤血管生成的病理生理学。
基于这项研究,慢性应激调节肿瘤血管生成的病理生理学(图5). 此外,慢性应激导致肿瘤内灌注值增加。此外,我们发现慢性应激通过增加HUVEC的增殖、迁移以及导管的形成来增加肿瘤血管生成。基于上述发现,慢性应激在肿瘤血管生成中发挥着重要作用。VEGF主要调节血管生成,也是多种癌症中VEC的候选自分泌生长因子(24). 事实上,我们还发现慢性应激会增加VEC中的VEGF自分泌,这可能会增加肿瘤血管生成。
在本研究中,暴露于人重组VEGF165可促进HUVEC内的丛蛋白A1和VEGFR2水平。我们的发现表明,VEGFR2和丛蛋白A1在异丙肾上腺素促进血管生成中发挥重要作用。众所周知,VEGFR2在血管生成中的作用。费拉拉及其同事报告称,VEGFR2介导VEGF功能,而前者存在于肿瘤相关VEC中(25). PlexinA1和VEGFR2可以构成受体复合体,从而对不同的心脏导管部位产生不同的影响(4). 阐明丛蛋白A1在血管生成过程中的作用具有重要意义。然后,我们的结果表明,HUVEC中的丛蛋白A1敲低降低了增殖、迁移和管形成。这为我们提供了有效的证据,即在慢性应激诱导的肿瘤血管生成中,丛蛋白A1在VEGF-VEGFR2信号通路中不可或缺。
JAK2-STAT3通路是最重要的细胞信号转导途径之一。一些研究表明,JAK-STAT3通路在内皮细胞激活中起着关键作用,可以增加内皮细胞的增殖和粘附(26,27). 例如,JAK-STAT3通路的激活对于IL-6介导的HUVEC炎症反应至关重要(28). 我们发现JAK2-STAT3信号通路参与内皮细胞在应激诱导的肿瘤进展中的激活,这在异丙肾上腺素激活丛蛋白A1和VEGFR2后立即发生。
这项研究有两个局限性。首先,我们没有使用肿瘤微环境激素来证实其对血管的影响。其次,我们没有确定VEGFR2和丛蛋白A1之间的蛋白质-蛋白质相互作用。
如本研究所示,应激相关激素与胃癌血管生成直接相关。它们促进VEGF的自分泌,增加VEGFR2和丛蛋白A1的水平,随后激活VEC中的JAK2-STAT3通路。因此,在未来的胃癌治疗工作中,应开发更多以丛蛋白A1为靶点的策略和抗血管生成的新疗法。
数据可用性声明
本文中包含了研究中提出的原始贡献/补充材料。可向相应作者进行进一步查询。
道德声明
承德医科大学伦理委员会批准了患者参与本项工作和血样使用的同意书(2020003)。患者/参与者提供了参与本研究的书面知情同意书。所有动物研究均经中国人民解放军总医院动物护理和使用委员会(2015-X11-09)批准。
作者贡献
YJL和HZZ进行了研究并撰写了手稿;YHL和XZ作为通讯作者审阅了手稿,进行了重大修改,并对试剂做出了贡献;YZZ、QX、LL和XL参与了关于手稿的讨论;HBZ和SZ参与组织样本采集;YZ和YL进行了实验并分析了数据。所有作者都参与了这篇文章并批准了提交的版本。
基金
本研究由国家自然科学基金资助(81672462,81703001)、河北省自然科学基金(H2019406073,H2020406008)、承德医学院大学级科研项目(202007,KY2021037)、河北省委卫生基金(20200355)、,河北省科技厅技术创新指导项目科技工作会议,河北省高等学校重点学科(病理学和病理生理学)。
利益冲突
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或金融关系的情况下进行的。
出版商备注
本文中表达的所有声明仅为作者的声明,不一定代表其附属组织的声明,也不一定代表出版商、编辑和审稿人的声明。本文中可能评估的任何产品,或其制造商可能提出的索赔,都不受出版商的保证或认可。
致谢
作者感谢参与本研究的患者。
补充材料
本文的补充材料可以在以下网站上找到:https://www.frontiersin.org/articles/10.3389/fonc.2021.709057/full#补充-材料
工具书类
1.Spiegel D、Bloom JR、Kraemer HC、Gottheil E.心理社会治疗对转移性乳腺癌患者生存率的影响。柳叶刀(1989) 2(8668):888–91. doi:10.1016/s0140-6736(89)91551-1
PubMed摘要|交叉引用全文|谷歌学者
2.Williams JB、Pang D、Delgado B、Kocherginsky M、Tretiakova M、Krausz T等。基因-环境相互作用模型揭示了社会隔离后乳腺基因表达改变和肿瘤生长增加。癌症预防研究(Phila)(2009) 2(10):850–61. doi:10.1158/1940-6207.CAPR-08-0238
PubMed摘要|交叉引用全文|谷歌学者
3.Le CP、Nowell CJ、Kim-Fuchs C、Botteri E、Hiller JG、Ismail H等。小鼠慢性应激重塑淋巴血管以促进肿瘤细胞扩散。国家公社(2016) 7:10634. doi:10.1038/ncomms10634
PubMed摘要|交叉引用全文|谷歌学者
4.Thaker PH、Han LY、Kamat AA、Arevalo JM、Takahashi R、Lu C等。慢性应激促进卵巢癌小鼠模型中的肿瘤生长和血管生成。自然·医学(2006) 12(8):939–44. doi:10.1038/nm1447
PubMed摘要|交叉引用全文|谷歌学者
5.Sood AK、Armaiz-Pena GN、Halder J、Nick AM、Stone RL、Hu W等。局部粘附激酶的肾上腺素能调节保护人卵巢癌细胞免受Anoikis侵袭。临床研究杂志(2010) 120(5):1515–23. doi:10.1172/JCI40802
PubMed摘要|交叉引用全文|谷歌学者
6.石M,刘丹,段H,钱L,王L,牛L,等。人乳腺癌细胞中β2肾上腺素能受体和Her2组成正反馈环。乳腺癌研究治疗(2011)125(2):351-62。doi:10.1007/s10549-010-0822-2
PubMed摘要|交叉引用全文|谷歌学者
7.Kinoshita J、Kitamura K、Kabashima A、Saeki H、Tanaka S、Sugimachi K。血管内皮生长因子-C(VEGF-C)在乳腺癌中的临床意义。乳腺癌研究治疗(2001) 66(2):159–64. doi:10.1023/a:1010692132669
PubMed摘要|交叉引用全文|谷歌学者
8.Sloan EK、Priceman SJ、Cox BF、Yu S、Pimentel MA、Tangkanangnukul V等。交感神经系统在原发性乳腺癌中诱导转移开关。癌症研究(2010) 70(18):7042–52. doi:10.1158/0008-5472.CAN-10-0522
PubMed摘要|交叉引用全文|谷歌学者
9.里维拉·LB,伯杰斯·G·癌症。肿瘤血管生成,从敌人到朋友。科学类(2015) 349(6249):694–5. doi:10.1126/science.aad0862
PubMed摘要|交叉引用全文|谷歌学者
10.Fuchs CS、Tomasek J、Yong CJ、Dumitru F、Passalacqua R、Goswami C等。Ramucrumab单药治疗先前治疗的晚期胃或胃食管交界处腺癌(REGARD):一项国际性、随机、多中心、安慰剂对照的3期试验。柳叶刀(2014)383(9911):31-9。doi:10.1016/S0140-6736(13)61719-5
PubMed摘要|交叉引用全文|谷歌学者
11.Papp KA、Tyring S、Lahfa M、Prinz J、Griffiths CE、Nakanishi AM等。依那西普治疗银屑病的全球III期随机对照试验:安全性、疗效和剂量减少效果。英国皮肤病学杂志(2005) 152(6):1304–12. doi:10.1111/j.1365-2133.2005.06688.x
PubMed摘要|交叉引用全文|谷歌学者
12.Wadhwa R、Elimova E、Shiozaki H、Sudo K、Blum MA、Estrella JS等。抗血管生成药物Ramucrumab:有意义还是边缘?抗癌治疗专家版(2014) 14(4):367–79. 数字对象标识代码:10.1586/14737140.2014.896207
PubMed摘要|交叉引用全文|谷歌学者
13.O’Connor BP,Ting JP。信号素和Plexins在免疫系统中的进化作用:Plexin-A1对树突状细胞功能的调节。免疫研究(2008) 41(3):217–22. doi:10.1007/s12026-008-8026-0
PubMed摘要|交叉引用全文|谷歌学者
14.Chen EY、Dobrinski KP、Brown KH、Clagg R、Edelman E、Ignatius MS等。跨物种阵列比较基因组杂交鉴定斑马鱼和人类胚胎横纹肌肉瘤中的新致癌事件。公共科学图书馆-基因(2013)9(8):e1003727。doi:10.1371/journal.pgen.1003727
PubMed摘要|交叉引用全文|谷歌学者
15.Toyofuku T、Zhang H、Kumanogoh A、Takegahara N、Suto F、Kamei J等。Sema6D通过其受体Plexin-A1与Off-Track和血管内皮生长因子受体2型的区域特异性关联在心脏形态发生中的双重作用。基因开发(2004) 18(4):435–47. 数字对象标识码:10.1101/gad.1167304
PubMed摘要|交叉引用全文|谷歌学者
16.赵XY,陈磊,李玉华,徐琼。PlexinA1在胃癌中的表达及其与肿瘤血管生成和增殖的关系。世界胃肠病杂志(2007) 13(48):6558–61. doi:10.3748/wjg.v13.i48.6558
PubMed摘要|交叉引用全文|谷歌学者
17.陆毅,徐强,左毅,刘磊,刘S,陈磊,等.异丙肾上腺素/β2-AR激活Plexin-A1/VEGFR2信号通过胃癌细胞分泌VEGF促进肿瘤血管生成。BMC癌症(2017) 17(1):875. doi:10.1186/s12885-017-3894-0
PubMed摘要|交叉引用全文|谷歌学者
18.黄Z,赵B,秦Z,李毅,王T,周伟,等。靶向CDK4和VEGFR2的新型双抑制剂协同抑制肿瘤进展和血管生成。欧洲药物化学杂志(2019) 181:111541. doi:10.1016/j.ejmech.2019.07.044
PubMed摘要|交叉引用全文|谷歌学者
19.Tang J,Li Z,Lu L,Cho CH.Beta肾上腺素能系统,调节肿瘤进展的后台操纵器和癌症治疗中的药物靶点。赛明癌症生物学(2013)23(第6部分B):533-42。doi:10.1016/j.semcancer.2013.08.009
PubMed摘要|交叉引用全文|谷歌学者
20.刘德,邓Q,孙磊,王涛,杨姿,陈浩,等。Her2-Let-7-Beta2-AR回路对Her2-阳性乳腺癌患者预后的影响。BMC癌症(2015) 15:832. doi:10.1186/s12885-015-1869-6
PubMed摘要|交叉引用全文|谷歌学者
21.卢永杰,耿志杰,孙晓英,李玉华,傅晓波,赵晓英,等。异丙肾上腺素诱导胃癌细胞上皮-间充质转化。分子细胞生物化学(2015) 408(1-2):1–13. doi:10.1007/s11010-015-2477-0
PubMed摘要|交叉引用全文|谷歌学者
22.Shan T,Cui X,Li W,Lin W,Li Y,Chen X,等。胃腺癌细胞系中去甲肾上腺素诱导的上皮-间充质转化的新调控程序。癌症科学(2014) 105(7):847–56. doi:10.1111/cas.12438
PubMed摘要|交叉引用全文|谷歌学者
23.Zahalka AH、Arnal-Estape A、Maryanovich M、Nakahara F、Cruz CD、Finley L等。肾上腺素能神经激活前列腺癌中的血管代谢开关。科学类(2017) 358(6361):321–6. doi:10.1126/science.aah5072
PubMed摘要|交叉引用全文|谷歌学者
24.Rebuzzi L、Willmann M、Sonneck K、Gleixner KV、Florian S、Kondo R等。犬肥大细胞瘤细胞中血管内皮生长因子(VEGF)和VEGF受体Flt-1和KDR的检测。兽医免疫病理学(2007) 115(3-4):320–33. doi:10.1016/j.vetimm.2006.11.009
PubMed摘要|交叉引用全文|谷歌学者
25.Ferrara N,Kerbel RS。血管生成作为治疗靶点。自然(2005) 438(7070):967–74. doi:10.1038/nature04483
PubMed摘要|交叉引用全文|谷歌学者
26.潘M,王H,安萨里KH,李X,孙伟,范Y。胆囊癌相关成纤维细胞促进胆囊癌中血管生成拟态形成和肿瘤生长通过通过IL-6-JAK-STAT3信号通路上调不良预后因子NOX4的表达。实验临床癌症研究杂志(2020) 39(1):234. doi:10.1186/s13046-020-01742-4
交叉引用全文|谷歌学者
27.Lee HY、Lee SY、Kim SD、Shim JW、Kim HJ、Jung YS等。鞘氨醇磷酰胆碱刺激人脐静脉内皮细胞产生CCL2。免疫学杂志(2011) 186(7):4347–53. doi:10.4049/jimmunol.1002068
PubMed摘要|交叉引用全文|谷歌学者
28.Zegeye MM、Lindkvist M、Falker K、Kumawat AK、Paramel G、Grenegard M等。JAK/STAT3和PI3K/AKT通路的激活对人类血管内皮细胞中IL-6转信号介导的前炎症反应至关重要。小区通信信号(2018)16(1):55。doi:10.1186/s12964-018-0268-4
PubMed摘要|交叉引用全文|谷歌学者