介绍
单词“寄生虫“从16世纪开始使用,源于希腊语寄生虫意思是“在别人的桌子上吃饭,”来自段落含义“旁边“+西托斯”食物。”寄生虫与其宿主之间的关系是一种固有的代谢关系。细胞内寄生虫以宿主为食,因此很可能在这一过程中干扰其代谢途径。事实上,最近人们对代谢交换在宿主-宿主相互作用中的作用产生了很大的兴趣(Blume和Seeber,2018年;Zuzarte-Luís and Mota,2018年;Krishnan等人,2019年). 近年来,我们对一种显著的代谢性主机-主机相互作用着迷;泰勒菌属寄生虫可以对宿主细胞进行重新编程,以驱动类似癌症的代谢状态。我们最令人兴奋的发现是肽基脯氨酸的关键作用顺/反异构酶Pin1在这种关系中发挥作用。
有 才能泰勒菌属寄生虫
泰勒菌属spp.是专性的细胞内寄生虫,属于顶端复合体门。两个泰勒菌属物种,帕尔瓦锥虫、和环状木霉是牛特有的病原体,由于治疗成本高、抗感染控制成本高、动物死亡率高和牛产量下降,导致疾病的发生,具有相当大的经济影响。热带泰勒虫病每年造成110多万头牛死亡,损失达数亿美元。感染者泰勒菌属导致奶牛淋巴增生性疾病,该疾病具有人类白血病的某些临床特征(Tretina等人,2015年).环状木霉感染牛B细胞和巨噬细胞,而相关物种帕尔瓦锥虫感染B和T淋巴细胞。泰勒菌属-感染细胞被转化并永生(Cheeseman和Weitzman,2015年;Tretina等人,2015年); 它们表现出癌症表型,如不受控制的增殖、生长因子的独立性、增强的侵袭性和在免疫缺陷小鼠中形成转移的能力(Tretina等人,2015年). 特别有趣的是,泰勒菌属-依赖变换是可逆的;用杀螨药Buparvaquone可以治愈这些动物。孵化泰勒菌属-受感染细胞在体外使用Buparvaquone可以减少宿主白细胞内的细胞内寄生虫数量,这些寄生虫会失去转化的表型,停止增殖,并恢复对凋亡的敏感性。为了驱动宿主细胞转化,寄生虫操纵控制细胞增殖和存活的宿主细胞信号通路。一些信号通路被牵连,包括c-Jun N末端激酶(JNK)和宿主核因子c-Myc、NF-κB和AP-1(Chaussepied等人,1998年;Heussler等人,2002年;Dessauge等人,2005年;Tretina等人,2015年). 我们发现Jun/AP-1转录因子维持着一个关键的致癌微RNA反馈环(Marsolier等人,2013年). 的另一个迷人特征泰勒菌属-诱导转化是在癌细胞中观察到的“Warburg效应”(以下称为Warburg-like效应)的代谢特征的诱导(凯恩斯等人,2011年;Medjkane和Weitzman,2013年;Medjkane等人,2014年;Metheni等人,2015年). 寄生虫诱导的Warburg-like效应显示了从氧化磷酸化转变为有氧糖酵解的典型迹象。我们和其他人先前报道了低氧诱导因子1α(HIF1α)在感染细胞中驱动糖酵解酶和代谢基因表达中的中心作用(Medjkane等人,2014年;Metheni等人,2015年). 尽管在识别转化表型的宿主途径方面取得了这一进展,但细胞内寄生虫如何启动导致宿主转录组重新布线的信号事件尚不清楚。
支持主机-寄生虫交互
为了确定潜在的分泌癌蛋白环状木霉,我们挖掘寄生虫基因组,寻找编码带有信号肽的蛋白质的基因,这些信号肽可能会分泌到宿主细胞质中,并充当“表观基因”(Cheeseman和Weitzman,2015年)破坏宿主调节通路的致癌信号。生物信息学管道产生了一个相对有限的候选基因列表,其中最有希望的是磷化依赖性肽基-脯氨酸的寄生虫同源物顺/反异构酶PIN1(Marsolier等人,2015年). 人类Pin1在致癌和代谢重编程中的作用提供了感染和通过泰勒菌属寄生虫(Nakatsu等人,2019年). 我们命名为TaPin1的寄生虫编码异构酶特别有趣;它具有催化异构酶结构域,哺乳动物Pin1中存在的WW结构域被假定的信号肽序列取代。虽然一些Pin1同系物也缺乏WW结构域,但TaPin1的PPLaase结构域很保守。事实上,TaPin1 PPIase域与hPin1的同源性为47%,与拟南芥AtPin1和43%布鲁氏锥虫Tb引脚1(Marsolier等人,2015年). 有趣的是,信号肽在非转基因物种中并不保守泰勒菌属或在相关的apicomplexan同系物中弓形虫或疟原虫(Marsolier等人,2015年). 我们表明TaPin1蛋白是一种善意的脯氨酰异构酶及其分泌到宿主细胞(Marsolier等人,2015年). 抗寄生虫药物Buparvaquone可以抑制TaPin1异构酶活性,这一发现突显了TaPin 1在寄生虫诱导转化过程中的重要性。另一个令人惊讶的发现是,对Buparvaquone耐药的寄生虫编码TaPin1的基因发生了突变。突尼斯和苏丹的耐药菌株也出现了同样的A53P突变(Marsolier等人,2015年;Salim等人,2019年). 这种突变会影响Buparvaquone进入活性位点并抑制异构酶活性的能力。有趣的是,仅在转化物种中观察到信号肽的存在(环状木霉和帕尔瓦锥虫),但不在非转化物种或密切相关的顶端复合体中,例如疟原虫或弓形虫(Marsolier等人,2015年). 虽然可能还有其他寄生基因编码的蛋白质有助于宿主细胞的转化,但TaPin1是脯氨酰异构酶如何进化成在宿主-寄主关系中起关键作用的一个显著例子。
TaPin1,一种分子林奇宾
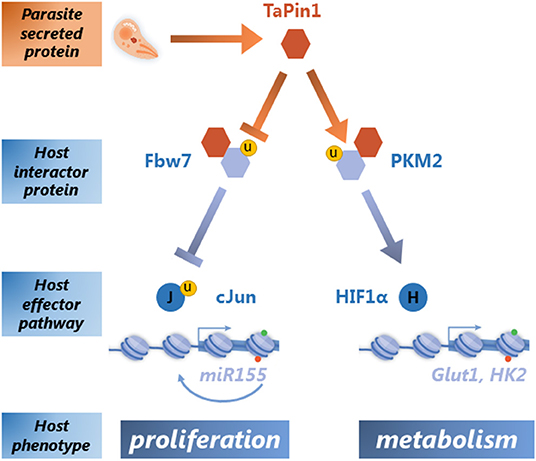
一旦TaPin1被确定为一个关键的寄生分泌表观基因,问题仍然是它如何劫持宿主细胞信号通路。Pin1是一种保守的酶,能在特定的蛋白质子集中特异异构化磷酸化的Ser/Thr-Pro键,从而诱导构象变化,影响其稳定性、定位和活性。人类Pin1蛋白具有多种底物,参与多种有助于转化的细胞过程(Marsolier和Weitzman,2014年;周、陆,2016). 对TaPin1相互作用蛋白和宿主伴侣蛋白的搜索确定了至少两种由寄生虫异构酶诱导的宿主途径(图1). 我们发现TaPin1蛋白与宿主泛素连接酶Fbw7相互作用,导致其自动降解(Marsolier等人,2015年). 这种相互作用使宿主癌蛋白c-Jun从Fbw7依赖的泛素化和降解中释放出来。c-Jun蛋白是AP-1转录因子的一部分,该转录因子诱导癌细胞R-155,从而驱动宿主细胞增殖(Marsolier等人,2013年). AP-1还诱导编码基质金属蛋白酶MMP-9的基因,该基因驱动宿主细胞侵袭表型(Cock-Rada等人,2012年). 我们还鉴定了宿主蛋白丙酮酸激酶亚型M2(PKM2)作为TaPin1相互作用物,该亚型对Warburg-like效应和癌细胞糖酵解酶的转录至关重要(Marsolier等人,2019年). 这一次的结果是PKM2的稳定,导致HIF-1α依赖性调节宿主代谢。TaPin1-PKM2-HIF-1α轴导致宿主代谢酶(如GLUT1和己糖激酶2)的诱导、葡萄糖摄取增加和寄生虫感染细胞表型的转化(Medjkane等人,2014年;Marsolier等人,2019年). 这些是寄生菌诱导的Warburg-like效应的综合特征。TaPin1稳定宿主PKM2蛋白,同时促进Fbw7降解的确切分子机制尚不清楚。我们假设PKM2或Fbw7的脯氨酰异构化可能会不同地影响与泛素连接酶或其他调节蛋白质稳定性的因素的相互作用。
讨论
许多关于Pin1磷酸化依赖性肽基-脯氨酸作用的研究顺/反异构酶坚定地将该蛋白作为致癌和代谢途径的关键调节器(Marsolier和Weitzman,2014年;周、陆,2016;Nakatsu等人,2019年). 寄生虫TaPin1的发现和表征将寄生虫与宿主的相互作用添加到这种多任务酶的作用列表中。如上所述,TaPin1将寄生与宿主代谢和宿主细胞增殖的调节联系起来。我们对宿主底物TaPin1结合和异构化的研究结果集中于战略性宿主转录重编程的调控,导致了两个主要的生物过程,为寄生虫提供了明显的优势(图1). 首先,TaPin1通过稳定c-Jun促进转化,从而促进寄生虫传播,从而促进宿主细胞增殖和肿瘤生长。其次,TaPin1通过激活PKM2-HIF1α轴诱导主要的代谢重编程。细胞葡萄糖资源的这种转变可能提供以下所需的关键营养素泰勒菌属宿主细胞内的增殖和维持。有趣的是,TaPin1信号肽在进化过程中的获得仅限于转化泰勒菌属物种(环状木霉和帕尔瓦锥虫)提供了一种令人信服的方式将其分泌到细胞质寄主室中,以劫持转导途径并重新连接寄主转录程序。通过这种方式,TaPin1对寄生虫的生存至关重要,是一个很有希望的药物靶点。事实上,在Buparvaquone耐药寄生虫领域的观察和TaPin1标签该基因强调了对仍能以突变蛋白为靶点的替代性Pin1抑制剂的需求。宿主牛的水平Bt引脚1转录物和蛋白质不受Buparvaquone治疗的影响,这表明该药物专门针对寄生虫蛋白质,这可能解释了未感染细胞中没有毒性。值得注意的是,Juglone,一种具有良好特征的哺乳动物Pin1抑制剂,可以替代Buparvaquone的治疗,从而降低寄生虫负担和感染的宿主细胞的生存能力环状木霉或巴氏锥虫体外培养(Marsolier等人,2015年). 显然,未来几年,来自不同物种的Pin1蛋白的多功能性和多任务性将继续令我们惊讶。这可能仍然是一个令人兴奋的领域,对癌症和传染病都具有临床相关性。
作者贡献
SM和JW写了这篇文章。
基金
我们实验室的工作得到了“我是谁?”实验室的支持#ANR-11-LABX-0071和巴黎大学IdEx#ANR-18-IdEx-0001由法国政府通过其未来投资计划、国家癌症研究所(ANR PATHO-METHYLOME#ANR-15-CE12-0020)、癌症防治与癌症2015计划(PARA-CAN#PARA-15-RCA)资助ARC pour la Recherche sur le Cancer基金会(ARC编号155029)和Gefluc les enterprises控制癌症。JW是法国大学研究所(IUF)的高级成员,SM是IUF的初级成员(2012ND 3369)。
利益冲突
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或金融关系的情况下进行的。
工具书类
Blume,M.和Seeber,F.(2018年)。弓形虫与宿主的代谢相互作用。F1000分辨率7:F1000教员版次-1719。doi:10.12688/f1000research.16021.1
PubMed摘要|CrossRef全文|谷歌学者
Cairns,R.A.、Harris,I.S.和Mak,T.W.(2011年)。癌细胞代谢的调节。Nat.Rev.癌症11, 85–95. doi:10.1038/nrc2981
PubMed摘要|CrossRef全文|谷歌学者
Chaussepied,M.、Lallemand,D.、Moreau,M.F.、Adamson,R.、Hall,R.和Langsley,G.(1998)。Jun和Fos家族成员的上调以及JNK的永久性活性导致了泰勒菌属-转化的白细胞。分子生物化学。寄生虫醇。94, 215–26. doi:10.1016/S0166-6851(98)00070-X
PubMed摘要|CrossRef全文|谷歌学者
Cheeseman,K.和Weitzman,J.B.(2015)。寄主-寄主相互作用:一种亲密的表观遗传关系。单元格。微生物。17, 1121–1132. doi:10.1111/cmi.12471
PubMed摘要|CrossRef全文|谷歌学者
Cock-Rada,A.M.、Medjkane,S.、Janski,N.、Yousfi,N.,Perichon,M.、Chaussepied,M.等人(2012年)。SMYD3通过表观遗传上调金属蛋白酶MMP-9促进癌症侵袭。癌症研究。72, 810–820. doi:10.1158/0008-5472.CAN-11-1052
PubMed摘要|CrossRef全文|谷歌学者
Dessauge,F.、Hilaly,S.、Baumgartner,M.、Blumen,B.、Werling,D.和Langsley,G.(2005)。c-Myc激活泰勒菌属寄生虫促进受感染的B淋巴细胞的存活。癌基因24, 1075–1083. doi:10.1038/sj.onc.1208314
PubMed摘要|CrossRef全文|谷歌学者
Heussler,V.T.、Rottenberg,S.、Schwab,R.、Küenzi,P.、Fernandez,P.C.、McKellar,S.等人(2002年)。转化寄生虫劫持宿主细胞IKK信号体泰勒菌属。科学类298, 1033–1036. doi:10.1126/science.1075462
PubMed摘要|CrossRef全文|谷歌学者
Krishnan,A.、Kloehn,J.、Lunghi,M.和Soldati-Favre,D.(2019年)。顶端复合物中维生素和辅因子的获取:合成与补救。生物学杂志。化学。295, 701–714. doi:10.1074/jbc。AW119.008150型
PubMed摘要|CrossRef全文|谷歌学者
Marsolier,J.、Perichon,M.、DeBarry,J.D.、Villoutreix,B.O.、Chluba,J.、Lopez,T.等人(2015)。泰勒菌属寄生虫分泌脯氨酸异构酶来维持宿主白细胞的转化。性质520, 378–82. doi:10.1038/nature14044
PubMed摘要|CrossRef全文|谷歌学者
Marsolier,J.、Perichon,M.、Weitzman,J.B.和Medjkane,S.(2019年)。分泌的寄生虫Pin1异构酶稳定宿主PKM2以重新编程宿主细胞代谢。Commun公司。生物。2:152. doi:10.1038/s42003-019-0386-6
PubMed摘要|CrossRef全文|谷歌学者
Marsolier,J.、Pineau,S.、Medjkane,S.、Perichon,M.、Yin,Q.、Flemington,E.等人(2013)。肿瘤成瘾是由miR-155反馈回路产生的泰勒虫属-转化的白细胞。《公共科学图书馆·病理学》。9:e1003222。doi:10.1371/journal.ppat.1003222
PubMed摘要|CrossRef全文|谷歌学者
Marsolier,J.和Weitzman,J.B.(2014)。Pin1:一种多才多艺的肽基脯氨酰顺反异构酶,是一种很有希望的人类癌症治疗靶点。医学科学。30, 772–778. doi:10.1051/medsci/20143008015
PubMed摘要|CrossRef全文|谷歌学者
Medjkane,S.、Perichon,M.、Marsolier,J.、Dairou,J.和Weitzman,J.B.(2014)。泰勒菌属诱导对宿主白细胞转化至关重要的氧化应激和HIF1α激活。癌基因33, 1809–1817. doi:10.1038/onc.2013.134
PubMed摘要|CrossRef全文|谷歌学者
Medjkane,S.和Weitzman,J.B.(2013)。可逆的Warburg效应是由泰勒菌属寄生虫转化宿主白细胞。细胞周期12, 2167–2168. doi:10.4161/cc.25540
PubMed摘要|CrossRef全文|谷歌学者
Metheni,M.、Lombès,A.、Bouillaud,F.、Batteux,F.和Langsley,G.(2015)。HIF-1α诱导、增殖和糖酵解泰勒菌属-受感染的白细胞。单元格。微生物。17, 467–472. doi:10.1111/cmi.12421
PubMed摘要|CrossRef全文|谷歌学者
Nakatsu,Y.、Yamamotoya,T.、Ueda,K.、Ono,H.、Inoue,M.-K.、Matsunaga,Y.等人(2019年)。脯氨酸异构酶Pin1在癌细胞代谢重编程中的作用。癌症快报。420, 106–114. doi:10.1016/j.canlet.2019.10.043
CrossRef全文|谷歌学者
Salim,B.、Chatanga,E.、Jannot,G.、Mossaad,E.、Nakao,R.和Weitzman,J.B.(2019年)。TaPIN1肽基脯氨酸异构酶基因突变泰勒菌属苏丹分离出的轮状寄生虫。国际寄生虫学杂志。药物抗药性。11, 101–105. doi:10.1016/j.ijpddr.2019.11.001
PubMed摘要|CrossRef全文|谷歌学者
Tretina,K.、Gotia,H.T.、Mann,D.J.和Silva,J.C.(2015)。泰勒菌属-转化的牛白细胞具有癌症特征。寄生虫趋势。31, 306–314. doi:10.1016/j.pt.2015.04.001
PubMed摘要|CrossRef全文|谷歌学者
Zhou,X.Z.和Lu,K.P.(2016)。异构酶PIN1控制许多致癌途径,是一个独特的药物靶点。Nat.Rev.癌症16, 463–478. doi:10.1038/nrc.2016.49
PubMed摘要|CrossRef全文|谷歌学者
Zuzarte-Luís,V.和Mota,M.M.(2018年)。寄生虫对寄主营养物质和环境信号的感知。宿主与微生物23, 749–758. doi:10.1016/j.chom.2018.05.018
PubMed摘要|CrossRef全文|谷歌学者