介绍
癌症恶病质是一种多因素综合征,其特征是骨骼肌和脂肪组织(AT)耗竭导致体重减轻,并与高静息能量消耗(REE)、进行性功能损害、生活质量差和生存期延长有关(1,2). 癌症恶病质患者体重减轻的程度无法通过减少食物摄入来解释,证据表明全身炎症是其病理生理学的核心。肿瘤和宿主衍生的细胞因子和免疫肽都会破坏正常的代谢,对癌症恶病质的分解代谢至关重要(三). 最近,一个国际共识专家小组认为肌肉损失是癌症恶病质定义的一个重要纳入标准,而AT损失可能存在也可能不存在(4). 事实上,肌肉丧失长期以来一直是恶病质研究的主导因素,直到最近,在过去十五年中进行的研究才开始揭示AT形态和功能的变化,这些变化在癌症恶病质的发展和进展中具有重要意义。
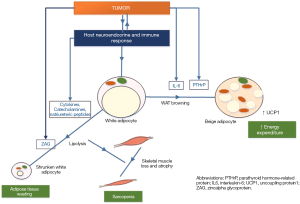
将AT视为惰性能量储存库的观点已被以下认识所取代:AT是一个多成分、异质和代谢活跃的器官,在全身具有重要的内分泌和旁分泌作用(5). AT在解剖位置和细胞组成方面具有多样性,重要的是,它具有高度的可塑性,能够适应生理和病理线索。长期以来,白色AT(WAT)被认为是成人中唯一相关的AT,其在癌症恶病质中的消失归因于炎症肿瘤微环境导致的大量脂解因子。然而,成人功能性棕色脂肪组织(BAT)的证明,以及白色脂肪细胞在肿瘤和宿主相关因素作用下转化为“米色”脂肪细胞的能力,从根本上改变了这一观点。这篇综述将讨论有关AT功能调节的现有知识以及不同类型AT在癌症恶病质中的作用。
AT类型和功能:白色、棕色和米色
两种主要类型的AT仓库,WAT和BAT,分别具有不同的储能和发热功能。根据位置和病理生理特性,脂肪细胞分为三类:白色、棕色和米色。
WAT公司
在成人中,WAT是体内最大的AT仓库和主要能量库,包括皮下和内脏WAT。它主要由专门摄取、储存和动员脂质的白色脂肪细胞组成。它含有消耗大部分细胞体积的单室脂滴和由结构蛋白和酶组成的外壳。摄入食物后,脂蛋白脂肪酶(LPL)从脂蛋白中释放出的多余游离脂肪酸(FA)被酯化为相对惰性的三酰甘油(TAG),随后储存在脂滴中。脂肪酸进入和离开这些脂肪细胞的流量是恒定的,而TAG的含量取决于脂肪生成(TAG在细胞质中的脂滴中的生物合成、合并和储存)和脂肪分解(TAG水解为FA和甘油)之间的净平衡,主要受交感神经系统(SNS)和胰岛素的严密调节(6,7). 在高能量需求期间,如禁食和运动期间,TAG储存被动员起来释放FA,这些FA被输送到外周组织进行β-氧化和ATP生成(8). 脂解由三种脂肪酶实现,即脂肪甘油三酯脂肪酶(ATGL)、激素敏感脂肪酶和单甘油脂肪酶,它们连续分解TAG以释放FA和甘油(图1) (9).
ATGL在TAG分解代谢中的关键作用从ATGL缺陷小鼠的脂肪分解严重减少和全身脂肪沉积增加中可以明显看出(10)以及ATGL基因突变的人类(11,12). 相比之下,HSL缺乏小鼠的刺激性脂肪分解仅表现出中度减少,脂肪沉积或肥胖没有增加(10,13). 一种重要的ATGL调节机制是CGI-58(比较基因识别58),它在基础条件下与脂滴相关结构蛋白紫苏素A隔离,形成一种非活性复合物,并且不能与ATGL结合。在高能量需求期间,脂解介质,如最重要的儿茶酚胺和利钠肽,与各自的脂肪细胞受体、β-肾上腺素受体(β-AR)和利钠素受体A(NPRA)结合,产生最终分别激活蛋白激酶A(PKA)和G(PKG)的信号,进而促进HSL和紫苏素A的磷酸化(图1),ATGL和HSL都负责TAG约95%的水解。ATGL代表CGI-58激活的唯一脂肪酶(12)以及那些CGI-58突变的患者由于不能激活ATGL而出现全系统脂肪沉积(14,15). 另一方面,G0S2(G0/S2开关基因2)已被确定为ATGL的主要选择性抑制剂(16). 胰岛素通过激活磷酸二酯酶3(可降低细胞内环腺苷酸水平)介导的强大的抗脂肪分解作用,从而抑制PKA活性,降低HSL和紫苏素磷酸化(7).
BAT公司
与白色脂肪细胞相比,棕色脂肪细胞含有多房脂滴,并富含线粒体,使其呈现棕色(17,18). 线粒体内膜解偶联蛋白1(UCP1)的高表达,通过解偶联ATP合成中的氧化磷酸化直接促进产热,以热量的形式耗散能量(19)UCP1是棕色脂肪活化的标志物。这些产热棕色脂肪细胞被认为来源于不同于白色脂肪细胞的细胞谱系,与心肌细胞共享谱系(20). BAT功能的特点是消耗能量(21)在很长一段时间内,功能显著的BAT被认为存在于新生儿中,随着年龄的增长,BAT迅速退化(22). 然而,BAT储存区位于成人,靠近主动脉和颈部锁骨上区域(23,24).
WAT的褐变
另一种类型的脂肪细胞,“brite”(棕色-白色)或“beige”脂肪细胞最近被鉴定出来。WAT仓库内出现米黄色脂肪细胞是对持续暴露于寒冷或β3-肾上腺素能刺激以及肿瘤相关因素的反应(25,26). 这些脂肪细胞被认为与白色脂肪细胞共享细胞谱系,但表达UCP1,并像棕色脂肪细胞一样消耗能量(23). 白到米色表型的渐进性转换或重塑被称为WAT褐变。在分子水平上,过氧化物酶体增殖物激活受体γ(PPARγ)、PPARγ辅激活物1-alpha(PGC-1α)和含有16个转录因子PR结构域(PDRM16)的转录事件调控分化为棕色脂肪细胞,这些转录事件与CCAAT/增强子结合蛋白C/EBPβ相互作用(27,28). 癌症患者中米色AT的扩张被认为是恶病质的重要驱动因素(29),稍后将在本次回顾中进行讨论。
癌症恶病质中AT丢失
AT耗竭在癌症恶病质的发展和进展中起着新的作用。在恶病质的实验模型中,AT的损失出现在骨骼肌质量和食物摄入减少之前(30,31). 同样,对主要为胃肠道癌症患者(n=311)的纵向身体成分(双能X射线吸收法)研究(32)显示体脂损失比瘦肉组织发生得更快、更早,且主要发生在躯干,其次是腿部和手臂。另一项对患有各种实体瘤的晚期癌症患者的研究表明,在死亡前7个月开始,AT的减少速度加快,死亡前2个月的平均减少率为29%(33). 在本研究中,AT损失与血浆磷脂FA的损失同时发生,是生存的预测因素。研究还表明,AT库的缩小是由于脂肪储备的耗尽导致脂肪细胞尺寸显著缩小,而不是由于细胞数量的减少(细胞死亡)(34-37). 癌症恶病质中AT丢失的机制被归因于脂解活性和脂质利用的增加(37)而其他机制,如脂肪生成受损和脂肪生成也可能起作用
脂肪分解活性增加和AT肌肉串话的证据
越来越多的证据表明,脂肪分解增强是癌症恶病质中AT丢失的核心。在小鼠肿瘤恶病质模型和恶病质癌症患者中观察到,通过空腹血浆甘油或脂肪酸与体脂的关系测量,脂肪分解率很高(25,26,38-42). 几种脂解酶和介质的高表达也表明脂解作用增强。恶病质癌症患者WAT中HSL mRNA和蛋白表达上调(25,26,40). 在一项研究中,汤普森等。表明皮下WAT中HSL mRNA增加了两倍,这与血清TAG和游离FA水平的两倍升高显著相关(40). 在另一项研究中,癌症患者的体重减轻伴随着HSL表达的增加,并且皮下WAT脂肪细胞中儿茶酚胺和利钠肽的脂肪分解作用增加了2-3倍,而WAT完全被HSL特异性抑制剂阻断(25). 达斯等。在两种小鼠恶病质模型中,ATGL活性增加与肿瘤生长和WAT丢失相关,癌症患者内脏WAT中HSL和ATGL增加与BMI呈负相关(38). 在功能研究中,ATGL基因敲除小鼠被证明可以防止WAT脂肪分解(38). 除了预防WAT丢失外,一项有趣的观察是骨骼肌质量的保持和肌肉分解代谢活动的预防,这表明AT和肌肉在癌症恶病质中存在重要的相互作用。HSL基因敲除小鼠对脂肪和肌肉损失也表现出类似的抵抗力,但程度较小(38).
在进行性恶病质期间,一些肿瘤和/或宿主衍生因子与AT耗竭有关(三,38,43-46). 这些因子包括炎症细胞因子,如肿瘤坏死因子α(TNFα)、白细胞介素(IL)-1、IL-6以及脂质动员因子锌α2-糖蛋白(ZAG)。此外,儿茶酚胺(小鼠和人类)和利钠肽(人类)在癌症恶病质中具有更高的诱导脂肪分解的能力。在Das的研究中等。在癌症恶病质的早期和中期,当食物摄入正常时,促炎细胞因子和ZAG水平升高(38). 脂溶性受体β1-AR在恶病质癌患者WAT中的表达较高,β1-AR蛋白的表达与HSL呈正相关(26). 研究表明,ZAG的表达增强并刺激啮齿动物脂肪细胞的脂肪分解(47,48). 在恶病质患者中,恶病质癌症患者AT中ZAG表达增强与体重减轻相关,并与BMI呈负相关(35). 脂肪分解活性增加产生的多余脂肪酸随后被线粒体氧化,在动物模型和恶病质患者中观察到调节线粒体脂质氧化的基因上调(34,37). 在恶病质患者的AT中,脂肪细胞特异性基因细胞死亡诱导DNA断裂因子-α样效应器A(CIDEA)的表达增加,该效应器参与调节脂肪分解和刺激FA氧化,已被证明可导致低基础脂肪分解(49). 癌症恶病质脂肪细胞中CIDEA的低表达和HSL和ATGL的高表达使得这些细胞在激素刺激后更容易激活脂解(9).
癌症恶病质中WAT褐变与适应性产热
长期以来,人们一直怀疑癌症患者的棕色脂肪与癌症恶病质中REE增加之间的关系(三,50). Cachetic C26结肠癌荷瘤小鼠的BAT阳性位点数高于18氟脱氧葡萄糖正电子发射断层扫描(18F-FDG PET),与非肿瘤小鼠相比,表明在恶病质中起作用(51). 在人类中,18一项研究显示,与年龄匹配的健康对照组相比,F-FDG PET研究显示癌症患者的BAT增加(50)而另一项研究发现,大多数成年人存在BAT,癌症患者和对照组之间没有差异(52). 因此,需要进行精心设计的研究,以了解BAT在人类癌症恶病质中的作用。
最近,癌症恶病质领域的一个重大进展是,人们认识到白色脂肪细胞经历表型变化,转化为米色脂肪细胞(WAT褐变)在实验性肿瘤小鼠模型和癌症患者中,生热活性增加导致能量消耗加快和恶病质传播(17,18,29,53). 最近在各种癌症恶病质啮齿动物模型中进行的两项关键的独立研究进一步提供了癌症恶病症中肿瘤和WAT褐变之间的机制联系。这些研究证实了WAT中米色脂肪细胞的生成,UCP1 mRNA和蛋白的表达增加,产热活性增加,是癌症中AT和骨骼肌消瘦发展的早期事件(17,18).
在Spiegelman小组的研究中,甲状旁腺激素相关肽(PTHrP)在脂肪细胞褐变中起着重要作用(17). 在LLC小鼠中注射抗PTHrP抗体可显著降低脂肪细胞中UCP1的表达,降低能量消耗以及AT和肌肉损失的严重程度,但并未完全抑制其表达(17)表明WAT褐变涉及其他因素。该研究还证明了棕色脂肪生成的转录调节因子如Prdm16和Pgc1α的表达增加,并证明在Prdm16缺陷的LLC小鼠中UCP1的表达受损,AT损失受到抑制(17)类似于另一项研究表明,缺乏Prdm16的小鼠能够抵抗褐变(54). 此外,很大一部分肺癌和结肠癌患者(47名患者中的17名)检测到PTHrP水平,这与低瘦体重和高REE相关(17).
在第二项研究中,Petruzzelli及其同事表现出更高的UCP1(UCP1)几种癌症恶病质小鼠模型中WAT表达和IL-6表达增加(18). 与移植了不表达IL-6的肿瘤细胞的小鼠相比,移植了表达IL-6肿瘤细胞的鼠体重显著减轻,使用IL-6阻断抗体或将黑色素瘤细胞移植到IL-6受体缺乏的小鼠体内减少了但没有完全抑制恶病质(18). 使用拮抗剂阻断β3肾上腺素能受体也能显著降低小鼠恶病质的发生,这与米色细胞中UCP1表达水平降低有关(18). 此外,小组发现UCP1(UCP1)结肠癌恶病质患者8份人类AT样本中有7份表达,而20名无恶病质的患者无表达(18).
脂肪生成和脂肪生成减少
除了脂肪分解外,脂肪生成受损以及脂肪细胞合成和储存脂质的能力也可能导致AT丢失。在各种癌症恶病质模型中已经证明了脂肪生成转录因子的表达减少,并与脂肪细胞大小的减少有关(34,55)和较高的TNF-α表达(34). 在动物肿瘤模型和恶病质癌症患者的AT中,脂肪细胞脂肪生成酶的表达降低,如脂肪酸合成酶(FAS)(30,56,57)肝脏脂肪生成增加和高甘油三酯血症(58). 许多动物研究也表明癌症中LPL活性降低(56,58-61). 一项对结直肠癌患者的研究发现,与远端AT相比,肿瘤附近内脏AT的LPL和FAS活性降低(57). 胰岛素敏感性降低在人类和动物癌症恶病质模型中普遍存在(25,46)并且可能通过脂肪生成信号的丧失和对脂肪分解途径的抑制性信号的去除而导致AT损失(图1). 需要更多的研究来确定脂肪生成和脂肪生成在癌症恶病质不同阶段的作用。
多种因素似乎参与了癌症恶病质的发展和进展。肿瘤反应中产生的促炎细胞因子以及肿瘤衍生因子直接或通过它们与参与能量调节的神经内分泌通路的相互作用影响AT。进一步讨论了影响AT的一些因素。
细胞因子
TNF公司-在癌症恶病质的啮齿动物模型中,α水平已被证明升高(31,38,62). 在小鼠模型中,腹腔注射表达TNF-α的癌细胞可促进体重减轻,而注射中和TNF-β抗体可避免WAT和瘦体重的减少(63,64). TNF-α通过多种途径刺激脂肪分解,包括通过p42/44丝裂原活化蛋白(MAP)激酶介导的胰岛素受体信号失活,从而抵消胰岛素的抗脂肪分解活性(65). TNF-α还通过减少紫苏素的产生促进脂肪分解,紫苏素保护脂肪细胞免受脂肪分解(65). 目前,TNF-α在人类癌症恶病质中的作用尚不清楚。血清TNF-α水平差异很大,大多数与体重减轻无关(三,25). 此外,抗肿瘤坏死因子α抗体的试验没有显示出任何益处,这表明仅以肿瘤坏死因子为靶点并不足以预防恶病质(66,67).
伊利诺伊州-6癌症恶病质动物模型中的水平增加(18,31,38,62,68)以及恶病质癌症患者(69-71),并且在肿瘤模型和癌症患者中使用抗IL-6单克隆抗体可以抑制恶病质(18,68,69). IL-6降低3T3-L1脂肪细胞中LPL活性以及周苷和PPARγmRNA的表达。如前所述,除了增强脂肪分解途径外,IL-6和其他因素还参与WAT褐变和BAT中脂质代谢的放松调节(53,72,73). 使用IL6阻断抗体或将黑色素瘤细胞移植到IL6受体缺陷小鼠中可以减少褐变和体重减轻,但不能完全抑制恶病质(18).
肿瘤因子
锯齿形是一种分泌的可溶性蛋白,在几种恶性肿瘤中过度表达(74)以及WAT、BAT和心脏等组织中(75,76). Tisdale及其同事发现了一种脂质流动因子(LMF),该因子与从恶病质诱导MAC16肿瘤小鼠的血清以及恶病质癌症患者的尿液和血清中鉴定的ZAG蛋白相同(77,78)ZAG的表达与啮齿动物脂肪细胞中脂肪分解增加有关,导致AT和体重减轻(47,48,79,80). 研究表明,体重减轻的增加与MAC16肿瘤小鼠WAT和BAT中ZAG mRNA和蛋白的增加有关(48)和恶病质癌症患者的AT(35). 然而,在两项癌症研究中,循环ZAG水平与体重或脂肪减少无关(35,81).
ZAG诱导的脂肪分解被认为与β-脂肪细胞中的AR(79)通过刺激GTP依赖过程中的腺苷酸环化酶(47),以及提升HSL(35)和ATGL活动(38). 虽然ZAG在野生型和ATGL基因敲除小鼠中都有表达,但只有野生型小鼠表现出恶病质(38). ZAG的表达似乎受糖皮质激素和SNS的调节。糖皮质激素通过增加ZAG表达来增加脂肪分解活性(82,83). 恶病质癌症啮齿动物模型(84)和癌症患者(85),血浆皮质醇水平升高与AT-ZAG表达升高和脂解升高有关。地塞米松和aβ3激动剂BRL 37344增加3T3-L1脂肪细胞中ZAG mRNA水平并刺激脂肪分解(83). 地塞米松的脂解活性被抗ZAG单克隆抗体阻断,表明地塞米森介导的脂解是通过诱导ZAG表达实现的。选择性β3-AR受体拮抗剂也完全减弱了地塞米松的作用,这表明产生的ZAG进入培养基并在细胞外发挥作用β3-银币(83).
甲状旁腺激素在许多肿瘤中过度表达,最近发现其在循环中的存在与转移癌患者更大程度的消瘦相关(17). PTHRP和PTH信号通过PTH受体传递,PTH受体是一种G蛋白偶联受体(GPCR),与β肾上腺素能受体一样,它可以激活环AMP依赖的PKA通路。一种特异性抗体中和PTHrP可减轻肿瘤小鼠AT和骨骼肌的消耗,并且AT中缺乏PTHR的小鼠对恶病质具有抵抗力(17). 因此,PTH/PTHrP通路可能是恶病质治疗的重要靶点。
热原性脂肪细胞分化的转录调控因子
UCP1基因的转录调控是脂肪细胞分化为产热棕色和米色脂肪细胞过程中的关键事件。在分子水平上,PPARy、PDRM16、PGC1α和C/EBPβ等多种转录因子调节棕色脂肪细胞特异性基因程序,β3-肾上腺素能受体信号通路下游(27,28). 在LLC小鼠中,脂肪细胞中UCP1表达增加,PDRM16和PGC1α表达增加(17)PRDM16缺陷小鼠UCP1表达/褐变受损,AT损失受到抑制(17,54). 因此,靶向抑制PRDM16和其他调节因子的途径可能会带来新的治疗途径。
应激激素和β肾上腺素能刺激与AT消耗
众所周知,由禁食、运动和其他激素调节的儿茶酚胺活性可通过β-AR(β1、β2和β3)激活PKA以诱导脂肪分解,还参与BAT产热和WAT褐变效应(7,86-90). 胃肠道癌症患者的皮下WAT显示,恶病质患者的β1-AR mRNA和蛋白表达显著高于癌症对照组和非癌症减肥对照组(26). 在本研究中,β1-AR蛋白的表达与脂肪分解率和HSL蛋白的表达呈正相关,而其他受体如β2-、β3和α2-在恶病质组中没有改变(26). 然而,在啮齿动物模型中,β3-AR被认为是白色和棕色脂肪细胞的主要受体(91)ZAG通过与该受体相互作用促进脂肪分解(79,83). 服用β3-AR激动剂可显著增加WAT脂肪分解和BAT产热,而激动剂对β3-AR缺乏小鼠无影响(92,93). β-肾上腺素能张力增加与恶病质和肥胖的WAT褐变有关。肥胖研究表明,中枢神经系统,尤其是下丘脑,是褐变的重要调节器(94)需要进行研究,以探索在癌症恶病质中的类似作用。
AT在癌症恶病质中的作用已演变为一个动态过程,在此过程中,来自肿瘤和宿主的多种因素导致AT脂质代谢的改变,特别是由于米黄色/棕色脂肪细胞的转化而增加脂肪分解和浪费能量(图2). 此外,由于肌肉损失似乎发生在WAT脂肪分解的下游,AT和肌肉损失之间存在重要的串扰。虽然已经取得了很大进展,但显然有必要进行更多的研究,以更好地了解癌症恶病质不同阶段AT改变的分子机制,最终目标是能够开发出改善这种状况的干预措施。正在进行的癌症恶病质人体试验似乎很有希望,但没有一项针对AT在癌症恶病症中的作用。目前,两个潜在的治疗领域包括抑制AT脂解活性的关键成分和驱动因素以及白-米转换。这些疗法可能对肌肉质量产生额外的有益下游影响,并可能改善患者报告的结果,如身体功能和握力。
致谢
没有。
利益冲突:作者没有利益冲突需要声明。
工具书类
- 曹德祥,吴国华,张斌,等。新发现癌症患者的静息能量消耗和身体成分。《临床营养学》2010;29:72-7. [交叉参考] [公共医学]
- Fearon K,Arends J,Baracos V.了解癌症恶病质的机制和治疗选择。Nat Rev Clin Oncol 2013;10:90-9. [交叉参考] [公共医学]
- 蒂斯代尔MJ。导致癌症恶病质的分子途径。生理学2005;20:340-8. [交叉参考] [公共医学]
- Fearon K、Strasser F、Anker SD等。癌症恶病质的定义和分类:国际共识。柳叶刀Oncol 2011;12:489-95. [交叉参考] [公共医学]
- Cinti S.脂肪器官:脂肪组织的形态学观点。营养学会2001年;60:319-28. [交叉参考] [公共医学]
- Nielsen TS、Jessen N、Jorgensen JO等。脂肪组织脂解的解剖:代谢疾病的分子调控和意义。《分子内分泌杂志》2014;52:R199-222。[交叉参考] [公共医学]
- Arner P.人类脂肪细胞脂肪分解:生物化学、调节和临床作用。最佳实践研究临床内分泌代谢。2005;19:471-82. [交叉参考] [公共医学]
- Lass A、Zimmermann R、Oberer M等。脂解-一种高度调节的多酶复合物介导细胞脂肪储存的分解代谢。2011年血脂研究进展;50:14-27. [交叉参考] [公共医学]
- Arner P,Langin D.脂解在脂质周转、癌症恶病质和肥胖诱导的胰岛素抵抗中的作用。2014年内分泌代谢趋势;25:255-62. [交叉参考] [公共医学]
- Haemmerle G、Lass A、Zimmermann R等。缺乏脂肪甘油三酯脂肪酶的小鼠脂肪分解缺陷和能量代谢改变。科学2006;312:734-7. [交叉参考] [公共医学]
- Fischer J、Lefevre C、Morava E等。编码脂肪甘油三酯脂肪酶(PNPLA2)的基因在伴有肌病的中性脂质沉积病中发生突变。Nat Genet 2007;39:28-30. [交叉参考] [公共医学]
- Schweiger M、Schreiber R、Haemmerle G等。脂肪甘油三酯脂肪酶和激素敏感脂肪酶是脂肪组织三酰甘油分解代谢的主要酶。生物化学杂志2006;281:40236-41。[交叉参考] [公共医学]
- Okazaki H、Osuga J、Tamura Y等。缺乏激素敏感脂肪酶的脂解:调节不同脂肪酶共同机制的证据。糖尿病2002;51:3368-75. [交叉参考] [公共医学]
- Lefèvre C、Jobard F、Caux F等。Chanarin-Dorfman综合征中编码酯酶/脂肪酶/硫酯酶亚家族新蛋白的基因CGI-58的突变。《美国人类遗传学杂志》2001年;69:1002-12. [交叉参考] [公共医学]
- Schweiger M、Lass A、Zimmermann R等。中性脂质沉积病:脂肪甘油三酯脂肪酶/PNPLA2或CGI-58/ABHD5突变引起的遗传疾病。美国生理内分泌代谢杂志2009;297:E289-296。[交叉参考] [公共医学]
- Yang X,Lu X,Lombes M,等。G(0)/G(1)开关基因2通过与脂肪甘油三酯脂肪酶的结合调节脂肪脂解。Cell Metab 2010;11:194-205. [交叉参考] [公共医学]
- Kir S、White JP、Kleiner S等。肿瘤衍生PTH相关蛋白引发脂肪组织褐变和癌症恶病质。《自然》2014;513:100-4. [交叉参考] [公共医学]
- Petruzzelli M、Schweiger M、Schreiber R等。从白色脂肪转变为棕色脂肪会增加癌症相关恶病质的能量消耗。Cell Metab 2014;20:433-47. [交叉参考] [公共医学]
- Puigserver P,Wu Z,Park CW,等。与适应性产热相关的核受体的冷诱导辅活化子。细胞1998;92:829-39. [交叉参考] [公共医学]
- Timmons JA、Wennmalm K、Larsson O等。肌源性基因表达特征确定棕色和白色脂肪细胞来源于不同的细胞谱系。美国国家科学院院刊2007;104:4401-6. [交叉参考] [公共医学]
- Giralt M,Villarroya F.白色,棕色,米色/棕色:不同的脂肪细胞具有不同的功能?内分泌2013;154:2992-3000. [交叉参考] [公共医学]
- Aherne W,Hull D.新生儿的棕色脂肪组织和产热。《病原菌杂志》1966;91:223-34. [交叉参考] [公共医学]
- Park A,Kim WK,Bae KH。来源于间充质干细胞的白色、米色和棕色脂肪细胞的区别。世界干细胞杂志2014;6:33-42. [交叉参考] [公共医学]
- Virtanen KA、Lidell ME、Orava J等。健康成年人的功能性棕色脂肪组织。2009年英国医学杂志;360:1518-25. [交叉参考] [公共医学]
- Agustsson T、Ryden M、Hoffstedt J等。癌症恶病质中脂肪分解增加的机制。癌症研究2007;67:5531-7. [交叉参考] [公共医学]
- 曹德祥,吴国华,杨泽安,等。β1肾上腺素受体在癌性恶病质脂肪分解增加中的作用。癌症科学2010;101:1639-45. [交叉参考] [公共医学]
- Ohno H、Shinoda K、Spiegelman BM等。PPARgamma激动剂通过稳定PRDM16蛋白诱导白棕色脂肪转化。Cell Metab 2012;15:395-404. [交叉参考] [公共医学]
- Seale P,Kajimura S,Yang W,等。用PRDM16测定棕色脂肪的转录控制。Cell Metab 2007;6:38-54. [交叉参考] [公共医学]
- Kir S,Spiegelman BM,恶病质与棕色脂肪:癌症中的燃烧问题。2016年癌症趋势;2:461-3. [交叉参考] [公共医学]
- Ishiko O,Nishimura S,Yasui T,等。与恶性肿瘤生长相关的脂肪组织的代谢和形态学特征。Jpn J癌症研究1999;90:655-9. [交叉参考] [公共医学]
- Byerley LO、Lee SH、Redmann S等。一种不同于锌α-2糖蛋白的新型血清因子的证据,该因子在恶病质早期发展中促进身体脂肪损失。营养癌2010;62:484-94. [交叉参考] [公共医学]
- Fouladiun M,Korner U,Bosaeus I等。接受姑息治疗的未经选择的癌症患者的身体成分和脂肪和瘦组织区域分布的时程变化——与食物摄入、代谢、运动能力和激素的相关性。癌症2005;103:2189-98. [交叉参考] [公共医学]
- Murphy RA、Wilke MS、Perrine M等。脂肪组织和血浆磷脂的丢失:与晚期癌症患者生存的关系。《临床营养学》2010;29:482-7. [交叉参考] [公共医学]
- Bing C、Russell S、Becket E等。癌症恶病质中的脂肪萎缩:荷瘤小鼠脂肪组织的形态学和分子分析。英国癌症杂志2006;95:1028-37. [交叉参考] [公共医学]
- Mracek T、Stephens NA、Gao D等。皮下脂肪组织增强的ZAG生成与胃肠道癌症患者的体重减轻有关。英国癌症杂志2011;104:441-7。[交叉参考] [公共医学]
- Rydén M、Agustsson T、Laurencikiene J等。脂解——不是炎症、细胞死亡或脂肪生成——参与了癌症恶病质中脂肪组织的丢失。癌症2008;113:1695-704. [交叉参考] [公共医学]
- Dahlman I、Mejhert N、Linder K等。脂肪组织途径参与癌症恶病质体重减轻。英国癌症杂志2010;102:1541-8. [交叉参考] [公共医学]
- Das SK,Eder S,Schauer S等。脂肪甘油三酯脂肪酶导致癌症相关恶病质。科学2011;333:233-8. [交叉参考] [公共医学]
- Shaw JH,Wolfe RR。脓毒症患者和胃肠道癌患者的脂肪酸和甘油动力学。葡萄糖输注和肠外喂养的反应。Ann Surg 1987;205:368-76. [交叉参考] [公共医学]
- Thompson MP、Cooper ST、Parry BR等。癌症患者脂肪组织中激素敏感脂肪酶mRNA表达增加。1993年生物化学与生物物理学学报;1180:236-42. [交叉参考] [公共医学]
- Legaspi A、Jeevanandam M、Starnes HF Jr等。癌症患者的全身脂质和能量代谢。代谢1987;36:958-63. [交叉参考] [公共医学]
- Gercel-Taylor C、Doering DL、Kraemer FB等。卵巢癌患者正常全身脂质代谢的异常。1996年妇科肿瘤;60:35-41. [交叉参考] [公共医学]
- Argilés JM,Busquets s,Lopez-Soriano FJ。癌症恶病质的抗炎治疗。欧洲药理学杂志2011;668补充1:S81-86。[交叉参考] [公共医学]
- Mantovani G,Maccio A,Mura L等。不同部位晚期癌症患者的血清瘦素和促炎细胞因子水平。《分子医学杂志》(Berl)2000;78:554-61. [交叉参考] [公共医学]
- Torti FM、Dieckmann B、Beutler B等。巨噬细胞因子抑制脂肪细胞基因表达:体外恶病质模型。科学1985;229:867-9. [交叉参考] [公共医学]
- Fearon KC,Glass DJ,Guttridge DC。癌症恶病质:介质、信号和代谢途径。Cell Metab 2012;16:153-66. [交叉参考] [公共医学]
- Hirai K、Hussey HJ、Barber MD等。从癌症患者尿液中分离出的脂质流动因子的生物学评价。1998年癌症研究;第58:2359-65页。[公共医学]
- Bing C、Bao Y、Jenkins J等。Zinc-alpha 2-糖蛋白是一种脂质动员因子,在脂肪细胞中表达,在患有癌症恶病质的小鼠中上调。美国国家科学院院刊2004;101:2500-5. [交叉参考] [公共医学]
- Nordström EA、Ryden m、Backlund EC等。细胞死亡诱导DFFA(DNA片段化因子-α)样效应剂A(CIDEA)在脂肪细胞脂解和肥胖中的人类特异性作用。糖尿病2005;54:1726-34. [交叉参考] [公共医学]
- Shellock FG,Riedinger MS,Fishbein MC。癌症患者的棕色脂肪组织:癌症诱导的恶病质的可能原因。《癌症研究与临床肿瘤学杂志》1986;111:82-5. [交叉参考] [公共医学]
- Fueger BJ、Czernin J、Hildebrandt I等。动物操作对小鼠18F-FDG PET研究结果的影响。2006年《Nucl Med杂志》;47:999-1006. [公共医学]
- Lee P、Greenfield JR、Ho KK等。成人棕色脂肪组织患病率和代谢意义的批判性评估。美国生理内分泌代谢杂志2010;299:E601-606。[交叉参考] [公共医学]
- Tsoli M、Moore M、Burg D等。棕色脂肪组织的生热激活和与小鼠癌症恶病质相关的脂质代谢失调。2012年癌症研究;72:4372-82. [交叉参考] [公共医学]
- Cohen P、Levy JD、Zhang Y等。PRDM16和米色脂肪的消融会导致代谢功能障碍和皮下脂肪向内脏脂肪的转换。细胞2014;156:304-16. [交叉参考] [公共医学]
- Batista ML Jr、Neves RX、Peres SB等。癌症恶病质发展过程中脂肪组织的非均质时间依赖性反应。《内分泌杂志》2012;215:363-73. [交叉参考] [公共医学]
- Lanza-Jacoby S、Lansey SC、Miller EE等。大鼠肿瘤生长过程中脂蛋白脂肪酶和脂肪酶活性的顺序变化。1984年癌症研究;44:5062-7之间。[公共医学]
- Notarnicola M、Miccolis A、Tutino V等。结直肠癌患者肿瘤周围脂肪组织中的低水平脂肪酶。脂质2012;47:59-63. [交叉参考] [公共医学]
- López-Soriano J,Argiles JM,Lopez-Sariano FJ。吉田AH-130腹水肝癌大鼠的脂质代谢。分子细胞生物化学1996;165:17-23. [交叉参考] [公共医学]
- López-Soriano J,Argiles JM,Lopez-Sariano FJ。吉田AH-130腹水肝癌诱导大鼠脂蛋白脂肪酶活性和脂质血症的顺序变化。1997年癌症快报;116:159-65. [交叉参考] [公共医学]
- Lopez-Soriano J、Argiles JM、Lopez-Soriano FJ。吉田AH-130腹水肝癌大鼠的明显高脂血症。生物化学Soc Trans 1995;23:492秒[交叉参考] [公共医学]
- Thompson MP、Koons JE、Tan ET等。修饰脂蛋白脂肪酶活性、脂肪生成速率和脂肪分解是导致携带包皮腺肿瘤ESR-586的C57BL小鼠脂质耗竭的因素。1981年癌症研究;41:3228-32. [公共医学]
- 陈淑珍、邱志刚。在小鼠模型中,GH、胰岛素和吲哚美辛联合治疗可缓解癌症恶病质。《内分泌杂志》2011;208:131-6. [交叉参考] [公共医学]
- Oliff A、Defeo-Jones D、Boyer M等。分泌人TNF/恶病质的肿瘤诱导小鼠恶病质。细胞1987;50:555-63. [交叉参考] [公共医学]
- Sherry BA,Gelin J,Fong Y,等。抗坏血素/肿瘤坏死因子-α抗体可减轻肿瘤模型中恶病质的发展。FASEB J 1989;3:1956-62. [交叉参考] [公共医学]
- Langin D,Arner P.TNFalpha和中性脂肪酶在人类脂肪组织脂肪分解中的重要性。2006年内分泌代谢趋势;17:314-20. [交叉参考] [公共医学]
- Jatoi A、Ritter HL、Dueck A等。英夫利昔单抗治疗老年和/或表现不佳的非小细胞肺癌患者癌症相关体重减轻的安慰剂对照双盲试验(N01C9)。肺癌2010;68:234-9. [交叉参考] [公共医学]
- Jatoi A、Dakhil SR、Nguyen PL等。依那西普治疗癌症厌食/体重减轻综合征的安慰剂对照双盲试验:来自North Central cancer Treatment Group的N00C1结果。癌症2007;110:1396-403. [交叉参考] [公共医学]
- Strassmann G、Fong M、Kenney JS等。白细胞介素6参与实验性癌症恶病质的证据。《临床投资杂志》1992年;89:1681-4. [交叉参考] [公共医学]
- Weidle UH,Klostermann S,Eggle D等。白细胞介素6/白细胞介素6受体相互作用及其作为治疗恶病质和癌症靶点的作用。癌症基因组蛋白质组学2010;7:287-302. [公共医学]
- Maltoni M、Fabbri L、Nanni O等。肿瘤坏死因子α和其他细胞因子的血清水平与癌症患者的体重减轻和厌食症无关。1997年癌症支持护理;5:130-5. [交叉参考] [公共医学]
- Staal-van den Brekel AJ、Dentener MA等。肺癌患者静息能量消耗增加和体重减轻与全身炎症反应相关。临床肿瘤学杂志1995;13:2600-5. [交叉参考] [公共医学]
- Inadera H、Nagai S、Dong HY等。结肠-26接种癌症恶病质模型中脂质耗尽因子的分子分析。国际癌症杂志2002;101:37-45。[交叉参考] [公共医学]
- Soda K、Kawakami M、Kashii A等。结肠26腺癌引起的癌症恶病质表现并非完全归因于白细胞介素-6。国际癌症杂志1995;62:332-6. [交叉参考] [公共医学]
- Albertus DL、Seder CW、Chen G等。AZGP1自身抗体预测生存率,组蛋白去乙酰化酶抑制剂增加肺腺癌的表达。《胸科肿瘤杂志》2008;3:1236-44. [交叉参考] [公共医学]
- Hale LP、Price DT、Sanchez LM等。锌α-2-糖蛋白由恶性前列腺上皮表达,可能作为前列腺癌的潜在血清标志物。2001年临床癌症研究;7:846-53. [公共医学]
- Díez-Itza I、Sanchez LM、Allende MT等。乳腺癌细胞液中Zn-alpha 2-糖蛋白水平及其与临床、组织学和生化参数的相关性。《欧洲癌症杂志》1993;29A:1256-60。[交叉参考] [公共医学]
- Todorov PT、McDevitt TM、Meyer DJ等。肿瘤脂质流动因子的纯化和表征。1998年癌症研究;58:2353-8. [公共医学]
- McDevitt TM、Todorov PT、Beck SA等。小鼠和人类体内与恶病质诱导肿瘤相关的脂质流动因子的纯化和表征。1995年癌症研究;55:1458-63. [公共医学]
- Russell ST、Zimmerman TP、Domin BA等。锌-α2-糖蛋白诱导体外脂肪分解和体内脂肪损失。2004年生物化学与生物物理学学报;1636:59-68. [交叉参考] [公共医学]
- Russell ST、Tisdale MJ。二十碳五烯酸(EPA)对癌症恶病质患者脂肪组织中脂质动员因子表达的影响。2005年前列腺素-白细胞精华脂肪酸;72:409-14. [交叉参考] [公共医学]
- Rydén M、Agustsson T、Andersson J等。脂肪酸锌-α2-糖蛋白是癌症和非癌症状态下的分解代谢标记物。《国际医学杂志》2012;271:414-20. [交叉参考] [公共医学]
- Bing C,Mracek T,Gao D,等。锌-α2-糖蛋白:体脂质量的脂肪因子调节剂?国际J Obes(伦敦)2010;34:1559-65. [交叉参考] [公共医学]
- Russell ST、Tisdale MJ。糖皮质激素在癌症恶病质脂肪组织中诱导锌α2-糖蛋白表达中的作用。英国癌症杂志2005;92:876-81. [交叉参考] [公共医学]
- 龚凤英,邓建业,朱海江,等。脂肪酸合成酶和激素敏感脂肪酶在肝脏中的表达与锌-α2-糖蛋白诱导的肥胖小鼠体脂损失有关。《中国医学科学杂志》2010;25分169秒-75秒。[交叉参考] [公共医学]
- Knapp ML、al-Sheibani S、Riches PG等。与晚期乳腺癌患者体重减轻相关的激素因素。Ann Clin Biochem 1991;28:480-6. [交叉参考] [公共医学]
- Bouyekhf M,Rule DC,Hu CY.儿茶酚胺对低能量和高能量饮食绵羊脂肪组织中脂解和酯化的影响。营养生物化学杂志1993;4:80-5. [交叉参考]
- Petrovic N、Walden TB、Shablina IG等。附睾来源的白色脂肪细胞培养物的慢性过氧化物酶体增殖物激活受体γ(PPARgamma)激活揭示了一组具有耐热能力的含UCP1的脂肪细胞,其分子上与经典的棕色脂肪细胞不同。生物化学杂志2010;285:7153-64. [交叉参考] [公共医学]
- Waldén TB、Hansen IR、Timmons JA等。棕色、“棕色”和白色脂肪组织的新招募与非纯化分子特征。美国生理内分泌代谢杂志2012;302:E19-31。[交叉参考] [公共医学]
- Cannon B,Nedergaard J.Brown脂肪组织:功能和生理意义。生理学评论。2004;84:277-359. [交叉参考] [公共医学]
- Klein S,Wolfe RR.食管癌恶病质患者的全身脂肪分解和甘油三酯-脂肪酸循环。《临床投资杂志》,1990年;86:1403-8. [交叉参考] [公共医学]
- Langin D、Portillo MP、Saulnier-Blache JS等。各种哺乳动物白脂肪细胞中三种β-肾上腺素受体亚型共存。欧洲药理学杂志1991;199:291-301. [交叉参考] [公共医学]
- Susulic VS、Frederich RC、Lawitts J等。β3-肾上腺素能受体基因的靶向破坏。生物化学杂志1995;270:29483-92. [交叉参考] [公共医学]
- Grujic D、Susulic VS、Harper ME等。白色和棕色脂肪细胞上的β-肾上腺素能受体介导β-选择性激动剂诱导的能量消耗、胰岛素分泌和食物摄入效应。使用转基因和基因敲除小鼠的研究。生物化学杂志1997;272:17686-93. [交叉参考] [公共医学]
- Cao L,Choi EY,Liu X,等。下丘脑脂肪细胞轴的遗传和环境激活诱导的白到棕色脂肪表型转换。细胞Metab 2011;14:324-38. [交叉参考] [公共医学]
引用本文为:Dalal S.癌症恶病质中的脂质代谢。2019年Ann Palliat Med;8(1):13-23. doi:10.21037/apm.2018.10.01