牛胰蛋白酶抑制剂的结构已根据在125 K下收集的数据精确到1.1º的分辨率。II型晶体的空间群为P(P)212121具有一= 75.39(3),b条= 22.581(7),c(c)= 28.606 (9) Å (囊性纤维变性。 一= 74.1,b条= 23.4,c(c)=28.9℃)。通过约束最小二乘法最小化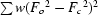 使用SHELXL公司93程序。随着模型的改进,加入了水分子,发现Gly57和Ala58这两个残基的电子密度异常清晰,这两个残留物在室温下基本上被遮蔽了。残基Glu7和Arg53的侧链在两个位置上用精确的占据因子建模。最终模型包含145.6个水分子,分布在167个位点上,一个磷酸基团无序分布在两个位点上。残基Arg1–Gly56中的Cα原子在室温和低温下的均方根差异为0.4Å。用各向异性和各向同性热参数对模型进行了改进,结果表明,原子位置没有显著差异。最终加权R(右)-因子打开F类2(水风险2)对于10–1.1°范围内的数据,各向异性模型和各向同性模型分别为35.9%和40.9%。常规R(右)-因素基于F类对于F类> 4σ(F类)分别为12.2%和14.6%,相当于所有数据的16.1%和18.7%。这些大的R(右)-因子差异未反映在R(右)(游离),分别为21.5(5)%和21.8(4)%,差异无统计学意义。这些结果,再加上精炼的相对直接性,清楚地突出了低温数据收集的好处。
使用SHELXL公司93程序。随着模型的改进,加入了水分子,发现Gly57和Ala58这两个残基的电子密度异常清晰,这两个残留物在室温下基本上被遮蔽了。残基Glu7和Arg53的侧链在两个位置上用精确的占据因子建模。最终模型包含145.6个水分子,分布在167个位点上,一个磷酸基团无序分布在两个位点上。残基Arg1–Gly56中的Cα原子在室温和低温下的均方根差异为0.4Å。用各向异性和各向同性热参数对模型进行了改进,结果表明,原子位置没有显著差异。最终加权R(右)-因子打开F类2(水风险2)对于10–1.1°范围内的数据,各向异性模型和各向同性模型分别为35.9%和40.9%。常规R(右)-因素基于F类对于F类> 4σ(F类)分别为12.2%和14.6%,相当于所有数据的16.1%和18.7%。这些大的R(右)-因子差异未反映在R(右)(游离),分别为21.5(5)%和21.8(4)%,差异无统计学意义。这些结果,再加上精炼的相对直接性,清楚地突出了低温数据收集的好处。