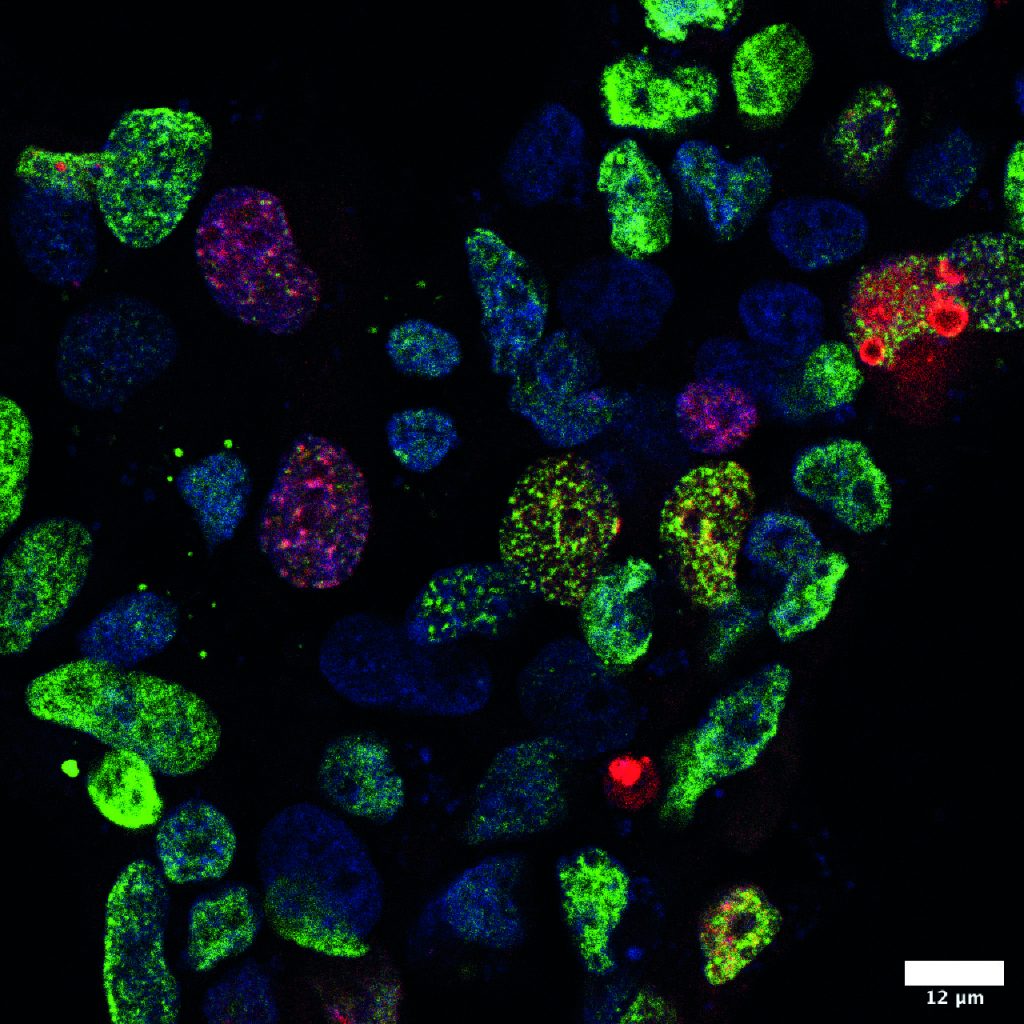
以前和现在的研究
泛素是一种76氨基酸多肽,是真核细胞中最丰富的蛋白质之一。在泛素化过程中,它与其他蛋白质共价连接,这通常会导致蛋白质降解,但也会改变改性蛋白质的功能。泛素化调节许多细胞过程,包括蛋白质周转、DNA修复、细胞分裂、水泡转运、自噬和先天免疫。泛素化的失调涉及许多重大人类疾病。泛素与蛋白质的连接是通过涉及E1、E2和E3酶的三个酶反应级联进行的,导致泛素C末端羧基通过异肽键与底物蛋白质中的赖氨酸残基连接。人类中有600多个基因编码E3泛素连接酶,这些酶构成人类基因组的重要部分。我们小组研究了人类和细菌来源的独特的、未被研究的泛素连接酶复合物的结构、功能和调节。
黑色素瘤相关抗原(MAGEs)-一个调节泛素连接酶的蛋白质家族
MAGE基因家族编码大约40种不同的蛋白质,它们共享一个共同的MAGE同源域。MAGE蛋白与几种神经发育障碍和肿瘤发生相关,与各种环泛素连接酶形成复合物,称为MAGE-RING连接酶(MRL),其靶向特定的细胞底物进行泛素化(Lee和Potts,2017年). MAGE蛋白在MRL复合物中的确切作用需要更好地理解,并且不清楚这些序列相似性为40-80%的蛋白如何能够识别各种RING蛋白。MAGE基因的错误调控或突变导致人类疾病的机制在大多数情况下仍然是一个谜。我们解决这些问题的方法包括对几种MAGE蛋白及其相关复合物进行结构、生化和功能检查。
我们的最新研究(Griffith-Jones等人,2024年)展示了癌症特异性MAGE-A4如何与其伙伴泛素连接酶RAD18相互作用。这为MAGE的许多特征提供了见解。下面列出了两个主要发现。
1) 我们发现MAGE-A4使用一个特殊的肽结合槽与其伴侣连接酶相互作用。我们分析的其他MAGE蛋白中似乎也保存了这个凹槽,这表明MAGE蛋白可能存在连接酶识别的共同机制。
2) MAGE-A4通过与RAD18结合,抑制RAD18的降解性自身泛素化,使其在细胞中稳定下来。
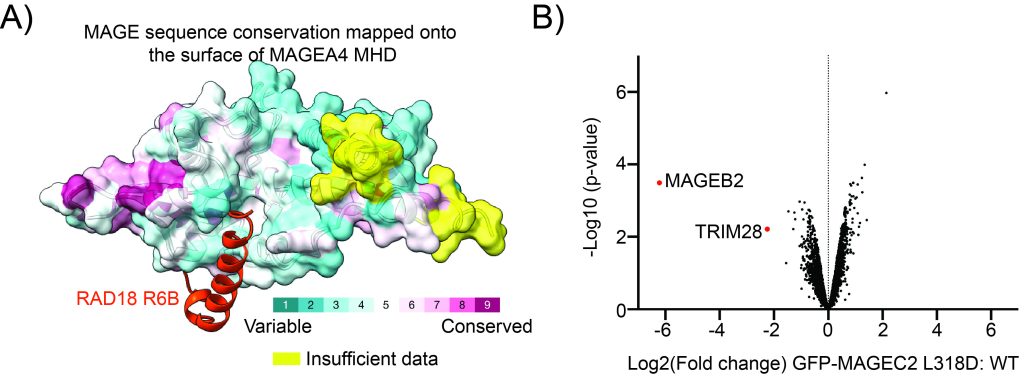
图:MAGE蛋白中的连接酶结合裂缝。A) MAGE-A4与泛素连接酶RAD18的短肽结合的AlphaFold模型。MAGE-A4在表面表征中被描绘,在映射到表面的MAGE蛋白中具有序列保守性。B) 火山图所示的定量质谱数据表明,MAGE-C2中等效沟的单点突变导致HEK细胞中与其伙伴泛素连接酶TRIM28的结合丧失。
我们正在进行的工作将建立在这些发现的基础上,在这方面,我们也在敏锐地探索其他与疾病相关的MAGE蛋白的分子和细胞机制。
一种识别泛素连接酶底物的简便方法
鉴于人类泛素连接酶-底物对领域存在巨大差距,有必要开发一种稳健但资源较少的方法来识别泛素连合酶的底物。我们开发了一种基于泛素特异性邻近性的标记方法,以选择性地将给定泛素连接酶的底物生物素化。我们的方法利用了E3-E2~Ub的酶中间态结构中观察到的E3-煤气催化结构域与泛素的接近性。通过将生物素连接酶BirA和Avi-tag变异体分别融合到候选E3连接酶和泛素,我们能够在变性条件下通过一步链霉亲和素下拉,特异性地富集真正的连接酶底物和潜在的新底物。在最近的一项研究中,我们成功地将我们的方法(Ub-POD)应用于三种不同的泛素连接酶(Mukhopadhyay等人,2023年)目前正计划将其系统地扩展到更多连接酶。我们还打算进一步提高该方法的特异性和效率。
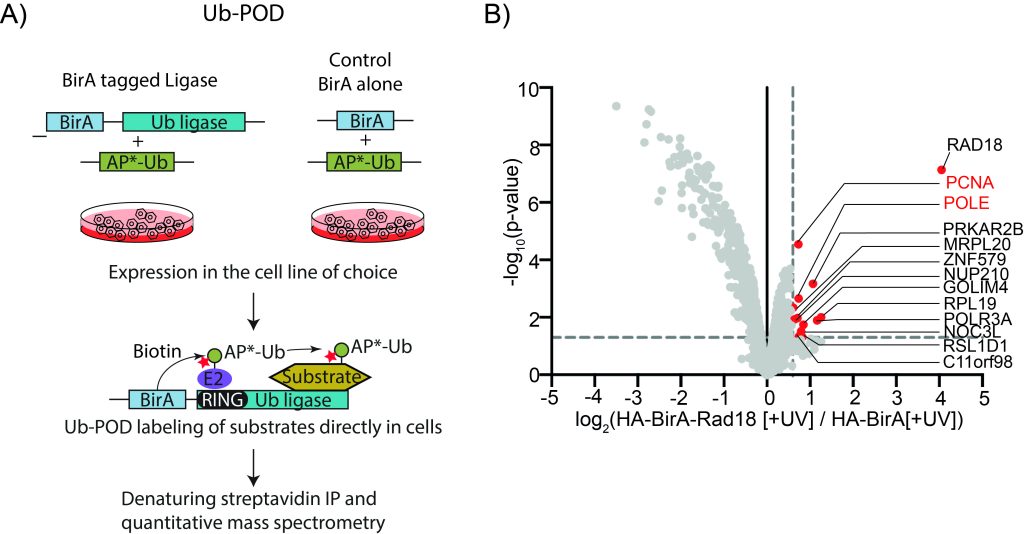
图:A) 识别泛素连接酶底物的Ub-POD方法概述。B) Ub-POD应用于泛素连接酶RAD18。火山图中的定量质谱数据显示已知和潜在新底物的识别。
利用主机泛化嗜肺军团菌
细菌没有泛素系统,但一些致病细菌已经发展出可以操纵宿主泛素系统的毒力因子(效应器)。在感染期间,这些效应器被分泌到宿主细胞中,使病原体避开宿主的免疫系统,并在宿主细胞质中建立成功的复制环境。军团菌通常存在于土壤和天然水源中,如果以气溶胶的形式吸入,会导致军团菌病,这是一种严重的肺炎。老年人和免疫系统受损的人有致命并发症的高风险。在感染期间,军团菌会向宿主的细胞液中分泌300多种效应物,以控制各种细胞吞噬事件,包括泛素信号系统。我们的研究重点是利用结构生物学、细胞生物学和蛋白质组学的工具,研究这些军团菌效应器如何与宿主的泛素系统相互作用。
我们的研究,以及其他人的研究,发现军团病的一种毒性效应物SdeA,与标准的三酶级联反应相比,使用了完全不同的机制将泛素附着到其底物上。(邱等,2016; Bhogaraju等人,2016年). SdeA介导的反应导致泛素的精氨酸-42通过磷酸核糖连接物附着到靶底物的丝氨酸上。这种将泛素连接到底物蛋白的独特过程包括形成磷酸二酯键,而不是典型的异肽键。目前尚不清楚这种独特形式的泛素化是否是由其他生物体内的酶进行的。我们研究了SidJ对这种不寻常形式的泛素化的调控,SidJ是军团菌的一种元效应器。SidJ以特定和及时的方式调节军团菌感染期间SdeA及其副产物引起的过度毒性。我们的研究发现,SidJ与宿主钙调蛋白合作,通过ATP依赖性谷氨酰化抑制SdeA的活性。SidJ与人钙调素复合物的低温电子显微镜(cryo-EM)结构揭示了钙调素如何激活SidJ变构。这种结构还证明SidJ有一个带有两个核苷酸结合囊的假激酶折叠(Bhogaraju等人,2019). 最近,我们使用低温电子显微镜测定了SidJ/Calmodulin与SdeA络合的两种催化中间态的结构(图1)。这揭示了一种新的谷氨酰化机制,该机制涉及通过赖氨酸AMP化对SidJ进行短暂的自我修饰(Adams等人,2021年). 在我们对军团菌其他泛素连接酶的研究中,我们确定了连接酶LubX与其底物和另一种军团菌SidH效应物复合体的低温电子显微镜结构。我们的结构表明,SidH具有一个tRNA结合位点,这对其细胞毒性很重要。我们正在通过合作,继续研究军团菌中的泛素信号,特别是在感染的情况下。
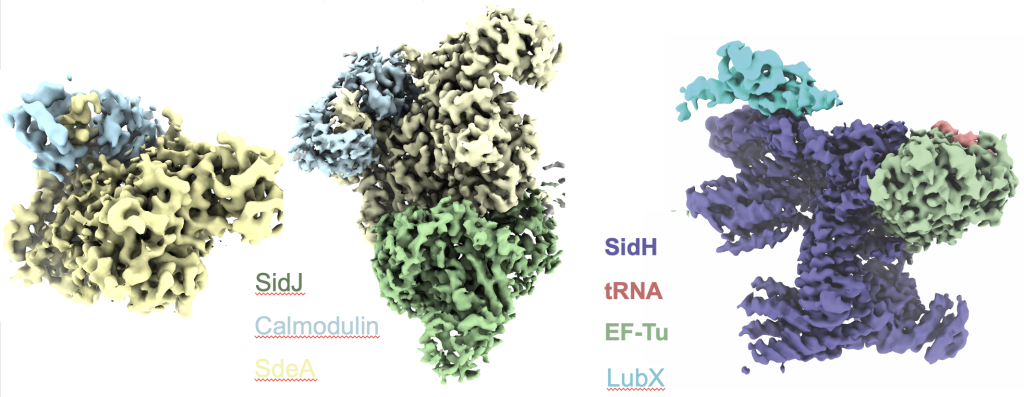
图:军团菌效应物复合物的低温电磁结构。左,SidJ与人钙调素复合物;中间,SidJ/Calmodulin/SdeA复合物;右图,SidH与细菌EF-Tu、tRNA和泛素连接酶LubX的复合物。
未来的项目和目标:
- 我们研究人类MRL复合物的目的是获得对相关人类疾病的分子理解,最终目标是提出精确的治疗靶点并在模型系统中验证它们。
- 我们将进一步开发Ub-POD并应用于广泛的泛素连接酶,并探索该方法在泛素以外的其他应用。
- 军团菌除了我们小组一直在研究的非经典泛素系统外,还有大量与宿主泛素系统相关的效应子。我们研究的目的是全面了解军团菌感染期间宿主泛素系统是如何被利用的,并寻找对抗军团菌病的潜在靶点。