在这里,我们描述了斑马鱼ENS的非神经元室,并确定了硬骨鱼EGC的常见和意外特性。具体而言,我们证明,在斑马鱼EGC中未检测到通常用于鉴定高等脊椎动物外周神经胶质细胞的标记,但EGC与其哺乳动物对应物具有相同的形态学特征和基因表达程序。然而,与哺乳动物肠胶质细胞不同,但根据脑RGCs的特性,斑马鱼EGCs的种群是动态的,在稳态过程中经历自我更新的增殖和神经元分化,这是由Notch信号调节的。我们的发现突显了脊椎动物肠神经胶质细胞的神经前体潜能体内并揭示了之前与大脑神经干细胞的意外相似性。
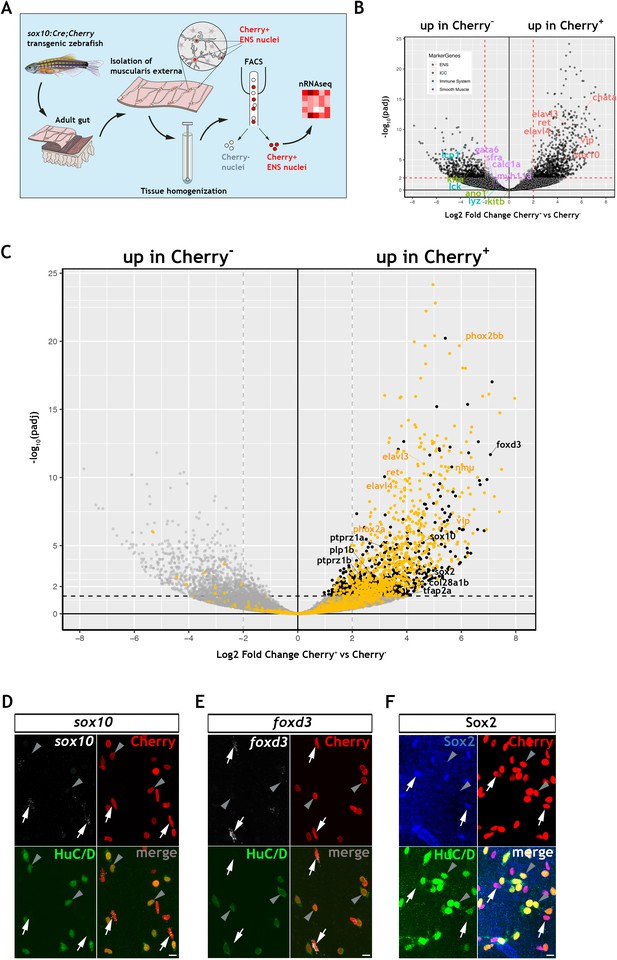
早期组织学研究表明,哺乳动物肠道胶质细胞与原生质星形胶质细胞非常相似,并表达中间丝GFAP,这是一种典型的星形胶质细胞标记物(杰森和米尔斯基,1980年;吕尔,2005). 进一步的EM分析揭示了啮齿动物肠道神经胶质网络的诊断超微结构特征(加贝拉,1981年). 扩展这些早期报道,我们和其他人已经确定了哺乳动物肠道神经胶质的四种形态亚型,它们与它们在肠道中的位置以及相对于肠壁神经节网络的位置相关(Boesmans等人,2015年;Gulbransen和Sharkey,2012年;哈纳尼和赖森巴赫,1994年). 我们目前的实验表明,哺乳动物肠道神经胶质细胞的所有主要形态和超微结构特征也都存在于Tg(her4.3:EGFP)+斑马鱼ENS的非神经元隔室,因此提供了强有力的证据,证明它代表硬骨ENS的EGC谱系。我们未能检测到通常用于鉴定哺乳动物肠道胶质细胞的胶质标记物(如GFAP和S100b)表明这些基因的表达可能不是脊椎动物ENS中运行的遗传程序的组成部分,而是表示为响应特定的局部线索而采用的EGC的动态生理状态。为了支持这一观点,GFAP是动态的,通常在哺乳动物EGC的亚群中检测到体内(Boesmans等人,2015年)GFAP和S100b在原代培养的人肠神经胶质细胞中表达增强,受到促炎刺激(Cirillo等人,2011年). 在炎症病理、感染或损伤后,确定这些神经胶质标记物是否也在斑马鱼EGCs中上调将是有趣的。
尽管未能检测到典型胶质细胞标记物的表达,但我们对斑马鱼EGC的转录组分析显示,硬骨鱼和哺乳动物肠道胶质细胞的基因表达谱有相当大的重叠。在这两个谱系表达的基因中,有编码早期NC细胞标记的基因sox10型,狐狸d3,tfap2a公司,斑马线2b和plp1(Hari等人,2012年;Knight等人,2003年;蒙代尔和拉博斯基,2011年;蒙代尔等人,2012年;Wang等人,2011年a;Weider和Wegner,2017年),PNS胶质特异性标记物col28a1b类(Grimal等人,2010年)以及干细胞调节器sox2和ptprz1a/b型(Belkind Gerson等人,2017;Fujikawa等人,2017年;Heanue和Pachnis,2011年). 在神经发育的背景下,这些基因的作用已被广泛研究(sox10型,狐狸d3,tfap2a公司,斑马线2b,维姆,sox2)和干细胞动力学(sox2,ptprz1a/b型)但它们对成年动物肠道神经胶质细胞的内环境稳定和功能的潜在贡献尚不清楚。我们认为,我们在硬骨鱼类和哺乳动物肠道神经胶质细胞之间鉴定的共享基因表达模块代表了进化保守的调节程序,对肠道生理学和ENS稳态至关重要,并强调脊椎动物EGC作为神经原性前体的潜力。
我们工作的一个意外发现是斑马鱼ENS中的非神经元室相对于其哺乳动物对应物的尺寸相对较小。一系列研究表明,胶质细胞调节CNS神经回路的突触活动,这表明,在进化过程中,星形胶质细胞的数量、大小和复杂性的增加促进了高等脊椎动物大脑神经处理能力的增强(Han等人,2013年;Oberheim等人,2006年). 也许哺乳动物的肠神经胶质细胞数量高于硬骨鱼类,也可能反映了脊椎动物进化过程中肠道神经回路功能复杂性的增加,以及EGC对维持上皮细胞内环境稳定的复杂肠道组织回路的调节范围的扩大,宿主防御与健康微生物群(Grubišić和Gulbransen,2017年).
一些报告已经证明,外周神经胶质细胞可以获得神经嵴干细胞(NCSCs)的特性,并产生不同的细胞类型。例如,与哺乳动物胚胎中生长的神经相关的雪旺细胞前体(SCP),除了产生成年动物的雪旺细胞谱系外,还作为多能祖细胞发挥作用,产生不同的细胞类型,包括间充质细胞和神经内分泌细胞、副交感神经细胞和黑素细胞(Parfejevs等人,2018年;Petersen和Adameyko,2017年). 与SCP的发育潜力相呼应,已经表达EGC分子标记的ENS祖细胞也能够产生肠神经元和成熟的肠神经胶质细胞(Cooper等人,2016年;Cooper等人,2017年;Lasrado等人,2017年). 除了这些研究外,越来越多的证据表明,成年动物的外周神经胶质细胞谱系可以获得NCSC特性,包括雪旺细胞、颈动脉体神经胶质和EGCs(Jessen等人,2015年;Pardal等人,2007年). 然而,人们普遍认为,损伤、感染或其他类型的应激(包括组织分离和培养)会诱导分化的胶质细胞重新编程为NCSC状态。因此,在哺乳动物中,当肌间神经丛受到化学损伤、血清素信号的药理激活或细菌性肠道感染时,EGC可能会经历有限的神经发生(Belkind-Gerson等人,2017年;Joseph等人,2011年;Laranjeira等人,2011年;Liu等人,2009年). 通过提供斑马鱼EGC的证据真诚地作为神经胶质细胞,也作为组成型ENS祖细胞体内我们的研究认为,哺乳动物肠神经胶质细胞在损伤和应激条件下的神经发生潜能反映了无羊膜脊椎动物早期的进化状态,其中相同的细胞类型表现出神经祖细胞和成熟胶质细胞的特性。尽管目前尚不清楚神经原潜能是否是硬骨骨EGC的独特特性,我们推测,低等脊椎动物的外周神经胶质细胞谱系代表了保留其发育选择,但通过获得有助于局部组织功能和体内平衡的额外专门功能来适应其所处的细胞环境的NCSC。理解支持NCSC特征保留的转录和表观遗传机制,同时允许个体发生期间的新功能适应,是基础生物学的一个令人兴奋的挑战,对生物医学研究具有实际意义。例如,确定驱动肠神经胶质细胞分化的分子机制体内将有助于制定策略,利用哺乳动物EGC固有的神经原潜能,恢复先天性或后天性肠道神经回路缺陷。
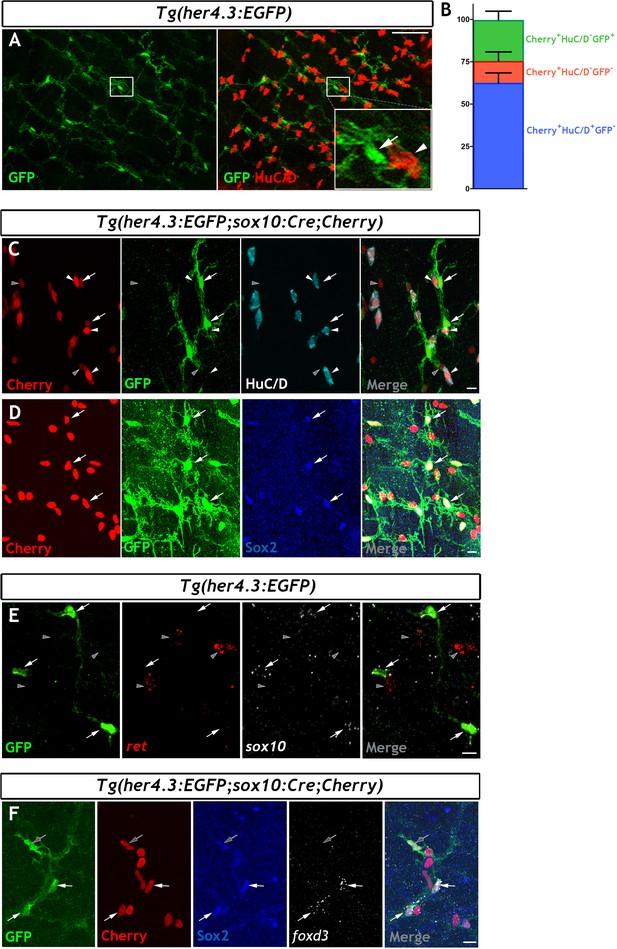
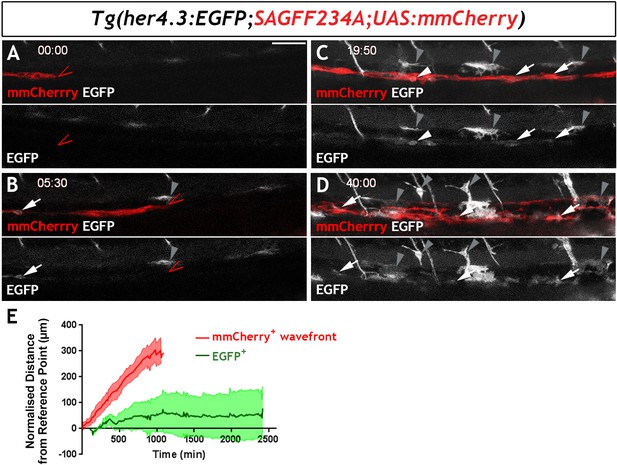
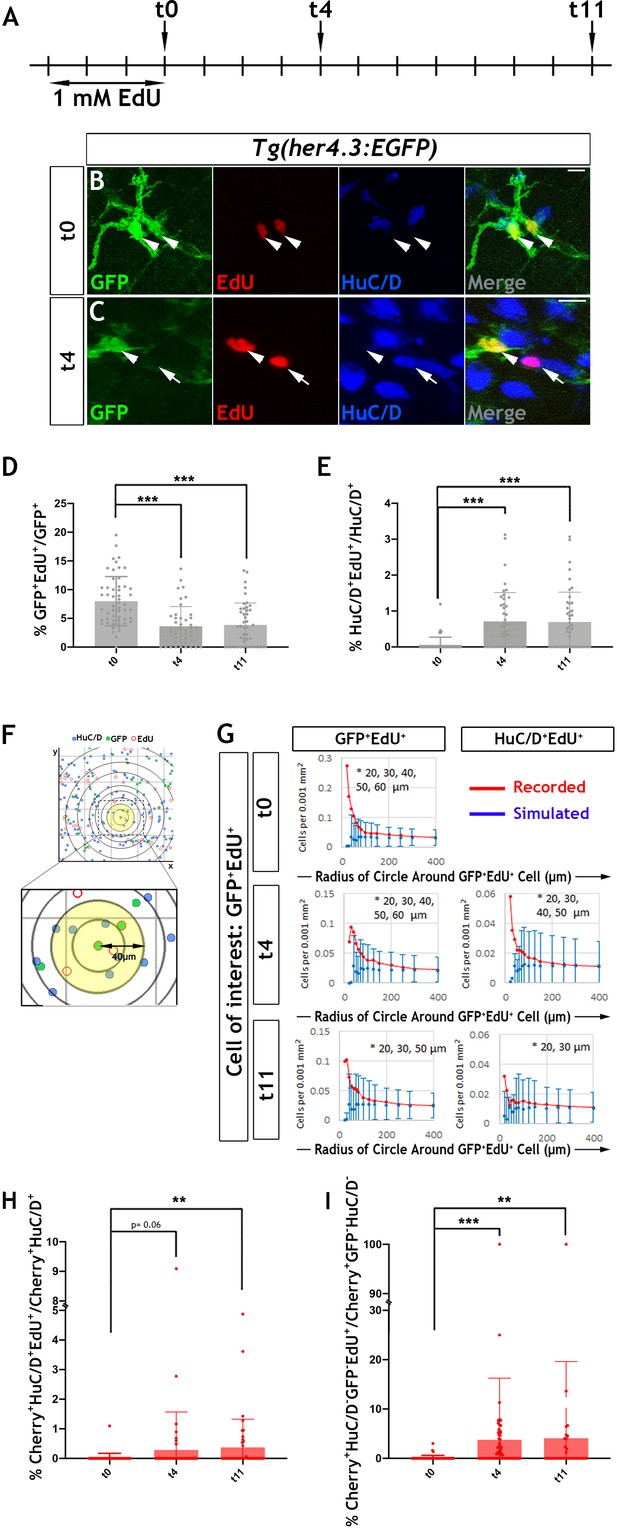
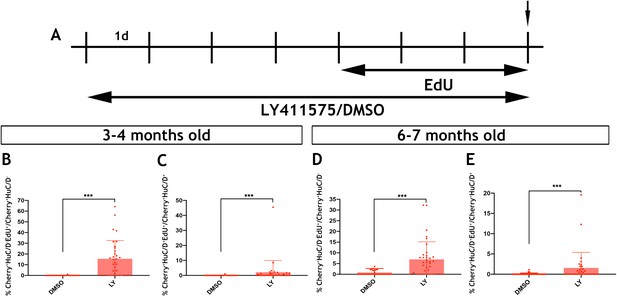
斑马鱼EGC融合了神经祖细胞和神经胶质细胞的特征,与RGC(广泛分布于硬骨脑中的神经干细胞)有着惊人的相似性,反映出其显著的神经生成和再生潜能(阿鲁尼和巴利·库伊夫,2016年;Than-Trong和Bally-Cuif,2015年),并承担通常归因于星形胶质细胞的功能(里昂和塔尔博特,2015年). RGC和EGC的相似性可能会超出常驻器官(大脑和肠道)对持续生长和特殊胶质细胞功能的需求所强加的粗略平价,并适用于控制其体内平衡和分化的特定细胞和分子机制。我们建议的模型(图6——补充图3)描述了成年斑马鱼EGC可用的神经原轨迹的关键阶段,反映了RGC向大脑皮层神经元的逐步分化(Than-Trong和Bally-Cuif,2015年;Than-Trong等人,2018年). 因此,与RGC类似,大多数EGC在稳定状态下保持静止(qEGC),但作为对未知信号的响应,其中一部分进入细胞周期,产生活性EGC(aEGC)。目前尚不清楚进入细胞周期的能力是否仅限于qEGC的一个子群。更一般地说,qEGC在多大程度上可以被分子细分为具有不同性质和功能的子集是未来研究的一个有趣的问题。qEGC和aEGC目前都由Notch活动报告员识别Tg(her4.3:EGFP)和代表通过细胞周期标记物表达和胸腺嘧啶类似物掺入(aEGC)区分的可逆细胞状态。灭绝Tg(her4.3:EGFP)这种表达与aEGC对肠神经前体细胞(eNPs)的不可逆结合有关,eNPs最终分化为成熟的肠神经元,能够整合到功能性肠神经回路中。我们认为eNP的这种瞬态群体对应于HuC/D-GFP公司-ENS中确定的细胞Tg(her4.3:EGFP;sox10:Cre;樱桃)斑马鱼(图3B). 该方案确保了EGC原始种群的长期维持和新肠神经元的生成,以满足肠道的物理生长及其固有神经网络的可塑性。
先前的研究已经确定了Notch信号及其靶基因在脊椎动物神经干细胞动力学控制中的核心作用(Chapouton等人,2010年;Imayoshi等人,2010年)并揭示了不同Notch受体在斑马鱼大脑生发区调节RGC增殖和分化中的不同贡献(Alunni等人,2013年;Than-Trong等人,2018年). 虽然相关的Notch信号成分尚待确定,但我们的实验证明,成年斑马鱼肠道中EGC的激活和分化也受Notch信号的控制,指出脊椎动物中控制CNS和ENS稳态的机制的进一步基本相似性。Notch信号也通过抑制ENS祖细胞的内在神经原程序而与哺乳动物ENS的发育有关(冈村和佐贺,2008年). 我们展示了Notch活动记者Tg(her4.3:EGFP)在侵入肠道并启动神经原性分化后不久,ENS祖细胞中被激活,这表明Notch信号在斑马鱼ENS发育中的作用类似,即,当早期ENS祖细胞进入前肠并诱导强大的神经源性转录因子(如Phox2B和Ascl1)时,它们获得的强烈神经源性偏向减弱(Charrier和Pilon,2017年).
斑马鱼ENS非神经元室中已确定的细胞类型的详细层次关系以及斑马鱼肠道中EGC动力学的潜在区域差异仍有待描述。此外,斑马鱼EGC驱动的成年肠道神经发生在多大程度上依赖于控制脊椎动物发育过程中肠道神经元分化的调节基因(例如ret(雷特),ascl1标准,pho2b型)目前尚不清楚。然而,支持成年斑马鱼EGC神经元分化的分子程序的系统特征可能为激活哺乳动物EGC的内在神经原潜能和修复因疾病或衰老而受损的胃肠神经网络提供策略。